黄瓜花叶病毒衣壳蛋白基因转化辣椒研究
作者:李华平 范怀忠 胡晋生 王敏
单位:李华平 范怀忠(华南农业大学资环学院,广东 广州510642);胡晋生 王敏(夏威夷大学植病系,美国96822)
关键词:黄瓜花叶病毒;辣椒;衣壳蛋白;表达与抗性
病毒学报000319 中图分类号:S436.418.1+2 文献标识码:A
文章编号:1000-8721(2000)03-0276-03
Studies on Transgenic Pepper Plants Transferred with the Coat Protein Gene of Cucumber Mosaic Virus
LI Hua-ping,FAN Huai-zhong
, http://www.100md.com
(South China Agricultural University, Guangzhou 510642, China)
John S Hu,WANG Ming
(University of Hawaii, USA 96822)
Abstract: The plant expression vector of the coat protein(CP) gene of cucumber mosaic virus (CMV) BS strain was used to transform three kinds of pepper (Capsicum annuum) tissues (cotyledon, stem and root) by agrobacterium-mediated co-cultivation. 53%-68.4% of the total tissues (639) can be induced to be calli, but only cotyledon calli can be further regenerated to form shoots (regenerated efficiency 39.7%). 70%(42/60) of the putative transformed plants were confirmed to have CP gene in their genomes by Southern blot. The mRNAs and the CP were respectively found in 80% of transgenic plants by Northern blot and DAS-ELISA. 24 of the transgenic plants expressing CP gene of BS strain showed three kinds of resistant level (severe symptom, delay of symptomatic development, no symptom) to infection of CMV-BS and of CMV-P. However, there was distinctly higher resistance to inoculation of CMV-BS than that with CMV-P in these transgenic plants.
, 百拇医药
Key words: Cucumber mosaic virus; pepper; coat protein gene(CP); expression and resistance
黄瓜花叶病毒(cucumber mosaic virus,CMV)的普遍发生和严重危害是辣椒生产上的一个重要限制因素,寻求新的防治方法是当前辣椒生产上的当务之急。我们在南方香蕉花叶病的调查研究中共鉴定了三种CMV株系[1,2,3],并将其优势株系CMV-BS的衣壳蛋白(coat protein,CP)基因转入了土尔其(Turkish)烟、本生烟(Benthemiana)[4]和广东两种烤烟(G28和K326)[5],对其后代的检测表明,表达CMV-BS株系CP基因的植株具有较为广谱的抗病毒能力。因此我们利用农杆菌双元载体系统将CMV-BS株系的CP基因转化入了辣椒。
从田间发病辣椒(Capsicum annuum)上获得一株CMV辣椒分离物,暂命名为CMV-P。在烟草(Nicotiana tabacum CV,HV38)上繁殖后采用李华平等[1]法提纯。华椒17号种子(由华中农业大学园艺系郑世发教授惠赠)于无激素的MSO培养基[6]上发芽后作为转基因受体材料。
, http://www.100md.com
CMV-BS株系CP基因植物表达载体(图1)的构建方法见文献[5]。含植物表达载体的农杆菌LBA4404(pAL4404)用半量MSO培养基按1:10稀释,取12天苗龄的幼苗在菌液中切下子叶、茎和根部,接种5~10min后,用灭菌滤纸吸干菌液,于MS-P培养基(每升含:MS 10倍大量元素100ml,MS 10倍微量元素100ml,Myo-inositol 100mg,Casein hydrolysate 100mg,蔗糖30g,BA5mg,GA32mg,维生素B10.8mg,烟酸1mg,维生素B61mg,phytagel2g,pH5.7)共培养24h。转移无污染的植物组织于含有100mg/L卡那霉素和500mg/L羧苄青霉素的MS-P培养基上,16h光照、8h黑暗、25℃下培养,每10天换1次培养基。切下由愈伤组织生成的茎芽,置于含有100mg/L卡那霉素和300mg/L羧苄青霉素的MS-R培养基(每升含:MS 10倍大量元素50ml,MS 10倍微量元素100ml,Myo-inositol 100mg,Casein hydrolysate 100mg,蔗糖20g,IAA 0.4mg,NAA 0.4mg,维生素B10.8mg,烟酸1mg,Phytage l2g,pH5.7)上诱导生根,待根系发达后移栽于温室。用CTAB法[7]提取转化后辣椒植株的总核酸,经RNase酶消化后,取约250ng用TaqDNA聚合酶进行CP基因的PCR扩增[4]。其扩增产物进行1%琼脂糖凝胶电泳检测。选取部分PCR阳性的转化辣椒植株,用CTAB法分别提取总核酸,经RNase和NcoI酶切后,进行Southern blot杂交。参照Verwoerd等[8]的方法分别提取转基因植株的总RNA,用于Northern blot杂交[4]。其放射性探针的制备、杂交方法见文献[4]。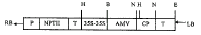
, 百拇医药
图1 CMV-BS株系CP基因植物表达载体示意图
Figure 1 The sketch map of the plant expression vector of CMV-BS CP gene
B.BglⅡ;E.EcoRI;H.Hind Ⅲ;N.NcoⅠ;
AMV. AMV 5’non-traslatable leader sequence.
采集Northern blot具阳性反应的植株的叶片,分别用CMV-C的抗血清(纯化IgG,由夏威夷大学病毒研究室John S Hu博士提供)进行双抗体夹心法(DAS-ELISA)测定CP表达状况[2]。以10μg/ml纯化病毒(BS株系)为阳性对照,非转化的健康植株为空白对照。重复测定3次。将转基因的辣椒植株(R0)分别采用常规机械接种法接种CMV-BS和CMV-P分离物,病毒接种量为100μg/ml,接种后第4天重复接种1次。接种的植株置于25℃~28℃的温室内,观察症状发生情况。
, 百拇医药
以农杆菌共培养法转化CP基因,分别以辣椒子叶、幼茎和根为受体,进行了3批共639个植物组织的转化试验。结果表明:经农杆菌转化的子叶、幼茎和根都能在含有卡那霉素的培养基上形成愈伤组织,但只有子叶能够从愈伤组织进一步分化成幼芽和根(表1),而非转化对照不能产生愈伤组织,而且随着组培时间的延长而逐渐发黄直至完全褐化死亡。
表1 CP基因对辣椒不同组织的转化频率及植株再生率
Table 1 Different pepper tissue transformation and regeneration
efficiencies with CMV-BS CP gene Tissue of
pepper
No.of
, 百拇医药
transformed tissue
Efficiency (%)
Callus1
Shoot2
Cotyledon
267
68.4
39.7
Stem
189
53.0
0
, 百拇医药
Root
183
58.5
0
1 Efficiency: Tissue number of grown callus /Total number of transformed tissues;
2 Efficiency:Number of regenerated shoot tissues/Total number of callus tissues。
在转化的植株中,选取120株进行CP基因的PCR扩增分析,有102株显示了CP基因的扩增带,图2显示了其中27株的PCR结果。在这27株中,有24株显示了明显的扩增带,2株有微弱的扩增带,1株完全没有扩增带。其扩增带的分子量约600bp,与预计的相符。而空白对照则完全没有扩增带。
, 百拇医药
图2 PCR检测转化辣椒植株的结果
Figure 2 PCR analysis of transformed pepper plants
1-27. The number of transformed plants; 28.Untransformed
healthy plant;M.DNA marker (φX174/Hae Ⅲ).
选取在PCR中具有明显扩增带的60株转化植株进行Southern blot分析,结果42株具有明显的杂交信号,图3显示了其中15株的结果。在这15株中,有6株具有较强的杂交信号,4株杂交信号较弱,5株完全没有信号。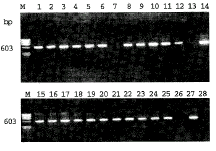
, 百拇医药 图3 转化辣椒植株的Southern blot检测结果
Figure 3 Southern blot analysis of CP
gene of transformed plants
1-6,8-11,14,17-20.The number of transformed plants;
-CK.Untransformed plant.
从Southern blot检测显示有CP基因整合的40株植株中,分别提取总RNA进行Northern blot分析,有32株显示了明显的杂交信号,图4为其中10株的分析结果。在这10株中,有8株具有核酸杂交信号,其中2株的杂交信号较弱,2株无信号。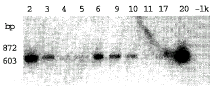
, 百拇医药
图4 转基因辣椒植株的Northern blot结果
Figure 4 Northern blot analysis of CP
gene of transformed plants
2-6,9-11,17,20.The number of transgenic plants;
-CK;Untransformed healthy plant.
选取具有CP基因转录的32株植株,利用DAS-ELISA法对CP基因的翻译进行分析。3次试验重复结果显示,以10μg/ml纯化病毒为阳性对照的OD405nm值为1.836,而空白对照为0.009;CP基因转化的植株为0.089至0.208。这表明所有具有CP基因转录的植株都有CP蛋白的表达。
, 百拇医药
选取具有CP基因表达的转基因植株(R0)24株,以12株为一组,分别用辣椒CMV-P和香蕉CMV-BS株系进行攻击接种。结果显示:(1)非转化对照在接种7天后都出现明显症状。(2)用CMV-P和CMV-BS接种的转基因植株有三种不同的抗性反应,即症状严重型(S),发病早,症状严重,与非转化对照无异。症状延迟型(D),比症状严重型植株延迟出现病状10天以上,且症状明显减轻。无症状型(R),至接种后50天没有任何症状表现(图5)。(3)转基因植株的抗性对CMV-BS较CMV-P的要高,在BS接种的12株植株中,有6株表现无症状;而在P接种的12株中,只有3株表现无症状(图5)。(4)植株的抗性反应与CP基因的翻译累积量没有明显的相关性,其DAS-ELISA法测定的OD405nm值:症状严重型为0.089~0.193,症状延迟型为0.091~0.201,无症状型为0.12~0.208。(5)植株的抗性反应与CP基因的mRNA的转录量密切有关,图4中2、6和20号植株在Northern blot中具有较强的杂交信号,则在抗病性测定中表现了对CMV-BS较高的抗病性。一般而言,mRNA转录量愈大,则抗性愈强。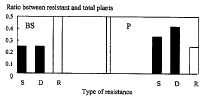
, 百拇医药
图5 转基因植株对攻毒株系(P,BS)的抗性反应
Figure 5 Reaction of transgenic plants inoculated
with CMV-BS and CMV-P
S.Susceptible;D.Delay of symptomatic development;R.Resistant.
CMV是危害辣椒的主要病毒,寻找新的、有效的防治方法是当前生产上面临的一个重要问题。本研究通过农杆菌共培养法将CMV-BS株系的CP基因转化入了辣椒植株,初步结果表明,部分转基因植株表现了对CMV-BS和辣椒CMV-P的抗性。这一工作的开展为最终获得纯合的、遗传性状稳定的抗病的辣椒工程品系奠定了基础。
基金项目:教育部优秀年轻教师基金(200011)和广东省自然科学基金(990714)
, 百拇医药
作者简介:李华平,男,湖北天门人,理学博士,副教授,主要从事植物病毒和抗病毒基因工程研究。
参考文献:
[1] 李华平, 范怀忠. 侵染香蕉的黄瓜花叶病毒株系的形态和生物学研究[J]. 中国病毒学,1996, 11:148-156.
[2] 李华平,胡晋生,范怀忠. 侵染香蕉的黄瓜花叶病毒株系的血清学特征[J]. 中国病毒学,1997, 12: 91-94.
[3] 李华平,胡晋生, Barry K, et al. 黄瓜花叶病毒香蕉株系的衣壳蛋白基因克隆和序列分析[J]. 病毒学报,1996, 12: 235-242.
[4] 李华平,胡晋生,Barry, K, et al. ,黄瓜花叶病毒香蕉株系衣壳蛋白转基因烟草的研究[J]. 病毒学报,1996,12: 162-169.
, http://www.100md.com
[5] 陈元生, 肖火根,张曙光,等. 烤烟栽培品种G28和K326抗黄瓜花叶病毒的遗传转化[J]. 中国病毒学,1998, 13: 257-262.
[6] Horsch R B, Fry J E, Hoffman N, et al. A simple and general method for transferring genes into plants[J]. Science, 1985, 227:1229-1231.
[7] Xie W S, Hu J S. Molecular cloning, sequence analysis, and detection of banana bunchy top virus in Hawaii[J]. Phytopath, 1995, 85: 339-347.
收稿日期:1998-10-19;修回日期:1999-02-03, http://www.100md.com
单位:李华平 范怀忠(华南农业大学资环学院,广东 广州510642);胡晋生 王敏(夏威夷大学植病系,美国96822)
关键词:黄瓜花叶病毒;辣椒;衣壳蛋白;表达与抗性
病毒学报000319 中图分类号:S436.418.1+2 文献标识码:A
文章编号:1000-8721(2000)03-0276-03
Studies on Transgenic Pepper Plants Transferred with the Coat Protein Gene of Cucumber Mosaic Virus
LI Hua-ping,FAN Huai-zhong
, http://www.100md.com
(South China Agricultural University, Guangzhou 510642, China)
John S Hu,WANG Ming
(University of Hawaii, USA 96822)
Abstract: The plant expression vector of the coat protein(CP) gene of cucumber mosaic virus (CMV) BS strain was used to transform three kinds of pepper (Capsicum annuum) tissues (cotyledon, stem and root) by agrobacterium-mediated co-cultivation. 53%-68.4% of the total tissues (639) can be induced to be calli, but only cotyledon calli can be further regenerated to form shoots (regenerated efficiency 39.7%). 70%(42/60) of the putative transformed plants were confirmed to have CP gene in their genomes by Southern blot. The mRNAs and the CP were respectively found in 80% of transgenic plants by Northern blot and DAS-ELISA. 24 of the transgenic plants expressing CP gene of BS strain showed three kinds of resistant level (severe symptom, delay of symptomatic development, no symptom) to infection of CMV-BS and of CMV-P. However, there was distinctly higher resistance to inoculation of CMV-BS than that with CMV-P in these transgenic plants.
, 百拇医药
Key words: Cucumber mosaic virus; pepper; coat protein gene(CP); expression and resistance
黄瓜花叶病毒(cucumber mosaic virus,CMV)的普遍发生和严重危害是辣椒生产上的一个重要限制因素,寻求新的防治方法是当前辣椒生产上的当务之急。我们在南方香蕉花叶病的调查研究中共鉴定了三种CMV株系[1,2,3],并将其优势株系CMV-BS的衣壳蛋白(coat protein,CP)基因转入了土尔其(Turkish)烟、本生烟(Benthemiana)[4]和广东两种烤烟(G28和K326)[5],对其后代的检测表明,表达CMV-BS株系CP基因的植株具有较为广谱的抗病毒能力。因此我们利用农杆菌双元载体系统将CMV-BS株系的CP基因转化入了辣椒。
从田间发病辣椒(Capsicum annuum)上获得一株CMV辣椒分离物,暂命名为CMV-P。在烟草(Nicotiana tabacum CV,HV38)上繁殖后采用李华平等[1]法提纯。华椒17号种子(由华中农业大学园艺系郑世发教授惠赠)于无激素的MSO培养基[6]上发芽后作为转基因受体材料。
, http://www.100md.com
CMV-BS株系CP基因植物表达载体(图1)的构建方法见文献[5]。含植物表达载体的农杆菌LBA4404(pAL4404)用半量MSO培养基按1:10稀释,取12天苗龄的幼苗在菌液中切下子叶、茎和根部,接种5~10min后,用灭菌滤纸吸干菌液,于MS-P培养基(每升含:MS 10倍大量元素100ml,MS 10倍微量元素100ml,Myo-inositol 100mg,Casein hydrolysate 100mg,蔗糖30g,BA5mg,GA32mg,维生素B10.8mg,烟酸1mg,维生素B61mg,phytagel2g,pH5.7)共培养24h。转移无污染的植物组织于含有100mg/L卡那霉素和500mg/L羧苄青霉素的MS-P培养基上,16h光照、8h黑暗、25℃下培养,每10天换1次培养基。切下由愈伤组织生成的茎芽,置于含有100mg/L卡那霉素和300mg/L羧苄青霉素的MS-R培养基(每升含:MS 10倍大量元素50ml,MS 10倍微量元素100ml,Myo-inositol 100mg,Casein hydrolysate 100mg,蔗糖20g,IAA 0.4mg,NAA 0.4mg,维生素B10.8mg,烟酸1mg,Phytage l2g,pH5.7)上诱导生根,待根系发达后移栽于温室。用CTAB法[7]提取转化后辣椒植株的总核酸,经RNase酶消化后,取约250ng用TaqDNA聚合酶进行CP基因的PCR扩增[4]。其扩增产物进行1%琼脂糖凝胶电泳检测。选取部分PCR阳性的转化辣椒植株,用CTAB法分别提取总核酸,经RNase和NcoI酶切后,进行Southern blot杂交。参照Verwoerd等[8]的方法分别提取转基因植株的总RNA,用于Northern blot杂交[4]。其放射性探针的制备、杂交方法见文献[4]。

, 百拇医药
图1 CMV-BS株系CP基因植物表达载体示意图
Figure 1 The sketch map of the plant expression vector of CMV-BS CP gene
B.BglⅡ;E.EcoRI;H.Hind Ⅲ;N.NcoⅠ;
AMV. AMV 5’non-traslatable leader sequence.
采集Northern blot具阳性反应的植株的叶片,分别用CMV-C的抗血清(纯化IgG,由夏威夷大学病毒研究室John S Hu博士提供)进行双抗体夹心法(DAS-ELISA)测定CP表达状况[2]。以10μg/ml纯化病毒(BS株系)为阳性对照,非转化的健康植株为空白对照。重复测定3次。将转基因的辣椒植株(R0)分别采用常规机械接种法接种CMV-BS和CMV-P分离物,病毒接种量为100μg/ml,接种后第4天重复接种1次。接种的植株置于25℃~28℃的温室内,观察症状发生情况。
, 百拇医药
以农杆菌共培养法转化CP基因,分别以辣椒子叶、幼茎和根为受体,进行了3批共639个植物组织的转化试验。结果表明:经农杆菌转化的子叶、幼茎和根都能在含有卡那霉素的培养基上形成愈伤组织,但只有子叶能够从愈伤组织进一步分化成幼芽和根(表1),而非转化对照不能产生愈伤组织,而且随着组培时间的延长而逐渐发黄直至完全褐化死亡。
表1 CP基因对辣椒不同组织的转化频率及植株再生率
Table 1 Different pepper tissue transformation and regeneration
efficiencies with CMV-BS CP gene Tissue of
pepper
No.of
, 百拇医药
transformed tissue
Efficiency (%)
Callus1
Shoot2
Cotyledon
267
68.4
39.7
Stem
189
53.0
0
, 百拇医药
Root
183
58.5
0
1 Efficiency: Tissue number of grown callus /Total number of transformed tissues;
2 Efficiency:Number of regenerated shoot tissues/Total number of callus tissues。
在转化的植株中,选取120株进行CP基因的PCR扩增分析,有102株显示了CP基因的扩增带,图2显示了其中27株的PCR结果。在这27株中,有24株显示了明显的扩增带,2株有微弱的扩增带,1株完全没有扩增带。其扩增带的分子量约600bp,与预计的相符。而空白对照则完全没有扩增带。

, 百拇医药
图2 PCR检测转化辣椒植株的结果
Figure 2 PCR analysis of transformed pepper plants
1-27. The number of transformed plants; 28.Untransformed
healthy plant;M.DNA marker (φX174/Hae Ⅲ).
选取在PCR中具有明显扩增带的60株转化植株进行Southern blot分析,结果42株具有明显的杂交信号,图3显示了其中15株的结果。在这15株中,有6株具有较强的杂交信号,4株杂交信号较弱,5株完全没有信号。

, 百拇医药 图3 转化辣椒植株的Southern blot检测结果
Figure 3 Southern blot analysis of CP
gene of transformed plants
1-6,8-11,14,17-20.The number of transformed plants;
-CK.Untransformed plant.
从Southern blot检测显示有CP基因整合的40株植株中,分别提取总RNA进行Northern blot分析,有32株显示了明显的杂交信号,图4为其中10株的分析结果。在这10株中,有8株具有核酸杂交信号,其中2株的杂交信号较弱,2株无信号。

, 百拇医药
图4 转基因辣椒植株的Northern blot结果
Figure 4 Northern blot analysis of CP
gene of transformed plants
2-6,9-11,17,20.The number of transgenic plants;
-CK;Untransformed healthy plant.
选取具有CP基因转录的32株植株,利用DAS-ELISA法对CP基因的翻译进行分析。3次试验重复结果显示,以10μg/ml纯化病毒为阳性对照的OD405nm值为1.836,而空白对照为0.009;CP基因转化的植株为0.089至0.208。这表明所有具有CP基因转录的植株都有CP蛋白的表达。
, 百拇医药
选取具有CP基因表达的转基因植株(R0)24株,以12株为一组,分别用辣椒CMV-P和香蕉CMV-BS株系进行攻击接种。结果显示:(1)非转化对照在接种7天后都出现明显症状。(2)用CMV-P和CMV-BS接种的转基因植株有三种不同的抗性反应,即症状严重型(S),发病早,症状严重,与非转化对照无异。症状延迟型(D),比症状严重型植株延迟出现病状10天以上,且症状明显减轻。无症状型(R),至接种后50天没有任何症状表现(图5)。(3)转基因植株的抗性对CMV-BS较CMV-P的要高,在BS接种的12株植株中,有6株表现无症状;而在P接种的12株中,只有3株表现无症状(图5)。(4)植株的抗性反应与CP基因的翻译累积量没有明显的相关性,其DAS-ELISA法测定的OD405nm值:症状严重型为0.089~0.193,症状延迟型为0.091~0.201,无症状型为0.12~0.208。(5)植株的抗性反应与CP基因的mRNA的转录量密切有关,图4中2、6和20号植株在Northern blot中具有较强的杂交信号,则在抗病性测定中表现了对CMV-BS较高的抗病性。一般而言,mRNA转录量愈大,则抗性愈强。

, 百拇医药
图5 转基因植株对攻毒株系(P,BS)的抗性反应
Figure 5 Reaction of transgenic plants inoculated
with CMV-BS and CMV-P
S.Susceptible;D.Delay of symptomatic development;R.Resistant.
CMV是危害辣椒的主要病毒,寻找新的、有效的防治方法是当前生产上面临的一个重要问题。本研究通过农杆菌共培养法将CMV-BS株系的CP基因转化入了辣椒植株,初步结果表明,部分转基因植株表现了对CMV-BS和辣椒CMV-P的抗性。这一工作的开展为最终获得纯合的、遗传性状稳定的抗病的辣椒工程品系奠定了基础。
基金项目:教育部优秀年轻教师基金(200011)和广东省自然科学基金(990714)
, 百拇医药
作者简介:李华平,男,湖北天门人,理学博士,副教授,主要从事植物病毒和抗病毒基因工程研究。
参考文献:
[1] 李华平, 范怀忠. 侵染香蕉的黄瓜花叶病毒株系的形态和生物学研究[J]. 中国病毒学,1996, 11:148-156.
[2] 李华平,胡晋生,范怀忠. 侵染香蕉的黄瓜花叶病毒株系的血清学特征[J]. 中国病毒学,1997, 12: 91-94.
[3] 李华平,胡晋生, Barry K, et al. 黄瓜花叶病毒香蕉株系的衣壳蛋白基因克隆和序列分析[J]. 病毒学报,1996, 12: 235-242.
[4] 李华平,胡晋生,Barry, K, et al. ,黄瓜花叶病毒香蕉株系衣壳蛋白转基因烟草的研究[J]. 病毒学报,1996,12: 162-169.
, http://www.100md.com
[5] 陈元生, 肖火根,张曙光,等. 烤烟栽培品种G28和K326抗黄瓜花叶病毒的遗传转化[J]. 中国病毒学,1998, 13: 257-262.
[6] Horsch R B, Fry J E, Hoffman N, et al. A simple and general method for transferring genes into plants[J]. Science, 1985, 227:1229-1231.
[7] Xie W S, Hu J S. Molecular cloning, sequence analysis, and detection of banana bunchy top virus in Hawaii[J]. Phytopath, 1995, 85: 339-347.
收稿日期:1998-10-19;修回日期:1999-02-03, http://www.100md.com