大鼠脊髓后角浅层初级传入C纤维内μ阿片受体的免疫组织化学定位光镜与电镜研究*
作者:李和 王小丽 张亦农 杨世明 李肇春
单位:李和 王小丽 张亦农 杨世明 李肇春(同济医科大学组织学胚胎学教研室,武汉 430030)
关键词:阿片受体;辣椒素;西非单叶豆同工凝集素;C纤维;初级传入;脊髓后角;免疫电镜
解剖学报990301
【摘要】 目的 在光镜及电镜下观察大鼠脊髓后角内μ阿片受体(MOR)与C纤维的关系,为进一步揭示阿片镇痛的突触机制提供形态学证据。 方法 根据辣椒素对初级传入神经中C纤维的特异性神经毒性,在大鼠蛛网膜下腔注射辣椒素以毁损C纤维,用免疫组织化学ABC法比较脊髓后角内MOR免疫反应性的变化;根据西非单叶豆同工凝集素I-B4(griffonia simplicifolia isolectin I-B4,I-B4)与初级传入C纤维选择性结合的特性,应用双标(免疫)组织化学电镜技术(ABC-纳金法)分别标记脊髓后角内I-B4结合位点和MOR。 结果 大鼠蛛网膜下腔注射辣椒素3~7d后,其脊髓后角Ⅰ~Ⅱ层内的MOR免疫反应性较对照动物明显减弱;电镜下在大鼠脊髓后角浅层内观察到,MOR不仅定位于树突内,也分布在含I-B4结合位点的C纤维终末内。无论在树突内还是在轴突终末内,MOR主要分布在非突触部位,仅少量MOR与突触前膜和/或突触后膜有关。 结论 脊髓后角中部分MOR来源于辣椒素敏感的C纤维,外源性吗啡或内源性吗啡样物质如内吗啡肽等MOR激动剂在脊髓后角内既可通过突触后(树突内)的MOR发挥作用,也可通过突触前(轴突终末内)的MOR对C纤维产生突触前抑制效应,而且在此过程中,MOR激动剂在非突触部位的作用可能是主要的。
, http://www.100md.com
IMMUNOHISTOCHEMICAL LOCALIZATION OF μ OPIOID RECEPTOR
IN PRIMARY AFFERENT C FIBER WITHIN THE SUPERFICIAL
LAYERS OF THE RAT SPINAL DORSAL HORN
A LIGHT AND ELECTRON MICROCOPIC STUDY
Li HeΔ, Wang Xiaoli, Zhang Yinong, Yiang Shiming, Li Zhaochun
(Department of Histology and Embryology,Taongji Medical University,Wuhan)
, 百拇医药
【Abstract】 Objective To provide morphological evidences for further revealing synaptic mechanism of opioid analgesia,the relation of μopioid receptor(MOR) to primary afferent C fiber in the spinal dorsal horn of the rat was light-and electron-microscopically observed.Methods According to the specific neurotoxicity of capsaicin to C fiber,capsaicin was injected subarachnoidally in the rat and the change of MOR immunoreactivity was detected in the rat spinal dorsal horn by using immunohistochemistry(ABC method);Based upon the selectivity of isolectin I-B4 from griffonia simpliciflia binding to C fiber,the I-B4 binding sites and MOR in the spinal dorsal horn were double labeled(immunohistochemical)histochemical electron microscopy(ABC-Nanogold method).Results During 3~7 days after subarachnoidal injetion of capsaicin,the MOR immunorecativity in the laminae Ⅰ~Ⅱ of the spinal dorsal horn of the rat treated with capsaicin was markedly decreased as compared with that of the control rat.Under electron microscope,it was observed that in the superficial layers of the spinal cord,MOR was distributed in some axonal terminals including the terminals of C fibers containing I-B4 binding sites as well as in the dendrites.In both the dendrites and the axonal terminals,MORs were mainly localized in the non-synaptic membranes except for the minority associated with pre-and/or post-synaptic membranes.Conclusion A considerable amount of MOR in the spinal dorsal horn originates from the primary afferent C fibers and morphine or endogenous morphine-like substances such as endomorphin may act not only on postsynaptic MOR in the dendrites but also on presynaptic MOR in the axonal terminal of C fiber to inhibit the input of C fiber,and in these processes,the nonsynaptic action of MOR agonists is likely essential.
, http://www.100md.com
【Key words】 Opioid receptor; Capsaicin; Griffonia simpliciflia isolectin; C fiber; Primary afferent; Spinal dorsal horn; Immunoelectron microscope
阿片物质可在脊髓后角产生明显的镇痛效应,这一作用既与对脊髓后角第二级痛觉神经元的突触后抑制有关[1],也可能涉及到对传递痛觉的初级传入神经元的突触前抑制[2]。一些功能实验表明,阿片物质能抑制初级传入神经元释放P物质[3],但由于实验技术的限制,目前尚无令人信服的形态学资料能证明阿片物质以突触前抑制方式抑制传入痛觉的初级传入C纤维释放P物质等痛觉递质或调质的结构基础。阿片物质通过相应的受体实现其生理作用。在哺乳动物神经系统,包括脊髓后角,至少存在μ、δ和κ 3种阿片受体[4],其中μ阿片受体(MOR)在脊髓后角介导吗啡及内源性阿片物质的镇痛作用中尤其重要[5]。有资料表明,初级传入神经元可表达MOR[4,6,7],脊髓后角内的一些轴突终末也呈MOR免疫反应阳性[5],但这些轴突终末是否属于初级传入纤维及初级传入神经中与痛觉传入有关的C纤维是否也含有MOR还不能肯定。因此,本实验根据辣椒素对初级传入C纤维的特异性神经毒性[8]和西非单叶豆(griffonia simplicifolia)同工凝集素I-B4(I-B4)与C纤维选择性结合的特性[9],应用免疫组织化学光镜、电镜技术,观察大鼠脊髓后角浅层内MOR免疫反应性与C纤维间的关系。
, 百拇医药
材料和方法
雄性Wistar大鼠14只,体重200~250g。其中10只用于辣椒素毁损实验,另4只用于电镜实验。在辣椒素毁损实验中,将10只大鼠随机分成5对,以腹腔注射苯巴比妥钠(40 mg/kg体重)麻醉后按Yaksh和Rudy[10]的方法行蛛网膜下腔瘘管埋植术,瘘管从小脑延髓池处插入,下端达脊髓腰膨大上缘(插入约7 cm)。每对大鼠中,1只经瘘管缓慢注入0.25%辣椒素(溶于含50%二甲基亚砜的消毒等渗液[11]——溶媒中)25μl(辣椒素注射组),另1只注射溶媒25μl作为对照组。手术后动物存活3d或7d。3d或7d后,大鼠在深麻醉(按100 mg/kg体重腹腔注射苯巴比妥钠)下,用含4%多聚甲醛和1%苦味酸的0.1 mol/L磷酸缓冲液(PB,pH7.3)灌注固定,取L2~4段脊髓,用上述固定液后固定4h,25%蔗糖过夜。第2d进行恒冷箱切片,片厚30 μm。切片时,将每一对脊髓置于同一载物台上同步切片,以保证同一对脊髓的各对切片厚度相同。切片在细胞培养板中以飘浮法行MOR免疫组织化学反应(ABC法)。每对动物同步切下的切片始终处于同等条件下反应。
, http://www.100md.com
用于电镜观察的大鼠在深麻醉下,经左心室用含4%多聚甲醛、0.75%苦味酸和0.075%戊二醛的PB灌注固定。灌注结束后立即取L2~4段脊髓,用不含戊二醛的上述固定液后固定4~6h,继而以0.01 mol/L磷酸盐缓冲液(PBS;pH7.3)漂洗1~2h后进行振动切片(片厚50~70 μm)。切片经防冰晶处理(切片在含15%甘油、20%庶糖的PBS中振摇沉底)后,以液氮速冻0.5~1 min,并以PBS迅速回温。接着对切片进行包埋前电镜单标或双标染色[12]:(1)I-B4单标染色:2 mg/L生物素化的I-B4(BSI-B4,Sigma)4℃下孵育40~45h,ABC复合物(1∶100)室温孵育2h,含0.03%DAB和0.003%H2O2的Tris-HCl缓冲液(TB,pH7.6)呈色15~20min;(2)I-B4与MOR双标染色:2 mg/L生物素化的I-B4与0.4 mg/L的豚鼠抗MOR C末端多肽抗体的混合物4℃下孵育40~45h;ABC复合物(1∶100)与纳金标记的羊抗豚鼠IgG Fab’片段(1∶100~150,Nanoprobes)的混合物室温孵育2h,银加强液(HQ silverTM,Nanoprobes)室温反应5~10 min;含0.03% DAB和0.003%H2O22的TB呈色15~20 min。在上述单标及双标染色中,I-B4、各种抗体和ABC复合物等试剂均以含3%牛血清白蛋白的PBS稀释。标记反应结束后,切片以1%锇酸(以PB配制)后固定30~40 min,常规脱水、Epon812浸透、平板包埋、聚合。在体视显微镜下仔细切取标记反应满意的阳性部位(脊髓后角浅层),以502快粘胶将其粘于树脂块头上进行超薄切片。切片经过或不经过电子染色后在电镜下观察。
, 百拇医药
结果
1. 辣椒素对MOR免疫反应性的影响
正常对照组大鼠脊髓内,MOR免疫反应性主要分布在后角浅层(Ⅰ~Ⅱ层),在第Ⅱ层中最强,第Ⅰ层中呈中等强度(图1)。在高倍镜下可见少数MOR阳性胞体存在于第Ⅱ层中,但在第Ⅰ层中未见阳性胞体。在辣椒素注射组,在大鼠蛛网膜下腔注射辣椒素后第3d天,脊髓后角Ⅰ~Ⅱ层内的MOR免疫反应性即已减弱,在第7d减弱更明显(图2),但分布均无变化。
2. MOR免疫反应性的超微结构定位
在I-B4单标切片中,电镜下可见脊髓后角浅层内一些轴突终末被标记,反应产物弥散性分布在阳性轴突终末内的囊泡膜上,使囊泡膜的电子密度明显增高(图3)。在双标切片上,代表MOR的阳性标记信号呈大小不一、电子密度很高的颗粒(银加强后的纳金-银颗粒),其形状多为圆形,颗粒较大者形状稍不规则(图4~6)。MOR既存在于一些树突内,也定位在一些轴突及其终末内(包括部分呈I-B4结合反应阳性的轴突终末)(图4~6)。在树突中,MOR多定位于树突膜上,少数可见于树突胞质中(图4,6)。在树突膜上的颗粒除少数与突触后膜有关(图4)外,多数定位在非突触膜上(图4,6)。MOR免疫反应性在I-B4阳性和I-B4阴性的轴突或轴突终末上的定位基本一致。在I-B4阳性轴突终末中,MOR既存在于轴膜上也存在于终末胞质内(图4~6)。在胞质中的MOR多与突触小泡有关,而分布在轴膜上的MOR除极少数存在于突触前膜上外,绝大多数位于突触前膜以外部位(图4~6)。
, http://www.100md.com
讨论
阿片受体是一组G蛋白偶联受体,至少包括μ、δ和κ 3个亚型[4],其中μ亚型(MOR)与外源性阿片类物质-吗啡或其内源性配基-内吗啡肽具有极高的亲合力[5,13]。随着MOR分子克隆和相应抗体制备的成功,使MOR的原位杂交和免疫组织化学研究成为可能。原位杂交研究显示,部分脊神经节细胞(包括小细胞)可表达MOR[4,6];免疫组织化学研究则观察到一些中小型脊神经节细胞呈MOR阳性免疫反应[7];脊神经后根切断后,后角浅层MOR免疫反应性明显减弱[14]。由此表明初级感觉神经元含MOR,后角浅层内部分MOR来自初级感觉神经元。辣椒素是一种对传入痛觉的小神经节细胞具有特异性毒性的神经毒剂[8],蛛网膜下腔注射辣椒素可导致来自初级传入神经元的C纤维变性[8,15],因而辣椒素是选择性研究C纤维的一种有用的工具药。在本研究中,当蛛网膜下腔注射辣椒素后,脊髓后角Ⅰ~Ⅱ层内的MOR免疫反应性因C纤维变性而明显减弱,表明脊髓后角内的MOR有相当一部分系来自小的初级传入神经元,并定位在终止于后角浅层的C纤维中枢突中。
, http://www.100md.com
已有免疫电镜观察发现在脊髓后角浅层内有轴突终末含MOR,但这些含MOR的轴突终末是否为初级传入C纤维的终末则未加以鉴定[5]。griffonia simplicifolia的同工凝集素I-B4能与小的初级传入神经元上的D-半乳糖残基选择性结合,在脊髓后角中能鉴别包括P物质能纤维在内的无髓初级传入纤维即C纤维[9],I-B4与D-半乳糖残基的结合反应是C纤维上的一种特异性组织化学标记[9,12]。在本实验的双标电镜研究部分,我们观察到在脊髓后角浅层,部分呈I-B4结合反应阳性的轴突终末含有MOR免疫反应性。这一结果进一步证明了MOR存在于包括C纤维在内的初级传入纤维终末中,为MOR激动剂能对C纤维的传入或其中递质的释放进行突触前抑制的观点提供了直接的形态学证据。
后根切断术后,脊髓后角内仍保留一定强度的MOR免疫反应性[14];含脑啡肽的轴突终末与脊髓后角神经元的树突间存在轴树突触[15];阿片受体激动剂可抑制离子电泳导入的P物质、兴奋性氨基酸对后角神经元的兴奋作用[1,5]。这些资料均提示阿片受体存在于后角神经元的树突或胞体上,Cheng等[5]的报道和本研究观察到的MOR在脊髓后角中的一些树突上的定位则进一步证明了这一点。
, 百拇医药
无论是在轴突终末中,还是在树突中,MOR极少定位于突触处(前膜或后膜),而主要定位于非突触部位。在孤束核[16]等处,MOR的超微结构定位也是如此。我们以前曾在以辣椒素导致C纤维变性的大鼠脊髓后角内观察到,含脑啡肽的轴突终末与C纤维的变性终末间极少形成典型的轴轴突触,而非突触性的轴轴接触则相对较多[15]。因此,吗啡或内源性吗啡样物质的非突触释放和弥散及在非突触部位通过MOR发挥作用可能更为重要。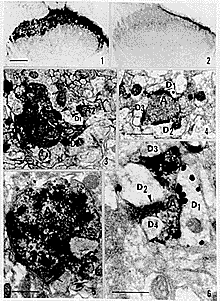
图版说明
图1 对照组大鼠脊髓后角Ⅰ~Ⅱ层内的MOR免疫反应性
图2 辣椒素处理组脊髓后角Ⅰ~Ⅱ层内MOR免疫反应性较对照组明显减弱
图3 脊髓后角浅层内一I-B4标记的轴突终末(A1)和一非I-B4标记的轴突终末(A2)与同一树突(D1)形成非对称性轴-树突触,A1还与另一树突(D2)形成非对称性轴-树突触。三角示特化的突触后膜
, http://www.100md.com
图4 脊髓后角浅层内一轴突终末(A)与3个树突(D1~D3)分别形成轴树突触。在D1、D2中可见代表MOR免疫反应性的纳金-银颗粒主要分布在树突的非突触部位,D1中还可见纳金-银颗粒位于突触后膜(箭头)
图5 脊髓后角浅层内I-B4与MOR双标轴突终末(A),MOR免疫反应性(纳金-银颗粒)定位于突触前膜(大三角)、非突触部位的轴膜(小三角)及轴质中,并见一纳金-银颗粒定位于树突的突触后膜上(箭头)
图6 脊髓后角浅层中一含MOR的I-B4阳性轴突终末(A)、一MOR阳性树突(D1)与3个MOR阴性树突(D2~D4)。纳金-银颗粒标记的MOR在轴突终末和树突中均定位于非突触部位。三角示特化的突触后膜。标尺:图1,2中为200 μm,图3~6中为0.5 μm
Expanation of figures
Fig.1 MOR immunoreactivity in the laminae Ⅰ-Ⅱ of the spinal dorsal horn of control rat.
, 百拇医药
Fig.2 MOR immunoreactivity decreases markedly in the laminae Ⅰ-Ⅱ of the spinal dorsal horn of the rat treated with capsaicin,as compared with that of control rat.
Fig.3 An I-B4-positive axonic terminal (A1) and an I-B4-negative axonal terminal(A2) in the suerficial layers of the spinal dorsal horn form asymmertic axodendritic synapses with a same dendrite (D1) and A1 synapses asymmetrically with another dendrite(D2).Trigons point to the specialized postsynaptic membranes.
, 百拇医药
Fig.4 An axonal terminal (A) formed axodendritic synapses with 3 dendrites(D1~D3),respectively,in the superficial layers of the spinal dorsal horn.In D1 and D2,MOR immunoreactivities indicated by nanogold-silver particles are mainly distributed in the nonsynaptic membranes,but in D1, a nanogold-silver particle pointed with an arrow is located on postsynaptic membrane.
Fig.5 An axonal terminal (A) double-labelled with I-B4 and MOR in the superficial layers of the spinal dorsal horn in which MOR immunoreactivities indicated by nanogold-silver particles are localized on presynaptic membrane(large trigon),on axonal membrane of nonsynaptic portion(small trigon)and in axoplasma.One nanogold-silver particle is also seen to be localized on the postsynaptic membrane(arrow).
, 百拇医药
Fig.6 An I-B4-postive axonic terminal(A) containing MOR and a MOR-positive dendrites(D1) and three MOR-negative dendrites(D2-D4) in the superficial layers of the spinal dorsal horn.MOR labeled by nanogold-silver particles are nonsynaptically localized in both axonal terminal and dendrites.Trigon points to the specialized postsynaptic membrane.
Scale bar,200 μm in Fig.1 and 2,0,5 μm in Fig.3-6.
* 国家自然科学基金(No.39770386)和国家教委留学回国人员科研基金资助课题
, 百拇医药
△ Department of Histology and Embryology,Tong Ji Medical University, Wuhan 430030,China
参考文献
[1]Yoshimura M,North RA.Substantia gelatinosa neurones hyperpolarized in vitro by enkephalin.Nature,1983,305(5934):529
[2]MacDonald RL,Nelson PG.Specific-opiate-induced depression of transmitter release form dorsal root ganglion cells in culture.Science,1978,199(4336):1449
, 百拇医药
[3]Jessell TM,Iversen LL.Opiate analgesics inhibit substance P release from rat trigeminal nucleus.Nature,1977,268(5620):549
[4]Minami M,Satch M.Molecular biology of the opioid receptors:structures funtions and distributions.Neurosci Res,1995,23(1):121
[5]Cheng PY,Moriwaki A,Wang JB,et al.Ultrastructural localization of μ-opioid receptors in the superficial layers of the rat cervical spinal cord:extrasynaptic localization and proximityto Leu5-enkephalin.Brain Res,1996,731(1);141
, http://www.100md.com
[6]Mansour A,Fox CA,Burke S,et al.Mu,delta,and kappa opioid receptor mRNA expression in the rat CNS:An in situ hybridization study.J Comp Neurol,1994,350(3):412
[7]Ding Y Q,Kaneko T,Nomura S,et al.Immunohistochemical localization of μ-opioid receptors in the central nervous system of the rat.J Comp Neurol,1996,367(3):375
[8]Fitzgerald M.Capsaicin and sensory neuron-A review.Pain,1983,15(1):109
, http://www.100md.com [9]Streit WJ,Schulte BA,Balentine JD,et al.Evidence for glycoconjugate in nociceptive primary sensory neurons and its origin from the Golgi complex.Brain Res,1986,377(1):1
[10]Yaksh TL,Rudy TA.Chronic catheterization of the spinal subsubarachnoid space.Physiol Behav,1976,17(3):1031
[11]Spampinato S.Romuald P,Candaletti S,et al.Distinguishable effects of intrathecal dynorphins,somatostatin,neurotensin and s-calcitonin on nociception and motor function in the rat.Pain,1988,35(1):95
, 百拇医药
[12]王小丽,李宏莲,杨世民,等.P物质与Griffonia simplicifolia I-B4结合位点在大鼠一级传入神经元内共存.神经解剖学杂志,1998,14(3):(印刷中)
[13]韩济生,万有.“内吗啡肽”的发现是阿片肽研究的一次突破.生理科学进展,1997,28(3):237
[14]Ding Y Q,Nomura S,Kaneko T,et al.Co-localization of μ opioid receptor-like and substance P-like immunoreactivities in axon terminals within the superficial layers of the medullary and spinal dorsal horn of the rat.Neuroscience Lett,1995,198(1):45
, 百拇医药 [15]李和,水野升.大鼠脊髓后角内甲啡肽标记与非标记结构与C纤维间关系的免疫电镜研究.神经解剖学杂志,1996,12(4):401
[16]Cheng PY,Lin Chen LY,Chen C,et al.Immunolabeling of μ opioid receptors in the rat nucleus of the solitary tract extrasynaptic plasmalemmal localization and association with leu5-enkephalin.J Comp Neurol,1996,371(4):522
收稿1998-04 修回1998-10, 百拇医药
单位:李和 王小丽 张亦农 杨世明 李肇春(同济医科大学组织学胚胎学教研室,武汉 430030)
关键词:阿片受体;辣椒素;西非单叶豆同工凝集素;C纤维;初级传入;脊髓后角;免疫电镜
解剖学报990301
【摘要】 目的 在光镜及电镜下观察大鼠脊髓后角内μ阿片受体(MOR)与C纤维的关系,为进一步揭示阿片镇痛的突触机制提供形态学证据。 方法 根据辣椒素对初级传入神经中C纤维的特异性神经毒性,在大鼠蛛网膜下腔注射辣椒素以毁损C纤维,用免疫组织化学ABC法比较脊髓后角内MOR免疫反应性的变化;根据西非单叶豆同工凝集素I-B4(griffonia simplicifolia isolectin I-B4,I-B4)与初级传入C纤维选择性结合的特性,应用双标(免疫)组织化学电镜技术(ABC-纳金法)分别标记脊髓后角内I-B4结合位点和MOR。 结果 大鼠蛛网膜下腔注射辣椒素3~7d后,其脊髓后角Ⅰ~Ⅱ层内的MOR免疫反应性较对照动物明显减弱;电镜下在大鼠脊髓后角浅层内观察到,MOR不仅定位于树突内,也分布在含I-B4结合位点的C纤维终末内。无论在树突内还是在轴突终末内,MOR主要分布在非突触部位,仅少量MOR与突触前膜和/或突触后膜有关。 结论 脊髓后角中部分MOR来源于辣椒素敏感的C纤维,外源性吗啡或内源性吗啡样物质如内吗啡肽等MOR激动剂在脊髓后角内既可通过突触后(树突内)的MOR发挥作用,也可通过突触前(轴突终末内)的MOR对C纤维产生突触前抑制效应,而且在此过程中,MOR激动剂在非突触部位的作用可能是主要的。
, http://www.100md.com
IMMUNOHISTOCHEMICAL LOCALIZATION OF μ OPIOID RECEPTOR
IN PRIMARY AFFERENT C FIBER WITHIN THE SUPERFICIAL
LAYERS OF THE RAT SPINAL DORSAL HORN
A LIGHT AND ELECTRON MICROCOPIC STUDY
Li HeΔ, Wang Xiaoli, Zhang Yinong, Yiang Shiming, Li Zhaochun
(Department of Histology and Embryology,Taongji Medical University,Wuhan)
, 百拇医药
【Abstract】 Objective To provide morphological evidences for further revealing synaptic mechanism of opioid analgesia,the relation of μopioid receptor(MOR) to primary afferent C fiber in the spinal dorsal horn of the rat was light-and electron-microscopically observed.Methods According to the specific neurotoxicity of capsaicin to C fiber,capsaicin was injected subarachnoidally in the rat and the change of MOR immunoreactivity was detected in the rat spinal dorsal horn by using immunohistochemistry(ABC method);Based upon the selectivity of isolectin I-B4 from griffonia simpliciflia binding to C fiber,the I-B4 binding sites and MOR in the spinal dorsal horn were double labeled(immunohistochemical)histochemical electron microscopy(ABC-Nanogold method).Results During 3~7 days after subarachnoidal injetion of capsaicin,the MOR immunorecativity in the laminae Ⅰ~Ⅱ of the spinal dorsal horn of the rat treated with capsaicin was markedly decreased as compared with that of the control rat.Under electron microscope,it was observed that in the superficial layers of the spinal cord,MOR was distributed in some axonal terminals including the terminals of C fibers containing I-B4 binding sites as well as in the dendrites.In both the dendrites and the axonal terminals,MORs were mainly localized in the non-synaptic membranes except for the minority associated with pre-and/or post-synaptic membranes.Conclusion A considerable amount of MOR in the spinal dorsal horn originates from the primary afferent C fibers and morphine or endogenous morphine-like substances such as endomorphin may act not only on postsynaptic MOR in the dendrites but also on presynaptic MOR in the axonal terminal of C fiber to inhibit the input of C fiber,and in these processes,the nonsynaptic action of MOR agonists is likely essential.
, http://www.100md.com
【Key words】 Opioid receptor; Capsaicin; Griffonia simpliciflia isolectin; C fiber; Primary afferent; Spinal dorsal horn; Immunoelectron microscope
阿片物质可在脊髓后角产生明显的镇痛效应,这一作用既与对脊髓后角第二级痛觉神经元的突触后抑制有关[1],也可能涉及到对传递痛觉的初级传入神经元的突触前抑制[2]。一些功能实验表明,阿片物质能抑制初级传入神经元释放P物质[3],但由于实验技术的限制,目前尚无令人信服的形态学资料能证明阿片物质以突触前抑制方式抑制传入痛觉的初级传入C纤维释放P物质等痛觉递质或调质的结构基础。阿片物质通过相应的受体实现其生理作用。在哺乳动物神经系统,包括脊髓后角,至少存在μ、δ和κ 3种阿片受体[4],其中μ阿片受体(MOR)在脊髓后角介导吗啡及内源性阿片物质的镇痛作用中尤其重要[5]。有资料表明,初级传入神经元可表达MOR[4,6,7],脊髓后角内的一些轴突终末也呈MOR免疫反应阳性[5],但这些轴突终末是否属于初级传入纤维及初级传入神经中与痛觉传入有关的C纤维是否也含有MOR还不能肯定。因此,本实验根据辣椒素对初级传入C纤维的特异性神经毒性[8]和西非单叶豆(griffonia simplicifolia)同工凝集素I-B4(I-B4)与C纤维选择性结合的特性[9],应用免疫组织化学光镜、电镜技术,观察大鼠脊髓后角浅层内MOR免疫反应性与C纤维间的关系。
, 百拇医药
材料和方法
雄性Wistar大鼠14只,体重200~250g。其中10只用于辣椒素毁损实验,另4只用于电镜实验。在辣椒素毁损实验中,将10只大鼠随机分成5对,以腹腔注射苯巴比妥钠(40 mg/kg体重)麻醉后按Yaksh和Rudy[10]的方法行蛛网膜下腔瘘管埋植术,瘘管从小脑延髓池处插入,下端达脊髓腰膨大上缘(插入约7 cm)。每对大鼠中,1只经瘘管缓慢注入0.25%辣椒素(溶于含50%二甲基亚砜的消毒等渗液[11]——溶媒中)25μl(辣椒素注射组),另1只注射溶媒25μl作为对照组。手术后动物存活3d或7d。3d或7d后,大鼠在深麻醉(按100 mg/kg体重腹腔注射苯巴比妥钠)下,用含4%多聚甲醛和1%苦味酸的0.1 mol/L磷酸缓冲液(PB,pH7.3)灌注固定,取L2~4段脊髓,用上述固定液后固定4h,25%蔗糖过夜。第2d进行恒冷箱切片,片厚30 μm。切片时,将每一对脊髓置于同一载物台上同步切片,以保证同一对脊髓的各对切片厚度相同。切片在细胞培养板中以飘浮法行MOR免疫组织化学反应(ABC法)。每对动物同步切下的切片始终处于同等条件下反应。
, http://www.100md.com
用于电镜观察的大鼠在深麻醉下,经左心室用含4%多聚甲醛、0.75%苦味酸和0.075%戊二醛的PB灌注固定。灌注结束后立即取L2~4段脊髓,用不含戊二醛的上述固定液后固定4~6h,继而以0.01 mol/L磷酸盐缓冲液(PBS;pH7.3)漂洗1~2h后进行振动切片(片厚50~70 μm)。切片经防冰晶处理(切片在含15%甘油、20%庶糖的PBS中振摇沉底)后,以液氮速冻0.5~1 min,并以PBS迅速回温。接着对切片进行包埋前电镜单标或双标染色[12]:(1)I-B4单标染色:2 mg/L生物素化的I-B4(BSI-B4,Sigma)4℃下孵育40~45h,ABC复合物(1∶100)室温孵育2h,含0.03%DAB和0.003%H2O2的Tris-HCl缓冲液(TB,pH7.6)呈色15~20min;(2)I-B4与MOR双标染色:2 mg/L生物素化的I-B4与0.4 mg/L的豚鼠抗MOR C末端多肽抗体的混合物4℃下孵育40~45h;ABC复合物(1∶100)与纳金标记的羊抗豚鼠IgG Fab’片段(1∶100~150,Nanoprobes)的混合物室温孵育2h,银加强液(HQ silverTM,Nanoprobes)室温反应5~10 min;含0.03% DAB和0.003%H2O22的TB呈色15~20 min。在上述单标及双标染色中,I-B4、各种抗体和ABC复合物等试剂均以含3%牛血清白蛋白的PBS稀释。标记反应结束后,切片以1%锇酸(以PB配制)后固定30~40 min,常规脱水、Epon812浸透、平板包埋、聚合。在体视显微镜下仔细切取标记反应满意的阳性部位(脊髓后角浅层),以502快粘胶将其粘于树脂块头上进行超薄切片。切片经过或不经过电子染色后在电镜下观察。
, 百拇医药
结果
1. 辣椒素对MOR免疫反应性的影响
正常对照组大鼠脊髓内,MOR免疫反应性主要分布在后角浅层(Ⅰ~Ⅱ层),在第Ⅱ层中最强,第Ⅰ层中呈中等强度(图1)。在高倍镜下可见少数MOR阳性胞体存在于第Ⅱ层中,但在第Ⅰ层中未见阳性胞体。在辣椒素注射组,在大鼠蛛网膜下腔注射辣椒素后第3d天,脊髓后角Ⅰ~Ⅱ层内的MOR免疫反应性即已减弱,在第7d减弱更明显(图2),但分布均无变化。
2. MOR免疫反应性的超微结构定位
在I-B4单标切片中,电镜下可见脊髓后角浅层内一些轴突终末被标记,反应产物弥散性分布在阳性轴突终末内的囊泡膜上,使囊泡膜的电子密度明显增高(图3)。在双标切片上,代表MOR的阳性标记信号呈大小不一、电子密度很高的颗粒(银加强后的纳金-银颗粒),其形状多为圆形,颗粒较大者形状稍不规则(图4~6)。MOR既存在于一些树突内,也定位在一些轴突及其终末内(包括部分呈I-B4结合反应阳性的轴突终末)(图4~6)。在树突中,MOR多定位于树突膜上,少数可见于树突胞质中(图4,6)。在树突膜上的颗粒除少数与突触后膜有关(图4)外,多数定位在非突触膜上(图4,6)。MOR免疫反应性在I-B4阳性和I-B4阴性的轴突或轴突终末上的定位基本一致。在I-B4阳性轴突终末中,MOR既存在于轴膜上也存在于终末胞质内(图4~6)。在胞质中的MOR多与突触小泡有关,而分布在轴膜上的MOR除极少数存在于突触前膜上外,绝大多数位于突触前膜以外部位(图4~6)。
, http://www.100md.com
讨论
阿片受体是一组G蛋白偶联受体,至少包括μ、δ和κ 3个亚型[4],其中μ亚型(MOR)与外源性阿片类物质-吗啡或其内源性配基-内吗啡肽具有极高的亲合力[5,13]。随着MOR分子克隆和相应抗体制备的成功,使MOR的原位杂交和免疫组织化学研究成为可能。原位杂交研究显示,部分脊神经节细胞(包括小细胞)可表达MOR[4,6];免疫组织化学研究则观察到一些中小型脊神经节细胞呈MOR阳性免疫反应[7];脊神经后根切断后,后角浅层MOR免疫反应性明显减弱[14]。由此表明初级感觉神经元含MOR,后角浅层内部分MOR来自初级感觉神经元。辣椒素是一种对传入痛觉的小神经节细胞具有特异性毒性的神经毒剂[8],蛛网膜下腔注射辣椒素可导致来自初级传入神经元的C纤维变性[8,15],因而辣椒素是选择性研究C纤维的一种有用的工具药。在本研究中,当蛛网膜下腔注射辣椒素后,脊髓后角Ⅰ~Ⅱ层内的MOR免疫反应性因C纤维变性而明显减弱,表明脊髓后角内的MOR有相当一部分系来自小的初级传入神经元,并定位在终止于后角浅层的C纤维中枢突中。
, http://www.100md.com
已有免疫电镜观察发现在脊髓后角浅层内有轴突终末含MOR,但这些含MOR的轴突终末是否为初级传入C纤维的终末则未加以鉴定[5]。griffonia simplicifolia的同工凝集素I-B4能与小的初级传入神经元上的D-半乳糖残基选择性结合,在脊髓后角中能鉴别包括P物质能纤维在内的无髓初级传入纤维即C纤维[9],I-B4与D-半乳糖残基的结合反应是C纤维上的一种特异性组织化学标记[9,12]。在本实验的双标电镜研究部分,我们观察到在脊髓后角浅层,部分呈I-B4结合反应阳性的轴突终末含有MOR免疫反应性。这一结果进一步证明了MOR存在于包括C纤维在内的初级传入纤维终末中,为MOR激动剂能对C纤维的传入或其中递质的释放进行突触前抑制的观点提供了直接的形态学证据。
后根切断术后,脊髓后角内仍保留一定强度的MOR免疫反应性[14];含脑啡肽的轴突终末与脊髓后角神经元的树突间存在轴树突触[15];阿片受体激动剂可抑制离子电泳导入的P物质、兴奋性氨基酸对后角神经元的兴奋作用[1,5]。这些资料均提示阿片受体存在于后角神经元的树突或胞体上,Cheng等[5]的报道和本研究观察到的MOR在脊髓后角中的一些树突上的定位则进一步证明了这一点。
, 百拇医药
无论是在轴突终末中,还是在树突中,MOR极少定位于突触处(前膜或后膜),而主要定位于非突触部位。在孤束核[16]等处,MOR的超微结构定位也是如此。我们以前曾在以辣椒素导致C纤维变性的大鼠脊髓后角内观察到,含脑啡肽的轴突终末与C纤维的变性终末间极少形成典型的轴轴突触,而非突触性的轴轴接触则相对较多[15]。因此,吗啡或内源性吗啡样物质的非突触释放和弥散及在非突触部位通过MOR发挥作用可能更为重要。

图版说明
图1 对照组大鼠脊髓后角Ⅰ~Ⅱ层内的MOR免疫反应性
图2 辣椒素处理组脊髓后角Ⅰ~Ⅱ层内MOR免疫反应性较对照组明显减弱
图3 脊髓后角浅层内一I-B4标记的轴突终末(A1)和一非I-B4标记的轴突终末(A2)与同一树突(D1)形成非对称性轴-树突触,A1还与另一树突(D2)形成非对称性轴-树突触。三角示特化的突触后膜
, http://www.100md.com
图4 脊髓后角浅层内一轴突终末(A)与3个树突(D1~D3)分别形成轴树突触。在D1、D2中可见代表MOR免疫反应性的纳金-银颗粒主要分布在树突的非突触部位,D1中还可见纳金-银颗粒位于突触后膜(箭头)
图5 脊髓后角浅层内I-B4与MOR双标轴突终末(A),MOR免疫反应性(纳金-银颗粒)定位于突触前膜(大三角)、非突触部位的轴膜(小三角)及轴质中,并见一纳金-银颗粒定位于树突的突触后膜上(箭头)
图6 脊髓后角浅层中一含MOR的I-B4阳性轴突终末(A)、一MOR阳性树突(D1)与3个MOR阴性树突(D2~D4)。纳金-银颗粒标记的MOR在轴突终末和树突中均定位于非突触部位。三角示特化的突触后膜。标尺:图1,2中为200 μm,图3~6中为0.5 μm
Expanation of figures
Fig.1 MOR immunoreactivity in the laminae Ⅰ-Ⅱ of the spinal dorsal horn of control rat.
, 百拇医药
Fig.2 MOR immunoreactivity decreases markedly in the laminae Ⅰ-Ⅱ of the spinal dorsal horn of the rat treated with capsaicin,as compared with that of control rat.
Fig.3 An I-B4-positive axonic terminal (A1) and an I-B4-negative axonal terminal(A2) in the suerficial layers of the spinal dorsal horn form asymmertic axodendritic synapses with a same dendrite (D1) and A1 synapses asymmetrically with another dendrite(D2).Trigons point to the specialized postsynaptic membranes.
, 百拇医药
Fig.4 An axonal terminal (A) formed axodendritic synapses with 3 dendrites(D1~D3),respectively,in the superficial layers of the spinal dorsal horn.In D1 and D2,MOR immunoreactivities indicated by nanogold-silver particles are mainly distributed in the nonsynaptic membranes,but in D1, a nanogold-silver particle pointed with an arrow is located on postsynaptic membrane.
Fig.5 An axonal terminal (A) double-labelled with I-B4 and MOR in the superficial layers of the spinal dorsal horn in which MOR immunoreactivities indicated by nanogold-silver particles are localized on presynaptic membrane(large trigon),on axonal membrane of nonsynaptic portion(small trigon)and in axoplasma.One nanogold-silver particle is also seen to be localized on the postsynaptic membrane(arrow).
, 百拇医药
Fig.6 An I-B4-postive axonic terminal(A) containing MOR and a MOR-positive dendrites(D1) and three MOR-negative dendrites(D2-D4) in the superficial layers of the spinal dorsal horn.MOR labeled by nanogold-silver particles are nonsynaptically localized in both axonal terminal and dendrites.Trigon points to the specialized postsynaptic membrane.
Scale bar,200 μm in Fig.1 and 2,0,5 μm in Fig.3-6.
* 国家自然科学基金(No.39770386)和国家教委留学回国人员科研基金资助课题
, 百拇医药
△ Department of Histology and Embryology,Tong Ji Medical University, Wuhan 430030,China
参考文献
[1]Yoshimura M,North RA.Substantia gelatinosa neurones hyperpolarized in vitro by enkephalin.Nature,1983,305(5934):529
[2]MacDonald RL,Nelson PG.Specific-opiate-induced depression of transmitter release form dorsal root ganglion cells in culture.Science,1978,199(4336):1449
, 百拇医药
[3]Jessell TM,Iversen LL.Opiate analgesics inhibit substance P release from rat trigeminal nucleus.Nature,1977,268(5620):549
[4]Minami M,Satch M.Molecular biology of the opioid receptors:structures funtions and distributions.Neurosci Res,1995,23(1):121
[5]Cheng PY,Moriwaki A,Wang JB,et al.Ultrastructural localization of μ-opioid receptors in the superficial layers of the rat cervical spinal cord:extrasynaptic localization and proximityto Leu5-enkephalin.Brain Res,1996,731(1);141
, http://www.100md.com
[6]Mansour A,Fox CA,Burke S,et al.Mu,delta,and kappa opioid receptor mRNA expression in the rat CNS:An in situ hybridization study.J Comp Neurol,1994,350(3):412
[7]Ding Y Q,Kaneko T,Nomura S,et al.Immunohistochemical localization of μ-opioid receptors in the central nervous system of the rat.J Comp Neurol,1996,367(3):375
[8]Fitzgerald M.Capsaicin and sensory neuron-A review.Pain,1983,15(1):109
, http://www.100md.com [9]Streit WJ,Schulte BA,Balentine JD,et al.Evidence for glycoconjugate in nociceptive primary sensory neurons and its origin from the Golgi complex.Brain Res,1986,377(1):1
[10]Yaksh TL,Rudy TA.Chronic catheterization of the spinal subsubarachnoid space.Physiol Behav,1976,17(3):1031
[11]Spampinato S.Romuald P,Candaletti S,et al.Distinguishable effects of intrathecal dynorphins,somatostatin,neurotensin and s-calcitonin on nociception and motor function in the rat.Pain,1988,35(1):95
, 百拇医药
[12]王小丽,李宏莲,杨世民,等.P物质与Griffonia simplicifolia I-B4结合位点在大鼠一级传入神经元内共存.神经解剖学杂志,1998,14(3):(印刷中)
[13]韩济生,万有.“内吗啡肽”的发现是阿片肽研究的一次突破.生理科学进展,1997,28(3):237
[14]Ding Y Q,Nomura S,Kaneko T,et al.Co-localization of μ opioid receptor-like and substance P-like immunoreactivities in axon terminals within the superficial layers of the medullary and spinal dorsal horn of the rat.Neuroscience Lett,1995,198(1):45
, 百拇医药 [15]李和,水野升.大鼠脊髓后角内甲啡肽标记与非标记结构与C纤维间关系的免疫电镜研究.神经解剖学杂志,1996,12(4):401
[16]Cheng PY,Lin Chen LY,Chen C,et al.Immunolabeling of μ opioid receptors in the rat nucleus of the solitary tract extrasynaptic plasmalemmal localization and association with leu5-enkephalin.J Comp Neurol,1996,371(4):522
收稿1998-04 修回1998-10, 百拇医药