马铃薯Y病毒普通系外壳蛋白基因在大肠杆菌中的表达*
作者:王振东 张 敏 谷达 上田一郎
单位:王振东 张 敏(沈阳农业大学植保系,沈阳 110161);谷达 上田一郎(日本北海道大学农学部植物ウイルス学讲座,日本札幌060)
关键词:马铃薯Y病毒普通系;外壳蛋白基因;表达产物;抗血清
中国病毒学990212 摘 要 将马铃薯Y病毒普通系(PVY0)的外壳蛋白基因克隆到表达质粒pMAL-c2中,构建这一基因在大肠杆菌中的表达载体pMAL-c2-PVY0CP。SDS-PAGE及Western blotting检测结果表明,这一表达栽体在E.coli DH5α中经IPTG诱导可表达分子量为71.8kDa的特异性融合蛋白。以amylose resin亲合柱层析纯化这一融合蛋白为抗原,免疫家兔制备了效价为1∶1024的特异性抗血清。用该抗血清可通过对流免疫电泳、免疫双扩散及Western blotting对PVY进行检测。
, http://www.100md.com
The Expression of Potato Virus Y Common Strain (PVY0)
Coat Protein Gene in Escherichia coli
Wang Zhendong1 Zhang Min1 Tatsuji Hataya2 Ichiro Uyeda2
1(Department of Plant Protection, Shenyang Agricultural University, Shenyang 110161)
2(Laboratory of Plant Virology, Faculty of Agriculture, Hokkaido University, Supporo 060, Japan)
, 百拇医药
Abstract The IPTG-inducible expression vector pMAL-c2-PVY0 CP contaning coat protein (CP) gene of potato virus Y common strain (PVY0) was constructed by cloning PVY0 CP gene into plasmid pMAL-c2 and transferred into E.coli DH5α. The results of SDS-PAGE and Western blotting show that the specific fusion protein with Mr 71.8 kDa was expressed in E.coli DH5α by IPTG induction. The fusion protein expressed was separated by amylose resin affinity chromatography and injected into rabbit to prepare antiserum. The titer of antiserum is 1∶1024 detected by micro-precipitation. The antiserum is useful for identification of PVY in plant materials.
, http://www.100md.com
Key words PVY common strain, Coat proteins, Expression products, Antiserum
马铃薯Y病毒(Potato virus Y,PVY)是马铃薯Y病毒组的模式成员,分布世界各地,有多个株系分化,主要危害马铃薯及烟草,造成严重经济损失[1]。PVY粒体呈线条状,含有大小约10kb的单链正义RNA基因组,基因组5′端有一基因组连接蛋白(VPg)及3′端有一Poly A,该基因组为一长的开放读框(ORF),可翻译成一个大的聚合蛋白[2]。通过PVYN(Tobacco veinal necrosis strain)全核酸序列分析,建立了其基因图谱。基因所编码的蛋白自5′端至3′端分别是31K蛋白、辅助蛋白(Helper component, HC)、胞质内含体蛋白(Cytoplasmic inclusion protein, CI)、基因组连接蛋白(Genome-linked protein, VPg),两个核内含体蛋白(Nuclear inclusion protein)即蛋白酶(Protease NIa)和复制酶(Polymerase NIb)及位于3′非翻译区上游的外壳蛋白(CP)[2]。本文将报道PVY0外壳蛋白基因在大肠杆菌中的表达,及用表达产物制备特异性抗血清用于PVY检测的结果。
, 百拇医药
1 材料与方法
1.1 材料
1.1.1 菌种、质粒与单克隆抗体 E.coli DH5α;含有PVY0外壳蛋白基因的质粒pGEM7Z-PVY0CP;表达质粒pMAL-c2及单克隆抗体MoAb PVY0-21H05与MoAb PVYN-4E7均由日本国北海道大学农学部植物病毒研究室提供。
1.1.2 酶及试剂 限制性内切酶;连接酶;PCR试剂盒分别购自Boehringer Mannheim, Amersham及日本宝酒造公司。
1.2 方法
1.2.1 PVY0CP基因的PCR扩增
, http://www.100md.com
1.2.1.1 引物 按文献[3]报道的PVY0序列合成一对CP基因引物。为便于克隆,在5′端引物上设计了EcoRI位点,在3′端引物上设计了PstI位点。引物序列为:5′端引物5′-CTC GAA TTC ATG GAT CAC CAT CAA G-3′;3′端引物5′-CGA CTG CAG TCA CAT GAT CTT GAC-3′。
1.2.1.2 PCR扩增 以质粒pGEM7Z-PVY0CP为模板,用5′和3′端引物扩增CP基因,PCR条件为94℃变性60s,55℃退火30s,72℃合成60s,扩增25个循环。
1.2.2 大肠杆菌表达载体的构建
酒精沉淀纯化PCR产物,用EcoRI和PstI双酶切后插入表达质粒pMAL-c2相应切点中转化E.coli DH5α。
, http://www.100md.com
1.2.3 重组子的鉴定筛选
碱法提取质粒[4],用EcoRI和PstI双酶切及用2.1.1项中的两段引物进行PCR扩增鉴定重组子。
1.2.4 表达载体的诱导表达
含PVY0CP基因表达载体的DH5α经37℃摇动培养过夜活化后,取10μL菌液接种到含0.1mmol/L IPTG的2mL Rich medium中,于37℃摇动培养诱导表达4h。
1.2.5 表达产物的SDS-PAGE分析
取培养物1.5mL装入eppendorf管中,离心收集细胞,细胞悬浮在75μL TE缓冲液中。取样品7μL加等量上样缓冲液,于100℃变性5min,按文献[4]方法进行SDS-PAGE电泳。电泳毕,用考马斯亮蓝染色,10%冰乙酸脱色,干燥胶板后拍照。
, http://www.100md.com
1.2.6 表达产物的Western blotting分析
1.2.6.1 转膜 SDS-PAGE后,凝胶放转移缓冲液(25mmol/L Tris, 192mmol/L 甘氨酸,20%(V/V)甲醇,pH8.3)中漂洗20min。按文献[5]方法将蛋白质从凝胶中电转移到硝酸纤维(NC)膜上,电压100V,电转移60min。
1.2.6.2 封闭 电转移毕的NC膜在50mL TBST缓冲液(10mmol/L Tris-HC1,pH 8.0,150mmol/L NaCl, 0.05% Tween-20)中漂洗,转入封闭液中(TBST+1% BSA)中封闭60min。
1.2.6.3 第一抗体反应 封闭后的NC膜装入小塑料袋中,加用TBS稀释的单克隆抗体MoAb PVY0-21H05或MoAb PVYN-4E7(1∶1000)5mL封闭塑料袋,于37℃保温60min,取出NC膜用TBST洗3次,每次15min。
, 百拇医药
1.2.6.4 第二抗体反应 NC膜装入小塑料袋中,加入用TBS稀释的羊抗兔-IgG-ALP(1∶800)5mL,封闭塑料袋,于37℃保温60min。同1.2.6.3项洗膜。
1.2.6.5 显色反应 装有NC膜的塑料袋中加入显色液5mL(即5 mL碱性磷酸缓冲液中含25μL 75mg/mL的氮蓝四唑二甲基甲酰胺液和18.75μL 50mg/mL的5′-bromo-4-Chloro-3-indoxyl phosphata二甲基甲酰胺液),于室温在暗处显色至条带清晰,取出NC膜干燥后拍照。
1.2.7 表达产物的纯化
按文献[6]方法进行表达产物的纯化。离心收集诱导表达细胞,用50mL裂解液悬浮细胞后用超声波处理,离心去细胞碎片,上清加3倍体积过柱缓冲液,样品过amylose resin亲合层析柱,流速为1mL/min。用3倍床体积的含0.25% Tween-20的过柱缓冲液洗床,流速为1 mL/min。最后用含10mmol/L麦芽糖的过柱缓冲液洗床,流速为1mL/min,流出液中含有表达产物,收集备用。
, http://www.100md.com
1.2.8 抗血清的制备
以纯化的表达产物为抗原对家兔进行耳静脉免疫注射。每周免疫一次,每次免疫抗原量为200~250μg,共免疫4次,最后一次免疫注射一周后采血,分离抗血清备用。
1.2.9 抗血清效价测定及PVY检测
以表达产物为抗原,用微量沉淀法测定抗血清效价。以感染PVY并表现病状的马铃薯叶片汁液为抗原,与所制备的抗血清进行对流免疫电泳,琼脂双扩散及Western blotting,检测样品中的PVY。
2 结果
2.1 PCR扩增结果 经1% agarose-EB电泳检测,PCR产物中含0.80kb的特异性核苷酸片段。结果见图1。该片段大小与文献[3]报道的PVY0CP基因一致。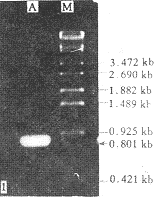
, http://www.100md.com
图1 PCR产物电泳图谱
A:PCR产物 M:λ-DNA-StyI marker
Fig.1 The electrophoresis pattern of PCR products
A:The products of PCR M:λ-DNA-StyI marker
2.2 表达载体的酶切及PCR鉴定结果 重组子DNA用EcoRI和PstI双酶切,可切下0.80kb的核苷酸片段,与预期大小一致,结果见图2。用一对PVY CP特异性引物进行PCR可扩增出0.80kb的DNA片段(图略),并把这一重组表达载体命名为pMAL-c2-PVY0CP,其构建策略见图3。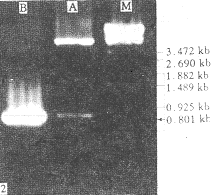
, 百拇医药
图2 重组克隆的酶切电泳图谱
A:EcoRI和PstI双酶切B:PCR产物 M:λ-DNA-StyI marker
Fig.2 The electrophoresis endonuclease restriction map of recombinant
A:EcoRI+Pst I cut B:PCR products M:λ-DNA-Sty I marker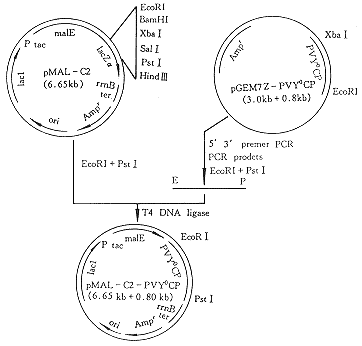
图3 表达载体pMAL-c2-PVY0CP的构建
Fig.3 Construction of expression vector pMAL-c2-PVY0 CP
, 百拇医药
2.3 表达产物的SDS-PAGE分析 SDS-PAGE电泳结果表明,含有pMAL-c2-PVY0 CP的工程菌DH5α经IPTG诱导后产生了一条分子量为71.8kDa的特异性蛋白质条带,分子量大小与预期一致,但在对照处理样品中无此条带产生。结果见图4。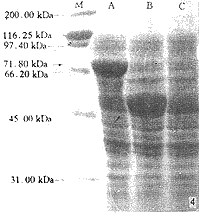
图4 表达产物的SDS-PAGE电泳图谱
M:蛋白分子量标准;A:从含有pMAL-c2-PVY0 CP的E.coli DH5α细胞中提取的可溶性蛋白;B:从含有pMAL-c2的E.coli DH5α细胞中提取的可溶性蛋白;C:从E.coli DH5α细胞中提取的可溶性蛋白。
Fig.4 The SDS-PAGE pattern of CBB stained
, 百拇医药
M:Protein molecular weight standards marker;
A:The soluble proteins extracted from E.coli DH5α cell transformed by expression vectors of pMAL-c2-PVY0 CP;
B:The soluble proteins extracted from E.coli DH5α cell transformed by pMAL-c2;
C:The soluble proteins extracted from E.coli DH5α cell.
2.4 表达产物的Western blotting分析 图5示表达产物与单克隆抗体MoAb PVY0-21H05在NC膜上的Western blotting结果,含pMAL-c2-PVY0 CP的工程菌DH5α有特异性杂交条带出现(泳道A),其它对照样品无杂交条带出现。同时也用MoAb PVYN-4E7在另一块NC膜上进行Western blotting,但无杂交条带出现,于是获得所表达的融合蛋白含有PVY0 CP亚基的直接实验证据。
, 百拇医药
图5 Western blotting图谱(单克隆抗体为MoAb PVY0-21H05)箭头示表达融合蛋白的位置 (71.8 kDa)
Fig.5 The pattern of Western blotting analysis (PVY0 specific MoAb PVY0-21H05 was used as a primary antibody) Arrow indicated the position of expression fusion protein (71.8 kDa)
2.5 抗血清的效价测定及PVY检测结果 微量沉淀法测得抗血清的效价为1∶1024,用该抗血清可用对流免疫电泳、琼脂双扩散及Western blotting检测出马铃薯叶片中的PVY。结果见图6(琼脂双扩散和Western blotting图略)。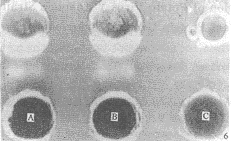
, 百拇医药
图6 对流免疫电泳反应
1.上排孔:用表达产物制备的抗血清;
2.下排孔:A和B为从感染PVY的马铃薯叶片中榨取的汁液,C为健株马铃薯叶片汁液。
Fig.6 Immunoelectrophoresis reaction
1.Up lane:PVY0 antiserum prepared by expression products in E.coli;
2.Down lane:The sap extracted from PVY infected potato leaf (A,B) and healthy potato leaf sap(C).
3 讨论
, http://www.100md.com
马铃薯Y病毒主要侵染茄科作物、园艺作物、牧草及花卉等,造成严重经济损失。近年来,马铃薯种薯及一些名贵花卉的组织培养快速繁殖产业,正在我国一些农业开发区院所及企业蓬勃兴起,于是便涉及到培养材料及组培苗的带毒检测问题。血清学方法是检测病毒的快速灵敏方法,但需大量高纯度的特异性抗血清。以往多用提纯的病毒粒体为抗原制备抗血清,但有很多弊端。如一些病毒在寄主体内含量较低,难以提纯获得足够的抗原。还有一些病毒分离提纯困难不易得到纯化的病毒粒体,以此为抗原制备的抗血清含有寄主蛋白抗体,通常产生假阳性反应,很难准确判断血清学反应结果。而通过基因工程技术使病毒外壳蛋白基因在原核细胞中表达,以表达产物的抗原制备抗血清,便可克服上述弊端,得到大量高特异性的抗血清。同时所构建的工程菌株可在超低温条件下长期保存,根据需要随时诱导表达用于抗血清的制备,可见这是一条制备抗血清的有效途径。
本研究采用的表达载体pMAL-c2是个带有多克隆位点(Poly linker)的载体。多克隆位点的上游含有malE基因,可编码产生42 kDa的麦芽糖结合蛋白(maltose-binding protein, MBP),因此外源基因以融合蛋白形式表达,一般情况下表达率可达到细胞总蛋白的20~40%,且表达产物极易通过亲合层析纯化,多数情况下所表达的病毒融合蛋白不影响其免疫原性和反应原性。本研究所构建的表达载体pMAL-c2-PVY0 CP在E.coli DH5α及JM 109中都能用IPTG诱导表达,所表达的融合蛋白为71.8 kDa(42 kDa+29.8 kDa)。在DH5α中,表达率可达细胞总蛋白的30%左右,IPTG诱导表达最适时间为4 h,诱导表达时间短于4 h或长于4 h都有表达率下降趋势。本研究制备的抗血清可用对流免疫电泳、琼脂双扩散及Western blotting进行PVY鉴定,为各种植物材料中PVY的检测提供了具有使用价值的特异性抗血清。
, http://www.100md.com
* 本研究受辽宁博士基金资助
参考文献
[1] Ward C W, Shukla D D. Taxonomy of potyviruses current problems and some solutions. Intervirology, 1991,32:269~296
[2] Jose L R, Sonia L, Juan A G. Review article, highlights and prospects of potyvirus molecular biology. J Gen Virol, 1992,73:1~16
[3] Bravo-Almonacid F, Mentaberry A N. Nucleotide cDNA sequence coding for the PVY0 coat protein. Nucl Acids Res, 1989,17:4401~4405
, 百拇医药
[4] Sambrook J, Fritsch E F, Maniatis T. Molecular cloning, a laboratory manual. 2nd ed. New York: Cold Spring Harbor Laboratory Press, 1989,18.47~18.55
[5] Towbin H, Staehelin T, Gordon J. Electrophoretic transfer of protein from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Proc Natl Acad Sci USA, 1979,76:4350~4354
[6] Ausubel F M, Brent R, Kingston K E et al. Expression and purification of maltose-binding protein fusions. In: Ausuble FM ed. Current protocols in molecular biology. New York: Greene Publishing and Wiley-Interscience. 1991.16.6.3~16.6.6
收稿日期:1998-04-20,修回日期:1998-06-29, 百拇医药
单位:王振东 张 敏(沈阳农业大学植保系,沈阳 110161);谷达 上田一郎(日本北海道大学农学部植物ウイルス学讲座,日本札幌060)
关键词:马铃薯Y病毒普通系;外壳蛋白基因;表达产物;抗血清
中国病毒学990212 摘 要 将马铃薯Y病毒普通系(PVY0)的外壳蛋白基因克隆到表达质粒pMAL-c2中,构建这一基因在大肠杆菌中的表达载体pMAL-c2-PVY0CP。SDS-PAGE及Western blotting检测结果表明,这一表达栽体在E.coli DH5α中经IPTG诱导可表达分子量为71.8kDa的特异性融合蛋白。以amylose resin亲合柱层析纯化这一融合蛋白为抗原,免疫家兔制备了效价为1∶1024的特异性抗血清。用该抗血清可通过对流免疫电泳、免疫双扩散及Western blotting对PVY进行检测。
, http://www.100md.com
The Expression of Potato Virus Y Common Strain (PVY0)
Coat Protein Gene in Escherichia coli
Wang Zhendong1 Zhang Min1 Tatsuji Hataya2 Ichiro Uyeda2
1(Department of Plant Protection, Shenyang Agricultural University, Shenyang 110161)
2(Laboratory of Plant Virology, Faculty of Agriculture, Hokkaido University, Supporo 060, Japan)
, 百拇医药
Abstract The IPTG-inducible expression vector pMAL-c2-PVY0 CP contaning coat protein (CP) gene of potato virus Y common strain (PVY0) was constructed by cloning PVY0 CP gene into plasmid pMAL-c2 and transferred into E.coli DH5α. The results of SDS-PAGE and Western blotting show that the specific fusion protein with Mr 71.8 kDa was expressed in E.coli DH5α by IPTG induction. The fusion protein expressed was separated by amylose resin affinity chromatography and injected into rabbit to prepare antiserum. The titer of antiserum is 1∶1024 detected by micro-precipitation. The antiserum is useful for identification of PVY in plant materials.
, http://www.100md.com
Key words PVY common strain, Coat proteins, Expression products, Antiserum
马铃薯Y病毒(Potato virus Y,PVY)是马铃薯Y病毒组的模式成员,分布世界各地,有多个株系分化,主要危害马铃薯及烟草,造成严重经济损失[1]。PVY粒体呈线条状,含有大小约10kb的单链正义RNA基因组,基因组5′端有一基因组连接蛋白(VPg)及3′端有一Poly A,该基因组为一长的开放读框(ORF),可翻译成一个大的聚合蛋白[2]。通过PVYN(Tobacco veinal necrosis strain)全核酸序列分析,建立了其基因图谱。基因所编码的蛋白自5′端至3′端分别是31K蛋白、辅助蛋白(Helper component, HC)、胞质内含体蛋白(Cytoplasmic inclusion protein, CI)、基因组连接蛋白(Genome-linked protein, VPg),两个核内含体蛋白(Nuclear inclusion protein)即蛋白酶(Protease NIa)和复制酶(Polymerase NIb)及位于3′非翻译区上游的外壳蛋白(CP)[2]。本文将报道PVY0外壳蛋白基因在大肠杆菌中的表达,及用表达产物制备特异性抗血清用于PVY检测的结果。
, 百拇医药
1 材料与方法
1.1 材料
1.1.1 菌种、质粒与单克隆抗体 E.coli DH5α;含有PVY0外壳蛋白基因的质粒pGEM7Z-PVY0CP;表达质粒pMAL-c2及单克隆抗体MoAb PVY0-21H05与MoAb PVYN-4E7均由日本国北海道大学农学部植物病毒研究室提供。
1.1.2 酶及试剂 限制性内切酶;连接酶;PCR试剂盒分别购自Boehringer Mannheim, Amersham及日本宝酒造公司。
1.2 方法
1.2.1 PVY0CP基因的PCR扩增
, http://www.100md.com
1.2.1.1 引物 按文献[3]报道的PVY0序列合成一对CP基因引物。为便于克隆,在5′端引物上设计了EcoRI位点,在3′端引物上设计了PstI位点。引物序列为:5′端引物5′-CTC GAA TTC ATG GAT CAC CAT CAA G-3′;3′端引物5′-CGA CTG CAG TCA CAT GAT CTT GAC-3′。
1.2.1.2 PCR扩增 以质粒pGEM7Z-PVY0CP为模板,用5′和3′端引物扩增CP基因,PCR条件为94℃变性60s,55℃退火30s,72℃合成60s,扩增25个循环。
1.2.2 大肠杆菌表达载体的构建
酒精沉淀纯化PCR产物,用EcoRI和PstI双酶切后插入表达质粒pMAL-c2相应切点中转化E.coli DH5α。
, http://www.100md.com
1.2.3 重组子的鉴定筛选
碱法提取质粒[4],用EcoRI和PstI双酶切及用2.1.1项中的两段引物进行PCR扩增鉴定重组子。
1.2.4 表达载体的诱导表达
含PVY0CP基因表达载体的DH5α经37℃摇动培养过夜活化后,取10μL菌液接种到含0.1mmol/L IPTG的2mL Rich medium中,于37℃摇动培养诱导表达4h。
1.2.5 表达产物的SDS-PAGE分析
取培养物1.5mL装入eppendorf管中,离心收集细胞,细胞悬浮在75μL TE缓冲液中。取样品7μL加等量上样缓冲液,于100℃变性5min,按文献[4]方法进行SDS-PAGE电泳。电泳毕,用考马斯亮蓝染色,10%冰乙酸脱色,干燥胶板后拍照。
, http://www.100md.com
1.2.6 表达产物的Western blotting分析
1.2.6.1 转膜 SDS-PAGE后,凝胶放转移缓冲液(25mmol/L Tris, 192mmol/L 甘氨酸,20%(V/V)甲醇,pH8.3)中漂洗20min。按文献[5]方法将蛋白质从凝胶中电转移到硝酸纤维(NC)膜上,电压100V,电转移60min。
1.2.6.2 封闭 电转移毕的NC膜在50mL TBST缓冲液(10mmol/L Tris-HC1,pH 8.0,150mmol/L NaCl, 0.05% Tween-20)中漂洗,转入封闭液中(TBST+1% BSA)中封闭60min。
1.2.6.3 第一抗体反应 封闭后的NC膜装入小塑料袋中,加用TBS稀释的单克隆抗体MoAb PVY0-21H05或MoAb PVYN-4E7(1∶1000)5mL封闭塑料袋,于37℃保温60min,取出NC膜用TBST洗3次,每次15min。
, 百拇医药
1.2.6.4 第二抗体反应 NC膜装入小塑料袋中,加入用TBS稀释的羊抗兔-IgG-ALP(1∶800)5mL,封闭塑料袋,于37℃保温60min。同1.2.6.3项洗膜。
1.2.6.5 显色反应 装有NC膜的塑料袋中加入显色液5mL(即5 mL碱性磷酸缓冲液中含25μL 75mg/mL的氮蓝四唑二甲基甲酰胺液和18.75μL 50mg/mL的5′-bromo-4-Chloro-3-indoxyl phosphata二甲基甲酰胺液),于室温在暗处显色至条带清晰,取出NC膜干燥后拍照。
1.2.7 表达产物的纯化
按文献[6]方法进行表达产物的纯化。离心收集诱导表达细胞,用50mL裂解液悬浮细胞后用超声波处理,离心去细胞碎片,上清加3倍体积过柱缓冲液,样品过amylose resin亲合层析柱,流速为1mL/min。用3倍床体积的含0.25% Tween-20的过柱缓冲液洗床,流速为1 mL/min。最后用含10mmol/L麦芽糖的过柱缓冲液洗床,流速为1mL/min,流出液中含有表达产物,收集备用。
, http://www.100md.com
1.2.8 抗血清的制备
以纯化的表达产物为抗原对家兔进行耳静脉免疫注射。每周免疫一次,每次免疫抗原量为200~250μg,共免疫4次,最后一次免疫注射一周后采血,分离抗血清备用。
1.2.9 抗血清效价测定及PVY检测
以表达产物为抗原,用微量沉淀法测定抗血清效价。以感染PVY并表现病状的马铃薯叶片汁液为抗原,与所制备的抗血清进行对流免疫电泳,琼脂双扩散及Western blotting,检测样品中的PVY。
2 结果
2.1 PCR扩增结果 经1% agarose-EB电泳检测,PCR产物中含0.80kb的特异性核苷酸片段。结果见图1。该片段大小与文献[3]报道的PVY0CP基因一致。

, http://www.100md.com
图1 PCR产物电泳图谱
A:PCR产物 M:λ-DNA-StyI marker
Fig.1 The electrophoresis pattern of PCR products
A:The products of PCR M:λ-DNA-StyI marker
2.2 表达载体的酶切及PCR鉴定结果 重组子DNA用EcoRI和PstI双酶切,可切下0.80kb的核苷酸片段,与预期大小一致,结果见图2。用一对PVY CP特异性引物进行PCR可扩增出0.80kb的DNA片段(图略),并把这一重组表达载体命名为pMAL-c2-PVY0CP,其构建策略见图3。

, 百拇医药
图2 重组克隆的酶切电泳图谱
A:EcoRI和PstI双酶切B:PCR产物 M:λ-DNA-StyI marker
Fig.2 The electrophoresis endonuclease restriction map of recombinant
A:EcoRI+Pst I cut B:PCR products M:λ-DNA-Sty I marker

图3 表达载体pMAL-c2-PVY0CP的构建
Fig.3 Construction of expression vector pMAL-c2-PVY0 CP
, 百拇医药
2.3 表达产物的SDS-PAGE分析 SDS-PAGE电泳结果表明,含有pMAL-c2-PVY0 CP的工程菌DH5α经IPTG诱导后产生了一条分子量为71.8kDa的特异性蛋白质条带,分子量大小与预期一致,但在对照处理样品中无此条带产生。结果见图4。

图4 表达产物的SDS-PAGE电泳图谱
M:蛋白分子量标准;A:从含有pMAL-c2-PVY0 CP的E.coli DH5α细胞中提取的可溶性蛋白;B:从含有pMAL-c2的E.coli DH5α细胞中提取的可溶性蛋白;C:从E.coli DH5α细胞中提取的可溶性蛋白。
Fig.4 The SDS-PAGE pattern of CBB stained
, 百拇医药
M:Protein molecular weight standards marker;
A:The soluble proteins extracted from E.coli DH5α cell transformed by expression vectors of pMAL-c2-PVY0 CP;
B:The soluble proteins extracted from E.coli DH5α cell transformed by pMAL-c2;
C:The soluble proteins extracted from E.coli DH5α cell.
2.4 表达产物的Western blotting分析 图5示表达产物与单克隆抗体MoAb PVY0-21H05在NC膜上的Western blotting结果,含pMAL-c2-PVY0 CP的工程菌DH5α有特异性杂交条带出现(泳道A),其它对照样品无杂交条带出现。同时也用MoAb PVYN-4E7在另一块NC膜上进行Western blotting,但无杂交条带出现,于是获得所表达的融合蛋白含有PVY0 CP亚基的直接实验证据。

, 百拇医药
图5 Western blotting图谱(单克隆抗体为MoAb PVY0-21H05)箭头示表达融合蛋白的位置 (71.8 kDa)
Fig.5 The pattern of Western blotting analysis (PVY0 specific MoAb PVY0-21H05 was used as a primary antibody) Arrow indicated the position of expression fusion protein (71.8 kDa)
2.5 抗血清的效价测定及PVY检测结果 微量沉淀法测得抗血清的效价为1∶1024,用该抗血清可用对流免疫电泳、琼脂双扩散及Western blotting检测出马铃薯叶片中的PVY。结果见图6(琼脂双扩散和Western blotting图略)。

, 百拇医药
图6 对流免疫电泳反应
1.上排孔:用表达产物制备的抗血清;
2.下排孔:A和B为从感染PVY的马铃薯叶片中榨取的汁液,C为健株马铃薯叶片汁液。
Fig.6 Immunoelectrophoresis reaction
1.Up lane:PVY0 antiserum prepared by expression products in E.coli;
2.Down lane:The sap extracted from PVY infected potato leaf (A,B) and healthy potato leaf sap(C).
3 讨论
, http://www.100md.com
马铃薯Y病毒主要侵染茄科作物、园艺作物、牧草及花卉等,造成严重经济损失。近年来,马铃薯种薯及一些名贵花卉的组织培养快速繁殖产业,正在我国一些农业开发区院所及企业蓬勃兴起,于是便涉及到培养材料及组培苗的带毒检测问题。血清学方法是检测病毒的快速灵敏方法,但需大量高纯度的特异性抗血清。以往多用提纯的病毒粒体为抗原制备抗血清,但有很多弊端。如一些病毒在寄主体内含量较低,难以提纯获得足够的抗原。还有一些病毒分离提纯困难不易得到纯化的病毒粒体,以此为抗原制备的抗血清含有寄主蛋白抗体,通常产生假阳性反应,很难准确判断血清学反应结果。而通过基因工程技术使病毒外壳蛋白基因在原核细胞中表达,以表达产物的抗原制备抗血清,便可克服上述弊端,得到大量高特异性的抗血清。同时所构建的工程菌株可在超低温条件下长期保存,根据需要随时诱导表达用于抗血清的制备,可见这是一条制备抗血清的有效途径。
本研究采用的表达载体pMAL-c2是个带有多克隆位点(Poly linker)的载体。多克隆位点的上游含有malE基因,可编码产生42 kDa的麦芽糖结合蛋白(maltose-binding protein, MBP),因此外源基因以融合蛋白形式表达,一般情况下表达率可达到细胞总蛋白的20~40%,且表达产物极易通过亲合层析纯化,多数情况下所表达的病毒融合蛋白不影响其免疫原性和反应原性。本研究所构建的表达载体pMAL-c2-PVY0 CP在E.coli DH5α及JM 109中都能用IPTG诱导表达,所表达的融合蛋白为71.8 kDa(42 kDa+29.8 kDa)。在DH5α中,表达率可达细胞总蛋白的30%左右,IPTG诱导表达最适时间为4 h,诱导表达时间短于4 h或长于4 h都有表达率下降趋势。本研究制备的抗血清可用对流免疫电泳、琼脂双扩散及Western blotting进行PVY鉴定,为各种植物材料中PVY的检测提供了具有使用价值的特异性抗血清。
, http://www.100md.com
* 本研究受辽宁博士基金资助
参考文献
[1] Ward C W, Shukla D D. Taxonomy of potyviruses current problems and some solutions. Intervirology, 1991,32:269~296
[2] Jose L R, Sonia L, Juan A G. Review article, highlights and prospects of potyvirus molecular biology. J Gen Virol, 1992,73:1~16
[3] Bravo-Almonacid F, Mentaberry A N. Nucleotide cDNA sequence coding for the PVY0 coat protein. Nucl Acids Res, 1989,17:4401~4405
, 百拇医药
[4] Sambrook J, Fritsch E F, Maniatis T. Molecular cloning, a laboratory manual. 2nd ed. New York: Cold Spring Harbor Laboratory Press, 1989,18.47~18.55
[5] Towbin H, Staehelin T, Gordon J. Electrophoretic transfer of protein from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Proc Natl Acad Sci USA, 1979,76:4350~4354
[6] Ausubel F M, Brent R, Kingston K E et al. Expression and purification of maltose-binding protein fusions. In: Ausuble FM ed. Current protocols in molecular biology. New York: Greene Publishing and Wiley-Interscience. 1991.16.6.3~16.6.6
收稿日期:1998-04-20,修回日期:1998-06-29, 百拇医药