固相杂交检测HCV RNA PCR产物方法的建立
作者:王凤水 王 宇 李世拥 安 萍 于 波 冯百芳
单位:北京军区总医院普外科实验室 北京市 100700
关键词:丙型肝炎病毒;RNA,病毒/分析;聚合酶链反应;固相杂交
摘 要 目的 建立简便
摘 要
目的 建立简便、快速的丙型肝炎病毒基因扩增产物的固相杂交检测方法.
方法 将标记有生物素的寡核苷酸引物所扩增的丙肝病毒基因产物,与通过结合在微孔反应板上的特异性探针进行快速杂交,然后通过辣根过氧化物酶标记的抗生物素进行酶联显色,读取光密度值.
结果 应用本方法对血清中丙型肝炎病毒核酸检测,灵敏度可达5拷贝~50拷贝/反应.
, http://www.100md.com
结论 此方法简便、快速、特异性好、敏感性高、结果判定指标客观,可广泛应用于病毒感染的临床诊断和疗效评价及其他基因的扩增检测和基因分型等.
中国图书馆分类号 R373.2
Solid phase hybridization detection of HCV RNA PCR products
WANG Feng-Shui1, WANG Yu2, LI Shi-Yong1, AN Ping1, YU Bo1 and FENG Bai-Fang2
1Department of General Surgery, Chinese PLA Beijing General Hospital, Beijing 100700, China
, http://www.100md.com
2Institute of Hepatology, Beijing Medical University, Beijing 100044, China
Subject headings hepatitis c virus;RNA, viral/analysis; polymerase chain reaction; solid phase hybridization
Abstract
AIM To establish a simple, rapid polymerase chain reaction (PCR) based DNA amplification technique for detecting HCV RNA PCR products.
METHODS For detecting HCV RNA, the primer labeled with biotin was used to amplify viral gene fragment. The 1st PCR product complemently hybridized with the specific probe covalently coupled onto microplate wells. Streptavidine-POD was used in colorimetric detection.
, http://www.100md.com
RESULTS The sensitivity of the detection system is 5 copies-50 copies of hepatitis C genome respectively.
CONCLUSION The method is simple and rapid with high specificity, sensitivity and semiquantification. It can be generally applied in detection of foreign pathogen in blood, body fluid and tissue samples, in clinical diagnosis and evaluation of antiviral therapeutic effect.
0 引言
丙型肝炎病毒(HCV)是输血后非甲非乙肝炎的主要病原体,为单链正股RNA病毒. 我国是肝炎大国,对于持续性HCV感染所致疾病,人们希望找到一种诊断标志,可以较好地反映疾病的发展情况,预后分析以及进行治疗效果评价. 随着基因分子生物学的发展和在病毒感染诊断方面的应用,最近人们越来越多地注意到,传统的PCR方法有一定的缺陷和不足,尤其是缺乏更高的特异性和客观性. 并且注意到病毒持续性感染时,被感染者体内病毒的含量与临床发病情况、对治疗的反应性和预后评价密切相关. 对于HCV感染者来说,被感染者血循环中HCV含量,是影响干扰素治疗效果的主要因素. 病毒含量高者,治疗后病毒阴转率低,并在停药后病毒含量多回复到治疗前水平. 最近又发现,在干扰素治疗初期,通过测定患者体内HCV水平是否降低,可有效地预测长期疗效. 这些观察促进了人们对HCV含量水平检测手段的研究. 由于很多人类致病病毒在人体内含量很低,直接进行核酸杂交,敏感性方面有很大局限,并且一般需要较昂贵的化学发光检测设备. 我们建立了一种基于基因扩增技术,与结合在固相载体上的寡核苷酸进行分子杂交并用酶联显色作为指示的快速、简便的肝炎病毒核酸半定量方法和标准化检测方法. 对病毒核酸特异性扩增产物进行定量分析,主要是基于扩增产物的量与被测样品中原始靶基因的含量有很好的对应关系,可以通过对扩增产物的含量分析,来反映被测病毒的实际含量[1-5].
, http://www.100md.com
1 材料和方法
1.1 材料 固相杂交反应用96孔微孔反应板,购自丹麦Nuck公司. HCV固化探针为5 '-CTCATACTAACGCCATGGCTAGACGCTTTC-3 ',位于HCV基因5 '非编码区,为不同基因型中高保守序列. 上述探针经过化学反应与微孔反应板形成共价键结合. 简要过程如下:寡核苷酸探针以适当浓度在碳二亚胺的作用下,50℃孵育5h. 用洗液洗板5次,每次2min,干燥,抽真空封存于铝箔袋中备用. 血清CH950046为HCV持续性携带者血清,经套式PCR测定为109拷贝/L[6].
1.2 方法
1.2.1 聚合酶链反应 应用异硫氰酸胍-酚-氯仿一步法提取HCV RNA,空气干燥后溶于焦碳酸二乙脂(DEPC)处理的去离子水.
HCV基因逆转录-基因扩增操作如下:10μL逆转录反应体系中含提取的病毒核酸,100U逆转录酶(superscript Gibco-BRL)及逆转录引物,5 '-TATCAGGCAGTACCACAAGG-3 '. 于42℃反应60min,合成cDNA. 基因扩增反应使用生物素标记的正链引物5 '-CTGTGAGGAACTACTGTCTT-3 ',扩增产物为254bp. 反应循环为94℃ 30s;55℃ 30s;72℃ 45s,共进行35个循环,取10μL扩增产物进行20g/L琼脂糖凝胶电泳观察. 套式PCR反应时,取5μL一次PCR产物,用一对内引物进行扩增,特异性扩增产物为145bp.
, 百拇医药
1.2.2 固相杂交 取扩增产物10μL,于94℃热变性10min后置冰浴2min,加至结合有特异性寡核苷酸探针的微孔反应板中,并加杂交液(含500g/L甲酰胺,6×SSC,1×FPG,25mmol/L KH2PO4,2g/LSDS,及200mg/L鱼精DNA)至100μL,充分混匀后于37℃杂交60min. 用37℃预热的洗液洗板4次,每次2min.
1.2.3 酶结合显色 杂交后,反应孔用10g/L小牛血清清蛋白于37℃封闭10min,弃去封闭液,加入100μL辣根过氧化物酶标记的链霉抗生物素2mg/L(Vector,SA-5004,美国)于37℃育30min,用洗液洗板4次,每次2min. 以邻苯二胺显色15min,加100μL 1mol/L硫酸终止反应,测A492nm值.
2 结果
2.1 定量检测条件的确定 HCV基因5 '非编码区寡核苷酸探针溶于0.1×TE,按(500~0.08)ng,100μL/孔,不同浓度包被微孔反应板,取10μL基因扩增产物进行固相杂交,酶反应显色,读取光密度值A492nm. 寡核苷酸探针用量与A492nm的对应关系见图1. 当每个反应孔所用探针量大于200ng时,A492nm值已大大超过光密度计测定线性范围,并趋饱和,本研究中选200ng/孔作为优选工作浓度. 为确定酶联显色时所用过氧化物酶浓度,取2μL PCR产物进行快速杂交,以(5-0.5)mg/L不同浓度的酶进行显色反应(图2). 根据阴性、阳性对照标本A492nm值的比较. 选取2mg/L酶浓度作为常规工作浓度.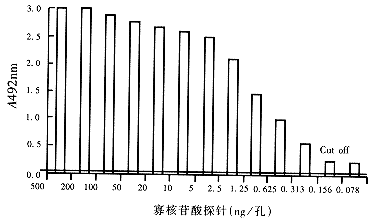
, 百拇医药
图1 寡核苷酸探针包被量与A492nm的对应关系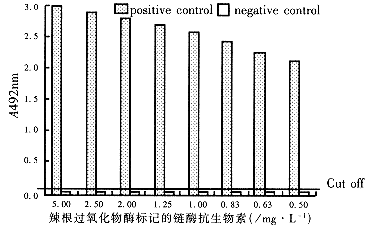
图2 不同酶浓度与A492nm的对应关系
2.2 逆转录-基因扩增产物的含量分析 应用生物素标记的引物扩增所得产物进行直接分析,检出的扩增产物最低DNA量为2pg. 富含丙肝病毒的血清用TE缓冲液进行10倍系列稀释,每一稀释度样品取3管分别提取病毒核酸进行逆转录和套式基因扩增反应. A,B,C为3次扩增实验,第1次PCR反应产物在10-2~10-3稀释度时可见弱阳性条带(图3),对此系列产物进行固相杂交显色测定,结果见表1及图4(A). 根据50例HCV RNA阴性标本所得光密度平均值为0.034,标准差为0.015,Cut off值取均值加3倍标准差,为0.079. 对3次反应结果进行平均计数,此血清中所含丙肝病毒阳性反应的最高稀释度为10-4,即可测出5个病毒基因拷贝,套式PCR产物电泳结果,3次反应的阳性最高稀释度均为10-5,即可检出1个拷贝(图3). 比较起来,固相杂交-酶显色测定方法比套式PCR方法的检出敏感性低一个数量级. 应用固相杂交检测2次PCR产物,其灵敏度与电泳检测相同[图4(B)].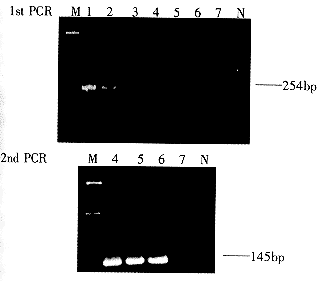
, 百拇医药
图3 HCV逆转录-PCR产物的琼脂糖凝胶电泳. 同一血清10倍系列稀释,3次重复试验一. 1-7:血清10倍系列稀释,从100至10-6稀释.
M:核酸分子质量标准. N:阴性对照.
图4 应用固相杂交酶促显色半定量检测结果. A,B,C:为同一血清3次重复试验. 样品稀释度和A492nm同表1.
应用固相杂交酶促显色半定量检测结果. A,B,C:为同一血清3次重复试验. 样品稀释度和A492nm同表1. 应用固相杂交酶促显色检测第2次PCR产物. 样品同图3中的电泳检测2次PCR产物.
应用固相杂交酶促显色检测第2次PCR产物. 样品同图3中的电泳检测2次PCR产物.
, http://www.100md.com
表1 核酸固相杂交检测的灵敏度 (A492nm)
Samples 100
10-1
10-2
10-3
10-4
10-5
10-6
NC
A 2.864
, 百拇医药
2.631
2.624
0.623
0.091
0.028
0.026
0.026
B 3.015
2.966
2.481
0.472
0.049
0.076
, http://www.100md.com
0.022
0.021
C 2.884
2.835
2.088
0.801
0.138
0.043
0.016
0.019
10n:10倍系列稀释血清.
3 讨论
, 百拇医药
应用体外基因扩增技术充分扩增微量病毒核酸,为保证对特异性靶序列产物的定量定性分析,引入了固相DNA分子杂交步骤.
这样就排除了可能由于非特异扩增产物所造成的干扰. 在技术上对本方法的基本要求是一次PCR的有效扩增. 这首先是由于在基因扩增过程中,只有一次PCR产物量与样品中原始靶模板含量间有对应关系,而套式PCR的反应是全或无的,已与原样品中的模板数无对应关系. 因此,基于基因扩增过程对微量核酸进行定量测定,只能测定一次扩增的产物,对于有逆转录反应的套式 PCR的检测,二次反应比一次反应的检出敏感性高100倍左右,而经固相杂交-酶显色反应,可比用电泳观察一次扩增产物敏感一个数量级,但比套式PCR的阳性最高稀释度低一个数量级.
我们所采用的上述几项技术,由于本身的一些性能的限制,尚有以下几个方面需进一步改进. ①本研究在进行基因扩增反应时为保证检出敏感性,采用了单一扩增参数,即35个扩增反应循环. 这虽有利于极微量靶基因的检出,却不能将病毒含量较高的样品区分开,造成高浓度含量段(>105拷贝)的扩增反应均为饱和反应,光密度值也均为超限值. 对此问题,可以分循环段取样品检测. 如在第20个扩增循环时取一次扩增产物与35个循环的扩增产物分别进行杂交和显色反应. 这样,病毒高含量的样品在20个循环时已有不同产量的扩增,则可在高含量段区分开病毒含量. ②由于分光光度计的线性测定范围狭窄,光密度值仅在0~2之间,在这样小的范围内要反映出101~106拷贝甚至更大的差异是非常困难的,也是这种测定手段的技术局限. 最近新发展的化学发光技术则可以克服这种不足,它具有更宽广的动态线性测定范围,通过宽广的数量级捕捉光量子,可得到与数量级相应的计数. 但由于化学发光计价格昂贵,广泛应用有一定的困难.
, 百拇医药
该研究建立的固相杂交-酶联显色方法,除可用于血清中病毒核酸含量的分析外,应用基因扩增产物与固相化捕捉探针的杂交,还可用于基因突变,基因型分析等的研究和临床应用.
作者简介:王凤水,男,1963-10-15生,江苏省徐州市人,汉族. 1986苏州医学院毕业. 1995年北京医科大学肝病学硕士,主治医师,讲师,1998年入北京军区总医院普外科,主要从事传染病学,分子病毒学及肿瘤实验诊断方面的研究,发表论文10篇.
通讯作者 王凤水, 100700,北京市东城区东四南门仓5号,北京军区总医院普外科实验室.
Correspondence to:WANG Feng-Shui, Laboratory of General Surgery, Chinese PLA Beijing General Hospital, Beijing 100700, China
, http://www.100md.com
Tel. +86.10.66721077
Email. walterw@public2.east.net.cn
4 参考文献
1 Mellors JW, Rinaldo CR Jr, Gupta P, White RM, Todd JA, Kingsley LA. Prognosis in HIV-1 infection predicted by the quantity of virus in plasma. Science, 1996;272:1167-1170
2 Kobayashi Y, Watanabe S, Konishi M, Yokoi M, Kakehashi R, Kaito M, Kondo M, Hayashi Y, Jomori T, Suzuki S. Quantitation and typing of serum hepatitis C virus RNA in patients with chronic hepatitis C treated with interferon-β. Hepatology, 1993;18:1319-1325
, http://www.100md.com
3 Mansfield ES, Woreley JM, Mckenzie SE, Surrey S, Rappaport E, Fortina P. Nucleic acid detection using non-radioactive labelling method. Mol Cell Probes, 1995;9:145-156
4 Mantero G, Zonaro A, Albertini A, Bertolo P, Primi D. DNA enzyme immunoassay: general method for detecting products of polymerase chain reaction. Clin Chem, 1991;37:422-429
5 Keller GH, Huang DP, Manak MM. A sensitive nonisotopic hybridization assay for HIV-1 DNA. Anal Biochem, 1989;177:27-32
6 Okamoto H, Okada S, Sugiyama Y, Tanaka T, Sugai Y, Akahane Y, Machida A, Mishiro S, Yoshizawa H, Miyakawa Y, Detection of hepatitis C virus RNA by a two-stage polymerase chain reaction with two pairs of primers deduced from the 5 '-noncoding region. Jpn J Exp Med, 1990;60:215-222
收稿日期 1999-02-05 修回日期 1999-03-28, 百拇医药
单位:北京军区总医院普外科实验室 北京市 100700
关键词:丙型肝炎病毒;RNA,病毒/分析;聚合酶链反应;固相杂交
摘 要 目的 建立简便
摘 要
目的 建立简便、快速的丙型肝炎病毒基因扩增产物的固相杂交检测方法.
方法 将标记有生物素的寡核苷酸引物所扩增的丙肝病毒基因产物,与通过结合在微孔反应板上的特异性探针进行快速杂交,然后通过辣根过氧化物酶标记的抗生物素进行酶联显色,读取光密度值.
结果 应用本方法对血清中丙型肝炎病毒核酸检测,灵敏度可达5拷贝~50拷贝/反应.
, http://www.100md.com
结论 此方法简便、快速、特异性好、敏感性高、结果判定指标客观,可广泛应用于病毒感染的临床诊断和疗效评价及其他基因的扩增检测和基因分型等.
中国图书馆分类号 R373.2
Solid phase hybridization detection of HCV RNA PCR products
WANG Feng-Shui1, WANG Yu2, LI Shi-Yong1, AN Ping1, YU Bo1 and FENG Bai-Fang2
1Department of General Surgery, Chinese PLA Beijing General Hospital, Beijing 100700, China
, http://www.100md.com
2Institute of Hepatology, Beijing Medical University, Beijing 100044, China
Subject headings hepatitis c virus;RNA, viral/analysis; polymerase chain reaction; solid phase hybridization
Abstract
AIM To establish a simple, rapid polymerase chain reaction (PCR) based DNA amplification technique for detecting HCV RNA PCR products.
METHODS For detecting HCV RNA, the primer labeled with biotin was used to amplify viral gene fragment. The 1st PCR product complemently hybridized with the specific probe covalently coupled onto microplate wells. Streptavidine-POD was used in colorimetric detection.
, http://www.100md.com
RESULTS The sensitivity of the detection system is 5 copies-50 copies of hepatitis C genome respectively.
CONCLUSION The method is simple and rapid with high specificity, sensitivity and semiquantification. It can be generally applied in detection of foreign pathogen in blood, body fluid and tissue samples, in clinical diagnosis and evaluation of antiviral therapeutic effect.
0 引言
丙型肝炎病毒(HCV)是输血后非甲非乙肝炎的主要病原体,为单链正股RNA病毒. 我国是肝炎大国,对于持续性HCV感染所致疾病,人们希望找到一种诊断标志,可以较好地反映疾病的发展情况,预后分析以及进行治疗效果评价. 随着基因分子生物学的发展和在病毒感染诊断方面的应用,最近人们越来越多地注意到,传统的PCR方法有一定的缺陷和不足,尤其是缺乏更高的特异性和客观性. 并且注意到病毒持续性感染时,被感染者体内病毒的含量与临床发病情况、对治疗的反应性和预后评价密切相关. 对于HCV感染者来说,被感染者血循环中HCV含量,是影响干扰素治疗效果的主要因素. 病毒含量高者,治疗后病毒阴转率低,并在停药后病毒含量多回复到治疗前水平. 最近又发现,在干扰素治疗初期,通过测定患者体内HCV水平是否降低,可有效地预测长期疗效. 这些观察促进了人们对HCV含量水平检测手段的研究. 由于很多人类致病病毒在人体内含量很低,直接进行核酸杂交,敏感性方面有很大局限,并且一般需要较昂贵的化学发光检测设备. 我们建立了一种基于基因扩增技术,与结合在固相载体上的寡核苷酸进行分子杂交并用酶联显色作为指示的快速、简便的肝炎病毒核酸半定量方法和标准化检测方法. 对病毒核酸特异性扩增产物进行定量分析,主要是基于扩增产物的量与被测样品中原始靶基因的含量有很好的对应关系,可以通过对扩增产物的含量分析,来反映被测病毒的实际含量[1-5].
, http://www.100md.com
1 材料和方法
1.1 材料 固相杂交反应用96孔微孔反应板,购自丹麦Nuck公司. HCV固化探针为5 '-CTCATACTAACGCCATGGCTAGACGCTTTC-3 ',位于HCV基因5 '非编码区,为不同基因型中高保守序列. 上述探针经过化学反应与微孔反应板形成共价键结合. 简要过程如下:寡核苷酸探针以适当浓度在碳二亚胺的作用下,50℃孵育5h. 用洗液洗板5次,每次2min,干燥,抽真空封存于铝箔袋中备用. 血清CH950046为HCV持续性携带者血清,经套式PCR测定为109拷贝/L[6].
1.2 方法
1.2.1 聚合酶链反应 应用异硫氰酸胍-酚-氯仿一步法提取HCV RNA,空气干燥后溶于焦碳酸二乙脂(DEPC)处理的去离子水.
HCV基因逆转录-基因扩增操作如下:10μL逆转录反应体系中含提取的病毒核酸,100U逆转录酶(superscript Gibco-BRL)及逆转录引物,5 '-TATCAGGCAGTACCACAAGG-3 '. 于42℃反应60min,合成cDNA. 基因扩增反应使用生物素标记的正链引物5 '-CTGTGAGGAACTACTGTCTT-3 ',扩增产物为254bp. 反应循环为94℃ 30s;55℃ 30s;72℃ 45s,共进行35个循环,取10μL扩增产物进行20g/L琼脂糖凝胶电泳观察. 套式PCR反应时,取5μL一次PCR产物,用一对内引物进行扩增,特异性扩增产物为145bp.
, 百拇医药
1.2.2 固相杂交 取扩增产物10μL,于94℃热变性10min后置冰浴2min,加至结合有特异性寡核苷酸探针的微孔反应板中,并加杂交液(含500g/L甲酰胺,6×SSC,1×FPG,25mmol/L KH2PO4,2g/LSDS,及200mg/L鱼精DNA)至100μL,充分混匀后于37℃杂交60min. 用37℃预热的洗液洗板4次,每次2min.
1.2.3 酶结合显色 杂交后,反应孔用10g/L小牛血清清蛋白于37℃封闭10min,弃去封闭液,加入100μL辣根过氧化物酶标记的链霉抗生物素2mg/L(Vector,SA-5004,美国)于37℃育30min,用洗液洗板4次,每次2min. 以邻苯二胺显色15min,加100μL 1mol/L硫酸终止反应,测A492nm值.
2 结果
2.1 定量检测条件的确定 HCV基因5 '非编码区寡核苷酸探针溶于0.1×TE,按(500~0.08)ng,100μL/孔,不同浓度包被微孔反应板,取10μL基因扩增产物进行固相杂交,酶反应显色,读取光密度值A492nm. 寡核苷酸探针用量与A492nm的对应关系见图1. 当每个反应孔所用探针量大于200ng时,A492nm值已大大超过光密度计测定线性范围,并趋饱和,本研究中选200ng/孔作为优选工作浓度. 为确定酶联显色时所用过氧化物酶浓度,取2μL PCR产物进行快速杂交,以(5-0.5)mg/L不同浓度的酶进行显色反应(图2). 根据阴性、阳性对照标本A492nm值的比较. 选取2mg/L酶浓度作为常规工作浓度.

, 百拇医药
图1 寡核苷酸探针包被量与A492nm的对应关系

图2 不同酶浓度与A492nm的对应关系
2.2 逆转录-基因扩增产物的含量分析 应用生物素标记的引物扩增所得产物进行直接分析,检出的扩增产物最低DNA量为2pg. 富含丙肝病毒的血清用TE缓冲液进行10倍系列稀释,每一稀释度样品取3管分别提取病毒核酸进行逆转录和套式基因扩增反应. A,B,C为3次扩增实验,第1次PCR反应产物在10-2~10-3稀释度时可见弱阳性条带(图3),对此系列产物进行固相杂交显色测定,结果见表1及图4(A). 根据50例HCV RNA阴性标本所得光密度平均值为0.034,标准差为0.015,Cut off值取均值加3倍标准差,为0.079. 对3次反应结果进行平均计数,此血清中所含丙肝病毒阳性反应的最高稀释度为10-4,即可测出5个病毒基因拷贝,套式PCR产物电泳结果,3次反应的阳性最高稀释度均为10-5,即可检出1个拷贝(图3). 比较起来,固相杂交-酶显色测定方法比套式PCR方法的检出敏感性低一个数量级. 应用固相杂交检测2次PCR产物,其灵敏度与电泳检测相同[图4(B)].

, 百拇医药
图3 HCV逆转录-PCR产物的琼脂糖凝胶电泳. 同一血清10倍系列稀释,3次重复试验一. 1-7:血清10倍系列稀释,从100至10-6稀释.
M:核酸分子质量标准. N:阴性对照.

图4
, http://www.100md.com
表1 核酸固相杂交检测的灵敏度 (A492nm)
Samples 100
10-1
10-2
10-3
10-4
10-5
10-6
NC
A 2.864
, 百拇医药
2.631
2.624
0.623
0.091
0.028
0.026
0.026
B 3.015
2.966
2.481
0.472
0.049
0.076
, http://www.100md.com
0.022
0.021
C 2.884
2.835
2.088
0.801
0.138
0.043
0.016
0.019
10n:10倍系列稀释血清.
3 讨论
, 百拇医药
应用体外基因扩增技术充分扩增微量病毒核酸,为保证对特异性靶序列产物的定量定性分析,引入了固相DNA分子杂交步骤.
这样就排除了可能由于非特异扩增产物所造成的干扰. 在技术上对本方法的基本要求是一次PCR的有效扩增. 这首先是由于在基因扩增过程中,只有一次PCR产物量与样品中原始靶模板含量间有对应关系,而套式PCR的反应是全或无的,已与原样品中的模板数无对应关系. 因此,基于基因扩增过程对微量核酸进行定量测定,只能测定一次扩增的产物,对于有逆转录反应的套式 PCR的检测,二次反应比一次反应的检出敏感性高100倍左右,而经固相杂交-酶显色反应,可比用电泳观察一次扩增产物敏感一个数量级,但比套式PCR的阳性最高稀释度低一个数量级.
我们所采用的上述几项技术,由于本身的一些性能的限制,尚有以下几个方面需进一步改进. ①本研究在进行基因扩增反应时为保证检出敏感性,采用了单一扩增参数,即35个扩增反应循环. 这虽有利于极微量靶基因的检出,却不能将病毒含量较高的样品区分开,造成高浓度含量段(>105拷贝)的扩增反应均为饱和反应,光密度值也均为超限值. 对此问题,可以分循环段取样品检测. 如在第20个扩增循环时取一次扩增产物与35个循环的扩增产物分别进行杂交和显色反应. 这样,病毒高含量的样品在20个循环时已有不同产量的扩增,则可在高含量段区分开病毒含量. ②由于分光光度计的线性测定范围狭窄,光密度值仅在0~2之间,在这样小的范围内要反映出101~106拷贝甚至更大的差异是非常困难的,也是这种测定手段的技术局限. 最近新发展的化学发光技术则可以克服这种不足,它具有更宽广的动态线性测定范围,通过宽广的数量级捕捉光量子,可得到与数量级相应的计数. 但由于化学发光计价格昂贵,广泛应用有一定的困难.
, 百拇医药
该研究建立的固相杂交-酶联显色方法,除可用于血清中病毒核酸含量的分析外,应用基因扩增产物与固相化捕捉探针的杂交,还可用于基因突变,基因型分析等的研究和临床应用.
作者简介:王凤水,男,1963-10-15生,江苏省徐州市人,汉族. 1986苏州医学院毕业. 1995年北京医科大学肝病学硕士,主治医师,讲师,1998年入北京军区总医院普外科,主要从事传染病学,分子病毒学及肿瘤实验诊断方面的研究,发表论文10篇.
通讯作者 王凤水, 100700,北京市东城区东四南门仓5号,北京军区总医院普外科实验室.
Correspondence to:WANG Feng-Shui, Laboratory of General Surgery, Chinese PLA Beijing General Hospital, Beijing 100700, China
, http://www.100md.com
Tel. +86.10.66721077
Email. walterw@public2.east.net.cn
4 参考文献
1 Mellors JW, Rinaldo CR Jr, Gupta P, White RM, Todd JA, Kingsley LA. Prognosis in HIV-1 infection predicted by the quantity of virus in plasma. Science, 1996;272:1167-1170
2 Kobayashi Y, Watanabe S, Konishi M, Yokoi M, Kakehashi R, Kaito M, Kondo M, Hayashi Y, Jomori T, Suzuki S. Quantitation and typing of serum hepatitis C virus RNA in patients with chronic hepatitis C treated with interferon-β. Hepatology, 1993;18:1319-1325
, http://www.100md.com
3 Mansfield ES, Woreley JM, Mckenzie SE, Surrey S, Rappaport E, Fortina P. Nucleic acid detection using non-radioactive labelling method. Mol Cell Probes, 1995;9:145-156
4 Mantero G, Zonaro A, Albertini A, Bertolo P, Primi D. DNA enzyme immunoassay: general method for detecting products of polymerase chain reaction. Clin Chem, 1991;37:422-429
5 Keller GH, Huang DP, Manak MM. A sensitive nonisotopic hybridization assay for HIV-1 DNA. Anal Biochem, 1989;177:27-32
6 Okamoto H, Okada S, Sugiyama Y, Tanaka T, Sugai Y, Akahane Y, Machida A, Mishiro S, Yoshizawa H, Miyakawa Y, Detection of hepatitis C virus RNA by a two-stage polymerase chain reaction with two pairs of primers deduced from the 5 '-noncoding region. Jpn J Exp Med, 1990;60:215-222
收稿日期 1999-02-05 修回日期 1999-03-28, 百拇医药