转化生长因子β受体在体外培养的人牙乳头细胞中的表达
作者:张莹 张郁 史俊南
单位:710032 西安,第四军医大学口腔医学院口腔内科
关键词:受体;转化生长因子β;牙乳头;细胞;培养的
中华口腔医学杂志000620 【摘要】 目的 探讨体外培养的人牙乳头细胞中转化生长因子β(transforming growth factor-β,TGF-β)受体的表达情况和外源性的TGF-β对人牙乳头细胞TGF-β受体的表达影响。方法 采用常规细胞培养、SP免疫组织化学及图像分析法,检测培养的人牙乳头细胞TGF-β受体的表达情况和外源性TGF-β对人牙乳头细胞TGF-β受体的表达影响。结果 TGF-βⅠ、Ⅱ型受体为强阳性表达,Ⅲ型受体为弱阳性表达。图像分析结果表明,各实验组与对照组灰度值经统计学分析差异无显著性(P>0.05)。结论 体外培养的人牙乳头细胞表达TGF-βⅠ、Ⅱ、Ⅲ型受体,外源性TGF-β不影响其受体表达水平。
, 百拇医药
The expression of TGF-β receptors on cultured human dental papilla cells
ZHANG Ying, ZHANG Yu, SHI Junnan.
(Department of Oral Medicine,School of Stomatology,The Fourth Military Medical University,Xi′an 710032, China)
【Abstract】 Objective To observe the expression of TGF-β receptors on cultured human dental papilla cells and the effects of TGF-β on TGF-β receptors of the cells. Methods The expression of TGF-β receptors on cultured human dental papilla cells and the effects of TGF-β on TGF-β receptors of the cells were examined by cell culture and immunohistochemical technique and image analysis.Results TypeⅠ, typeⅡreceptors for TGF-β in human dental papilla cells were stained strongly and type Ⅲ was weakly positive. Image analysis indicated that all experimental groups had no obvious difference with control groups (P>0.05). Conclusions Cultured human dental papilla cells express TGF-β typeⅠ, typeⅡ and type Ⅲ receptors. TGF-β has no obvious effects on the cell receptor expression.
, 百拇医药
【Key words】 Receptors,transforming growth factor beta; Dental papilla; Cells,cultured
转化生长因子β(transforming growth factor-β,TGF-β)是一族具有多种生物学功能的细胞因子,参与胚胎发育、损伤愈合、骨的重建以及免疫调节等生理和病理过程。其生物学作用是通过细胞膜表面的受体发挥的,已经发现有3种TGF-β受体,其中Ⅰ、Ⅱ型受体参与TGF-β的信号转导,Ⅲ型受体不参与TGF-β信号转导,但能调节TGF-β与信号转导受体的结合。我们应用免疫组化方法检测人牙乳头细胞TGF-β受体表达情况和外源性TGF-β对体外培养的人牙乳头细胞TGF-β受体表达的影响,从而为体外进一步研究TGF-β及其受体在牙乳头细胞分化中的作用打下基础。
材料和方法
1.材料:DMEM培养基(Gibco U.S.A.);胎牛血清(Hyclone U.S.A.);胰蛋白酶(Gibco U.S.A.);TGF-β(第四军医大学口腔医学院病理科,蛋白含量为1 g/L,从牛血小板中提取);24孔培养板(Gibco U.S.A.);CO2孵箱(Forma Scientific U.S.A.);YJ-875型超净工作台(苏州净化设备厂);TGF-β Ⅰ、Ⅱ、Ⅲ型受体的多克隆抗体(武汉博士德公司),Ⅰ、Ⅱ、Ⅲ型受体属特异性受体,不与其他细胞因子受体发生交叉反应;SP试剂盒(美国Zymed公司) ;Triton X-100(Gibeo, U.S.A.);DAB试剂盒(北京中山公司)。
, 百拇医药
2.细胞培养与标本制作:取生长良好的第6代人牙乳头细胞,用0.25%胰酶消化后,以2×104个/孔细胞浓度接种到24孔板中,每孔200 μl,将处理好的盖玻片预先放到24孔板中,待细胞爬满盖玻片80%后,将TGF-β以500、 5 000及50 000 μg/L的不同浓度加入培养液中,设对照组,培养72 h后取出盖玻片,4%多聚甲醛固定30 min,备用。
3.免疫组化染色:采用SP法,取固定好的细胞爬片,PBS洗5 min,0.25% Triton X-100处理15 min,0.3% H2O2室温下孵育10 min,以消除内源性过氧化物酶,正常羊血清孵育30 min,滴加一抗(1∶50),4℃湿盒24 h,复温 1 h,滴加生物素化二抗(1∶100),37℃孵育30 min,滴加酶结合物(1∶100),37℃孵育30 min,DAB显微镜下控制显色5~10 min上述各步骤后均用0.01 mol /L PBS振洗3次,每次5 min。阳性对照用乳腺癌组织,阴性对照用PBS代替一抗。苏木精复染,常规脱水,二甲苯透明,封片。利用HPIAS-1000高清晰度彩色病理图文分析系统(同济医科大学千屏影像公司)进行图像分析。
, 百拇医药
结果
1.不同浓度的TGF-βⅠ、Ⅱ、Ⅲ型受体免疫组化染色图像分析灰度值见表1。
表1 TGF-βⅠ、Ⅱ、Ⅲ型受体免疫组化染色图像分析灰度值(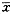 ±s) TGF-β浓度(μg/L)
±s) TGF-β浓度(μg/L)
RⅠ
RⅡ
RⅢ
对照组
187.64±7.79
179.84±7.74
207.26±9.78
, http://www.100md.com
500
180.67±6.92
188.13±8.49
203.46±6.57
5 000
191.32±8.41
192.82±7.28
206.54±8.43
50 000
184.86±6.54
195.67±9.19
207.29±7.82
, 百拇医药
注:TGF-β:转化生长因子β;RⅠ、RⅡ、RⅢ分别代表TGF-βⅠ、Ⅱ、Ⅲ型受体;各实验组与对照组经t检验差异无显著性,P>0.05
2.TGF-βⅠ、Ⅱ、Ⅲ型受体染色阳性部位在细胞膜和细胞浆,染色呈深棕色为强阳性,棕色为阳性,浅黄色为弱阳性。TGF-β Ⅰ、Ⅱ型受体为强阳性(图1,2),TGF-β Ⅲ型受体为弱阳性(图3),图像分析结果表明各实验组与对照组相比差异无显著性(P> 0.05)。
讨论
TGF-β超家族成员参与成牙本质细胞的分化,其作用是通过相应受体发挥的。已经发现有3种膜蛋白受体与TGF-β特异性结合。其中Ⅰ、Ⅱ型受体属于跨膜的丝氨酸-苏氨酸激酶受体家族,分子量分别为53 000和75 000。Ⅱ型受体能自由与配体结合,Ⅰ型受体只能识别配体与Ⅱ型受体结合的嵌合体,Ⅱ型受体单独与配体结合时结合能力很弱,但当Ⅰ型受体存在时结合就变得相当容易了[1]。因此,对于TGF-β的信号转导,Ⅰ、Ⅱ型受体是必不可少的。Ⅲ型受体是蛋白多聚糖,分子量为300 000左右,不参与信号转导,却能间接调节TGF-β的作用,可以提高TGF-β,尤其是亲和力较小的TGF-β2与信号受体的结合能力[2]。
, 百拇医药
近年来的研究表明,TGF-βⅠ型受体又分为结构相近的6个亚型,被称为活化素受体样激酶(activin receptor-like kinases,ALK)。Doons等观察外源性的重组骨形成蛋白7(bone morphogenesis protein-7,BMP-7)对稳定的小鼠成牙本质细胞系(MO6G3)BMP和ALK受体的表达情况,当细胞接近铺满时,不同时间加入不同剂量BMP-7,用反转录聚合酶链反应检测BMPs和ALK受体的mRNA表达,结果处理组与对照组均不表达ALK-3或ALK-6,但表达ALK-2受体,ALK-2受体的配体是BMP-7;同时观察到BMP-3和BMP-7的转录本。实验表明,外源性的BMP-7不影响成牙本质细胞的内源性BMPs和ALK受体的表达模式,BMP-7对MO6G3的作用可能是由ALK-2受体介导的。在本组实验中,体外培养的人牙乳头细胞表达TGF-β 3型受体,其中Ⅰ、Ⅱ型受体呈强阳性表达,Ⅲ型受体呈弱阳性表达,外源性TGF-β不影响其受体表达水平。这与上述报道相似,提示TGF-β主要通过Ⅰ、Ⅱ型受体发挥其生物学作用,Ⅲ型受体可能只起间接调节作用。
, 百拇医药
许多特异性效应物可改变受体的表达,从而改变了细胞对TGF-β的反应。BMP-2可降低TGF-β与TGF-βⅡ、Ⅲ型受体的结合,导致成骨细胞有丝分裂活动下降,增加胶原和碱性磷酸酶合成[3],在体外培养的肝脂肪细胞,TGF-β能够轻微上调TGF-βⅠ型和Ⅱ型受体的表达[4]。本组实验结果表明外源性TGF-β不影响其受体表达水平。受体水平表达的高低及Ⅰ、Ⅱ型受体的比例可以直接影响TGF-β功能的发挥,影响受体表达的因素较多,机制也较复杂,尚待今后进一步研究。
D′Souza等[5]通过免疫组化研究表明,在鼠牙胚发育的钟状期,TGF-β1在未分化的牙乳头细胞、内釉上皮细胞和已分化的成牙本质细胞和成釉细胞中有中度表达,表明TGF-β1可能以旁分泌的方式调节上皮-间质的相互作用以影响细胞的增殖和分化。体内研究发现,TGF-βⅠ、Ⅱ型受体在小鼠蕾状期、帽状期有表达[6],Ⅲ型受体在前成釉细胞有表达[7]。在体外培养的牛牙髓细胞分化的实验中发现,TGF-β超家族成员和其受体临时共同表达与成牙本质细胞分化有关[8]。探讨TGF-β受体在体外培养的人牙乳头细胞中的表达情况,对理解TGF-β及其受体在牙胚发育和成牙本质细胞分化中的作用有一定意义。
, http://www.100md.com
本实验首次观察到体外培养的人牙乳头细胞表达TGF-βⅠ、Ⅱ、Ⅲ型受体,提示TGF-β 可能通过自分泌和旁分泌方式与人牙乳头细胞表面受体结合,参与成牙本质细胞的分化与成熟。


图1 第6代人牙乳头细胞TGF-β Ⅰ型受体呈强阳性表达(SP免疫组化染色×10) 图2 第6代人牙乳头细胞TGF-β Ⅱ型受体呈强阳性表达(SP免疫组化染色×10) 图3 第6代人牙乳头
细胞TGF-β Ⅲ型受体呈弱阳性表达(SP免疫组化染色×10)
参考文献
, 百拇医药 1.Franzen P, ten Dijke P, Ichijo H, et al. Cloning of a TGF beta type Ⅰ receptor that forms a heteromeric complex with the TGF beta type Ⅱ receptor. Cell, 1993,75: 681-692.
2.Lopez-Casillas F, Payne HM, Andres JL, et al. Betaglycan can act as a dual modulator of TGF-beta access to signaling receptors: mapping of ligand binding and GAG acttachment sites .J Cell Biol, 1994, 124:557-568.
3.Centrella M, Casinghino S, Kim J, et al. Independent changes in type Ⅰ and type Ⅱ receptors for transforming growth factor beta induced by bone morphogenetic protein 2 parallel expression of the osteoblast phenotype. Mol Cell Biol, 1995, 15: 3 273-3 281.
, 百拇医药
4.Knittel T, Janneck T, Muller L, et al. Transforming growth factor beta 1-regulated gene expression of Ito cells. Hepatology, 1996,24:352-360.
5.D′Souza RN, Happonen RP, Ritter NM, et al. Temporal and spatial patterns of transforming growth factor-beta 1 expression in developing rat molars. Archs Oral Biol, 1990,35:957-965.
6.Iseki S, Osumi-Yamashita N, Miyazono K, et al. Localization of transforming growth factor-beta type Ⅰ and typeⅡ receptors in mouse development. Exp Cell Res, 1995,219:339-347.
, 百拇医药
7.Ruch JV, Lesot H, Begue-Kirn C. Odontoblast differentiation. Int J Dev Biol, 1995,39:51-68.
8.Toyono T, Nakashima M, Kuhara S, et al. Temporal changes in expression of transforming growth factor-betasuperfamily members and their receptors during bovine preodontoblast differentiation in vitro. Arch Oral Biol, 1997, 42:481-488.
(收稿日期:1999-10-20), 百拇医药
单位:710032 西安,第四军医大学口腔医学院口腔内科
关键词:受体;转化生长因子β;牙乳头;细胞;培养的
中华口腔医学杂志000620 【摘要】 目的 探讨体外培养的人牙乳头细胞中转化生长因子β(transforming growth factor-β,TGF-β)受体的表达情况和外源性的TGF-β对人牙乳头细胞TGF-β受体的表达影响。方法 采用常规细胞培养、SP免疫组织化学及图像分析法,检测培养的人牙乳头细胞TGF-β受体的表达情况和外源性TGF-β对人牙乳头细胞TGF-β受体的表达影响。结果 TGF-βⅠ、Ⅱ型受体为强阳性表达,Ⅲ型受体为弱阳性表达。图像分析结果表明,各实验组与对照组灰度值经统计学分析差异无显著性(P>0.05)。结论 体外培养的人牙乳头细胞表达TGF-βⅠ、Ⅱ、Ⅲ型受体,外源性TGF-β不影响其受体表达水平。
, 百拇医药
The expression of TGF-β receptors on cultured human dental papilla cells
ZHANG Ying, ZHANG Yu, SHI Junnan.
(Department of Oral Medicine,School of Stomatology,The Fourth Military Medical University,Xi′an 710032, China)
【Abstract】 Objective To observe the expression of TGF-β receptors on cultured human dental papilla cells and the effects of TGF-β on TGF-β receptors of the cells. Methods The expression of TGF-β receptors on cultured human dental papilla cells and the effects of TGF-β on TGF-β receptors of the cells were examined by cell culture and immunohistochemical technique and image analysis.Results TypeⅠ, typeⅡreceptors for TGF-β in human dental papilla cells were stained strongly and type Ⅲ was weakly positive. Image analysis indicated that all experimental groups had no obvious difference with control groups (P>0.05). Conclusions Cultured human dental papilla cells express TGF-β typeⅠ, typeⅡ and type Ⅲ receptors. TGF-β has no obvious effects on the cell receptor expression.
, 百拇医药
【Key words】 Receptors,transforming growth factor beta; Dental papilla; Cells,cultured
转化生长因子β(transforming growth factor-β,TGF-β)是一族具有多种生物学功能的细胞因子,参与胚胎发育、损伤愈合、骨的重建以及免疫调节等生理和病理过程。其生物学作用是通过细胞膜表面的受体发挥的,已经发现有3种TGF-β受体,其中Ⅰ、Ⅱ型受体参与TGF-β的信号转导,Ⅲ型受体不参与TGF-β信号转导,但能调节TGF-β与信号转导受体的结合。我们应用免疫组化方法检测人牙乳头细胞TGF-β受体表达情况和外源性TGF-β对体外培养的人牙乳头细胞TGF-β受体表达的影响,从而为体外进一步研究TGF-β及其受体在牙乳头细胞分化中的作用打下基础。
材料和方法
1.材料:DMEM培养基(Gibco U.S.A.);胎牛血清(Hyclone U.S.A.);胰蛋白酶(Gibco U.S.A.);TGF-β(第四军医大学口腔医学院病理科,蛋白含量为1 g/L,从牛血小板中提取);24孔培养板(Gibco U.S.A.);CO2孵箱(Forma Scientific U.S.A.);YJ-875型超净工作台(苏州净化设备厂);TGF-β Ⅰ、Ⅱ、Ⅲ型受体的多克隆抗体(武汉博士德公司),Ⅰ、Ⅱ、Ⅲ型受体属特异性受体,不与其他细胞因子受体发生交叉反应;SP试剂盒(美国Zymed公司) ;Triton X-100(Gibeo, U.S.A.);DAB试剂盒(北京中山公司)。
, 百拇医药
2.细胞培养与标本制作:取生长良好的第6代人牙乳头细胞,用0.25%胰酶消化后,以2×104个/孔细胞浓度接种到24孔板中,每孔200 μl,将处理好的盖玻片预先放到24孔板中,待细胞爬满盖玻片80%后,将TGF-β以500、 5 000及50 000 μg/L的不同浓度加入培养液中,设对照组,培养72 h后取出盖玻片,4%多聚甲醛固定30 min,备用。
3.免疫组化染色:采用SP法,取固定好的细胞爬片,PBS洗5 min,0.25% Triton X-100处理15 min,0.3% H2O2室温下孵育10 min,以消除内源性过氧化物酶,正常羊血清孵育30 min,滴加一抗(1∶50),4℃湿盒24 h,复温 1 h,滴加生物素化二抗(1∶100),37℃孵育30 min,滴加酶结合物(1∶100),37℃孵育30 min,DAB显微镜下控制显色5~10 min上述各步骤后均用0.01 mol /L PBS振洗3次,每次5 min。阳性对照用乳腺癌组织,阴性对照用PBS代替一抗。苏木精复染,常规脱水,二甲苯透明,封片。利用HPIAS-1000高清晰度彩色病理图文分析系统(同济医科大学千屏影像公司)进行图像分析。
, 百拇医药
结果
1.不同浓度的TGF-βⅠ、Ⅱ、Ⅲ型受体免疫组化染色图像分析灰度值见表1。
表1 TGF-βⅠ、Ⅱ、Ⅲ型受体免疫组化染色图像分析灰度值(
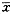 ±s) TGF-β浓度(μg/L)
±s) TGF-β浓度(μg/L)RⅠ
RⅡ
RⅢ
对照组
187.64±7.79
179.84±7.74
207.26±9.78
, http://www.100md.com
500
180.67±6.92
188.13±8.49
203.46±6.57
5 000
191.32±8.41
192.82±7.28
206.54±8.43
50 000
184.86±6.54
195.67±9.19
207.29±7.82
, 百拇医药
注:TGF-β:转化生长因子β;RⅠ、RⅡ、RⅢ分别代表TGF-βⅠ、Ⅱ、Ⅲ型受体;各实验组与对照组经t检验差异无显著性,P>0.05
2.TGF-βⅠ、Ⅱ、Ⅲ型受体染色阳性部位在细胞膜和细胞浆,染色呈深棕色为强阳性,棕色为阳性,浅黄色为弱阳性。TGF-β Ⅰ、Ⅱ型受体为强阳性(图1,2),TGF-β Ⅲ型受体为弱阳性(图3),图像分析结果表明各实验组与对照组相比差异无显著性(P> 0.05)。
讨论
TGF-β超家族成员参与成牙本质细胞的分化,其作用是通过相应受体发挥的。已经发现有3种膜蛋白受体与TGF-β特异性结合。其中Ⅰ、Ⅱ型受体属于跨膜的丝氨酸-苏氨酸激酶受体家族,分子量分别为53 000和75 000。Ⅱ型受体能自由与配体结合,Ⅰ型受体只能识别配体与Ⅱ型受体结合的嵌合体,Ⅱ型受体单独与配体结合时结合能力很弱,但当Ⅰ型受体存在时结合就变得相当容易了[1]。因此,对于TGF-β的信号转导,Ⅰ、Ⅱ型受体是必不可少的。Ⅲ型受体是蛋白多聚糖,分子量为300 000左右,不参与信号转导,却能间接调节TGF-β的作用,可以提高TGF-β,尤其是亲和力较小的TGF-β2与信号受体的结合能力[2]。
, 百拇医药
近年来的研究表明,TGF-βⅠ型受体又分为结构相近的6个亚型,被称为活化素受体样激酶(activin receptor-like kinases,ALK)。Doons等观察外源性的重组骨形成蛋白7(bone morphogenesis protein-7,BMP-7)对稳定的小鼠成牙本质细胞系(MO6G3)BMP和ALK受体的表达情况,当细胞接近铺满时,不同时间加入不同剂量BMP-7,用反转录聚合酶链反应检测BMPs和ALK受体的mRNA表达,结果处理组与对照组均不表达ALK-3或ALK-6,但表达ALK-2受体,ALK-2受体的配体是BMP-7;同时观察到BMP-3和BMP-7的转录本。实验表明,外源性的BMP-7不影响成牙本质细胞的内源性BMPs和ALK受体的表达模式,BMP-7对MO6G3的作用可能是由ALK-2受体介导的。在本组实验中,体外培养的人牙乳头细胞表达TGF-β 3型受体,其中Ⅰ、Ⅱ型受体呈强阳性表达,Ⅲ型受体呈弱阳性表达,外源性TGF-β不影响其受体表达水平。这与上述报道相似,提示TGF-β主要通过Ⅰ、Ⅱ型受体发挥其生物学作用,Ⅲ型受体可能只起间接调节作用。
, 百拇医药
许多特异性效应物可改变受体的表达,从而改变了细胞对TGF-β的反应。BMP-2可降低TGF-β与TGF-βⅡ、Ⅲ型受体的结合,导致成骨细胞有丝分裂活动下降,增加胶原和碱性磷酸酶合成[3],在体外培养的肝脂肪细胞,TGF-β能够轻微上调TGF-βⅠ型和Ⅱ型受体的表达[4]。本组实验结果表明外源性TGF-β不影响其受体表达水平。受体水平表达的高低及Ⅰ、Ⅱ型受体的比例可以直接影响TGF-β功能的发挥,影响受体表达的因素较多,机制也较复杂,尚待今后进一步研究。
D′Souza等[5]通过免疫组化研究表明,在鼠牙胚发育的钟状期,TGF-β1在未分化的牙乳头细胞、内釉上皮细胞和已分化的成牙本质细胞和成釉细胞中有中度表达,表明TGF-β1可能以旁分泌的方式调节上皮-间质的相互作用以影响细胞的增殖和分化。体内研究发现,TGF-βⅠ、Ⅱ型受体在小鼠蕾状期、帽状期有表达[6],Ⅲ型受体在前成釉细胞有表达[7]。在体外培养的牛牙髓细胞分化的实验中发现,TGF-β超家族成员和其受体临时共同表达与成牙本质细胞分化有关[8]。探讨TGF-β受体在体外培养的人牙乳头细胞中的表达情况,对理解TGF-β及其受体在牙胚发育和成牙本质细胞分化中的作用有一定意义。
, http://www.100md.com
本实验首次观察到体外培养的人牙乳头细胞表达TGF-βⅠ、Ⅱ、Ⅲ型受体,提示TGF-β 可能通过自分泌和旁分泌方式与人牙乳头细胞表面受体结合,参与成牙本质细胞的分化与成熟。



图1 第6代人牙乳头细胞TGF-β Ⅰ型受体呈强阳性表达(SP免疫组化染色×10) 图2 第6代人牙乳头细胞TGF-β Ⅱ型受体呈强阳性表达(SP免疫组化染色×10) 图3 第6代人牙乳头
细胞TGF-β Ⅲ型受体呈弱阳性表达(SP免疫组化染色×10)
参考文献
, 百拇医药 1.Franzen P, ten Dijke P, Ichijo H, et al. Cloning of a TGF beta type Ⅰ receptor that forms a heteromeric complex with the TGF beta type Ⅱ receptor. Cell, 1993,75: 681-692.
2.Lopez-Casillas F, Payne HM, Andres JL, et al. Betaglycan can act as a dual modulator of TGF-beta access to signaling receptors: mapping of ligand binding and GAG acttachment sites .J Cell Biol, 1994, 124:557-568.
3.Centrella M, Casinghino S, Kim J, et al. Independent changes in type Ⅰ and type Ⅱ receptors for transforming growth factor beta induced by bone morphogenetic protein 2 parallel expression of the osteoblast phenotype. Mol Cell Biol, 1995, 15: 3 273-3 281.
, 百拇医药
4.Knittel T, Janneck T, Muller L, et al. Transforming growth factor beta 1-regulated gene expression of Ito cells. Hepatology, 1996,24:352-360.
5.D′Souza RN, Happonen RP, Ritter NM, et al. Temporal and spatial patterns of transforming growth factor-beta 1 expression in developing rat molars. Archs Oral Biol, 1990,35:957-965.
6.Iseki S, Osumi-Yamashita N, Miyazono K, et al. Localization of transforming growth factor-beta type Ⅰ and typeⅡ receptors in mouse development. Exp Cell Res, 1995,219:339-347.
, 百拇医药
7.Ruch JV, Lesot H, Begue-Kirn C. Odontoblast differentiation. Int J Dev Biol, 1995,39:51-68.
8.Toyono T, Nakashima M, Kuhara S, et al. Temporal changes in expression of transforming growth factor-betasuperfamily members and their receptors during bovine preodontoblast differentiation in vitro. Arch Oral Biol, 1997, 42:481-488.
(收稿日期:1999-10-20), 百拇医药