NO对内毒素血症大鼠胰岛细胞的作用
作者:李 强 许霖水
单位:第三军医大学基础医学部生物化学教研室) 重庆,400038
关键词:一氧化氮;内毒素;胰岛细胞;单细胞凝胶电泳
第三军医大学学报ACTA ACADEMIAE MEDICINAE MILITARIS TERTIAE1999年 第21卷 第1期 VOL
提 要:目的探讨一氧化氮(NO)在内毒素血症大鼠胰岛细胞损伤中的作用机制。方法:以2 mg/kg体重LPS腹腔注射致内毒素血症大鼠为模型,观察血清、胰腺NO含量的动态变化,用β-NADPH-d组化染色检测胰岛诱生型一氧化氮合酶(iNOS)的表达,采用单细胞凝胶电泳技术,分析外源NO供体(硝普钠)和LPS在体外对胰岛细胞的损伤。结果:内毒素血症大鼠血清NO水平明显增高,胰腺NO含量在注射6 h开始增高,12 h达峰值,1 d后恢复至正常水平,胰岛iNOS表达于6 h开始升高,12 h明显增强。体外试验显示硝普钠能明显引起胰岛细胞DNA的损伤,而LPS作用不明显。结论:NO在内毒素血症胰岛细胞损伤中的作用机制可能是由于LPS在体内引起炎性细胞浸润,通过炎性或非炎性细胞促进胰岛细胞iNOS的表达,产生NO介导胰岛细胞DNA直接损伤所致。
, http://www.100md.com
中图法分类号:Q578
Effects of nitric oxide on islet cells during endotoxemia in rats
Li Qiang, Xu Linshui
(Department of Biochemistry, Third Military Medical University, Chongqing, 400038)
Abstract Objective: To explore the mechanism of the effects of nitric oxide (NO) on islet cells during endotoxemia in rats. Methods: After the model of endotoxemia was established in rats with intraperitoneal injection of LPS (2 mg/kg), the changes in NO levels of the serum and pancreas were dynamically observed. The expression of inducible nitric oxide (iNO) in the islet was determined with β-NADPH-d histochemical staining. DNA damage in islet cells by the external donor of NO (sodium nitroprusside) or LPS were assessed in vitro with single cell gel electrophoresis. Results: NO level in serum was significantly increased at the 6th h, picked at the 12th h and recovered to the normal on the 1st d in the pancreas after injection. The expression of iNOS in pancreatic islet also began to be enhanced at the 6th h and significantly enhanced at the 12th h after endotoxemia. In vitro experiment showed that sodium nitroprusside markedly damaged DNA in the islet cells but LPS did not exert the same effects. Conclusion: The mechanism of the effects of NO on islet cells during endotoxemia might be that the infiltration of the inflammatory or non-inflammatory cells induced by LPS stimulates the expression of iNOS that generates the NO free radicals inducing the DNA damage of islet cells.
, 百拇医药
Key words nitric oxide; endotoxin; islet cell; single cell gel electrophoresis
感染或炎症时可引起胰岛炎性细胞浸润,导致胰岛细胞损害,在胰岛素依赖型糖尿病(Insulin dependent diabetes mellitus,IDDM)的发病过程中有重要意义。资料表明,内毒素在体内亦能引起单核巨噬细胞浸润胰岛诱导胰岛表达iNOS[1]。但是内毒素诱导胰岛细胞损伤的详细机制尚不完全清楚,国内报道不多。本实验观察LPS致内毒素血症大鼠血清、胰腺NO含量的动态变化和胰岛iNOS的表达,比较研究NO供体硝普钠与LPS在体外对胰岛细胞DNA的直接损伤作用,以阐明LPS引起胰岛细胞损伤的作用机制。
1 材料与方法
1.1 材料
, 百拇医药 胶原酶(Ⅴ型),常熔点与低熔点琼脂糖,RPMI 1640培养基,内毒素(LPS,E coli 0127∶B8),十二烷基肌氨酸钠,溴化乙锭均为Sigma产品,β-NADPH(德国宝灵曼公司),其它试剂为分析纯。CO2孵箱(美国),Olympus荧光显微镜及照像系统(日本)。
1.2 方法
1.2.1动物模型 Wistar大鼠40只,由本校实验动物中心提供,体重180~200 g,雌雄不拘,随机分成6、12 h、1、3d组,并设正常对照组,每组8只,按2mg/kg体重LPS剂量腹腔注射大鼠,断头取血并摘取胰腺。
1.2.2 NO含量测定 胰腺制成匀浆,Lowry法蛋白定量进行校正,用NO2/NO3测定间接反映NO含量,结果以μmol/g蛋白表示。血清直接测定。参考Najwek等[2]的方法,用镀铜镉还原NO3再与Griess试剂显色,通过标准曲线回归方程计算结果。
, 百拇医药
1.2.3 iNOS表达 取正常组和内毒素血症组大鼠胰腺,参照Dawson[3]方法,胰腺切片进行胰β-NADPH-d组化染色,光镜观察胰岛,以每个胰岛50%以上胰岛细胞胞浆呈蓝色作为阳性,结果以阴性(-)、阳性(+)表示。
1.2.4 DNA损伤检测
1.2.4.1 胰岛细胞分离 无菌取正常Wistar大鼠胰腺剪成1~2 mm3,用胶原酶消化[4],经Ficoll密度梯度离心纯化,所得胰岛经抗胰岛素抗体免疫组织化学染色鉴定,胰岛含量大于80%,用EDTA和胰酶消化成单个细胞,于含10%小牛血清的1640培养液培养3 d,台盼蓝染色鉴定成活率大于85%。
1.2.4.2 单细胞凝胶电泳 上述培养细胞用1640培养液调整细胞数为10 000个/ml,在培养板上每孔加入0.5 ml,加入硝普钠终浓度分别为0、10、20、40 mmol/L 4组,同时另做终浓度为5、10 μg/ml LPS两组,每组平行5孔,置CO2孵箱育温5 h。按照Ross等[5]的方法,取每孔孵育胰岛细胞,作一张琼脂糖胶板进行电泳,经溴化乙锭染色,置Olympus荧光显微镜上观察,每个实验组随机计数100个细胞,计算慧星细胞百分率表示细胞迁移度(损伤度)。同时用接目测微器测定100个细胞核直径和慧尾长度,以(核直径+慧尾长度)±标准差表示细胞迁移率。
, http://www.100md.com
1.2.5 统计学处理 实验数据用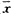 ±s表示,并采用t检验进行统计学分析。
±s表示,并采用t检验进行统计学分析。
2 结果
2.1 NO含量变化
内毒素血症大鼠血清NO含量在注射LPS后6h显著升高(P<0.01),12 h虽缓慢下降,但直到3 d仍高于对照组(P<0.01)。胰腺NO含量6 h开始上升,12 h达峰值(P<0.01),1 d后恢复至正常,见表1。
表1 内毒素血症大鼠血清和胰腺NO含量变化(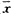 ±s)
±s)
Tab 1 Changes in NO in serum and pancreas of endotoxemic rats (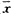 ±s)
±s)
, http://www.100md.com
Time after injection of LPS
Control
6 h
12 h
1 d
3 d
Serum(CB/μmol*L-1)
57.61±11.69
354.27±142.37*
270.42±102.79*
, 百拇医药
151.93±40.41*
123.03±42.54*
Pancreas(μmol/g)
2.18±0.63
2.49±0.61
3.79±1.29*
2.27±0.68
2.25±0.28
*:P<0.01 vs control
2.2 iNOS表达
, http://www.100md.com
正常对照组胰岛iNOS组化染色呈-~±,注射内毒素6 h,大鼠胰岛iNOS组化染色呈±~+显示表达增强,12 h染色呈+~,iNOS表达明显增强,1 d后恢复到正常,染色结果见图1。
2.3 NO和LPS致胰岛细胞损伤
表2所示,10、20、40 mmol/L的硝普钠体外作用5 h,胰岛细胞的细胞迁移率显著高于对照组(P<0.01),说明胰岛细胞DNA损伤显著,损伤细胞的百分率(细胞迁移度)明显高于对照组,并呈剂量依赖关系。而5、10 μg/ml的LPS作用5 h后,胰岛细胞损伤不明显(P<0.05)。图2显示正常及损伤细胞经单细胞凝胶电泳后DNA损伤形成慧星的荧光显微镜照像结果。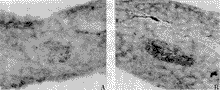
图1 iNOS在大鼠胰腺胰岛的表达
, 百拇医药 β-NADPH组化染色 (×200)
A:阴性胰岛 B:阳性胰岛
Fig 1 The expression of iNOS in pancreatic
islets β-NADPH-d stain (×200)
A:Negative pancreatic islets B:Positive pancreatic islets
表2 硝普钠和LPS作用胰岛细胞后细胞迁移率和迁移度改变(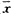 ±s)
±s)
Tab 2 Changes in DNA migration and rate of DNA damaged islet cells of pancreas with sodium nitroprusside or LPS(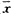 ±s)
±s)
, http://www.100md.com
Sodium nitroprusside (mmol/L)
LPS(μg/ml)
Control
10
20
40
5
10
DNA migration(μm)
34.85±2.36
41.18±4.61
59.99±10.79*
, 百拇医药
70.49±20.29*
35.41±2.87
36.16±3.47
Percent of damaged cells
15%
42%
63%
90%
14%
17%
*:P<0.01 vs control
, 百拇医药
图2 损伤胰岛细胞核DNA慧星的单细胞
凝胶电泳照像结果
A:正常细胞 B:损伤细胞(×400)
Fig 2 Single cell gel eletrophoresis of damaged
nuclear DNA comets of islet cell after assay
A:Normal cell B:Damaged cell(×400)
3 讨论
已知内毒素(LPS)在体内可通过刺激炎症细胞对胰岛浸润,引起胰岛或胰岛周围炎症反应,并通过巨噬细胞、淋巴细胞释放IL-1β,TNF-α,IFN-γ等细胞因子损伤胰岛细胞而导致IDDM[6]。同时体外试验也证实细胞因子单独或与LPS协同作用,亦能诱导胰岛细胞表达iNOS,产生NO抑制胰岛素分泌[7]。然而有关LPS引起胰岛细胞损伤的详细机制和作用环节未完全清楚,国内未见有报道。我们在整体观察LPS作用的基础上,还在离体条件下比较观察LPS和外源NO供体(硝普钠)对大鼠胰岛的损害,探讨LPS对胰岛损伤的详细作用机制。结果显示,大鼠注射LPS 6 h后血清和胰腺,NO水平明显升高,与此同时胰岛iNOS也同步于早期表达明显增强,表明内毒素(LPS)能诱导大鼠胰岛细胞iNOS的表达,产生NO增多。体外试验发现外源NO供体(硝普钠)对胰岛细胞DNA有明显损伤作用,而LPS在体外损伤不明显,提示LPS对胰岛的损伤作用是一种通过细胞因子刺激iNOS表达和NO生成,并由NO介导的间接作用。
, 百拇医药
细胞因子上述作用是通过激活核因子κB(NFκB)而启动系列信号传导,从而诱导iNOS的表达[8],大量产生NO,NO是一种具有广泛生物学活性的氮化物自由基,能与含硫铁中心的酶或含巯基多肽反应,抑制DNA合成;能产生高毒性的羟自由基和过氧化硝基化合物(ONOO),引起核酸亚硝酰基化反应,直接导致细胞DNA链断裂[9]。我们建立了单细胞凝胶电泳技术能快速、灵敏检测单个哺乳动物细胞DNA断裂[5],结果证实外源NO供体硝普钠在体外明显引起胰岛细胞DNA的断裂、损伤,但LPS作用不明显。由以上结果可以推断,内毒素(LPS)在体内引起胰岛炎性浸润,同时刺激巨噬细胞、淋巴细胞释放细胞因子,通过细胞因子诱导胰岛细胞表达iNOS,产生NO,并通过NO介导对胰岛细胞的损伤,可能在自身免疫性糖尿病发病中起重要作用。这一结果与Corbett[9]提出的LPS作为诱导物,诱导胰岛细胞损伤而导致糖尿病的看法相一致。
作者简介:李 强,男,27岁,信院医师,硕士兵,现在附属新桥医院检验科 重庆,400037
, 百拇医药
参考文献
[1] Pollock J S, Forstermann U, Tracey W R, et al. Nitric oxide synthase isozymes antibodies. Histochem J, 1995,27(10):738
[2] Cortas N K, Wakid N W. Determination of inorganic nitrate in serum and urine by a kinetic cadmium-reduction method. Clin Chem,1990,36(8):1440
[3] Dawson T M, Bredt D S, Fotubi M, et al. Nitric oxide synthase and neuronal β-NADPH diaphorase are indentical in brain and periphercal tissue. Proc Natl Acad Sci,1991,88(17):7797
, 百拇医药
[4] Gotoh M, Maki T, Satomi S, et al. Reproducible high yield of rat islets by stationary in vitro digestion following pancreatic ductal or portal venous collagenase injection. Transplantation,1987,43(5):725
[5] Ross G M, Mcmillan T J, Wilcox P, et al. The single cell microgel electrophoresis assay (comet assay): Technical aspects and applications. Mut Res,1995,337(1):57
[6] Kwon G, Corbett J A, Hauser S, et al. Evidence for involvement of the proteasome complex (26S) and NFκB in IL-1β-induced nitric oxide and prostaglandin production by rats islet and RINm5F cells. Diabetes,1998,47(4):583
, 百拇医药
[7] Stoltje P, Mcdaniel M. Multiple cytokins required for induction of nitric oxide synthase in mouse islets. Diabetes,1994,43(Suppl):235A
[8] Flodstrom M, Welsh N, Eizirik D L. Cytokines activate the nuclear factor κB (NFκB) and induce nitric oxide production in human pancreatic islet. FEBS lett,1996,385(1):4
[9] Corbett J A, Mcdniel M L. Does nitric oxide mediate autoimmune destruction of β-cells. Diabetes,1992,41(8):897
收稿:1998-10-30;修回:1998-12-23, 百拇医药
单位:第三军医大学基础医学部生物化学教研室) 重庆,400038
关键词:一氧化氮;内毒素;胰岛细胞;单细胞凝胶电泳
第三军医大学学报ACTA ACADEMIAE MEDICINAE MILITARIS TERTIAE1999年 第21卷 第1期 VOL
提 要:目的探讨一氧化氮(NO)在内毒素血症大鼠胰岛细胞损伤中的作用机制。方法:以2 mg/kg体重LPS腹腔注射致内毒素血症大鼠为模型,观察血清、胰腺NO含量的动态变化,用β-NADPH-d组化染色检测胰岛诱生型一氧化氮合酶(iNOS)的表达,采用单细胞凝胶电泳技术,分析外源NO供体(硝普钠)和LPS在体外对胰岛细胞的损伤。结果:内毒素血症大鼠血清NO水平明显增高,胰腺NO含量在注射6 h开始增高,12 h达峰值,1 d后恢复至正常水平,胰岛iNOS表达于6 h开始升高,12 h明显增强。体外试验显示硝普钠能明显引起胰岛细胞DNA的损伤,而LPS作用不明显。结论:NO在内毒素血症胰岛细胞损伤中的作用机制可能是由于LPS在体内引起炎性细胞浸润,通过炎性或非炎性细胞促进胰岛细胞iNOS的表达,产生NO介导胰岛细胞DNA直接损伤所致。
, http://www.100md.com
中图法分类号:Q578
Effects of nitric oxide on islet cells during endotoxemia in rats
Li Qiang, Xu Linshui
(Department of Biochemistry, Third Military Medical University, Chongqing, 400038)
Abstract Objective: To explore the mechanism of the effects of nitric oxide (NO) on islet cells during endotoxemia in rats. Methods: After the model of endotoxemia was established in rats with intraperitoneal injection of LPS (2 mg/kg), the changes in NO levels of the serum and pancreas were dynamically observed. The expression of inducible nitric oxide (iNO) in the islet was determined with β-NADPH-d histochemical staining. DNA damage in islet cells by the external donor of NO (sodium nitroprusside) or LPS were assessed in vitro with single cell gel electrophoresis. Results: NO level in serum was significantly increased at the 6th h, picked at the 12th h and recovered to the normal on the 1st d in the pancreas after injection. The expression of iNOS in pancreatic islet also began to be enhanced at the 6th h and significantly enhanced at the 12th h after endotoxemia. In vitro experiment showed that sodium nitroprusside markedly damaged DNA in the islet cells but LPS did not exert the same effects. Conclusion: The mechanism of the effects of NO on islet cells during endotoxemia might be that the infiltration of the inflammatory or non-inflammatory cells induced by LPS stimulates the expression of iNOS that generates the NO free radicals inducing the DNA damage of islet cells.
, 百拇医药
Key words nitric oxide; endotoxin; islet cell; single cell gel electrophoresis
感染或炎症时可引起胰岛炎性细胞浸润,导致胰岛细胞损害,在胰岛素依赖型糖尿病(Insulin dependent diabetes mellitus,IDDM)的发病过程中有重要意义。资料表明,内毒素在体内亦能引起单核巨噬细胞浸润胰岛诱导胰岛表达iNOS[1]。但是内毒素诱导胰岛细胞损伤的详细机制尚不完全清楚,国内报道不多。本实验观察LPS致内毒素血症大鼠血清、胰腺NO含量的动态变化和胰岛iNOS的表达,比较研究NO供体硝普钠与LPS在体外对胰岛细胞DNA的直接损伤作用,以阐明LPS引起胰岛细胞损伤的作用机制。
1 材料与方法
1.1 材料
, 百拇医药 胶原酶(Ⅴ型),常熔点与低熔点琼脂糖,RPMI 1640培养基,内毒素(LPS,E coli 0127∶B8),十二烷基肌氨酸钠,溴化乙锭均为Sigma产品,β-NADPH(德国宝灵曼公司),其它试剂为分析纯。CO2孵箱(美国),Olympus荧光显微镜及照像系统(日本)。
1.2 方法
1.2.1动物模型 Wistar大鼠40只,由本校实验动物中心提供,体重180~200 g,雌雄不拘,随机分成6、12 h、1、3d组,并设正常对照组,每组8只,按2mg/kg体重LPS剂量腹腔注射大鼠,断头取血并摘取胰腺。
1.2.2 NO含量测定 胰腺制成匀浆,Lowry法蛋白定量进行校正,用NO2/NO3测定间接反映NO含量,结果以μmol/g蛋白表示。血清直接测定。参考Najwek等[2]的方法,用镀铜镉还原NO3再与Griess试剂显色,通过标准曲线回归方程计算结果。
, 百拇医药
1.2.3 iNOS表达 取正常组和内毒素血症组大鼠胰腺,参照Dawson[3]方法,胰腺切片进行胰β-NADPH-d组化染色,光镜观察胰岛,以每个胰岛50%以上胰岛细胞胞浆呈蓝色作为阳性,结果以阴性(-)、阳性(+)表示。
1.2.4 DNA损伤检测
1.2.4.1 胰岛细胞分离 无菌取正常Wistar大鼠胰腺剪成1~2 mm3,用胶原酶消化[4],经Ficoll密度梯度离心纯化,所得胰岛经抗胰岛素抗体免疫组织化学染色鉴定,胰岛含量大于80%,用EDTA和胰酶消化成单个细胞,于含10%小牛血清的1640培养液培养3 d,台盼蓝染色鉴定成活率大于85%。
1.2.4.2 单细胞凝胶电泳 上述培养细胞用1640培养液调整细胞数为10 000个/ml,在培养板上每孔加入0.5 ml,加入硝普钠终浓度分别为0、10、20、40 mmol/L 4组,同时另做终浓度为5、10 μg/ml LPS两组,每组平行5孔,置CO2孵箱育温5 h。按照Ross等[5]的方法,取每孔孵育胰岛细胞,作一张琼脂糖胶板进行电泳,经溴化乙锭染色,置Olympus荧光显微镜上观察,每个实验组随机计数100个细胞,计算慧星细胞百分率表示细胞迁移度(损伤度)。同时用接目测微器测定100个细胞核直径和慧尾长度,以(核直径+慧尾长度)±标准差表示细胞迁移率。
, http://www.100md.com
1.2.5 统计学处理 实验数据用
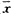 ±s表示,并采用t检验进行统计学分析。
±s表示,并采用t检验进行统计学分析。2 结果
2.1 NO含量变化
内毒素血症大鼠血清NO含量在注射LPS后6h显著升高(P<0.01),12 h虽缓慢下降,但直到3 d仍高于对照组(P<0.01)。胰腺NO含量6 h开始上升,12 h达峰值(P<0.01),1 d后恢复至正常,见表1。
表1 内毒素血症大鼠血清和胰腺NO含量变化(
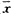 ±s)
±s)Tab 1 Changes in NO in serum and pancreas of endotoxemic rats (
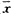 ±s)
±s), http://www.100md.com
Time after injection of LPS
Control
6 h
12 h
1 d
3 d
Serum(CB/μmol*L-1)
57.61±11.69
354.27±142.37*
270.42±102.79*
, 百拇医药
151.93±40.41*
123.03±42.54*
Pancreas(μmol/g)
2.18±0.63
2.49±0.61
3.79±1.29*
2.27±0.68
2.25±0.28
*:P<0.01 vs control
2.2 iNOS表达
, http://www.100md.com
正常对照组胰岛iNOS组化染色呈-~±,注射内毒素6 h,大鼠胰岛iNOS组化染色呈±~+显示表达增强,12 h染色呈+~,iNOS表达明显增强,1 d后恢复到正常,染色结果见图1。
2.3 NO和LPS致胰岛细胞损伤
表2所示,10、20、40 mmol/L的硝普钠体外作用5 h,胰岛细胞的细胞迁移率显著高于对照组(P<0.01),说明胰岛细胞DNA损伤显著,损伤细胞的百分率(细胞迁移度)明显高于对照组,并呈剂量依赖关系。而5、10 μg/ml的LPS作用5 h后,胰岛细胞损伤不明显(P<0.05)。图2显示正常及损伤细胞经单细胞凝胶电泳后DNA损伤形成慧星的荧光显微镜照像结果。

图1 iNOS在大鼠胰腺胰岛的表达
, 百拇医药 β-NADPH组化染色 (×200)
A:阴性胰岛 B:阳性胰岛
Fig 1 The expression of iNOS in pancreatic
islets β-NADPH-d stain (×200)
A:Negative pancreatic islets B:Positive pancreatic islets
表2 硝普钠和LPS作用胰岛细胞后细胞迁移率和迁移度改变(
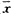 ±s)
±s)Tab 2 Changes in DNA migration and rate of DNA damaged islet cells of pancreas with sodium nitroprusside or LPS(
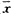 ±s)
±s), http://www.100md.com
Sodium nitroprusside (mmol/L)
LPS(μg/ml)
Control
10
20
40
5
10
DNA migration(μm)
34.85±2.36
41.18±4.61
59.99±10.79*
, 百拇医药
70.49±20.29*
35.41±2.87
36.16±3.47
Percent of damaged cells
15%
42%
63%
90%
14%
17%
*:P<0.01 vs control

, 百拇医药
图2 损伤胰岛细胞核DNA慧星的单细胞
凝胶电泳照像结果
A:正常细胞 B:损伤细胞(×400)
Fig 2 Single cell gel eletrophoresis of damaged
nuclear DNA comets of islet cell after assay
A:Normal cell B:Damaged cell(×400)
3 讨论
已知内毒素(LPS)在体内可通过刺激炎症细胞对胰岛浸润,引起胰岛或胰岛周围炎症反应,并通过巨噬细胞、淋巴细胞释放IL-1β,TNF-α,IFN-γ等细胞因子损伤胰岛细胞而导致IDDM[6]。同时体外试验也证实细胞因子单独或与LPS协同作用,亦能诱导胰岛细胞表达iNOS,产生NO抑制胰岛素分泌[7]。然而有关LPS引起胰岛细胞损伤的详细机制和作用环节未完全清楚,国内未见有报道。我们在整体观察LPS作用的基础上,还在离体条件下比较观察LPS和外源NO供体(硝普钠)对大鼠胰岛的损害,探讨LPS对胰岛损伤的详细作用机制。结果显示,大鼠注射LPS 6 h后血清和胰腺,NO水平明显升高,与此同时胰岛iNOS也同步于早期表达明显增强,表明内毒素(LPS)能诱导大鼠胰岛细胞iNOS的表达,产生NO增多。体外试验发现外源NO供体(硝普钠)对胰岛细胞DNA有明显损伤作用,而LPS在体外损伤不明显,提示LPS对胰岛的损伤作用是一种通过细胞因子刺激iNOS表达和NO生成,并由NO介导的间接作用。
, 百拇医药
细胞因子上述作用是通过激活核因子κB(NFκB)而启动系列信号传导,从而诱导iNOS的表达[8],大量产生NO,NO是一种具有广泛生物学活性的氮化物自由基,能与含硫铁中心的酶或含巯基多肽反应,抑制DNA合成;能产生高毒性的羟自由基和过氧化硝基化合物(ONOO),引起核酸亚硝酰基化反应,直接导致细胞DNA链断裂[9]。我们建立了单细胞凝胶电泳技术能快速、灵敏检测单个哺乳动物细胞DNA断裂[5],结果证实外源NO供体硝普钠在体外明显引起胰岛细胞DNA的断裂、损伤,但LPS作用不明显。由以上结果可以推断,内毒素(LPS)在体内引起胰岛炎性浸润,同时刺激巨噬细胞、淋巴细胞释放细胞因子,通过细胞因子诱导胰岛细胞表达iNOS,产生NO,并通过NO介导对胰岛细胞的损伤,可能在自身免疫性糖尿病发病中起重要作用。这一结果与Corbett[9]提出的LPS作为诱导物,诱导胰岛细胞损伤而导致糖尿病的看法相一致。
作者简介:李 强,男,27岁,信院医师,硕士兵,现在附属新桥医院检验科 重庆,400037
, 百拇医药
参考文献
[1] Pollock J S, Forstermann U, Tracey W R, et al. Nitric oxide synthase isozymes antibodies. Histochem J, 1995,27(10):738
[2] Cortas N K, Wakid N W. Determination of inorganic nitrate in serum and urine by a kinetic cadmium-reduction method. Clin Chem,1990,36(8):1440
[3] Dawson T M, Bredt D S, Fotubi M, et al. Nitric oxide synthase and neuronal β-NADPH diaphorase are indentical in brain and periphercal tissue. Proc Natl Acad Sci,1991,88(17):7797
, 百拇医药
[4] Gotoh M, Maki T, Satomi S, et al. Reproducible high yield of rat islets by stationary in vitro digestion following pancreatic ductal or portal venous collagenase injection. Transplantation,1987,43(5):725
[5] Ross G M, Mcmillan T J, Wilcox P, et al. The single cell microgel electrophoresis assay (comet assay): Technical aspects and applications. Mut Res,1995,337(1):57
[6] Kwon G, Corbett J A, Hauser S, et al. Evidence for involvement of the proteasome complex (26S) and NFκB in IL-1β-induced nitric oxide and prostaglandin production by rats islet and RINm5F cells. Diabetes,1998,47(4):583
, 百拇医药
[7] Stoltje P, Mcdaniel M. Multiple cytokins required for induction of nitric oxide synthase in mouse islets. Diabetes,1994,43(Suppl):235A
[8] Flodstrom M, Welsh N, Eizirik D L. Cytokines activate the nuclear factor κB (NFκB) and induce nitric oxide production in human pancreatic islet. FEBS lett,1996,385(1):4
[9] Corbett J A, Mcdniel M L. Does nitric oxide mediate autoimmune destruction of β-cells. Diabetes,1992,41(8):897
收稿:1998-10-30;修回:1998-12-23, 百拇医药