有效原代猪肝细胞培养体系的研制*
作者:陈 柯 高 毅 潘玉先 杨继震
单位:第一军医大学附属珠江医院普通外科 广东省广州市 510282
关键词:人工肝;肝细胞;细胞,培养的
中国图书资料分类号 R318
中国图书资料分类号 R318.14
摘 要
目的 建立一种有效的原代猪肝细胞长期培养体系. 为人工肝生物材料提供生存环境.
方法 把经二步胶原酶灌注法分离的猪肝细胞按3×105分别接种于无血清培养基、100mL/L胎牛血清培养基、100mL/L的猪门静脉血清培养基中. 光镜下观察各体系中肝细胞形态变化过程. 采用Beckman全自动生化分析仪检测各培养体系不同时间培养上清中Albumin, Urea的含量.
, 百拇医药
结果 原代猪肝细胞在三种不同培养体系中存活时间分别是:无血清培养基4d~5d,胎牛血清培养基35d~37d,猪门静脉血清培养基57d~58d. 存活的肝细胞功能活性除无血清培养组不明显外,胎牛血清培养组可维持4wk左右,猪门静脉血清培养组则可维持8wk左右
结论 门静脉血清培养体系是原代猪肝细胞较为理想的生存环境.
An effective system for culturing
primary porcine hepatocytes*
CHEN Ke, GAO Yi, PAN Yu-Xian and YANG Ji-Zhen
Department of General Surgery, Zhujiang Hospital, First Military Medical University, Guangzhou 510282, Guangdong Province, China
, 百拇医药
Subject headings artificial liver; hepatocytes; cell, cultured
Abstract
AIM To establish an effective primary porcine hepatocytes culturing system for the biological material of bioartificial liver(BAL).
METHODS Porcine hepatocytes were harvested by two-step perfusion collagenase method. Individually, cells were plated at a concentration of 3×105 in serum-free DMEM culture medium, DMEM culture medium supplemented with 10% fetal calf serum or 100mL/L porcine portal vein serum. Changes in cell spreading with time in culture were determined by taking phase contrast micrographs of cells. The concentration of albumin and urea were measured.
, http://www.100md.com
RESULTS The primary porcine hepatocytes viability and specific function were maintained in serum-free culture system for 7 days, in FCS system for 35-37 days,and in porcine portal vein serum system for over 50 days.
CONCLUSION The culture medium supplemented with porcine portal vein serum is an ideal circumstance for maintaining porcine hepatocytes viability in vitro.
0 引言
原代肝细胞作为BAL的生物材料必需解决以下两个问题:①长期维持离体肝细胞的生存和功能;②长期体外保存生物材料. 离体肝细胞体外生存时间短即在短期内就丧失生物活性是严重制约原代肝细胞作为BAL生物材料的主要因素. 为探索解决这些问题的方法,建立一种较为完善的肝细胞培养体系,通过离体长期培养来达到体外肝细胞长期保存的目的. 我们在基础培养基中加入猪门静脉血清作为细胞培养系统,并把这一体系与无血清培养体系和胎牛血清培养体系作一比较. 以形态学特征、生存时间及生物合成功能作为指标,来评价这一培养体系. 兹将具体实验报告如下.
, 百拇医药
1 材料和方法
1.1 材料 本地杂种猪5只,体重5kg~10kg,雌雄不限,1~2月龄,由中山医科大学实验动物中心提供. 主要试剂:胰岛素、胰高血糖素、转铁蛋白、氢化可的松、Ⅰ型胶原酶、苔盼蓝等由Sigma公司提供. 鼠尾胶自行配制. 门静脉血清在实验中收集. 肝脏灌注液配制见表1.
表1 各种肝脏灌注液配制
成分
Ⅰ
Ⅱ
Ⅲ
Ⅳ
NaCl(g)
8.3
, 百拇医药
3.9
4.0
8.3
KCl(g)
0.5
0.5
0.4
0.5
NaOH(g)
0.22
2.6
2.1
0.11
, http://www.100md.com
CaCl2(g)
0.53
0.136
0.136
MgCl2(g)
0.13
Na2SO4(g)
0.1
HEPES(g)
2.4
24
7.2
, http://www.100md.com
2.4
COLLAGENAS(Ⅰ)(g)
0.5
TRICINE(g)
6.5
TES(g)
6.9
pH
7.4
7.4~7.6
7.4
7.4
1.2 方法
, http://www.100md.com
1.2.1 猪肝细胞的分离培养 实验猪于术前12h禁食,用30g/L的戊巴比妥钠按50mg/kg ip麻醉,腹部备皮消毒,打开腹腔,暴露门静脉及下腔静脉,于下腔静脉内注射0.25mg(125IU)肝素. 分离门、下腔静脉,分别结扎其远心端,行近端插管并固定. 在肝静脉上端结扎下腔静脉. 分别用经37℃水浴预热的灌注Ⅰ液、Ⅱ液经门、腔静脉循环灌注,灌注流速为50mL/min~60mL/min,至肝脏变为苍白或黄白色,灌注时间约20min左右. 取下消化成熟的肝脏,切开肝包膜,将消化分离的肝细胞刷入经37℃水浴预热的Ⅲ液中. 分别经150,100,80μm滤网过滤,制备成粗制肝细胞悬液. 后以1000r/min的离心速度离心3min~5min,共离心3次. 把沉淀的肝细胞加入Ⅳ液中制备成肝细胞悬液备用. 门静脉分离后,分别行近端和远端插管固定,近端供肝脏灌注用,远端插管供抽取门静脉血用,每3min~5min抽吸1次,每次尽量抽取干净. 在实验中5只猪共收集到门静脉血1264mL. 以2000r/min的离心速度离心提取门静脉血清. 把第一次离心提取的血清再以2000r/min的离心速度离心3次,提炼成精制门静脉血清. 共精炼门静脉血清682mL. 精炼门静脉血清抽滤除菌并分装备用. 肝细胞培养(采用24目培养板作为培养器皿):每只猪肝细胞悬液随机等量分配到以下3组进行:①无血清培养;②胎牛血清培养;③猪门静脉血清培养. 实验共分5次进行,每只猪的处理过程相同. 每次具体培养过程如下:
, 百拇医药
无血清培养:分2组,其中一组作长期培养,另一组用做描绘细胞生长曲线标本. 长期培养(N=5孔):取猪肝细胞悬液1mL,含肝细胞3.0×105个,播种于已经铺好鼠尾胶的24目培养板中,并加2mL含有100μg/L胰高血糖素、100μg/L转铁蛋白、200μg/L氢化可的松、100μg/L胰岛素、200μg/L复达欣的无血清DMEM培养基. 置于恒温37℃二氧化碳培养箱中培养,培养24h后倒去培养上清,用少量培养液冲洗培养孔3次. 加入3mL含上述各因子的DMEM培养基继续培养. 以后定期进行换液,每次换取新鲜培养基1mL. 收集每次换液中的培养上清并将其离心去除细胞碎片,将处理后的培养上清置于-20℃的冰箱中保存以备生化检查;细胞曲线研究组(N=35孔):连续7d每天取5孔分离计数(一般培养处理同前).
胎牛血清培养:在DMEM基础培养基中按100mL/L的浓度加入胎牛血清,其他处理同无血清培养.
猪门静脉血清培养:在DMEM基础培养基中按100mL/L的浓度加入精炼的猪门静脉血清,其他处理同无血清培养.
, 百拇医药
1.2.2 细胞功能检测及形态学观察 光镜观察:Olmpus倒置相差生物显微镜及全自动显微摄影装置对培养中的肝细胞进行动态观察并摄影. 清蛋白及尿素合成功能检测:用Beckman全自动生化分析仪测定猪肝细胞培养时各上清中清蛋白及尿素含量.
统计学处理 指标以x±s表示,采用配对资料T检验进行数据处理,以P<0.05作为显著性界限.2 结果
平均每只猪肝获取2.72×1010个肝细胞,平均活力91.8% ,每克猪肝平均能获取7.01×107个肝细胞.
2.1 形态学观察 用倒置相差显微镜对培养中的肝细胞进行连续动态观察发现(图1,2):①游离的肝细胞呈分散状态,胞体为透亮的圆球形. 细胞接种4h后均可见贴壁生长的肝细胞,随后贴壁的肝细胞逐渐增多,24h后有较多的肝细胞贴壁,贴壁生长的肝细胞由圆球形变为扁平伸展形态. 虽然各培养体系中肝细胞的生存时间长短不同,但死亡前均有以下特点:肝细胞形态开始变为不规则形,胞质内可见明显的颗粒,并有空泡形成,细胞边缘不清渐渐细胞核消失最后脱落死亡. 无血清培养时肝细胞在培养后4h偶见贴壁的肝细胞,其后贴壁的肝细胞虽有增加但仍明显少于其他两种培养体系,培养3d就可见肝细胞内出现颗粒及空泡,培养5d时培养体系中的肝细胞已基本死亡,整个培养过程中基本未见双核肝细胞;胎牛血清培养体系培养后2h接种的肝细胞开始贴壁、伸展,双核肝细胞较多,有的肝细胞连接成丘岛状. 24h后大约有50%~60%的肝细胞贴壁. 接种后d3细胞开始增殖. 接种6d开始出现衰老细胞. 大约在20d左右肝细胞生满培养瓶壁. 培养后5wk左右开始肝细胞变粗糙,细胞边缘模糊不清,多数细胞内可见颗粒及空泡,其后2d左右肝细胞死亡脱落. 猪门静脉血清培养体系培养的肝细胞前24h细胞形态与胎牛血清培养体系的变化大致相同,但双核细胞明显较前两种多. 培养3d新生细胞布满视野,细胞相互连接成岛状、球状及条索状,新生细胞周围可见衰老的细胞浮起. 培养18d左右,肝细胞已基本布满培养瓶壁,此种状态可维持到52d左右. 52d后开始肝细胞变粗糙,细胞内有空泡及颗粒出现,d56后细胞基本死亡脱落. ②各培养体系中细胞生长情况及其生长曲线:本实验采用TB染色细胞计数法分别检测不同体系细胞生长情况,每一种体系每次分别计算5目中肝细胞均数,最终5次实验结果见(表1). 并根据表1绘出不同培养体系的肝细胞生长曲线(图3). 从图中可以看出门静脉血清培养体系中的肝细胞增殖能力明显高于其他两种体系.
, 百拇医药
表1 不同培养体系不同培养时间细胞数
( ±s,×105/孔)
±s,×105/孔)
t/d
1
2
3
4
5
6
7
, 百拇医药
门脉血
3.0±1.2
3.0±0.3
7.4±0.2a
14.3±0.3a
22.4±0.5a
25.7±0.3a
28.1±0.4a
牛血清
2.8±0.4
3.0±0.2
, 百拇医药
3.9±0.4
5.8±0.5
12.3±0.8
15.3±0.3
15.6±0.7
无血清
3.0±0.5
2.8±0.8
2.2±0.2
aP<0.05,vs 胎牛血清培养组.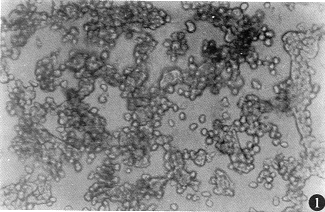
, http://www.100md.com
图1 门静脉血清培养30d肝细胞生长良好.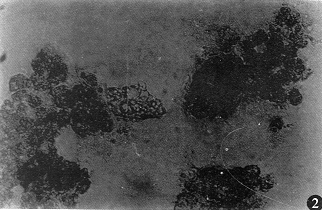
图2 胎牛血清培养后30d细胞内可见明显空泡及颗粒.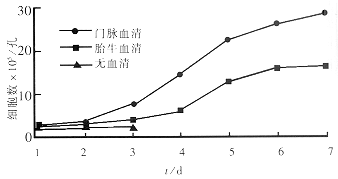
图3 各培养体系中肝细胞生长曲线.
2.2 生化功能测定 用Beckman全自动生化分析仪分别检测各培养上清液中清蛋白及尿素含量变化,结果显示:①无血清培养体系中肝细胞在接种后1d~2d内具有蛋白合成及尿素合成功能,培养4d以后肝细胞生物功能丧失;②在胎牛血清培养体系中肝细胞功能变化趋势同第一部分实验;③猪门静脉血清培养体系中肝细胞功能变化与胎牛培养体系中的变化相仿,但在培养d3~d5后肝细胞功能明显高于胎牛血清培养体系中的肝细胞,门静脉血清中的肝细胞在培养到50d左右时仍具有功能活性(图4,5).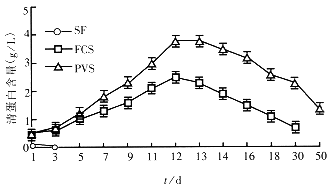
, 百拇医药
图4 培养体系中肝细胞合成蛋白能力变化.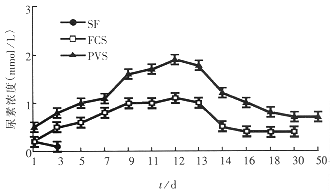
图5 各培养基中肝细胞合成尿素能力变化图.
3 讨论
现代BALSS的主要特点是其具有类似于人体肝脏的多种生物功能,而这些生物功能完全是来源于组合其中的生物材料. 多年的研究表明原代肝细胞是BALSS是其最理想的生物材料,但由于离体培养的肝细胞在短期内,其形态和功能就会发生明显变化,使利用离体肝细胞作为BAL的生物材料受到严重限制. 离体肝细胞其特有功能的丧失说明体外培养环境中缺乏人体内环境中某些元素,于是人们设想通过在单层细胞培养体系中添加某些营养成分和激素来促进肝细胞的蛋白合成及分泌功能,或在培养器皿壁覆盖生物基质,例如Ⅰ型胶原、 纤维粘连蛋白、鼠尾胶等,来改善肝细胞附壁和活性. 虽然上述培养方法较以前的各种方法有一定的改善,但这种作用是有限的也是临时性的. 目前国内外有很多相关学科的研究者正在探索一种新的并行之有效的体外原代肝细胞培养体系,已取得了初步成效. 其主要特点概括如下:①在基础培养基中加入激素类试剂[1]. 如胰岛素、胰高血糖素、转铁蛋白、氢化可的松等;②培养体系中添加细胞外生物基质[2-4];③培养体系中加入刺激肝细胞生长的因子[5,6]. 如肝细胞生长因子、上皮细胞生长因子等;④同其他内胚层、中胚层细胞共同培养;⑤三维立体细胞培养. 如微囊、巨囊等胶囊包裹培养、限制细胞贴壁的肝细胞集聚培养、微载体及中空纤维培养等[7,8];⑥在培养体系中加入多种氨基酸、能量营养物质. ⑦肝细胞培养体系中加入诱导剂,如二甲亚砜、戊巴比妥盐等[9]. 其他如国内王英杰et al[10]认为在胚胎肝细胞培养上清中含有某些成分不明的细胞生长因子可以刺激离体细胞的生长增殖. 以上各种培养方法都是为了让肝细胞能生活在更类似于体内环境的培养环境中.
, 百拇医药
众所周知,肝脏的血供大约70%来源于门脉系统,肝脏生长发育和功能维持主要依赖于门脉系统提供的营养环境. 也就是说在体肝细胞是在以门静脉血为主的“培养基”中生长并维持其功能. 门静脉血提供给体内肝细胞生长和维持其生物功能所必需的各种营养物质、包括各氨基酸、能量物质成分,此外还提供了多种生长因子和贴壁因子等. 本实验正是以此为基础,在基础培养基中添加猪门静脉血清并以此作为培养体系培养肝细胞. 实验结果表明肝细胞能在这一体系中长期生存并维持其生物功能. 从实验数据可以看出:在增殖前即培养前3d功能较低. 培养后的7d~14d维持较高功能状态. 肝细胞培养至d52(7wk以上)仍有一定的生物合成功能,基础培养上清中清蛋白水平仍高于起始水平. 本体系培养的肝细胞其生存时间及生物功能维持的时间明显长于无血清培养体系(3d)及胎牛血清培养体系(34d). 在国外报道的较好的培养体系中肝细胞生存时间一般都在4wk~5wk左右. 所以此培养体系较之其他培养体系来说,具有一定的优越性,是BAL中生物材料得以长期保存并维持功能较为理想的液态环境.
, 百拇医药
作者简介:
陈柯,男,1966-06-23生.江西瑞昌人,汉族.1990年江西医学院医疗系本科毕业.肝胆外科硕士,主治医师,主要从事肝胆疾病的外科治疗和研究.
*国家自然科学基金资助项目,No.39570212,广东省“五个一”重点课题.
通讯作者 陈柯,510282,第一军医大学附属珠江医院普通外科,广东省广州市工业大道中253号.
*Project supported by National Natural Science Fundation,No.39570212.
Correspondence to:CHEN Ke, Department of General Surgery, Zhujiang Hospital, First Military Medical University, Guangzhou 510282, Guangdong Province, China
, 百拇医药
Tel. +86.20.87377881 ext 2306
4 参考文献
[1] Kimura M, Ogihara M. Proliferation of adult rat hepatocytes in primary culture induced by insulin is potentiated by cAMP-elevating agents. Eur J Pharmacol, 1997;327:87-95
[2] Kono Y, Yang S, Roberts ES. Extended primary culture of human hepatocytes in a collagen gel sandwich system. In Vitro Cell Dev Biol Anim, 1997;33:467-472
, 百拇医药
[3] Taguchi K, Matsushita M, Takahashi M, Uchino J. Development of a bioartificial liver with sandwiched-cultured hepatocytes between two collagen gel layers. Artif Organs, 1996;20:178-185
[4] Koike M, Matsushita M, Taguchi K, Uchino J. Function of culturing monolayer hepatocytes by collagen gel coating and co-culture with nonparenchymal cells. Artif Organs, 1996;20:186-192
[5] Schuppan D, Schmid M, Somasundaram R, Ackermann R, Ruehl M, Naksmura T. Collagens in the liver extracellular matrix bind hepatocyte growth factor. Gastroenterology, 1998;114:139-152
, 百拇医药
[6] Hu MY, Cipolle M, Begue JM, Sielaff T, Lovdahl MJ, Mann HJ, Remmel RP. Effect of hepatocyte growth factor on viability and biotransformation function of hepatocytes in gel entrapped and monolayer culture. Crit Care Med, 1995;23:1237-1242
[7] Flendrig LM, te-Velde AA, Chenuleau RA. Semipermeable hollow fiber membranes in hepatocyte bioreactors a prerequisite for a successful bioartificial liver Artif Organs, 1997;21:1177-1181
, 百拇医药 [8] Sielaff TD, Nyberg SL, Rollins MD, Hu-MY, Amiot B, Lee A. Characterization of the three-compartment gel-entrapment porcine hepatocyte bioartificial liver. Cell Biol Toxicol, 1997;13:357-364
[9] Cable EE, Isom HC. Exposure of primary rat hepatocytes in long-term DMSO culture to selected transition metals induces hepatocyte proliferation and formation of duct-like structures. Hepatology, 1997;26:1444-1457
[10] 王英杰,王小红. 培养人胎肝细胞的形态与功能研究. 新消化病学杂志,1997;5:291-292
收稿日期 1998-06-06 修回日期 1998-12-12, 百拇医药
单位:第一军医大学附属珠江医院普通外科 广东省广州市 510282
关键词:人工肝;肝细胞;细胞,培养的
中国图书资料分类号 R318
中国图书资料分类号 R318.14
摘 要
目的 建立一种有效的原代猪肝细胞长期培养体系. 为人工肝生物材料提供生存环境.
方法 把经二步胶原酶灌注法分离的猪肝细胞按3×105分别接种于无血清培养基、100mL/L胎牛血清培养基、100mL/L的猪门静脉血清培养基中. 光镜下观察各体系中肝细胞形态变化过程. 采用Beckman全自动生化分析仪检测各培养体系不同时间培养上清中Albumin, Urea的含量.
, 百拇医药
结果 原代猪肝细胞在三种不同培养体系中存活时间分别是:无血清培养基4d~5d,胎牛血清培养基35d~37d,猪门静脉血清培养基57d~58d. 存活的肝细胞功能活性除无血清培养组不明显外,胎牛血清培养组可维持4wk左右,猪门静脉血清培养组则可维持8wk左右
结论 门静脉血清培养体系是原代猪肝细胞较为理想的生存环境.
An effective system for culturing
primary porcine hepatocytes*
CHEN Ke, GAO Yi, PAN Yu-Xian and YANG Ji-Zhen
Department of General Surgery, Zhujiang Hospital, First Military Medical University, Guangzhou 510282, Guangdong Province, China
, 百拇医药
Subject headings artificial liver; hepatocytes; cell, cultured
Abstract
AIM To establish an effective primary porcine hepatocytes culturing system for the biological material of bioartificial liver(BAL).
METHODS Porcine hepatocytes were harvested by two-step perfusion collagenase method. Individually, cells were plated at a concentration of 3×105 in serum-free DMEM culture medium, DMEM culture medium supplemented with 10% fetal calf serum or 100mL/L porcine portal vein serum. Changes in cell spreading with time in culture were determined by taking phase contrast micrographs of cells. The concentration of albumin and urea were measured.
, http://www.100md.com
RESULTS The primary porcine hepatocytes viability and specific function were maintained in serum-free culture system for 7 days, in FCS system for 35-37 days,and in porcine portal vein serum system for over 50 days.
CONCLUSION The culture medium supplemented with porcine portal vein serum is an ideal circumstance for maintaining porcine hepatocytes viability in vitro.
0 引言
原代肝细胞作为BAL的生物材料必需解决以下两个问题:①长期维持离体肝细胞的生存和功能;②长期体外保存生物材料. 离体肝细胞体外生存时间短即在短期内就丧失生物活性是严重制约原代肝细胞作为BAL生物材料的主要因素. 为探索解决这些问题的方法,建立一种较为完善的肝细胞培养体系,通过离体长期培养来达到体外肝细胞长期保存的目的. 我们在基础培养基中加入猪门静脉血清作为细胞培养系统,并把这一体系与无血清培养体系和胎牛血清培养体系作一比较. 以形态学特征、生存时间及生物合成功能作为指标,来评价这一培养体系. 兹将具体实验报告如下.
, 百拇医药
1 材料和方法
1.1 材料 本地杂种猪5只,体重5kg~10kg,雌雄不限,1~2月龄,由中山医科大学实验动物中心提供. 主要试剂:胰岛素、胰高血糖素、转铁蛋白、氢化可的松、Ⅰ型胶原酶、苔盼蓝等由Sigma公司提供. 鼠尾胶自行配制. 门静脉血清在实验中收集. 肝脏灌注液配制见表1.
表1 各种肝脏灌注液配制
成分
Ⅰ
Ⅱ
Ⅲ
Ⅳ
NaCl(g)
8.3
, 百拇医药
3.9
4.0
8.3
KCl(g)
0.5
0.5
0.4
0.5
NaOH(g)
0.22
2.6
2.1
0.11
, http://www.100md.com
CaCl2(g)
0.53
0.136
0.136
MgCl2(g)
0.13
Na2SO4(g)
0.1
HEPES(g)
2.4
24
7.2
, http://www.100md.com
2.4
COLLAGENAS(Ⅰ)(g)
0.5
TRICINE(g)
6.5
TES(g)
6.9
pH
7.4
7.4~7.6
7.4
7.4
1.2 方法
, http://www.100md.com
1.2.1 猪肝细胞的分离培养 实验猪于术前12h禁食,用30g/L的戊巴比妥钠按50mg/kg ip麻醉,腹部备皮消毒,打开腹腔,暴露门静脉及下腔静脉,于下腔静脉内注射0.25mg(125IU)肝素. 分离门、下腔静脉,分别结扎其远心端,行近端插管并固定. 在肝静脉上端结扎下腔静脉. 分别用经37℃水浴预热的灌注Ⅰ液、Ⅱ液经门、腔静脉循环灌注,灌注流速为50mL/min~60mL/min,至肝脏变为苍白或黄白色,灌注时间约20min左右. 取下消化成熟的肝脏,切开肝包膜,将消化分离的肝细胞刷入经37℃水浴预热的Ⅲ液中. 分别经150,100,80μm滤网过滤,制备成粗制肝细胞悬液. 后以1000r/min的离心速度离心3min~5min,共离心3次. 把沉淀的肝细胞加入Ⅳ液中制备成肝细胞悬液备用. 门静脉分离后,分别行近端和远端插管固定,近端供肝脏灌注用,远端插管供抽取门静脉血用,每3min~5min抽吸1次,每次尽量抽取干净. 在实验中5只猪共收集到门静脉血1264mL. 以2000r/min的离心速度离心提取门静脉血清. 把第一次离心提取的血清再以2000r/min的离心速度离心3次,提炼成精制门静脉血清. 共精炼门静脉血清682mL. 精炼门静脉血清抽滤除菌并分装备用. 肝细胞培养(采用24目培养板作为培养器皿):每只猪肝细胞悬液随机等量分配到以下3组进行:①无血清培养;②胎牛血清培养;③猪门静脉血清培养. 实验共分5次进行,每只猪的处理过程相同. 每次具体培养过程如下:
, 百拇医药
无血清培养:分2组,其中一组作长期培养,另一组用做描绘细胞生长曲线标本. 长期培养(N=5孔):取猪肝细胞悬液1mL,含肝细胞3.0×105个,播种于已经铺好鼠尾胶的24目培养板中,并加2mL含有100μg/L胰高血糖素、100μg/L转铁蛋白、200μg/L氢化可的松、100μg/L胰岛素、200μg/L复达欣的无血清DMEM培养基. 置于恒温37℃二氧化碳培养箱中培养,培养24h后倒去培养上清,用少量培养液冲洗培养孔3次. 加入3mL含上述各因子的DMEM培养基继续培养. 以后定期进行换液,每次换取新鲜培养基1mL. 收集每次换液中的培养上清并将其离心去除细胞碎片,将处理后的培养上清置于-20℃的冰箱中保存以备生化检查;细胞曲线研究组(N=35孔):连续7d每天取5孔分离计数(一般培养处理同前).
胎牛血清培养:在DMEM基础培养基中按100mL/L的浓度加入胎牛血清,其他处理同无血清培养.
猪门静脉血清培养:在DMEM基础培养基中按100mL/L的浓度加入精炼的猪门静脉血清,其他处理同无血清培养.
, 百拇医药
1.2.2 细胞功能检测及形态学观察 光镜观察:Olmpus倒置相差生物显微镜及全自动显微摄影装置对培养中的肝细胞进行动态观察并摄影. 清蛋白及尿素合成功能检测:用Beckman全自动生化分析仪测定猪肝细胞培养时各上清中清蛋白及尿素含量.
统计学处理 指标以x±s表示,采用配对资料T检验进行数据处理,以P<0.05作为显著性界限.2 结果
平均每只猪肝获取2.72×1010个肝细胞,平均活力91.8% ,每克猪肝平均能获取7.01×107个肝细胞.
2.1 形态学观察 用倒置相差显微镜对培养中的肝细胞进行连续动态观察发现(图1,2):①游离的肝细胞呈分散状态,胞体为透亮的圆球形. 细胞接种4h后均可见贴壁生长的肝细胞,随后贴壁的肝细胞逐渐增多,24h后有较多的肝细胞贴壁,贴壁生长的肝细胞由圆球形变为扁平伸展形态. 虽然各培养体系中肝细胞的生存时间长短不同,但死亡前均有以下特点:肝细胞形态开始变为不规则形,胞质内可见明显的颗粒,并有空泡形成,细胞边缘不清渐渐细胞核消失最后脱落死亡. 无血清培养时肝细胞在培养后4h偶见贴壁的肝细胞,其后贴壁的肝细胞虽有增加但仍明显少于其他两种培养体系,培养3d就可见肝细胞内出现颗粒及空泡,培养5d时培养体系中的肝细胞已基本死亡,整个培养过程中基本未见双核肝细胞;胎牛血清培养体系培养后2h接种的肝细胞开始贴壁、伸展,双核肝细胞较多,有的肝细胞连接成丘岛状. 24h后大约有50%~60%的肝细胞贴壁. 接种后d3细胞开始增殖. 接种6d开始出现衰老细胞. 大约在20d左右肝细胞生满培养瓶壁. 培养后5wk左右开始肝细胞变粗糙,细胞边缘模糊不清,多数细胞内可见颗粒及空泡,其后2d左右肝细胞死亡脱落. 猪门静脉血清培养体系培养的肝细胞前24h细胞形态与胎牛血清培养体系的变化大致相同,但双核细胞明显较前两种多. 培养3d新生细胞布满视野,细胞相互连接成岛状、球状及条索状,新生细胞周围可见衰老的细胞浮起. 培养18d左右,肝细胞已基本布满培养瓶壁,此种状态可维持到52d左右. 52d后开始肝细胞变粗糙,细胞内有空泡及颗粒出现,d56后细胞基本死亡脱落. ②各培养体系中细胞生长情况及其生长曲线:本实验采用TB染色细胞计数法分别检测不同体系细胞生长情况,每一种体系每次分别计算5目中肝细胞均数,最终5次实验结果见(表1). 并根据表1绘出不同培养体系的肝细胞生长曲线(图3). 从图中可以看出门静脉血清培养体系中的肝细胞增殖能力明显高于其他两种体系.
, 百拇医药
表1 不同培养体系不同培养时间细胞数
(
t/d
1
2
3
4
5
6
7
, 百拇医药
门脉血
3.0±1.2
3.0±0.3
7.4±0.2a
14.3±0.3a
22.4±0.5a
25.7±0.3a
28.1±0.4a
牛血清
2.8±0.4
3.0±0.2
, 百拇医药
3.9±0.4
5.8±0.5
12.3±0.8
15.3±0.3
15.6±0.7
无血清
3.0±0.5
2.8±0.8
2.2±0.2
aP<0.05,vs 胎牛血清培养组.

, http://www.100md.com
图1 门静脉血清培养30d肝细胞生长良好.

图2 胎牛血清培养后30d细胞内可见明显空泡及颗粒.

图3 各培养体系中肝细胞生长曲线.
2.2 生化功能测定 用Beckman全自动生化分析仪分别检测各培养上清液中清蛋白及尿素含量变化,结果显示:①无血清培养体系中肝细胞在接种后1d~2d内具有蛋白合成及尿素合成功能,培养4d以后肝细胞生物功能丧失;②在胎牛血清培养体系中肝细胞功能变化趋势同第一部分实验;③猪门静脉血清培养体系中肝细胞功能变化与胎牛培养体系中的变化相仿,但在培养d3~d5后肝细胞功能明显高于胎牛血清培养体系中的肝细胞,门静脉血清中的肝细胞在培养到50d左右时仍具有功能活性(图4,5).

, 百拇医药
图4 培养体系中肝细胞合成蛋白能力变化.

图5 各培养基中肝细胞合成尿素能力变化图.
3 讨论
现代BALSS的主要特点是其具有类似于人体肝脏的多种生物功能,而这些生物功能完全是来源于组合其中的生物材料. 多年的研究表明原代肝细胞是BALSS是其最理想的生物材料,但由于离体培养的肝细胞在短期内,其形态和功能就会发生明显变化,使利用离体肝细胞作为BAL的生物材料受到严重限制. 离体肝细胞其特有功能的丧失说明体外培养环境中缺乏人体内环境中某些元素,于是人们设想通过在单层细胞培养体系中添加某些营养成分和激素来促进肝细胞的蛋白合成及分泌功能,或在培养器皿壁覆盖生物基质,例如Ⅰ型胶原、 纤维粘连蛋白、鼠尾胶等,来改善肝细胞附壁和活性. 虽然上述培养方法较以前的各种方法有一定的改善,但这种作用是有限的也是临时性的. 目前国内外有很多相关学科的研究者正在探索一种新的并行之有效的体外原代肝细胞培养体系,已取得了初步成效. 其主要特点概括如下:①在基础培养基中加入激素类试剂[1]. 如胰岛素、胰高血糖素、转铁蛋白、氢化可的松等;②培养体系中添加细胞外生物基质[2-4];③培养体系中加入刺激肝细胞生长的因子[5,6]. 如肝细胞生长因子、上皮细胞生长因子等;④同其他内胚层、中胚层细胞共同培养;⑤三维立体细胞培养. 如微囊、巨囊等胶囊包裹培养、限制细胞贴壁的肝细胞集聚培养、微载体及中空纤维培养等[7,8];⑥在培养体系中加入多种氨基酸、能量营养物质. ⑦肝细胞培养体系中加入诱导剂,如二甲亚砜、戊巴比妥盐等[9]. 其他如国内王英杰et al[10]认为在胚胎肝细胞培养上清中含有某些成分不明的细胞生长因子可以刺激离体细胞的生长增殖. 以上各种培养方法都是为了让肝细胞能生活在更类似于体内环境的培养环境中.
, 百拇医药
众所周知,肝脏的血供大约70%来源于门脉系统,肝脏生长发育和功能维持主要依赖于门脉系统提供的营养环境. 也就是说在体肝细胞是在以门静脉血为主的“培养基”中生长并维持其功能. 门静脉血提供给体内肝细胞生长和维持其生物功能所必需的各种营养物质、包括各氨基酸、能量物质成分,此外还提供了多种生长因子和贴壁因子等. 本实验正是以此为基础,在基础培养基中添加猪门静脉血清并以此作为培养体系培养肝细胞. 实验结果表明肝细胞能在这一体系中长期生存并维持其生物功能. 从实验数据可以看出:在增殖前即培养前3d功能较低. 培养后的7d~14d维持较高功能状态. 肝细胞培养至d52(7wk以上)仍有一定的生物合成功能,基础培养上清中清蛋白水平仍高于起始水平. 本体系培养的肝细胞其生存时间及生物功能维持的时间明显长于无血清培养体系(3d)及胎牛血清培养体系(34d). 在国外报道的较好的培养体系中肝细胞生存时间一般都在4wk~5wk左右. 所以此培养体系较之其他培养体系来说,具有一定的优越性,是BAL中生物材料得以长期保存并维持功能较为理想的液态环境.
, 百拇医药
作者简介:
陈柯,男,1966-06-23生.江西瑞昌人,汉族.1990年江西医学院医疗系本科毕业.肝胆外科硕士,主治医师,主要从事肝胆疾病的外科治疗和研究.
*国家自然科学基金资助项目,No.39570212,广东省“五个一”重点课题.
通讯作者 陈柯,510282,第一军医大学附属珠江医院普通外科,广东省广州市工业大道中253号.
*Project supported by National Natural Science Fundation,No.39570212.
Correspondence to:CHEN Ke, Department of General Surgery, Zhujiang Hospital, First Military Medical University, Guangzhou 510282, Guangdong Province, China
, 百拇医药
Tel. +86.20.87377881 ext 2306
4 参考文献
[1] Kimura M, Ogihara M. Proliferation of adult rat hepatocytes in primary culture induced by insulin is potentiated by cAMP-elevating agents. Eur J Pharmacol, 1997;327:87-95
[2] Kono Y, Yang S, Roberts ES. Extended primary culture of human hepatocytes in a collagen gel sandwich system. In Vitro Cell Dev Biol Anim, 1997;33:467-472
, 百拇医药
[3] Taguchi K, Matsushita M, Takahashi M, Uchino J. Development of a bioartificial liver with sandwiched-cultured hepatocytes between two collagen gel layers. Artif Organs, 1996;20:178-185
[4] Koike M, Matsushita M, Taguchi K, Uchino J. Function of culturing monolayer hepatocytes by collagen gel coating and co-culture with nonparenchymal cells. Artif Organs, 1996;20:186-192
[5] Schuppan D, Schmid M, Somasundaram R, Ackermann R, Ruehl M, Naksmura T. Collagens in the liver extracellular matrix bind hepatocyte growth factor. Gastroenterology, 1998;114:139-152
, 百拇医药
[6] Hu MY, Cipolle M, Begue JM, Sielaff T, Lovdahl MJ, Mann HJ, Remmel RP. Effect of hepatocyte growth factor on viability and biotransformation function of hepatocytes in gel entrapped and monolayer culture. Crit Care Med, 1995;23:1237-1242
[7] Flendrig LM, te-Velde AA, Chenuleau RA. Semipermeable hollow fiber membranes in hepatocyte bioreactors a prerequisite for a successful bioartificial liver Artif Organs, 1997;21:1177-1181
, 百拇医药 [8] Sielaff TD, Nyberg SL, Rollins MD, Hu-MY, Amiot B, Lee A. Characterization of the three-compartment gel-entrapment porcine hepatocyte bioartificial liver. Cell Biol Toxicol, 1997;13:357-364
[9] Cable EE, Isom HC. Exposure of primary rat hepatocytes in long-term DMSO culture to selected transition metals induces hepatocyte proliferation and formation of duct-like structures. Hepatology, 1997;26:1444-1457
[10] 王英杰,王小红. 培养人胎肝细胞的形态与功能研究. 新消化病学杂志,1997;5:291-292
收稿日期 1998-06-06 修回日期 1998-12-12, 百拇医药