重组人血管生长素的纯化*
作者:吴锦银 江悦华 王 捷 张宏斌 李 明
单位:广州军区广州总医院医学实验科(510010)
关键词:重组人血管生长素;纯化;鸡胚绒毛尿囊膜
广东医学990203 【摘要】 目的 建立表达重组人血管生长素(recombinant human angiogenin, rhANG)的简便纯化工艺,为扩大生产及临床应用打下基础。方法 工程菌经超声破碎,离心洗涤后,变性萃取rhANG的包涵体,通过Sephacryl S-200柱层析分离,再经CuCl2复性,得到rhANG纯品。结果 所获取rhANG的纯度达96%以上,蛋白回收率为80%,活性测定经鸡胚绒毛尿囊膜(chorioallantoic membrane, CAM)测试法显示,该rhANG具有明显的促血管生长作用。结论 建立了一套较为简捷的rhANG纯化技术。
, 百拇医药
Purification of recombinant human angiogenin Wu Jinyin, Jiang Yuehua, Wang Jie, et al.Department of Medical Research, Guangzhou General Hospital of PLA, Guangzhou 510010
【Abstract】 Objective To establish a simple purification technology of recombinant human angiogenin (rhANG) for its clinical application.Methods Engineer bacteria were disrupted by sonication, and the inclusion bodies of recombinant human angiogenin were pelleted by centrifugation. The pellet was washed and extracted. Purified recombinant human angiogenin were prepared by chromatographic separation and renaturation. The activities of recombinant human angiogenin were detected by means of chorioallantoic membrane (CAM).Results The overall protein lossing rate was about 80%. The purity of recombinant human angiogenin was more than 96%, and the purified recombinant human angiogenin had a prominent vasotropic growth effect. Conclusion A simple technique for the rhANG purification is set up.
, 百拇医药
【Key words】 Recombinant human angiogenin Purification Chorioallantoic membrane
血管生长素(Angiogenin, ANG)是一种存在于正常血浆及实体肿瘤组织中的一种蛋白质,它具有很强的促血管生长作用,且ANG与恶性肿瘤的快速生长和转移、损伤组织的修复、类风湿性关节炎的发生发展均有密切关系。故探讨简单易行的制备、纯化,是开展重组人血管生长素(recombinant human angiogenin,rhANG)研究与应用的前提。国内现有关rhANG纯化研究尚未见报道,由于血管生长因子重组蛋白是以包涵体形式存在于E.coli细胞浆中,因此,我们参照其他基因工程产物的纯化方法[1,2],利用现有的实验室条件略作修改,目的是建立一种较为简易的提纯方法,为进一步大量生产rhANG做实验室准备,现报道如下。
1 材料与方法
, 百拇医药
1.1 材料 表达人rhANG的E.Coli由复旦大学遗传所构建。rhANG表达质粒含AP抗体基因,受Clts857温敏诱导系统调节。
1.2 主要试剂 十二烷基磺酸钠(SDS)为Serva产品,低分子标准蛋白,Sephadex G-25,Sephacryl S-200为Pharmacia产品,二硫苏糖醇(DTT)购于华美公司,尿素及氯化铜等均为国产。受精鸡胚由广州华农养鸡场提供。
1.3 主要仪器 高速离心机,超声细胞粉碎机,Bio-Rad低压层析系统。
1.4 rhANG的分离纯化 发酵培养的rhANG菌液经离心收集菌体悬于50 mmol/L pH 8.2 Tris-HCl,1 mmol/L EDTA(TE)缓冲液,反复离心洗涤3次(10℃,8 600 g,10 min)。按1∶10(W/V)再加入TE悬浮,在冰浴下超声破碎细胞。经离心(10℃,10 000 g,15 min)收集沉淀。再用TE反复洗涤离心2次,弃上清液后加入适量的TE,待充分混匀后,在室温下边搅边滴加等量8 mol/L尿素-TE,作用30 min,离心收集沉淀,加入2%SDS-1 mmol/L、DTT-1 mmol/L、EDTA-50 mmol/L PB(pH 7.0),充分震荡溶解;经离心(10℃,12 000 g,30 min),上清液即为rHANG粗提物。粗提物经Sephacryl S200柱(2.6 cm×90 cm),以1% SDS-1 mmol/L DTT 1 mmol/L EDTA-50 mmol/L PB(pH 7.0)作为洗脱液,流速36 ml/h,分管收集得到rhANG纯品。
, 百拇医药
1.5 rhANG复性 Sephacryl S-200柱层析得到的rhANG,加入DTT至终浓度为2.5 mmol/L PB(pH 7.0)作为洗脱液,流速120 mL/h,收集rhANG加氯化铜至终浓度为50 μmol/L,于24℃复性1.5 h,再加入1 mmol/L EDTA终止反应,-20℃保存备用。
1.6 蛋白质含量测定 采用考马斯亮蓝G-250法[3]及280 nm/260 nm紫外吸收法。
1.7 rhANG纯度鉴定 采用SDS-PAGE电泳法。
1.8 rhANG生物活性测定 采用鸡胚绒毛尿囊膜(CAM)按文献[4]报道的方法进行测定。
2 结果
2.1 rhANG包含体制备结果 见SDS-PAGE(图1),纯度达50%以上。
, http://www.100md.com
2.2 Sephacryl S-200凝胶过滤纯化(图2) 分离出3个峰,将收集的组分进行SDS-PAGE(图1),rhANG在第3峰出现,纯度达96%以上,分子量为14.4 kd。
图1 rhANG的SDS-PAGE图谱
1.rhANG菌液诱导前 2.rhANG菌液诱导后 3.纯化的rhANG包涵体 4.Sephacryl S-200柱层析纯化物 5.纯rhANG 6.标准分子量蛋白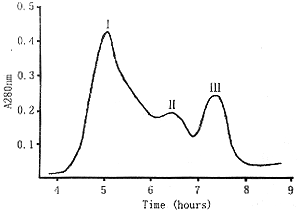
图2 Sephacry1 S-200柱层析纯化rhANG
, http://www.100md.com
2.3 rhANG纯化结果 经包涵体制备,Sephacryl S-200凝胶过滤及氯化铜复性后,rhANG的纯度明显提高。从SDS-PAGE电泳(图1),rhANG显示一条区带,利用Gelworks ID Advanced软件对该区带进行扫描分析,结果表明纯度达96%以上。本实验于IL工程菌发酵培养液中,可纯化得到rhANG纯品约120 mg,回收率为42%左右。
2.4 rhANG活性测定结果 即取10 d龄鸡胚,开窗后在其尿囊膜的无血管区放几张已高压消毒的小滤纸片,然后在纸片中加入待测样品10 μL,继续孵育2 d后取CAM膜观察血管生长情况,见照片1(对照)和照片2(样品),可见rhANG具有促进血管生长活性作用。
3 讨论
ANG表达量的大小直接影响ANG的纯化工艺,为此我们在rhANG的制备过程中,首先设法提高ANG在大肠杆菌中的表达量,用不同的培养基筛选出该工程菌最嗜好的改良M9培养基,其表达量占菌体总蛋白的20.47%。
, 百拇医药
我们利用包涵体和还原型rhANG的不溶性,以离心为主要手段,通过细菌破碎,包涵体的溶解,Sephacryl S-200柱层析纯化,Sephadex G-25柱除盐,复性等程序,获得高纯度rhANG。本法与周永春、白云等[1,2]的纯化方法相比,更为简单,操作时间大大缩短,且产量、纯度活性均能达到满意的效果。
在实验中我们发现,单纯超声破碎,在小规模下且菌量较少的情况下效果较好,由于能量传递和局部产热等原因,很难用于大体积细胞悬液的破碎,这样部分未破碎细胞与包涵体混在一起,给后期纯化带来困难。因此,在较大规模纯化时,先用溶菌酶破碎细菌的细胞膜,再结合超声破碎方法,可显著提高包涵体的纯度和回收率。
由于低生物学活性的还原型ANG需要经过氧化使ANG分子结构中的Cys26-81、Cys 39-92、Cys 57-107位上的-SH基形成二硫键,并去除高浓度变性剂才能恢复ANG的天然结构和生物学活性。因此,在氧化复性之前,我们采用Sephadex G-25凝胶过滤柱层析分离去除残留的还原剂。影响蛋白质复性的因素有很多,如pH、盐浓度、变性剂去除的速度、蛋白浓度等,对ANG来说,影响氧化复性最重要的因素是变性剂浓度,因高浓度变性剂对rhANG的正确折迭有干扰,本实验采用2%的SDS,同时将还原型的rhANG中的DTT和EDTA除去,用50 μmol/L浓度氯化铜复性,可提高折迭效率。
, 百拇医药
*本课题为广东省自然科学基金资助项目(编号:960668)
4 参考文献
1 周永春,贾 林,陆 峰,等.由大肠杆菌表达的重组人粒细胞-巨噬细胞集落刺激因子的纯化和鉴定.药物生物技术,1997,4(2):72
2 白 云,朱锡华.重组人IL-2在E.coli中的高效表达诱导因素及其纯化的研究.免疫学杂志,1990,6(4):229
3 彭秀玲,袁汉英,谢 毅,等.基因工程实验技术.第2版.长沙:湖南科学技术出版社,1997.264
4 姜志钢,鄂 征.鸡胚绒毛尿囊膜检测肿瘤血管生长作用改良技术方法.解剖学报,1989,12:142, 百拇医药
单位:广州军区广州总医院医学实验科(510010)
关键词:重组人血管生长素;纯化;鸡胚绒毛尿囊膜
广东医学990203 【摘要】 目的 建立表达重组人血管生长素(recombinant human angiogenin, rhANG)的简便纯化工艺,为扩大生产及临床应用打下基础。方法 工程菌经超声破碎,离心洗涤后,变性萃取rhANG的包涵体,通过Sephacryl S-200柱层析分离,再经CuCl2复性,得到rhANG纯品。结果 所获取rhANG的纯度达96%以上,蛋白回收率为80%,活性测定经鸡胚绒毛尿囊膜(chorioallantoic membrane, CAM)测试法显示,该rhANG具有明显的促血管生长作用。结论 建立了一套较为简捷的rhANG纯化技术。
, 百拇医药
Purification of recombinant human angiogenin Wu Jinyin, Jiang Yuehua, Wang Jie, et al.Department of Medical Research, Guangzhou General Hospital of PLA, Guangzhou 510010
【Abstract】 Objective To establish a simple purification technology of recombinant human angiogenin (rhANG) for its clinical application.Methods Engineer bacteria were disrupted by sonication, and the inclusion bodies of recombinant human angiogenin were pelleted by centrifugation. The pellet was washed and extracted. Purified recombinant human angiogenin were prepared by chromatographic separation and renaturation. The activities of recombinant human angiogenin were detected by means of chorioallantoic membrane (CAM).Results The overall protein lossing rate was about 80%. The purity of recombinant human angiogenin was more than 96%, and the purified recombinant human angiogenin had a prominent vasotropic growth effect. Conclusion A simple technique for the rhANG purification is set up.
, 百拇医药
【Key words】 Recombinant human angiogenin Purification Chorioallantoic membrane
血管生长素(Angiogenin, ANG)是一种存在于正常血浆及实体肿瘤组织中的一种蛋白质,它具有很强的促血管生长作用,且ANG与恶性肿瘤的快速生长和转移、损伤组织的修复、类风湿性关节炎的发生发展均有密切关系。故探讨简单易行的制备、纯化,是开展重组人血管生长素(recombinant human angiogenin,rhANG)研究与应用的前提。国内现有关rhANG纯化研究尚未见报道,由于血管生长因子重组蛋白是以包涵体形式存在于E.coli细胞浆中,因此,我们参照其他基因工程产物的纯化方法[1,2],利用现有的实验室条件略作修改,目的是建立一种较为简易的提纯方法,为进一步大量生产rhANG做实验室准备,现报道如下。
1 材料与方法
, 百拇医药
1.1 材料 表达人rhANG的E.Coli由复旦大学遗传所构建。rhANG表达质粒含AP抗体基因,受Clts857温敏诱导系统调节。
1.2 主要试剂 十二烷基磺酸钠(SDS)为Serva产品,低分子标准蛋白,Sephadex G-25,Sephacryl S-200为Pharmacia产品,二硫苏糖醇(DTT)购于华美公司,尿素及氯化铜等均为国产。受精鸡胚由广州华农养鸡场提供。
1.3 主要仪器 高速离心机,超声细胞粉碎机,Bio-Rad低压层析系统。
1.4 rhANG的分离纯化 发酵培养的rhANG菌液经离心收集菌体悬于50 mmol/L pH 8.2 Tris-HCl,1 mmol/L EDTA(TE)缓冲液,反复离心洗涤3次(10℃,8 600 g,10 min)。按1∶10(W/V)再加入TE悬浮,在冰浴下超声破碎细胞。经离心(10℃,10 000 g,15 min)收集沉淀。再用TE反复洗涤离心2次,弃上清液后加入适量的TE,待充分混匀后,在室温下边搅边滴加等量8 mol/L尿素-TE,作用30 min,离心收集沉淀,加入2%SDS-1 mmol/L、DTT-1 mmol/L、EDTA-50 mmol/L PB(pH 7.0),充分震荡溶解;经离心(10℃,12 000 g,30 min),上清液即为rHANG粗提物。粗提物经Sephacryl S200柱(2.6 cm×90 cm),以1% SDS-1 mmol/L DTT 1 mmol/L EDTA-50 mmol/L PB(pH 7.0)作为洗脱液,流速36 ml/h,分管收集得到rhANG纯品。
, 百拇医药
1.5 rhANG复性 Sephacryl S-200柱层析得到的rhANG,加入DTT至终浓度为2.5 mmol/L PB(pH 7.0)作为洗脱液,流速120 mL/h,收集rhANG加氯化铜至终浓度为50 μmol/L,于24℃复性1.5 h,再加入1 mmol/L EDTA终止反应,-20℃保存备用。
1.6 蛋白质含量测定 采用考马斯亮蓝G-250法[3]及280 nm/260 nm紫外吸收法。
1.7 rhANG纯度鉴定 采用SDS-PAGE电泳法。
1.8 rhANG生物活性测定 采用鸡胚绒毛尿囊膜(CAM)按文献[4]报道的方法进行测定。
2 结果
2.1 rhANG包含体制备结果 见SDS-PAGE(图1),纯度达50%以上。
, http://www.100md.com
2.2 Sephacryl S-200凝胶过滤纯化(图2) 分离出3个峰,将收集的组分进行SDS-PAGE(图1),rhANG在第3峰出现,纯度达96%以上,分子量为14.4 kd。

图1 rhANG的SDS-PAGE图谱
1.rhANG菌液诱导前 2.rhANG菌液诱导后 3.纯化的rhANG包涵体 4.Sephacryl S-200柱层析纯化物 5.纯rhANG 6.标准分子量蛋白

图2 Sephacry1 S-200柱层析纯化rhANG

, http://www.100md.com
2.3 rhANG纯化结果 经包涵体制备,Sephacryl S-200凝胶过滤及氯化铜复性后,rhANG的纯度明显提高。从SDS-PAGE电泳(图1),rhANG显示一条区带,利用Gelworks ID Advanced软件对该区带进行扫描分析,结果表明纯度达96%以上。本实验于IL工程菌发酵培养液中,可纯化得到rhANG纯品约120 mg,回收率为42%左右。
2.4 rhANG活性测定结果 即取10 d龄鸡胚,开窗后在其尿囊膜的无血管区放几张已高压消毒的小滤纸片,然后在纸片中加入待测样品10 μL,继续孵育2 d后取CAM膜观察血管生长情况,见照片1(对照)和照片2(样品),可见rhANG具有促进血管生长活性作用。
3 讨论
ANG表达量的大小直接影响ANG的纯化工艺,为此我们在rhANG的制备过程中,首先设法提高ANG在大肠杆菌中的表达量,用不同的培养基筛选出该工程菌最嗜好的改良M9培养基,其表达量占菌体总蛋白的20.47%。
, 百拇医药
我们利用包涵体和还原型rhANG的不溶性,以离心为主要手段,通过细菌破碎,包涵体的溶解,Sephacryl S-200柱层析纯化,Sephadex G-25柱除盐,复性等程序,获得高纯度rhANG。本法与周永春、白云等[1,2]的纯化方法相比,更为简单,操作时间大大缩短,且产量、纯度活性均能达到满意的效果。
在实验中我们发现,单纯超声破碎,在小规模下且菌量较少的情况下效果较好,由于能量传递和局部产热等原因,很难用于大体积细胞悬液的破碎,这样部分未破碎细胞与包涵体混在一起,给后期纯化带来困难。因此,在较大规模纯化时,先用溶菌酶破碎细菌的细胞膜,再结合超声破碎方法,可显著提高包涵体的纯度和回收率。
由于低生物学活性的还原型ANG需要经过氧化使ANG分子结构中的Cys26-81、Cys 39-92、Cys 57-107位上的-SH基形成二硫键,并去除高浓度变性剂才能恢复ANG的天然结构和生物学活性。因此,在氧化复性之前,我们采用Sephadex G-25凝胶过滤柱层析分离去除残留的还原剂。影响蛋白质复性的因素有很多,如pH、盐浓度、变性剂去除的速度、蛋白浓度等,对ANG来说,影响氧化复性最重要的因素是变性剂浓度,因高浓度变性剂对rhANG的正确折迭有干扰,本实验采用2%的SDS,同时将还原型的rhANG中的DTT和EDTA除去,用50 μmol/L浓度氯化铜复性,可提高折迭效率。
, 百拇医药
*本课题为广东省自然科学基金资助项目(编号:960668)
4 参考文献
1 周永春,贾 林,陆 峰,等.由大肠杆菌表达的重组人粒细胞-巨噬细胞集落刺激因子的纯化和鉴定.药物生物技术,1997,4(2):72
2 白 云,朱锡华.重组人IL-2在E.coli中的高效表达诱导因素及其纯化的研究.免疫学杂志,1990,6(4):229
3 彭秀玲,袁汉英,谢 毅,等.基因工程实验技术.第2版.长沙:湖南科学技术出版社,1997.264
4 姜志钢,鄂 征.鸡胚绒毛尿囊膜检测肿瘤血管生长作用改良技术方法.解剖学报,1989,12:142, 百拇医药