γ-射线诱导HL-60细胞凋亡的形态学研究*
作者:李小明 宋天保 童 新 孙志贤
单位:李小明 宋天保(西安医科大学组织学胚胎学教研室,西安 710061);童 新 孙志贤(军事医学科学院放射医学研究所,北京 100850)
关键词:辐射;细胞凋亡;HL-60细胞;形态学
解剖学报990416 【摘要】 目的 观察γ-射线诱导HL-60细胞凋亡的形态学变化。 方法 应用Hoechst33258荧光显微镜及透射电子显微镜进行观察。 结果 γ-射线诱导HL-60细胞死亡的主要方式是凋亡,凋亡细胞具有典型的形态特征,细胞核染色质凝集边聚;发现细胞核经多种形式形成核碎块;并可见具有不同内含物的凋亡小体;内质网增多,参与形成核碎块。 结论 同一因素诱导同一细胞凋亡,细胞核的变化可有多种形式。γ-射线诱导K562和CEM细胞凋亡的形态学变化与HL-60细胞的不同,反映出同一因素诱导不同细胞凋亡的途径有一定的差异。
, http://www.100md.com
STUDY ON THE MORPHOLOGY OF APOPTOTIC HL-60 CELLS
INDUCED BY γ-IRRADIATION
Li Xiaoming, Song TianbaoΔ, Tong Xin**, Sun Zhixian**
(Department of Histology and Embryology,Xi'an Medical University, Xi'an;
**Institute of Radiation Medicine,Academy of Military Medical Sciences,Beijing)
, 百拇医药 【Abstract】 Objective To observe the morphologic features of apoptotic HL-60 cells after γ-irradiation. Methods The morphology was analyzed by transmission electron microscopy and fluorescence microscopy. Results There were typical apoptotic features of morphology in HL-60 apoptosis.Chromatin was condensed along nuclear periphery.Different types of nuclear fragmentation and apoptotic bodies containing different composition were found.Proliferated endopalsmic reticulum is interrelated with the formation of the nuclear fragmentation. Conclusion There are multiple pathways for nuclear fragmentation in the apoptosis induced by one stimulus.The different nuclear morphology in HL-60,K562 and CEM cells suggests that these cells may undergo apoptosis through multiple pathways.
, 百拇医药
【Key words】 Radiation; Apoptosis; HL-60 cells; Morphology
细胞凋亡是多细胞有机体在细胞分化发育中及在各种生理、病理条件下起重要作用的一种调节适应过程[1,2],这个过程经历信号引发、调控执行和结构变化三个阶段[3]。细胞凋亡时细胞形态改变是凋亡调控中一系列生化事件的最终结果,其特征是染色质浓集,沿核膜边聚,细胞核形成一或多个含致密染色质的核碎块分散于细胞内,以及特征性凋亡小体形成[4]。不同因素对不同类型细胞所诱发的凋亡的分子生化途径有所不同,使最终的形态学改变也存在一些差异[5,6]。为观察γ-射线诱导HL-60细胞凋亡形态学变化特征,本实验以光镜、荧光显微镜及透射电镜观察凋亡细胞形态,明确HL-60细胞凋亡特点,为研究γ-射线诱导HL-60细胞凋亡的分子机制提供参考。
材料和方法
, 百拇医药
1. 材料
人早幼粒白血病细胞株HL-60、人红白血病细胞株K562及急性T淋巴细胞白血病细胞株CEM由军事医学科学院二所提供,60Co辐射源(军事医学科学院二所),Hoechst 33258为Fluka公司产品,其他化学试剂为国产分析纯。
2. 细胞培养
HL-60、K562及CEM细胞均为悬浮细胞,在RPMI1640培养基(含10%小牛血清)中、37℃、5%CO2条件下培养,3d传代1次。取对数生长期细胞用于实验。
3. γ-射线照射
照射前1d细胞换液,照射时细胞浓度为1×106/ml,HL-60细胞以5Gy γ-射线照射,剂量率1.943Gy/min,于照后继续培养9、12、24、30h;K562和CEM细胞以20Gy照射,剂量率4.087Gy/min,于照后继续培养0.5、1、1.5、2、3d。分别收获细胞用于DNA梯状带(DNA ladder)检测。以未照射常规培养细胞为阴性对照。
, 百拇医药
4. 细胞凋亡时限检测
在1×106个经PBS洗涤后的离心沉淀细胞中加入0.5ml低渗裂解液(1mmol/L EDTA,10mmol/L Tris,100mmol/L NaCl,1%SDS,含100mg/L蛋白酶K),混匀,37℃ 30min,离心沉淀(12 000rpm);上清用酚:氯仿:异戊醇(1∶12∶1)抽提,无水乙醇和NaAc沉淀DNA,溶于Tris-EDTA(TE)缓冲液中。1%琼脂糖凝胶电泳,端电压60V,1h,紫外光下观察。以DNA梯状带出现作为细胞凋亡判断标准。取凋亡前、后细胞用于形态学观察。
5. 苏木素染色
HL-60细胞,用LTP-C型离心涂片机(北京四环科学仪器厂生产)制备单细胞涂片,常规苏木素染色,光镜观察。
6. Hoechst 33258染色
, 百拇医药
HL-60、K562及CEM细胞,分别制备单细胞涂片,甲醇:冰乙酸(3∶1)固定5min,点加Hoechst 33258染液(5mg/L)染色10min,稍洗,荧光显微镜下观察。活细胞核呈弥散均匀白色荧光,出现凋亡细胞时,细胞核或胞质内可见浓染致密的白色颗粒状荧光。
7. 透射电镜样品制备
HL-60细胞,PBS洗涤,离心入琼脂块,3%戊二醛固定2h、1%锇酸固定1h,50%~90%乙醇系列脱水,10min/次,丙酮浸透,Epon812包埋,常规制备超薄切片(Leica Company Model S),透射电镜(Philip EM-400T)观察。
结 果
1. 细胞凋亡时限
HL-60细胞于5Gy照后24h(图1),CEM细胞于20Gy照后24h,K562细胞于20Gy照后36h出现DNA梯状带。
, 百拇医药
图1 5Gy照后不同时间HL-60细胞DNA电泳结果。a.未照射(阴性对照) b.12h c.24h d.30h e.DNA marker
Fig.1 Agarose gel electrophoresis of DNA extracted from HL-60 after 5Gy γ-irradiation at different time.a,0Gy(control); b,12h;c,24h;d,30h;e,DNA marker.
2. 苏木素染色光镜观察
早期,见HL-60细胞胞体变大,胞膜出泡,细胞核染色加深不明显。后期,在细胞之间可见着色与细胞相同或加深的大小不一的圆形凋亡小体。
3. Hoechst 33258染色荧光显微镜观察
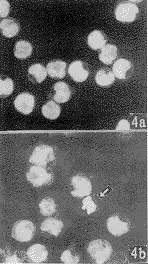
, 百拇医药 早期,凋亡HL-60细胞膜出泡明显,细胞核荧光增强,个别细胞可见染色质边聚形成新月状。后期,大多数细胞核碎裂形成多个大小不一,染色质致密团分散于细胞内。细胞间可见许多大小不一和荧光强度不等的凋亡小体(图2)。K562和CEM细胞形态变化与HL-60稍有不同。K562细胞易见到致密染色质边聚及胞膜发泡现象,后期细胞核并无碎裂,而是形成一个致密细胞核(图3)。CEM出泡不明显,凋亡小体少见,主要是含一个致密细胞核的凋亡细胞(图4)。
4. 电镜观察
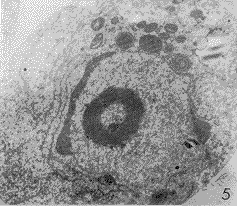
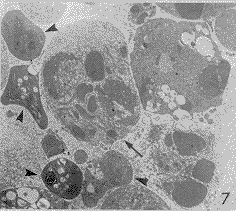
HL-60细胞,除正常形态细胞外,多为具有凋亡形态特征的凋亡细胞。早期,细胞核染色质增粗,并沿核膜不均匀边聚(图5),随着染色质积聚的增多呈新月状(图6)。在核染色质变化的同时,粗面内质网增多,多层环绕胞核(图5,6)。后期,细胞核分割形成两个或多个核碎片。细胞核的分割存在3种形式,有些细胞核在致密染色质边聚的地方凸起,最后从根部断裂脱离主核,这样形成的核碎块均含致密染色质,与主核大小相差悬殊(图5,7);有些细胞核可能通过核膜凹陷,自我分割形成多个核碎块,这些核碎块有或无致密染色质(图8),大小较均匀,且集中分布于胞质中;有些细胞核在自我分割时无染色质密集现象(图9)。胞膜发泡后与主细胞脱离,形成凋亡小体(图10),为大小不一的圆形小体,分散于细胞之间(图7,10)。凋亡小体内可见细胞器,有些凋亡小体含致密核成分,有些只含致密的或未改变的细胞质。
, http://www.100md.com
讨论
通过荧光显微镜及电镜观察显示,经γ-射线照射,HL-60细胞表现出典型的细胞凋亡形态变化,即染色质浓集及凋亡小体形成。其主要特点是:1.细胞核变化的多样性:(1)通过核膜突起形成核碎块;(2)通过核膜凹陷自我分割;(3)核自我分割时无或有染色质浓集现象,或两者并存;(4)未见仅含1个致密细胞核的凋亡细胞;2.凋亡小体内含物的多样性:(1)仅含致密或不致密细胞质;(2)仅含致密染色质;(3)仅含细胞质和细胞器;(4)多种成分并存。Dini等[6]用3种因素诱发U937细胞凋亡,发现细胞核的碎裂存在4种方式,除以上所述的3种以外还见有丝分裂样变化。这种细胞核碎裂方式的不同是由不同诱发因素所决定的。他们认为,细胞核变化的差异除与诱发因素有关,可能还取决于凋亡细胞功能状态以及细胞所处的分裂阶段[7]。我们的实验结果发现,以γ-射线这一种因素诱导HL-60这种细胞,凋亡细胞核的变化也存在多种形式。以往的研究表明,HL-60细胞经γ-射线照射首先阻抑在G2期,从此进入凋亡(另文报道)。所以,要明确γ-射线诱导HL-60细胞凋亡时细胞核变化多样性是否与细胞所处的细胞周期阶段及功能状态有关,还需做大量的工作。
, http://www.100md.com
细胞凋亡时,粗面内质网、线粒体和溶酶体等细胞器增多,是细胞的一种代偿性反应。与正常HL-60细胞比较(未附照片),本研究见粗面内质网增多,并多层环绕细胞核,这可能是凋亡细胞正常形态和功能的保护性反应[8]。随着凋亡过程的继续,细胞成分相继变性,在内质网参与下,最后整个凋亡细胞全部分割包裹,细胞失去正常结构功能,最终凋亡。这种凋亡形式呈现出典型的自噬特征[8~10]。
以DNA梯状带为判断标准,HL-60细胞于5Gy照射后24h、K562细胞于20Gy照射后36h和CEM细胞于20Gy照射后24h出现凋亡,反映出这3种细胞对γ-射线照射的敏感性不同。以荧光显微镜观察3种凋亡细胞,表现出的形态特征也不同。由此反映出它们发生凋亡的分子调控机制可能存在差异。
由于HL-60细胞染色质浓集形成1或2个致密核现象罕见,有些细胞在核分割时无染色质凝集,故苏木素染色观察细胞凋亡形态特征不明显。Hoechst 33258染色荧光显微镜观察凋亡的方法,快速、简便,但荧光易淬灭。透射电镜观察法,细胞核及细胞器微细结构清晰易辨,但操作复杂,成本高。所以在分析凋亡时,要根据诱发因素、细胞类型及实验目的和实验条件选择合适的方法。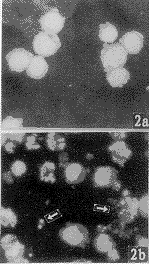





, 百拇医药
图版说明
图2 Hoechst33258染色显示γ-射线诱导HL-60细胞凋亡.a.未照射对照细胞,b.凋亡细胞和凋亡小体(↑) ×132
图3 Hoechst33258染色显示γ-射线诱导K562细胞凋亡.a.未照射对照细胞,b.凋亡细胞(↑) ×132
图4 Hoechst33258染色显示γ-射线诱导CEM细胞凋亡.a.未照射对照细胞,b.凋亡细胞(↑) ×132
图5 凋亡HL-60细胞,染色质浓集边聚 ×10000
图6 凋亡HL-60细胞,染色质浓集呈新月状 ×13000
图7 凋亡HL-60细胞,核分割成核碎片(↑),凋亡小体(▲) ×6000
, 百拇医药
图8 凋亡HL-60细胞,核自我分割时有或无染色质浓集 ×10000
图9 凋亡HL-60细胞,核自我分割时无染色质浓集(↑);刚形成的凋亡小体,含细胞器(▲) ×8000
图10 凋亡HL-60细胞,凋亡小体正在形成(↑);凋亡小体(▲) ×6000
Explanation of figures
Fig.2 Apoptotic morphology of HL-60 cells stained with Hoechst 33258.a,unirradiated control; b,apoptotic cells and apoptotic body(↑). ×132
Fig.3 Apoptotic morphology of K562 cells stained with Hoechst 33258.a,unirradiated control; b,apoptotic cells and apoptotic body(↑). ×132
, 百拇医药
Fig.4 Apoptotic morphology of CEM cells stained with Hoechst 33258.a,unirradiated control; b,apoptotic cells and apoptotic body(↑). ×132
Fig.5 An apoptotic HL-60 cell showing condensed chromatin abutting on the nuclear membrane. ×10000
Fig.6 An apoptotic HL-60 cell showing condensed chromatin forming the crescen t-like nucleus. ×13000
Fig.7 Apoptotic HL-60 cells showing nuclear fragments(↑) and apoptotic bodies(▲). ×6 000
, http://www.100md.com
Fig.8 An apoptotic HL-60 cell showing nuclear fragmentation by cleavage with or without condensed chromatin. ×10 000
Fig.9 An apoptotic HL-60 cell showing nuclear fragmentation by cleavage without condensed chromatin(↑),and just formed apoptotic body containing organelles(▲). ×8000
Fig.10 An apoptotic HL-60 cell showing apoptotic body forming from an HL-60 cell(↑) and an apoptotic body(▲). ×6000
, 百拇医药 * 国家自然科学基金资助课题(No.39770823)
△ Department of Histology and Embryology.Xi'an Medical University,Xi'an 710061,China
参考文献
1 Negri C,Donzelli M,Bernardi R,et al.Multiparametric staining to identify apoptotic human cells.Exp Cell Res,1997,234(1):174
2 Miscia S,Baldassarre D,Rana RA,et al.Engagement of DNA polymerases during apoptosis.Cell Prolif,1997,30(8-9):325
, 百拇医药
3 Nicholson DW,Thornberry NA.Caspases:killer proteases.TIBS,1997,22(8):299
4 Allen RT,Hunter Ⅲ WJ,Agrawal DK.Morphological and biochemical characterization and analysis of apoptosis.JPM,1997,37(4):215
5 Ghibelli L,Maresca V,Coppola S,et al.Protease inhibitors block apoptosis at intermediate stages:a compared analysis of DNA fragmentation and apoptotic nuclear morphology.FEBS Lett,1995,377(1):9
, 百拇医药 6 Dini L,Coppola S,Ruzittu MT,et al.Multiple pathways for apoptotic nuclear fragmentation.Exp Cell Res,1996,223(2):340
7 Le PT,Maecker HT,Cook JE.In situ detection and characterization of apoptotic thymocytes in human thymus.J Immunol,1995,154(9):4371
8 Piao YJ,Ogawa K,Ono K,et al.Ultrastructural and cytochemical observations on the effects of colchicine on autophagy in rat hepatocytes.Acta Histochem Cytochem,1992,25(1):147
9 朴英杰,黄行许,霍霞,等.淋巴细胞自噬性凋亡的超微结构化学研究.第一军医大学学报,1996,16(3):165
10 朴英杰.溶酶体.细胞生物学进展,1993,3(1):64
收稿1998-07 修回1999-01, 百拇医药
单位:李小明 宋天保(西安医科大学组织学胚胎学教研室,西安 710061);童 新 孙志贤(军事医学科学院放射医学研究所,北京 100850)
关键词:辐射;细胞凋亡;HL-60细胞;形态学
解剖学报990416 【摘要】 目的 观察γ-射线诱导HL-60细胞凋亡的形态学变化。 方法 应用Hoechst33258荧光显微镜及透射电子显微镜进行观察。 结果 γ-射线诱导HL-60细胞死亡的主要方式是凋亡,凋亡细胞具有典型的形态特征,细胞核染色质凝集边聚;发现细胞核经多种形式形成核碎块;并可见具有不同内含物的凋亡小体;内质网增多,参与形成核碎块。 结论 同一因素诱导同一细胞凋亡,细胞核的变化可有多种形式。γ-射线诱导K562和CEM细胞凋亡的形态学变化与HL-60细胞的不同,反映出同一因素诱导不同细胞凋亡的途径有一定的差异。
, http://www.100md.com
STUDY ON THE MORPHOLOGY OF APOPTOTIC HL-60 CELLS
INDUCED BY γ-IRRADIATION
Li Xiaoming, Song TianbaoΔ, Tong Xin**, Sun Zhixian**
(Department of Histology and Embryology,Xi'an Medical University, Xi'an;
**Institute of Radiation Medicine,Academy of Military Medical Sciences,Beijing)
, 百拇医药 【Abstract】 Objective To observe the morphologic features of apoptotic HL-60 cells after γ-irradiation. Methods The morphology was analyzed by transmission electron microscopy and fluorescence microscopy. Results There were typical apoptotic features of morphology in HL-60 apoptosis.Chromatin was condensed along nuclear periphery.Different types of nuclear fragmentation and apoptotic bodies containing different composition were found.Proliferated endopalsmic reticulum is interrelated with the formation of the nuclear fragmentation. Conclusion There are multiple pathways for nuclear fragmentation in the apoptosis induced by one stimulus.The different nuclear morphology in HL-60,K562 and CEM cells suggests that these cells may undergo apoptosis through multiple pathways.
, 百拇医药
【Key words】 Radiation; Apoptosis; HL-60 cells; Morphology
细胞凋亡是多细胞有机体在细胞分化发育中及在各种生理、病理条件下起重要作用的一种调节适应过程[1,2],这个过程经历信号引发、调控执行和结构变化三个阶段[3]。细胞凋亡时细胞形态改变是凋亡调控中一系列生化事件的最终结果,其特征是染色质浓集,沿核膜边聚,细胞核形成一或多个含致密染色质的核碎块分散于细胞内,以及特征性凋亡小体形成[4]。不同因素对不同类型细胞所诱发的凋亡的分子生化途径有所不同,使最终的形态学改变也存在一些差异[5,6]。为观察γ-射线诱导HL-60细胞凋亡形态学变化特征,本实验以光镜、荧光显微镜及透射电镜观察凋亡细胞形态,明确HL-60细胞凋亡特点,为研究γ-射线诱导HL-60细胞凋亡的分子机制提供参考。
材料和方法
, 百拇医药
1. 材料
人早幼粒白血病细胞株HL-60、人红白血病细胞株K562及急性T淋巴细胞白血病细胞株CEM由军事医学科学院二所提供,60Co辐射源(军事医学科学院二所),Hoechst 33258为Fluka公司产品,其他化学试剂为国产分析纯。
2. 细胞培养
HL-60、K562及CEM细胞均为悬浮细胞,在RPMI1640培养基(含10%小牛血清)中、37℃、5%CO2条件下培养,3d传代1次。取对数生长期细胞用于实验。
3. γ-射线照射
照射前1d细胞换液,照射时细胞浓度为1×106/ml,HL-60细胞以5Gy γ-射线照射,剂量率1.943Gy/min,于照后继续培养9、12、24、30h;K562和CEM细胞以20Gy照射,剂量率4.087Gy/min,于照后继续培养0.5、1、1.5、2、3d。分别收获细胞用于DNA梯状带(DNA ladder)检测。以未照射常规培养细胞为阴性对照。
, 百拇医药
4. 细胞凋亡时限检测
在1×106个经PBS洗涤后的离心沉淀细胞中加入0.5ml低渗裂解液(1mmol/L EDTA,10mmol/L Tris,100mmol/L NaCl,1%SDS,含100mg/L蛋白酶K),混匀,37℃ 30min,离心沉淀(12 000rpm);上清用酚:氯仿:异戊醇(1∶12∶1)抽提,无水乙醇和NaAc沉淀DNA,溶于Tris-EDTA(TE)缓冲液中。1%琼脂糖凝胶电泳,端电压60V,1h,紫外光下观察。以DNA梯状带出现作为细胞凋亡判断标准。取凋亡前、后细胞用于形态学观察。
5. 苏木素染色
HL-60细胞,用LTP-C型离心涂片机(北京四环科学仪器厂生产)制备单细胞涂片,常规苏木素染色,光镜观察。
6. Hoechst 33258染色
, 百拇医药
HL-60、K562及CEM细胞,分别制备单细胞涂片,甲醇:冰乙酸(3∶1)固定5min,点加Hoechst 33258染液(5mg/L)染色10min,稍洗,荧光显微镜下观察。活细胞核呈弥散均匀白色荧光,出现凋亡细胞时,细胞核或胞质内可见浓染致密的白色颗粒状荧光。
7. 透射电镜样品制备
HL-60细胞,PBS洗涤,离心入琼脂块,3%戊二醛固定2h、1%锇酸固定1h,50%~90%乙醇系列脱水,10min/次,丙酮浸透,Epon812包埋,常规制备超薄切片(Leica Company Model S),透射电镜(Philip EM-400T)观察。
结 果
1. 细胞凋亡时限
HL-60细胞于5Gy照后24h(图1),CEM细胞于20Gy照后24h,K562细胞于20Gy照后36h出现DNA梯状带。

, 百拇医药
图1 5Gy照后不同时间HL-60细胞DNA电泳结果。a.未照射(阴性对照) b.12h c.24h d.30h e.DNA marker
Fig.1 Agarose gel electrophoresis of DNA extracted from HL-60 after 5Gy γ-irradiation at different time.a,0Gy(control); b,12h;c,24h;d,30h;e,DNA marker.
2. 苏木素染色光镜观察
早期,见HL-60细胞胞体变大,胞膜出泡,细胞核染色加深不明显。后期,在细胞之间可见着色与细胞相同或加深的大小不一的圆形凋亡小体。
3. Hoechst 33258染色荧光显微镜观察
, 百拇医药 早期,凋亡HL-60细胞膜出泡明显,细胞核荧光增强,个别细胞可见染色质边聚形成新月状。后期,大多数细胞核碎裂形成多个大小不一,染色质致密团分散于细胞内。细胞间可见许多大小不一和荧光强度不等的凋亡小体(图2)。K562和CEM细胞形态变化与HL-60稍有不同。K562细胞易见到致密染色质边聚及胞膜发泡现象,后期细胞核并无碎裂,而是形成一个致密细胞核(图3)。CEM出泡不明显,凋亡小体少见,主要是含一个致密细胞核的凋亡细胞(图4)。
4. 电镜观察
HL-60细胞,除正常形态细胞外,多为具有凋亡形态特征的凋亡细胞。早期,细胞核染色质增粗,并沿核膜不均匀边聚(图5),随着染色质积聚的增多呈新月状(图6)。在核染色质变化的同时,粗面内质网增多,多层环绕胞核(图5,6)。后期,细胞核分割形成两个或多个核碎片。细胞核的分割存在3种形式,有些细胞核在致密染色质边聚的地方凸起,最后从根部断裂脱离主核,这样形成的核碎块均含致密染色质,与主核大小相差悬殊(图5,7);有些细胞核可能通过核膜凹陷,自我分割形成多个核碎块,这些核碎块有或无致密染色质(图8),大小较均匀,且集中分布于胞质中;有些细胞核在自我分割时无染色质密集现象(图9)。胞膜发泡后与主细胞脱离,形成凋亡小体(图10),为大小不一的圆形小体,分散于细胞之间(图7,10)。凋亡小体内可见细胞器,有些凋亡小体含致密核成分,有些只含致密的或未改变的细胞质。
, http://www.100md.com
讨论
通过荧光显微镜及电镜观察显示,经γ-射线照射,HL-60细胞表现出典型的细胞凋亡形态变化,即染色质浓集及凋亡小体形成。其主要特点是:1.细胞核变化的多样性:(1)通过核膜突起形成核碎块;(2)通过核膜凹陷自我分割;(3)核自我分割时无或有染色质浓集现象,或两者并存;(4)未见仅含1个致密细胞核的凋亡细胞;2.凋亡小体内含物的多样性:(1)仅含致密或不致密细胞质;(2)仅含致密染色质;(3)仅含细胞质和细胞器;(4)多种成分并存。Dini等[6]用3种因素诱发U937细胞凋亡,发现细胞核的碎裂存在4种方式,除以上所述的3种以外还见有丝分裂样变化。这种细胞核碎裂方式的不同是由不同诱发因素所决定的。他们认为,细胞核变化的差异除与诱发因素有关,可能还取决于凋亡细胞功能状态以及细胞所处的分裂阶段[7]。我们的实验结果发现,以γ-射线这一种因素诱导HL-60这种细胞,凋亡细胞核的变化也存在多种形式。以往的研究表明,HL-60细胞经γ-射线照射首先阻抑在G2期,从此进入凋亡(另文报道)。所以,要明确γ-射线诱导HL-60细胞凋亡时细胞核变化多样性是否与细胞所处的细胞周期阶段及功能状态有关,还需做大量的工作。
, http://www.100md.com
细胞凋亡时,粗面内质网、线粒体和溶酶体等细胞器增多,是细胞的一种代偿性反应。与正常HL-60细胞比较(未附照片),本研究见粗面内质网增多,并多层环绕细胞核,这可能是凋亡细胞正常形态和功能的保护性反应[8]。随着凋亡过程的继续,细胞成分相继变性,在内质网参与下,最后整个凋亡细胞全部分割包裹,细胞失去正常结构功能,最终凋亡。这种凋亡形式呈现出典型的自噬特征[8~10]。
以DNA梯状带为判断标准,HL-60细胞于5Gy照射后24h、K562细胞于20Gy照射后36h和CEM细胞于20Gy照射后24h出现凋亡,反映出这3种细胞对γ-射线照射的敏感性不同。以荧光显微镜观察3种凋亡细胞,表现出的形态特征也不同。由此反映出它们发生凋亡的分子调控机制可能存在差异。
由于HL-60细胞染色质浓集形成1或2个致密核现象罕见,有些细胞在核分割时无染色质凝集,故苏木素染色观察细胞凋亡形态特征不明显。Hoechst 33258染色荧光显微镜观察凋亡的方法,快速、简便,但荧光易淬灭。透射电镜观察法,细胞核及细胞器微细结构清晰易辨,但操作复杂,成本高。所以在分析凋亡时,要根据诱发因素、细胞类型及实验目的和实验条件选择合适的方法。









, 百拇医药
图版说明
图2 Hoechst33258染色显示γ-射线诱导HL-60细胞凋亡.a.未照射对照细胞,b.凋亡细胞和凋亡小体(↑) ×132
图3 Hoechst33258染色显示γ-射线诱导K562细胞凋亡.a.未照射对照细胞,b.凋亡细胞(↑) ×132
图4 Hoechst33258染色显示γ-射线诱导CEM细胞凋亡.a.未照射对照细胞,b.凋亡细胞(↑) ×132
图5 凋亡HL-60细胞,染色质浓集边聚 ×10000
图6 凋亡HL-60细胞,染色质浓集呈新月状 ×13000
图7 凋亡HL-60细胞,核分割成核碎片(↑),凋亡小体(▲) ×6000
, 百拇医药
图8 凋亡HL-60细胞,核自我分割时有或无染色质浓集 ×10000
图9 凋亡HL-60细胞,核自我分割时无染色质浓集(↑);刚形成的凋亡小体,含细胞器(▲) ×8000
图10 凋亡HL-60细胞,凋亡小体正在形成(↑);凋亡小体(▲) ×6000
Explanation of figures
Fig.2 Apoptotic morphology of HL-60 cells stained with Hoechst 33258.a,unirradiated control; b,apoptotic cells and apoptotic body(↑). ×132
Fig.3 Apoptotic morphology of K562 cells stained with Hoechst 33258.a,unirradiated control; b,apoptotic cells and apoptotic body(↑). ×132
, 百拇医药
Fig.4 Apoptotic morphology of CEM cells stained with Hoechst 33258.a,unirradiated control; b,apoptotic cells and apoptotic body(↑). ×132
Fig.5 An apoptotic HL-60 cell showing condensed chromatin abutting on the nuclear membrane. ×10000
Fig.6 An apoptotic HL-60 cell showing condensed chromatin forming the crescen t-like nucleus. ×13000
Fig.7 Apoptotic HL-60 cells showing nuclear fragments(↑) and apoptotic bodies(▲). ×6 000
, http://www.100md.com
Fig.8 An apoptotic HL-60 cell showing nuclear fragmentation by cleavage with or without condensed chromatin. ×10 000
Fig.9 An apoptotic HL-60 cell showing nuclear fragmentation by cleavage without condensed chromatin(↑),and just formed apoptotic body containing organelles(▲). ×8000
Fig.10 An apoptotic HL-60 cell showing apoptotic body forming from an HL-60 cell(↑) and an apoptotic body(▲). ×6000
, 百拇医药 * 国家自然科学基金资助课题(No.39770823)
△ Department of Histology and Embryology.Xi'an Medical University,Xi'an 710061,China
参考文献
1 Negri C,Donzelli M,Bernardi R,et al.Multiparametric staining to identify apoptotic human cells.Exp Cell Res,1997,234(1):174
2 Miscia S,Baldassarre D,Rana RA,et al.Engagement of DNA polymerases during apoptosis.Cell Prolif,1997,30(8-9):325
, 百拇医药
3 Nicholson DW,Thornberry NA.Caspases:killer proteases.TIBS,1997,22(8):299
4 Allen RT,Hunter Ⅲ WJ,Agrawal DK.Morphological and biochemical characterization and analysis of apoptosis.JPM,1997,37(4):215
5 Ghibelli L,Maresca V,Coppola S,et al.Protease inhibitors block apoptosis at intermediate stages:a compared analysis of DNA fragmentation and apoptotic nuclear morphology.FEBS Lett,1995,377(1):9
, 百拇医药 6 Dini L,Coppola S,Ruzittu MT,et al.Multiple pathways for apoptotic nuclear fragmentation.Exp Cell Res,1996,223(2):340
7 Le PT,Maecker HT,Cook JE.In situ detection and characterization of apoptotic thymocytes in human thymus.J Immunol,1995,154(9):4371
8 Piao YJ,Ogawa K,Ono K,et al.Ultrastructural and cytochemical observations on the effects of colchicine on autophagy in rat hepatocytes.Acta Histochem Cytochem,1992,25(1):147
9 朴英杰,黄行许,霍霞,等.淋巴细胞自噬性凋亡的超微结构化学研究.第一军医大学学报,1996,16(3):165
10 朴英杰.溶酶体.细胞生物学进展,1993,3(1):64
收稿1998-07 修回1999-01, 百拇医药