百日咳菌液诱发大鼠脑水肿时脑组织中兴奋性氨基酸时相的变化
作者:尹飞 杨于嘉 虞佩兰 陶永光 毛定安
单位:尹飞(长沙,湖南医科大学湘雅医院儿科 410008);于嘉(长沙,湖南医科大学湘雅医院儿科 410008);虞佩兰(长沙,湖南医科大学湘雅医院儿科 410008);陶永光(长沙,湖南医科大学湘雅医院儿科 410008);毛定安(长沙,湖南医科大学湘雅医院儿科 410008)
关键词:脑水肿;兴奋性氨基酸类
中华儿科杂志000103 摘 要:目的 了解百日咳菌液诱发大鼠脑水肿时脑组织中兴奋性氨基酸时相的变化及与感染性脑水肿的关系。方法 SD大鼠81只,随机分成空白对照组(C组),生理盐水对照组(NS组),百日咳菌液组(PB组)。百日咳菌液诱发大鼠感染性脑水肿后,应用高效液相色谱法检测大鼠脑组织匀浆中兴奋性氨基酸含量。结果 C组和NS各组脑组织匀浆中谷氨酸(Glu)、门冬氨酸(Asp)含量较稳定,各组差异无显著意义(P>0.05)。PB组注射菌液后30 min,大鼠脑组织中Glu[(11.03±2.44)μmol/g脑组织]和Asp含量[(1.57±0.37)μmol/g脑组织]明显增加,与C组[Glu (7.12±0.80) μmol/g脑组织,Asp (0.99±0.15)μmol/g脑组织]、NS组及PB 5、60、120和240 min组比较,差异有非常显著意义 (P均<0.01)。 结论 兴奋性氨基酸增高与感染性脑水肿关系密切,其参与了感染性脑损害的过程。
, http://www.100md.com
Time-course changes of the excitatory amino acid content in brain tissue of infectious brain edema induced by Pertussis Bacilli in rats
YIN Fei
(Department of Pediatrics, Xiangya Hospital, Hunan Medical University, Changsha 410008, China)
YANG Yujia
(Department of Pediatrics, Xiangya Hospital, Hunan Medical University, Changsha 410008, China)
, 百拇医药
YU Peilan
(Department of Pediatrics, Xiangya Hospital, Hunan Medical University, Changsha 410008, China)
Abstract:Objective To understand time-course changes of excitatory amino acids (EAAs) content in brain tissue of infectious brain edema induced by Pertussis Bacilli in rats and relationship between EAAs and infectious brain edema. Methods Eighty-one SD rats were randomly divided into 3 groups: sham control group (C group), normal saline group (NS group) and Pertussis Bacilli group (PB group). High performance liquid chromatography was used to measure EAAs content in brain tissue in vivo after brain edema induced by infection with Pertussis Bacilli in rats. Results Glutamic acid (Glu) and Aspartic acid (Asp) contents of homogenized brain tissue in rats of C and NS groups were kept steady state and no significant differences (P>0. 05). Thirty minutes after injection with Pertussis Bacilli, the concentrations of Glu[(11.03±2.44)μmol/g brain tissue] and Asp [(1.57±0.37) μmol/g brain tissue] were significantly increased in PB group, which was significantly different (P<0.01) from the concentrations of Glu and Asp in C group [(7.12±0.80) and (0.99±0.15) μmol/g brain tissue, respectively], NS group as well as all other PB groups with Pertussis Bacilli injections 5, 60, 120 and 240 minutes later. Conclusion EAAs were involved in infectious brain edema of Pertussis Bacilli and might play an important role in infectious brain injury.
, http://www.100md.com
Key words:Brain edema; Excitatory amino acids▲
兴奋性氨基酸(excitatory amino acids, EAAs)主要为谷氨酸(glutamate, Glu)、门冬氨酸(aspartate, Asp),是中枢神经系统主要的兴奋性神经递质。EAAs不但可通过与相应的受体相结合参与中枢神经系统的信息传递;而且还可作为内源性兴奋毒素,破坏中枢神经细胞,导致神经功能障碍[1]。近年来的研究证实,EAAs与缺血性、创伤性脑损伤有关,在缺血早期,细胞外的EAAs就明显增高[2]。但EAAs与感染性脑损伤的关系研究较少,感染性脑水肿时EAAs的变化未见报道。我们用大鼠百日咳菌液感染性脑水肿模型,检测大鼠脑组织中EAAs含量的时相动态变化,以探讨EAAs与感染性脑水肿的关系。
材料和方法
一、实验大鼠分组
, 百拇医药
SD大鼠81只,体重(200±30) g,随机分成3组:(1)空白对照组(C组)7只,不作任何处理断头处死;(2)生理盐水对照组(NS组)35只;(3)百日咳菌液组(PB组)39只。按观察时间不同,NS组和PB组又分为5、30、60、120(各组均为7只和8只)和240 min组(7只和7只)。
二、实验大鼠模型制作
乌拉坦麻醉大鼠后,分离左侧股动脉,将内径0.56 mm塑料管插入左股动脉后,连接四道生理仪监测血压及取血样。颈正中切口,分离左颈总动脉,颈外动脉、颈内动脉及分支,结扎翼腭动脉和枕动脉。夹闭颈外动脉后,用1 ml注射器配4.5号针头于左颈总动脉穿刺向左颈内动脉注射百日咳菌液0.2 ml/kg(含菌10.8×109/ml,使用前超声波充分破碎),5~15 s内注射完毕。NS组大鼠则用同法注射等量的灭菌生理盐水。各组大鼠观察至相应的时间断头处死。
三、脑含水量、Na+、K+含量的测定
, 百拇医药
用干湿法测定大鼠左大脑半球脑含水量;用原子吸收分光光度法测定相应干脑组织的Na+、K+含量。
四、脑组织EAAs测定
大鼠断头处死,迅速取出左大脑部分全层脑组织,称湿重后按10∶1(V/V)加入无水乙醇,恒速匀浆35次左右,取匀浆液置离心管中,4℃ 20 000 r/min离心30 min,收集上清液,用高效液体色谱法测定EAAs含量。
五、统计学处理
数据均采用Excel 5.0软件计算。计量数据用均数±标准差( ±s)表示,组间比较用F检验,同阶段比较用t检验。
±s)表示,组间比较用F检验,同阶段比较用t检验。
结果
, http://www.100md.com
一、血压监测及血气分析结果
实验大鼠体温均维持在(37.0±0.5)℃。平均动脉压、pH、PaCO2、PaO2在实验过程中差异均无显著意义(P>0.05)(表1)。
表1 各组大鼠平均动脉压和血气分析结果( ±s) 组别
±s) 组别
鼠数
平均动脉压(mm Hg)
pH值
PaO2(mm Hg)
PaCO2(mm Hg)
, http://www.100md.com
注射前
处死前
注射前
处死前
注射前
处死前
注射前
处死前
NS组
5 min
7
98±8
98±5
, http://www.100md.com
7.431±0.030
7.420±0.041
102±13
101± 8
38±5
39±5
30 min
7
99±3
96±4
7.388±0.032
7.381±0.080
, http://www.100md.com
97± 8
94± 8
37±7
35±5
60 min
7
99±4
98±7
7.401±0.044
7.414±0.063
99±11
98± 9
35±4
, http://www.100md.com
35±5
120 min
7
99±4
97±5
7.390±0.028
7.397±0.042
101±12
101±11
38±5
38±7
240 min
, 百拇医药 7
99±5
102±5
7.400±0.033
7.394±0.071
100±11
101±17
37±6
38±5
PB组
5 min
8
99±3
, 百拇医药
98±4
7.431±0.039
7.390±0.022
103± 5
102± 7
38±7
38±5
30 min
8
93±5
95±8
7.388±0.021
, http://www.100md.com 7.372±0.060
101± 7
102±15
40±5
41±7
60 min
8
96±8
97±7
7.384±0.029
7.354±0.047
105±10
, 百拇医药 101±14
38±6
38±8
120 min
8
97±8
96±6
7.403±0.031
7.376±0.041
101±14
98± 8
38±3
41±6
, 百拇医药
240 min
7
97±6
99±6
7.372±0.054
7.359±0.083
98± 5
97±17
38±5
40±5
注:1 mm Hg=0.133 kPa
二、脑含水量及脑组织Na+、K+含量
, 百拇医药
C组和NS组各组脑含水量、Na+、K+含量相对稳定,差异无显著意义(P>0.05)。PB组脑含水量、Na+含量明显高于C组和NS组,并随时间增加而逐渐增多,注射菌液后4 h为最高值(表2)。
表2 NS、PB组不同时间大鼠脑含水量及Na+、K+含量的变化( ±s) 组别
±s) 组别
含水量(%)
Na+(mmol/kg)
K+(mmol/kg)
NS组
, 百拇医药
PB组
t值
NS组
PB组
t值
NS组
PB组
t值
C组(注射前)
78.4±0.4
191±4
453±12
注射后
, http://www.100md.com
5 min
78.8±0.8
78.9±0.6
0.28
191±4
196±14
1.05
451±32
465±31
0.86
30 min
78.8±0.7
, 百拇医药 79.7±0.5*
2.90**
195±6
208±14*
2.40**
451±31
461±25
0.71
60 min
78.6±0.6
81.0±0.9*
, 百拇医药
5.98△
191±5
235±25*
4.58△
462±18
441±23
1.96
120 min
78.7±0.8
81.1±0.8*
5.80△
, 百拇医药
193±6
240±25*
4.90△
447±16
442±30
0.42
240 min
78.6±0.3
82.2±0.3*
22.45△
194±7
, http://www.100md.com
277±19*
11.05△
447±11
358±25*
8.51△
阶段间比较F
21.86△△
25.27△△
5.96△△
注:与C组比较,*P<0.01;两组同阶段比较,**P<0.05,△P<0.01;阶段间总比较,△△P<0.01
, 百拇医药
三、光镜、电镜观察结果
光镜:NS组脑组织结构正常。PB 5 min组毛细管血管变圆,神经元及神经胶质细胞无明显改变。PB 30 min组血管周围间隙明显增宽。PB 60 min和120 min组毛细血管周围水肿明显,神经元和胶质细胞周围间隙增宽。 PB 120 min组还可见部分神经细胞核固缩变性。240 min组可见弥漫的灶性水肿区,该处血管周围间隙明显增宽,神经细胞和胶质细胞周围空隙增大,神经元细胞空泡样变性(图1~4)。电镜:NS组神经细胞和胶质细胞结构正常。PB 5 min组部分胶质细胞肿胀,海马神经元胞体的超微结构形态基本正常。PB 30 min组:毛细血管管周胶质细胞突起肿胀明显,部分出现空泡样改变。神经元胞体粗面内质网轻度扩张,部分线粒体水肿,神经毡可见大小不一的空泡。PB 60 min组:胶质细胞严重肿胀,毛细血管管周水肿明显,毛细血管内皮细胞呈锯齿状改变,并出现了较多的吞饮小泡。神经细胞胞质内粗面内质网扩张,线粒体肿胀。PB 120 min:胶质细胞核周围间隙明显增宽,部分细胞膜破裂,融合成水肿区域,毛细血管周出现空泡化。神经元胞体电子密度增高,部分细胞呈暗细胞改变,神经元胞体周围出现大量空泡结构,神经毡周围出现高密度的电子碎块。PB 240 min:胶质细胞肿胀明显,有的细胞膜破裂,融合成大片水肿区域,毛细血管内皮细胞内吞饮小泡大量增加,部分聚集成葡萄状,毛细血管周围胶质细胞突起严重水肿。神经元细胞皱缩,粗面内质网扩张,线粒体肿胀,细胞内有空泡样改变(图5~9)。


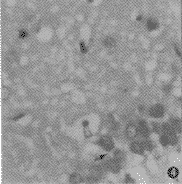





, http://www.100md.com
图1 注射菌液30 min脑组织 示毛细血管扩张,周围间隙增宽(↑)(苏木素-伊红染色 光镜 ×200) 图2 注射菌液60 min脑组织 示血管周围水肿明显,神经细胞周围间隙增宽(↑)(苏木素-伊红染色 光镜 ×100) 图3 注射菌液120 min脑组织 示部分神经细胞核固缩变性,细胞周围间隙增宽(↑)(苏木素-伊红染色 光镜 ×200) 图4 注射菌液240 min脑组织 示神经细胞周围空隙增大,部分神经细胞空泡变性(↑)(苏木素-伊红染色 光镜 ×200) 图5 注射菌液5 min脑组织电镜图 示部分胶质细胞水肿(↑)(电镜 ×5 000) 图6 注射菌液30 min脑组织电镜图 示毛细血管周胶质细胞突起肿胀明显(↑),神经毡可见大小不一的空泡( )(电镜 ×3 000) 图7 注射菌液60 min脑组织电镜图 示毛细血管周水肿明显(↑),毛细血管内皮细胞呈锯齿状改变,有较多的吞饮小泡,胶质细胞肿胀明显(
)(电镜 ×3 000) 图7 注射菌液60 min脑组织电镜图 示毛细血管周水肿明显(↑),毛细血管内皮细胞呈锯齿状改变,有较多的吞饮小泡,胶质细胞肿胀明显( )(电镜 ×5 000) 图8 注射菌液120 min脑组织电镜图 示毛细血管周出现空泡化(↑),神经毡周围出现高密度的电子碎片,神经元胞体电子密度增高(
)(电镜 ×5 000) 图8 注射菌液120 min脑组织电镜图 示毛细血管周出现空泡化(↑),神经毡周围出现高密度的电子碎片,神经元胞体电子密度增高( )(电镜 ×4 000) 图9 注射菌液240 min脑组织电镜图 示毛细血管内皮细胞吞饮小泡大量增加,部分聚集成葡萄状(↑),胶质细胞严重肿胀(
)(电镜 ×4 000) 图9 注射菌液240 min脑组织电镜图 示毛细血管内皮细胞吞饮小泡大量增加,部分聚集成葡萄状(↑),胶质细胞严重肿胀( )(电镜 ×4 000)
)(电镜 ×4 000)
, http://www.100md.com
四、脑组织EAAs含量的变化
PB组在注射菌液后30 min Glu和Asp显著增高,与C组和NS组及PB组的5、60、120、240 min组相比差异有非常显著意义(P<0.01)(表3)。
表3 NS、PB组不同时间大鼠脑组织匀浆兴奋性氨基酸动态变化( ±s) 组别
±s) 组别
Glu(μmol/g脑组织)
Asp(μmol/g脑组织)
NS组
PB组
t值
, 百拇医药 NS组
PB组
t值
C组(注射前)
7.12±0.80
0.99±0.15
注射后
5 min
7.11±0.91
7.22±1.21
0.20
0.92±0.10
0.92±0.24
, 百拇医药
0
30 min
6.98±0.28
11.03±2.44*
4.35**
0.94±0.19
1.57±0.37*
4.05**
60 min
7.00±0.78
6.37±1.68
, http://www.100md.com
0.91
0.95±0.17
0.92±0.26
0.26
120 min
6.91±0.45
6.49±1.66
0.65
0.93±0.19
0.93±0.27
0
240 min
, 百拇医药
6.75±0.50
5.12±0.55*
5.80**
0.96±0.16
0.84±0.17
1.36
阶段间比较F
2.76△
6.48△
注:与C组比较,*P<0.01;两组同阶段比较,**P<0.01;阶段间总比较,△P<0.01
, 百拇医药
讨论
脑含水量和Na+、K+含量是反映脑水肿的重要指标。本实验发现大鼠注射菌液后30 min脑含水量和Na+含量逐渐增加,并随注射菌液后时间的增加而逐渐增多,240 min达高峰。而光镜和电镜的改变是判断脑水脑的主要标准之一。本实验发现注射菌液5 min后,胶质细胞就出现了肿胀。注射菌液30 min后,光镜和电镜均可见毛细血管管周胶质细胞肿胀明显,毛细血管周围间隙增宽,表现为血管源性脑水肿。以后随注射菌液时间的延长,上述改变更加明显,毛细血管周围出现空泡变性,内皮细胞线粒体肿胀,细胞呈锯齿状改变,毛细血管内皮细胞出现大量的吞饮小泡,胶质细胞空泡化。同时出现神经元胞体线粒体肿胀,空泡化,嵴断裂,细胞核固缩变性。上述改变显示,PB所致的脑水肿为混合性脑水肿。说明已成功地复制了大鼠感染性脑水肿模型。
近年来,EAAs的神经毒性作用受到了广泛重视。其兴奋性毒性机制可能有两方面:EAAs大量释放,导致神经细胞渗透性改变,使K+外流,Cl-、Na+及水内流,从而引起神经细胞急性肿胀;另一方面EAAs可介导受体依赖性钙大量内流,使细胞内钙超载,从而引起一系列改变,导致神经细胞迟发性损害[3]。本研究采用高效液相色谱荧光检测法检测脑组织匀浆上清液中Glu和Asp的水平,结果显示,C组和NS各组Glu和Asp含量变化不大(P>0.05),而PB组的Glu和Asp含量在注射菌液后30 min开始增加,并迅速达高峰,与C组和相应时间的NS组及PB 5、60、120和240 min组比较,差异有非常显著意义(P<0.01),之后EAAs浓度迅速下降。其结果与缺氧缺血性脑损伤EAAs的改变有类似之处[4]。Guerra-Romero等[5]发现兔实验性肺炎球菌脑膜炎脑组织间隙内和脑脊液(CSF)中Glu和Asp浓度明显增高。细菌性脑膜炎患儿CSF中的EAAs含量也明显增高[6]。Leib等[7]使用非选择性的EAAs受体拮抗剂犬尿烯酸(kynurenic acid)可明显减轻兔链球菌脑膜炎时大脑皮质和海马组织的感染性脑损伤。由此可见,EAAs不但与缺血性脑损害密切相关,而且参与了感染性脑损伤的过程,是感染性脑损伤的重要发病机制之一。尤其是在百日咳菌液大鼠脑水肿的病理过程中,注射菌液后30 min EAAs含量显著增高,提示EAAs含量的增高可能是感染性脑水肿的启动因素之一。
, http://www.100md.com
感染性脑水肿时EAAs含量增加也可能与脑缺血有关。因为感染性脑水肿时毛细血管内皮细胞及毛细血管周围病变逐渐加重,使血流缓慢而粘滞。同时感染性脑水肿时颅内压升高,可能导致脑组织继发性缺血。注射菌液后240 min,Glu含量明显下降,可能的原因有[8]:(1)合成不足,释放增多;(2)神经细胞及神经胶质细胞再摄取减少;(3)释放的EAAs入血循环而丢失;其意义值得我们进一步探讨。
基金项目:国家自然科学基金资助项目(39470233)
参考文献:
[1]Faden Al, Demediuk P, Panter SS, et al. The role of excitatory amino acids and NMDA receptors in tranmatic brain injury. Science, 1989, 244:798-800.
, http://www.100md.com
[2]Silverstein FS, Nalk B, Simpson J. Hypxia-ischemia stimulates hippocampal glutamate efflux in perinatal rat brain:an in vivo microdialysis study. Pediatr Res, 1991, 30:587-590.
[3]Greenamyre JT, Porter HP. Anatomy and physiology of glutamate in the CNS. Neurology, 1994, 44 Suppl 8:s7-s13.
[4]Katoh H, Sima K, Nawashiro H, et al. The effect of MK-801 on extracellular neuroactive amino acids in hippocampus after closed head injury followed by hypoxia in rats. Brain Res, 1997, 758:153-162.
, 百拇医药
[5]Guerra-Romero L, Tureen JH, Fournier MA, et al. Amino acids in cerebrospinal and brain interstitial fluid in experimental pneumococcal meningitis. Pediatr Res, 1993, 33:510-513.
[6]San JV, Khai N, Seaale T, et al. Increased cerebrospinal fluid free amino acids concentrations in children with bacterial meningitis. Scand J Infect Dis, 1982, 14:23-26.
[7]Leib SL, Kim YK, Ferriero DM, et al. Neuroprotective effect of excitatory amino acid antagonist kynurenic acid in experimental bacterial meningitis. J Infect Dis, 1996, 173:166-171.
[8]黎红华,郑彩梅. 兴奋性氨基酸在缺血性海马神经元损害中的作用的研究. 中国神经精神病杂志, 1993, 19:197-199.
收稿日期:1999-03-25, http://www.100md.com
单位:尹飞(长沙,湖南医科大学湘雅医院儿科 410008);于嘉(长沙,湖南医科大学湘雅医院儿科 410008);虞佩兰(长沙,湖南医科大学湘雅医院儿科 410008);陶永光(长沙,湖南医科大学湘雅医院儿科 410008);毛定安(长沙,湖南医科大学湘雅医院儿科 410008)
关键词:脑水肿;兴奋性氨基酸类
中华儿科杂志000103 摘 要:目的 了解百日咳菌液诱发大鼠脑水肿时脑组织中兴奋性氨基酸时相的变化及与感染性脑水肿的关系。方法 SD大鼠81只,随机分成空白对照组(C组),生理盐水对照组(NS组),百日咳菌液组(PB组)。百日咳菌液诱发大鼠感染性脑水肿后,应用高效液相色谱法检测大鼠脑组织匀浆中兴奋性氨基酸含量。结果 C组和NS各组脑组织匀浆中谷氨酸(Glu)、门冬氨酸(Asp)含量较稳定,各组差异无显著意义(P>0.05)。PB组注射菌液后30 min,大鼠脑组织中Glu[(11.03±2.44)μmol/g脑组织]和Asp含量[(1.57±0.37)μmol/g脑组织]明显增加,与C组[Glu (7.12±0.80) μmol/g脑组织,Asp (0.99±0.15)μmol/g脑组织]、NS组及PB 5、60、120和240 min组比较,差异有非常显著意义 (P均<0.01)。 结论 兴奋性氨基酸增高与感染性脑水肿关系密切,其参与了感染性脑损害的过程。
, http://www.100md.com
Time-course changes of the excitatory amino acid content in brain tissue of infectious brain edema induced by Pertussis Bacilli in rats
YIN Fei
(Department of Pediatrics, Xiangya Hospital, Hunan Medical University, Changsha 410008, China)
YANG Yujia
(Department of Pediatrics, Xiangya Hospital, Hunan Medical University, Changsha 410008, China)
, 百拇医药
YU Peilan
(Department of Pediatrics, Xiangya Hospital, Hunan Medical University, Changsha 410008, China)
Abstract:Objective To understand time-course changes of excitatory amino acids (EAAs) content in brain tissue of infectious brain edema induced by Pertussis Bacilli in rats and relationship between EAAs and infectious brain edema. Methods Eighty-one SD rats were randomly divided into 3 groups: sham control group (C group), normal saline group (NS group) and Pertussis Bacilli group (PB group). High performance liquid chromatography was used to measure EAAs content in brain tissue in vivo after brain edema induced by infection with Pertussis Bacilli in rats. Results Glutamic acid (Glu) and Aspartic acid (Asp) contents of homogenized brain tissue in rats of C and NS groups were kept steady state and no significant differences (P>0. 05). Thirty minutes after injection with Pertussis Bacilli, the concentrations of Glu[(11.03±2.44)μmol/g brain tissue] and Asp [(1.57±0.37) μmol/g brain tissue] were significantly increased in PB group, which was significantly different (P<0.01) from the concentrations of Glu and Asp in C group [(7.12±0.80) and (0.99±0.15) μmol/g brain tissue, respectively], NS group as well as all other PB groups with Pertussis Bacilli injections 5, 60, 120 and 240 minutes later. Conclusion EAAs were involved in infectious brain edema of Pertussis Bacilli and might play an important role in infectious brain injury.
, http://www.100md.com
Key words:Brain edema; Excitatory amino acids▲
兴奋性氨基酸(excitatory amino acids, EAAs)主要为谷氨酸(glutamate, Glu)、门冬氨酸(aspartate, Asp),是中枢神经系统主要的兴奋性神经递质。EAAs不但可通过与相应的受体相结合参与中枢神经系统的信息传递;而且还可作为内源性兴奋毒素,破坏中枢神经细胞,导致神经功能障碍[1]。近年来的研究证实,EAAs与缺血性、创伤性脑损伤有关,在缺血早期,细胞外的EAAs就明显增高[2]。但EAAs与感染性脑损伤的关系研究较少,感染性脑水肿时EAAs的变化未见报道。我们用大鼠百日咳菌液感染性脑水肿模型,检测大鼠脑组织中EAAs含量的时相动态变化,以探讨EAAs与感染性脑水肿的关系。
材料和方法
一、实验大鼠分组
, 百拇医药
SD大鼠81只,体重(200±30) g,随机分成3组:(1)空白对照组(C组)7只,不作任何处理断头处死;(2)生理盐水对照组(NS组)35只;(3)百日咳菌液组(PB组)39只。按观察时间不同,NS组和PB组又分为5、30、60、120(各组均为7只和8只)和240 min组(7只和7只)。
二、实验大鼠模型制作
乌拉坦麻醉大鼠后,分离左侧股动脉,将内径0.56 mm塑料管插入左股动脉后,连接四道生理仪监测血压及取血样。颈正中切口,分离左颈总动脉,颈外动脉、颈内动脉及分支,结扎翼腭动脉和枕动脉。夹闭颈外动脉后,用1 ml注射器配4.5号针头于左颈总动脉穿刺向左颈内动脉注射百日咳菌液0.2 ml/kg(含菌10.8×109/ml,使用前超声波充分破碎),5~15 s内注射完毕。NS组大鼠则用同法注射等量的灭菌生理盐水。各组大鼠观察至相应的时间断头处死。
三、脑含水量、Na+、K+含量的测定
, 百拇医药
用干湿法测定大鼠左大脑半球脑含水量;用原子吸收分光光度法测定相应干脑组织的Na+、K+含量。
四、脑组织EAAs测定
大鼠断头处死,迅速取出左大脑部分全层脑组织,称湿重后按10∶1(V/V)加入无水乙醇,恒速匀浆35次左右,取匀浆液置离心管中,4℃ 20 000 r/min离心30 min,收集上清液,用高效液体色谱法测定EAAs含量。
五、统计学处理
数据均采用Excel 5.0软件计算。计量数据用均数±标准差(
 ±s)表示,组间比较用F检验,同阶段比较用t检验。
±s)表示,组间比较用F检验,同阶段比较用t检验。结果
, http://www.100md.com
一、血压监测及血气分析结果
实验大鼠体温均维持在(37.0±0.5)℃。平均动脉压、pH、PaCO2、PaO2在实验过程中差异均无显著意义(P>0.05)(表1)。
表1 各组大鼠平均动脉压和血气分析结果(
 ±s) 组别
±s) 组别鼠数
平均动脉压(mm Hg)
pH值
PaO2(mm Hg)
PaCO2(mm Hg)
, http://www.100md.com
注射前
处死前
注射前
处死前
注射前
处死前
注射前
处死前
NS组
5 min
7
98±8
98±5
, http://www.100md.com
7.431±0.030
7.420±0.041
102±13
101± 8
38±5
39±5
30 min
7
99±3
96±4
7.388±0.032
7.381±0.080
, http://www.100md.com
97± 8
94± 8
37±7
35±5
60 min
7
99±4
98±7
7.401±0.044
7.414±0.063
99±11
98± 9
35±4
, http://www.100md.com
35±5
120 min
7
99±4
97±5
7.390±0.028
7.397±0.042
101±12
101±11
38±5
38±7
240 min
, 百拇医药 7
99±5
102±5
7.400±0.033
7.394±0.071
100±11
101±17
37±6
38±5
PB组
5 min
8
99±3
, 百拇医药
98±4
7.431±0.039
7.390±0.022
103± 5
102± 7
38±7
38±5
30 min
8
93±5
95±8
7.388±0.021
, http://www.100md.com 7.372±0.060
101± 7
102±15
40±5
41±7
60 min
8
96±8
97±7
7.384±0.029
7.354±0.047
105±10
, 百拇医药 101±14
38±6
38±8
120 min
8
97±8
96±6
7.403±0.031
7.376±0.041
101±14
98± 8
38±3
41±6
, 百拇医药
240 min
7
97±6
99±6
7.372±0.054
7.359±0.083
98± 5
97±17
38±5
40±5
注:1 mm Hg=0.133 kPa
二、脑含水量及脑组织Na+、K+含量
, 百拇医药
C组和NS组各组脑含水量、Na+、K+含量相对稳定,差异无显著意义(P>0.05)。PB组脑含水量、Na+含量明显高于C组和NS组,并随时间增加而逐渐增多,注射菌液后4 h为最高值(表2)。
表2 NS、PB组不同时间大鼠脑含水量及Na+、K+含量的变化(
 ±s) 组别
±s) 组别含水量(%)
Na+(mmol/kg)
K+(mmol/kg)
NS组
, 百拇医药
PB组
t值
NS组
PB组
t值
NS组
PB组
t值
C组(注射前)
78.4±0.4
191±4
453±12
注射后
, http://www.100md.com
5 min
78.8±0.8
78.9±0.6
0.28
191±4
196±14
1.05
451±32
465±31
0.86
30 min
78.8±0.7
, 百拇医药 79.7±0.5*
2.90**
195±6
208±14*
2.40**
451±31
461±25
0.71
60 min
78.6±0.6
81.0±0.9*
, 百拇医药
5.98△
191±5
235±25*
4.58△
462±18
441±23
1.96
120 min
78.7±0.8
81.1±0.8*
5.80△
, 百拇医药
193±6
240±25*
4.90△
447±16
442±30
0.42
240 min
78.6±0.3
82.2±0.3*
22.45△
194±7
, http://www.100md.com
277±19*
11.05△
447±11
358±25*
8.51△
阶段间比较F
21.86△△
25.27△△
5.96△△
注:与C组比较,*P<0.01;两组同阶段比较,**P<0.05,△P<0.01;阶段间总比较,△△P<0.01
, 百拇医药
三、光镜、电镜观察结果
光镜:NS组脑组织结构正常。PB 5 min组毛细管血管变圆,神经元及神经胶质细胞无明显改变。PB 30 min组血管周围间隙明显增宽。PB 60 min和120 min组毛细血管周围水肿明显,神经元和胶质细胞周围间隙增宽。 PB 120 min组还可见部分神经细胞核固缩变性。240 min组可见弥漫的灶性水肿区,该处血管周围间隙明显增宽,神经细胞和胶质细胞周围空隙增大,神经元细胞空泡样变性(图1~4)。电镜:NS组神经细胞和胶质细胞结构正常。PB 5 min组部分胶质细胞肿胀,海马神经元胞体的超微结构形态基本正常。PB 30 min组:毛细血管管周胶质细胞突起肿胀明显,部分出现空泡样改变。神经元胞体粗面内质网轻度扩张,部分线粒体水肿,神经毡可见大小不一的空泡。PB 60 min组:胶质细胞严重肿胀,毛细血管管周水肿明显,毛细血管内皮细胞呈锯齿状改变,并出现了较多的吞饮小泡。神经细胞胞质内粗面内质网扩张,线粒体肿胀。PB 120 min:胶质细胞核周围间隙明显增宽,部分细胞膜破裂,融合成水肿区域,毛细血管周出现空泡化。神经元胞体电子密度增高,部分细胞呈暗细胞改变,神经元胞体周围出现大量空泡结构,神经毡周围出现高密度的电子碎块。PB 240 min:胶质细胞肿胀明显,有的细胞膜破裂,融合成大片水肿区域,毛细血管内皮细胞内吞饮小泡大量增加,部分聚集成葡萄状,毛细血管周围胶质细胞突起严重水肿。神经元细胞皱缩,粗面内质网扩张,线粒体肿胀,细胞内有空泡样改变(图5~9)。









, http://www.100md.com
图1 注射菌液30 min脑组织 示毛细血管扩张,周围间隙增宽(↑)(苏木素-伊红染色 光镜 ×200) 图2 注射菌液60 min脑组织 示血管周围水肿明显,神经细胞周围间隙增宽(↑)(苏木素-伊红染色 光镜 ×100) 图3 注射菌液120 min脑组织 示部分神经细胞核固缩变性,细胞周围间隙增宽(↑)(苏木素-伊红染色 光镜 ×200) 图4 注射菌液240 min脑组织 示神经细胞周围空隙增大,部分神经细胞空泡变性(↑)(苏木素-伊红染色 光镜 ×200) 图5 注射菌液5 min脑组织电镜图 示部分胶质细胞水肿(↑)(电镜 ×5 000) 图6 注射菌液30 min脑组织电镜图 示毛细血管周胶质细胞突起肿胀明显(↑),神经毡可见大小不一的空泡(
 )(电镜 ×3 000) 图7 注射菌液60 min脑组织电镜图 示毛细血管周水肿明显(↑),毛细血管内皮细胞呈锯齿状改变,有较多的吞饮小泡,胶质细胞肿胀明显(
)(电镜 ×3 000) 图7 注射菌液60 min脑组织电镜图 示毛细血管周水肿明显(↑),毛细血管内皮细胞呈锯齿状改变,有较多的吞饮小泡,胶质细胞肿胀明显( )(电镜 ×5 000) 图8 注射菌液120 min脑组织电镜图 示毛细血管周出现空泡化(↑),神经毡周围出现高密度的电子碎片,神经元胞体电子密度增高(
)(电镜 ×5 000) 图8 注射菌液120 min脑组织电镜图 示毛细血管周出现空泡化(↑),神经毡周围出现高密度的电子碎片,神经元胞体电子密度增高( )(电镜 ×4 000) 图9 注射菌液240 min脑组织电镜图 示毛细血管内皮细胞吞饮小泡大量增加,部分聚集成葡萄状(↑),胶质细胞严重肿胀(
)(电镜 ×4 000) 图9 注射菌液240 min脑组织电镜图 示毛细血管内皮细胞吞饮小泡大量增加,部分聚集成葡萄状(↑),胶质细胞严重肿胀( )(电镜 ×4 000)
)(电镜 ×4 000), http://www.100md.com
四、脑组织EAAs含量的变化
PB组在注射菌液后30 min Glu和Asp显著增高,与C组和NS组及PB组的5、60、120、240 min组相比差异有非常显著意义(P<0.01)(表3)。
表3 NS、PB组不同时间大鼠脑组织匀浆兴奋性氨基酸动态变化(
 ±s) 组别
±s) 组别Glu(μmol/g脑组织)
Asp(μmol/g脑组织)
NS组
PB组
t值
, 百拇医药 NS组
PB组
t值
C组(注射前)
7.12±0.80
0.99±0.15
注射后
5 min
7.11±0.91
7.22±1.21
0.20
0.92±0.10
0.92±0.24
, 百拇医药
0
30 min
6.98±0.28
11.03±2.44*
4.35**
0.94±0.19
1.57±0.37*
4.05**
60 min
7.00±0.78
6.37±1.68
, http://www.100md.com
0.91
0.95±0.17
0.92±0.26
0.26
120 min
6.91±0.45
6.49±1.66
0.65
0.93±0.19
0.93±0.27
0
240 min
, 百拇医药
6.75±0.50
5.12±0.55*
5.80**
0.96±0.16
0.84±0.17
1.36
阶段间比较F
2.76△
6.48△
注:与C组比较,*P<0.01;两组同阶段比较,**P<0.01;阶段间总比较,△P<0.01
, 百拇医药
讨论
脑含水量和Na+、K+含量是反映脑水肿的重要指标。本实验发现大鼠注射菌液后30 min脑含水量和Na+含量逐渐增加,并随注射菌液后时间的增加而逐渐增多,240 min达高峰。而光镜和电镜的改变是判断脑水脑的主要标准之一。本实验发现注射菌液5 min后,胶质细胞就出现了肿胀。注射菌液30 min后,光镜和电镜均可见毛细血管管周胶质细胞肿胀明显,毛细血管周围间隙增宽,表现为血管源性脑水肿。以后随注射菌液时间的延长,上述改变更加明显,毛细血管周围出现空泡变性,内皮细胞线粒体肿胀,细胞呈锯齿状改变,毛细血管内皮细胞出现大量的吞饮小泡,胶质细胞空泡化。同时出现神经元胞体线粒体肿胀,空泡化,嵴断裂,细胞核固缩变性。上述改变显示,PB所致的脑水肿为混合性脑水肿。说明已成功地复制了大鼠感染性脑水肿模型。
近年来,EAAs的神经毒性作用受到了广泛重视。其兴奋性毒性机制可能有两方面:EAAs大量释放,导致神经细胞渗透性改变,使K+外流,Cl-、Na+及水内流,从而引起神经细胞急性肿胀;另一方面EAAs可介导受体依赖性钙大量内流,使细胞内钙超载,从而引起一系列改变,导致神经细胞迟发性损害[3]。本研究采用高效液相色谱荧光检测法检测脑组织匀浆上清液中Glu和Asp的水平,结果显示,C组和NS各组Glu和Asp含量变化不大(P>0.05),而PB组的Glu和Asp含量在注射菌液后30 min开始增加,并迅速达高峰,与C组和相应时间的NS组及PB 5、60、120和240 min组比较,差异有非常显著意义(P<0.01),之后EAAs浓度迅速下降。其结果与缺氧缺血性脑损伤EAAs的改变有类似之处[4]。Guerra-Romero等[5]发现兔实验性肺炎球菌脑膜炎脑组织间隙内和脑脊液(CSF)中Glu和Asp浓度明显增高。细菌性脑膜炎患儿CSF中的EAAs含量也明显增高[6]。Leib等[7]使用非选择性的EAAs受体拮抗剂犬尿烯酸(kynurenic acid)可明显减轻兔链球菌脑膜炎时大脑皮质和海马组织的感染性脑损伤。由此可见,EAAs不但与缺血性脑损害密切相关,而且参与了感染性脑损伤的过程,是感染性脑损伤的重要发病机制之一。尤其是在百日咳菌液大鼠脑水肿的病理过程中,注射菌液后30 min EAAs含量显著增高,提示EAAs含量的增高可能是感染性脑水肿的启动因素之一。
, http://www.100md.com
感染性脑水肿时EAAs含量增加也可能与脑缺血有关。因为感染性脑水肿时毛细血管内皮细胞及毛细血管周围病变逐渐加重,使血流缓慢而粘滞。同时感染性脑水肿时颅内压升高,可能导致脑组织继发性缺血。注射菌液后240 min,Glu含量明显下降,可能的原因有[8]:(1)合成不足,释放增多;(2)神经细胞及神经胶质细胞再摄取减少;(3)释放的EAAs入血循环而丢失;其意义值得我们进一步探讨。
基金项目:国家自然科学基金资助项目(39470233)
参考文献:
[1]Faden Al, Demediuk P, Panter SS, et al. The role of excitatory amino acids and NMDA receptors in tranmatic brain injury. Science, 1989, 244:798-800.
, http://www.100md.com
[2]Silverstein FS, Nalk B, Simpson J. Hypxia-ischemia stimulates hippocampal glutamate efflux in perinatal rat brain:an in vivo microdialysis study. Pediatr Res, 1991, 30:587-590.
[3]Greenamyre JT, Porter HP. Anatomy and physiology of glutamate in the CNS. Neurology, 1994, 44 Suppl 8:s7-s13.
[4]Katoh H, Sima K, Nawashiro H, et al. The effect of MK-801 on extracellular neuroactive amino acids in hippocampus after closed head injury followed by hypoxia in rats. Brain Res, 1997, 758:153-162.
, 百拇医药
[5]Guerra-Romero L, Tureen JH, Fournier MA, et al. Amino acids in cerebrospinal and brain interstitial fluid in experimental pneumococcal meningitis. Pediatr Res, 1993, 33:510-513.
[6]San JV, Khai N, Seaale T, et al. Increased cerebrospinal fluid free amino acids concentrations in children with bacterial meningitis. Scand J Infect Dis, 1982, 14:23-26.
[7]Leib SL, Kim YK, Ferriero DM, et al. Neuroprotective effect of excitatory amino acid antagonist kynurenic acid in experimental bacterial meningitis. J Infect Dis, 1996, 173:166-171.
[8]黎红华,郑彩梅. 兴奋性氨基酸在缺血性海马神经元损害中的作用的研究. 中国神经精神病杂志, 1993, 19:197-199.
收稿日期:1999-03-25, http://www.100md.com