奥替普拉诱发人肺腺癌细胞凋亡的研究
作者:柏华 罗贤懋 胡国刚 魏慧娟 陈凤 朱明
单位:罗贤懋 胡国刚 魏慧娟 陈凤 朱明(100021 北京市 中国协和医科大学中国医学科学院肿瘤研究所肿瘤医院;柏华 (现在首都医科大学宣武医院 北京市 100053))
关键词:吡嗪类;脱噬作用;肺肿瘤;腺癌
中华预防医学杂志990308 摘要 目的 探讨奥替普拉(oltipraz)能否诱发人肺腺癌细胞凋亡及其机制。方法 应用光镜、DNA电泳、流式细胞仪、活细胞视频观察进行检测和分析。结果 癌细胞在奥替普拉作用下,细胞分裂阻滞在分裂中期,G2/M百分比增高,出现细胞凋亡峰,凋亡细胞出现胞体固缩、核染色质凝聚或者断裂,细胞DNA裂解片段呈现典型的“梯形”条带。奥替普拉诱导的GLC细胞凋亡在使用浓度120 μg/ml时效果明显。结论 奥替普拉在适当浓度时能够诱发人肺腺癌细胞凋亡,这种作用与分裂期阻滞密切相关。
, http://www.100md.com
Studies on Apoptosis of Human Lung Adenocarcinoma Cells Induced by Oltipraz
BAI Hua, LUO Xianmao, HU Guogang, et al.
Cancer Institute and Cancer Hospital, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100021
Abstract Objective To study whether oltipraz can induce apoptosis of human lung adenocarcinoma (GLC-82) cells and its possible mechanism. Methods Light microscopy, DNA electrophoresis, flow cytometry and video time-lapse monitoring were used to observe apoptosis of GLC-82 induced by oltipraz. Results GLC-82 cells treated with oltipraz underwent the arrest of cell mitosis at metaphase, higher percentage of G2/M and peak of apoptosis were found, and cell body shrunk, nuclear chromosome condensed or fragmented and nuclear DNA fragment displayed “laden” bands in apoptic cells. Apoptosis of GLC-82 induced by oltipraz was more obvious at a concentration of 120 μg/ml. Conclusion Oltipraz could induce apoptosis of GLC-82 at certain concentrations, which associated closely with the arrest of mitotic cycle.
, 百拇医药
Key words Pyrazines Apoptosis Lung neoplasms Adenocarcinoma
奥替普拉(oltipraz)是从十字花科(cruciferase)蔬菜等绿色植物中提取的巯基类化合物,中文全称为5-(2-吡嗪基)-4-甲1,2-二羟基-3-硫酮;它对多种癌症包括肝癌、胃癌、结肠癌、肺癌、胰腺癌等均有较好防治作用。奥替普拉防治癌症的机制可能是与减少致癌性的DNA加成物形成,减低酪氨酸蛋白激酶(TPK)活性,增加谷胱甘肽转移酶(GST)、环氧化脱氢酶、P450、NADPH∶QR等解毒酶活性有关[1]。我们在研究奥替普拉阻断人肺早期癌变的基础上,探讨奥替普拉的促细胞凋亡作用,揭示奥替普拉防癌抑癌的机制。
材料与方法
1.细胞培养和药物:人肺腺癌细胞(GLC-82)生长在含10%胎牛血清和0.5%青链霉素的RPMI-1640(Gibco,美国)培养基中,细胞贴壁生长。奥替普拉由美国国立卫生研究院(NIH)Bourat博士赠送,纯度99.7%,溶解在100%二甲基亚砜(DMSO)中,工作浓度为50~250 μg/ml不等。
, 百拇医药
2.光镜观察:经奥替普拉处理后的细胞定时用胰酶消化收集,离心涂片,甲醇固定,Giemsa染色观察,0.4%台盼蓝鉴定细胞活性。
3.活细胞视频(video time-lapse monitor)观察:将培养细胞及培养皿置于倒置相差显微镜平台上,平台温度与细胞培养箱相同。记录细胞形态变化72小时,视频观察记录的时间比率为1∶720。
4.流式细胞分析(碘化丙啶染色法):常规胰酶消化制成单细胞悬液,每毫升2×106个细胞,70%乙醇固定,4℃存放。测样前PBS离心沉淀去除固定液,加200 μl核糖核酸酶A(RNaseA)37℃水浴30分钟,再加800 μl碘化丙啶(PI)染色液混匀(0.5 mg/ml)置4℃避光0.5~1小时。用FACScan流式细胞仪测定。实验重复5次。以Cell FIT软件分析处理数据。
5.DNA凝胶电泳分析:各类培养细胞消化传代,在对数生长期进行药物处理。按常规法提取细胞DNA,置于含EBr的1.5%琼脂糖凝胶中进行电泳,细胞出现PCD时呈典型的“梯状”条带。
, 百拇医药
6.细胞毒理的比色法测定(SRB法):用96孔板,每孔加0.1 ml DMEM(含细胞5 000/孔),培养24小时;第2天用不同浓度(50、75、100、125、150、200 μg/ml)的奥替普拉分别处理细胞,每组8孔,再培养24小时,48小时或72小时。然后倒去DMEM,每孔加10%三氯醋酸100 μl,30分钟,清水洗4次,空气干燥,再每孔加入0.4% SRB 100 μl,30分钟,再用1%醋酸轻洗4遍,甩干;最后每孔加入10 mmol/L三羟甲基氨基甲烷(Tris)200 μl,静置10秒,用酶联免疫仪检测570 nm吸光度值。重复测5次。
结果
1.形态学观察:细胞经奥替普拉(120 μg/ml)处理72小时,可见胞体固缩,胞膜完整或消失,胞浆嗜碱性,核染色质浓缩或断裂。油镜下见细胞膜起泡(blebbing),部分细胞有凋亡小体(apoptoic bodies)。
, http://www.100md.com 2.SRB法筛选奥替普拉剂量:奥替普拉稀释成50、100、150、200、250 μg/ml,加到96孔板培养的GLC细胞中加奥替普拉后第1~4天,每天取1板用SRB法测定GLC细胞相对存活率,由此作出奥替普拉作用于GLC细胞的剂量/时间-反应曲线(图1)。由图1可见奥替普拉短期和低剂量作用细胞,可刺激CLC生长,提高细胞成活率。在24~28小时之间细胞存活率的变化较平缓。取48小时实验结果,作奥替普拉浓度与细胞相对生存率关系图(图2)。用作图法可求出ID20(20%致死量)对应的浓度为140 μg/ml,ID5对应的浓度为95 μg/ml。从而认定95~140 μg/ml是奥替普拉诱导GLC凋亡的大致范围。
图1 奥替普拉作用于GLC细胞的剂量-时间反应曲线
, http://www.100md.com
图2 奥替普拉浓度与GLC细胞相对生存率关系图
3.流式细胞仪分析细胞凋亡:奥替普拉配成90~140 μg/ml的系列浓度,分别作用于GLC细胞,并设对照。用流式细胞仪分析奥替普拉诱导GLC细胞凋亡的百分数(n=5),对照组为(3.1±0.2)%、90 μg/ml组(3.3±0.3)%、100 μg/ml组(3.4±0.3)%、110 μg/ml组(8.7±1.4)%、120 μg/ml组(18.1±3.7)%、130 μg/ml组(11.9±3.2)%、140 μg/ml组(4.5±0.5)%。在流式细胞拟合图上,发生凋亡时出现亚G1峰,即亚二倍体峰(图3),对照组无亚G1峰(图4)。
图3 用120 μg/ml奥替普拉处理的GLC细胞
经流式细胞仪分析
, 百拇医药
图4 正常GLC细胞经流式细胞仪分析
4.DNA “Ladder”:凋亡发生过程中会出现细胞核DNA的降解,降解后产生的DNA片段由185 bp的多聚体组成。在1.5%琼脂糖凝胶电泳上表现出具特征性的凋亡DNA“梯形”。如图5所示,120 μg/ml奥替普拉诱导了GLC细胞出现DNA梯状物。
①用120 μg/ml 奥替普拉处理GLC细胞,②用110 μg/ml
奥替普拉处理GLC细胞,③正常GLC细胞(对照)
图5 琼脂糖凝胶电泳分析各处理组细胞DNA
5.细胞周期分析:以不同浓度的奥替普拉处理GLC细胞,用FCM仪分析,随着奥替普拉浓度增加,逐步达到诱导凋亡剂量时,G0/G1期细胞比值增大。S+G2/M期细胞比值下降(表1)。
, http://www.100md.com
表1 奥替普拉诱导GLC细胞凋亡时对细胞
周期的影响(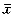 ±s,n=5) 剂量组
±s,n=5) 剂量组
G0/G1
(S+G2)/M
对照组
45.3±2.4
54.7±2.5
80 μg/ml
50.9±2.1
49.1±2.2
, http://www.100md.com
100 μg/ml
54.6±2.9
45.4±1.9
120 μg/ml
63.2±2.7
36.8±1.6
6.活细胞变化视频记录:奥替普拉(120 μg/ml)处理GLC细胞后,细胞逐渐变圆,折光性增强,核染色质浓缩,表明细胞进入分裂期阻滞状态;其后细胞有芽状突起,胞体破裂,细胞固缩,发生凋亡。
讨论
奥替普拉是1,2-二羟基-3硫酮的衍生物,其结构中烯羟基同一个电疏散性硫酮的偶联对活化一些脱氧化酶是必要的。最早它仅用于血吸虫病治疗,后来发现奥替普拉有防癌抑癌作用,因而1993年美国NCI倡议用它作为临床Ⅰ期抗癌药物试用[2]。它的抗癌机制是否与凋亡相关是值得探索的问题。我们先用SRB法筛选了奥替普拉的有效剂量范围,通过初筛、复筛,发现奥替普拉在120 μg/ml的浓度,能诱导GLC细胞出现较典型的凋亡征象。通过流式细胞术还测定了凋亡细胞的百分数,观察了细胞周期的变化,发现奥替普拉在诱导GLC细胞凋亡时能使G0/G1期细胞百分比增加,结合活细胞变化视频记录提示奥替普拉的抑癌作用与诱使细胞周期的分裂中期阻滞相关。这种阻滞是否是通过某种蛋白质因子诱使某些基因表达值得探索。
, 百拇医药
凋亡是细胞主动参与的在某些基因调控下进行的程序化细胞死亡。细胞凋亡与肿瘤的发生、发展和转归有密切的关系,放射、化疗、抗体、淋巴因子等均可促进癌细胞的凋亡。许多学者已经用某些抗癌药物成功地诱导了体外培养细胞的凋亡,他们发现这种细胞死亡过程不导致溶酶体及细胞膜破裂,没有细胞内涵物外泄,故不引起炎症反应和次级损伤,它的结局是被吞噬细胞或邻周细胞所识别、吞噬、或自然脱落而离开生物体[3]。细胞凋亡受一系列相关基因调控,目前认为c-myc、EIA、APO-1/Fas等基因可促进凋亡,bcl-2、p53、IAP、EIB等基因可抑制凋亡,越来越多的凋亡相关基因已被发现或克隆[4],奥替普拉与凋亡相关基因有何联系是我们需要进一步探讨的问题。
奥替普拉的防癌抑癌作用与酪氨酸蛋白激酶、黄曲霉素B1醛还原酶(AFAR)、GST、环氧化脱氢酶活性及p53、c-myc、c-H-ras基因等异常表达均关系密切,奥替普拉通过使GST mRNA稳定性增大和转录水平的效率增加而影响GST-π基因的表达调控[5]。我们曾用奥替普拉作用于导入了反义GST-π基因的转化Rat-1细胞,发现它能通过诱导某种蛋白质因子与DSE(一种基因调控元件)结合而影响c-fos基因表达,这种结合有一定特异性[6]。上述资料还难以揭示奥替普拉诱导肿瘤细胞凋亡的机制,我们推测,它可能作用于已经存在的蛋白,通过改变它们的稳定性或磷酸化状态来影响凋亡;它还可能通过负调节一些影响凋亡的转录因子而使细胞易于凋亡。
, 百拇医药
参考文献
1 Egner PA, Kensler TW, Prestera T, et al. Regulation of phase 2 enzyme induction by oltipraz and other dithiolethione. Carcinogenesis, 1994,15:177-181.
2 Rao CV, Rivenson A, Katiwalla M, et al. Chemopreventive effect of oltipraz during different stages of experimental colon carcinogenesis induced by azoxymethane in male F344 rats. Cancer Res, 1993;53:2502-2506.
3 Tormanen U, Erola AK, Rainnio P, et al. Enhanced apoptosis predicts shortened survival in non-small cell lung cardinoma. Cancer Res, 1995,55:5595-5602.
, 百拇医药
4 Ellis RE. Mechanisms and functions of cell death. Annu Rev Cell Biol, 1991,7:663-698.
5 Davidson NE, Egner PA, Kensler TW. Transcriptional control of glutathione S-transferase gene expression by the chemoprotective agent 5-(2-pyrazinyl)-4-methyl-1, 2-dithiole-3-thione(oltipraz) in rat liver. Cancer Res, 1990,50:2251-2255
6 柏华.人肺癌变早期阻断及其分子机制研究.生理科学进展,1998,29:235-238
收稿日期:1998-10-08 修回日期:1999-02-24, http://www.100md.com
单位:罗贤懋 胡国刚 魏慧娟 陈凤 朱明(100021 北京市 中国协和医科大学中国医学科学院肿瘤研究所肿瘤医院;柏华 (现在首都医科大学宣武医院 北京市 100053))
关键词:吡嗪类;脱噬作用;肺肿瘤;腺癌
中华预防医学杂志990308 摘要 目的 探讨奥替普拉(oltipraz)能否诱发人肺腺癌细胞凋亡及其机制。方法 应用光镜、DNA电泳、流式细胞仪、活细胞视频观察进行检测和分析。结果 癌细胞在奥替普拉作用下,细胞分裂阻滞在分裂中期,G2/M百分比增高,出现细胞凋亡峰,凋亡细胞出现胞体固缩、核染色质凝聚或者断裂,细胞DNA裂解片段呈现典型的“梯形”条带。奥替普拉诱导的GLC细胞凋亡在使用浓度120 μg/ml时效果明显。结论 奥替普拉在适当浓度时能够诱发人肺腺癌细胞凋亡,这种作用与分裂期阻滞密切相关。
, http://www.100md.com
Studies on Apoptosis of Human Lung Adenocarcinoma Cells Induced by Oltipraz
BAI Hua, LUO Xianmao, HU Guogang, et al.
Cancer Institute and Cancer Hospital, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100021
Abstract Objective To study whether oltipraz can induce apoptosis of human lung adenocarcinoma (GLC-82) cells and its possible mechanism. Methods Light microscopy, DNA electrophoresis, flow cytometry and video time-lapse monitoring were used to observe apoptosis of GLC-82 induced by oltipraz. Results GLC-82 cells treated with oltipraz underwent the arrest of cell mitosis at metaphase, higher percentage of G2/M and peak of apoptosis were found, and cell body shrunk, nuclear chromosome condensed or fragmented and nuclear DNA fragment displayed “laden” bands in apoptic cells. Apoptosis of GLC-82 induced by oltipraz was more obvious at a concentration of 120 μg/ml. Conclusion Oltipraz could induce apoptosis of GLC-82 at certain concentrations, which associated closely with the arrest of mitotic cycle.
, 百拇医药
Key words Pyrazines Apoptosis Lung neoplasms Adenocarcinoma
奥替普拉(oltipraz)是从十字花科(cruciferase)蔬菜等绿色植物中提取的巯基类化合物,中文全称为5-(2-吡嗪基)-4-甲1,2-二羟基-3-硫酮;它对多种癌症包括肝癌、胃癌、结肠癌、肺癌、胰腺癌等均有较好防治作用。奥替普拉防治癌症的机制可能是与减少致癌性的DNA加成物形成,减低酪氨酸蛋白激酶(TPK)活性,增加谷胱甘肽转移酶(GST)、环氧化脱氢酶、P450、NADPH∶QR等解毒酶活性有关[1]。我们在研究奥替普拉阻断人肺早期癌变的基础上,探讨奥替普拉的促细胞凋亡作用,揭示奥替普拉防癌抑癌的机制。
材料与方法
1.细胞培养和药物:人肺腺癌细胞(GLC-82)生长在含10%胎牛血清和0.5%青链霉素的RPMI-1640(Gibco,美国)培养基中,细胞贴壁生长。奥替普拉由美国国立卫生研究院(NIH)Bourat博士赠送,纯度99.7%,溶解在100%二甲基亚砜(DMSO)中,工作浓度为50~250 μg/ml不等。
, 百拇医药
2.光镜观察:经奥替普拉处理后的细胞定时用胰酶消化收集,离心涂片,甲醇固定,Giemsa染色观察,0.4%台盼蓝鉴定细胞活性。
3.活细胞视频(video time-lapse monitor)观察:将培养细胞及培养皿置于倒置相差显微镜平台上,平台温度与细胞培养箱相同。记录细胞形态变化72小时,视频观察记录的时间比率为1∶720。
4.流式细胞分析(碘化丙啶染色法):常规胰酶消化制成单细胞悬液,每毫升2×106个细胞,70%乙醇固定,4℃存放。测样前PBS离心沉淀去除固定液,加200 μl核糖核酸酶A(RNaseA)37℃水浴30分钟,再加800 μl碘化丙啶(PI)染色液混匀(0.5 mg/ml)置4℃避光0.5~1小时。用FACScan流式细胞仪测定。实验重复5次。以Cell FIT软件分析处理数据。
5.DNA凝胶电泳分析:各类培养细胞消化传代,在对数生长期进行药物处理。按常规法提取细胞DNA,置于含EBr的1.5%琼脂糖凝胶中进行电泳,细胞出现PCD时呈典型的“梯状”条带。
, 百拇医药
6.细胞毒理的比色法测定(SRB法):用96孔板,每孔加0.1 ml DMEM(含细胞5 000/孔),培养24小时;第2天用不同浓度(50、75、100、125、150、200 μg/ml)的奥替普拉分别处理细胞,每组8孔,再培养24小时,48小时或72小时。然后倒去DMEM,每孔加10%三氯醋酸100 μl,30分钟,清水洗4次,空气干燥,再每孔加入0.4% SRB 100 μl,30分钟,再用1%醋酸轻洗4遍,甩干;最后每孔加入10 mmol/L三羟甲基氨基甲烷(Tris)200 μl,静置10秒,用酶联免疫仪检测570 nm吸光度值。重复测5次。
结果
1.形态学观察:细胞经奥替普拉(120 μg/ml)处理72小时,可见胞体固缩,胞膜完整或消失,胞浆嗜碱性,核染色质浓缩或断裂。油镜下见细胞膜起泡(blebbing),部分细胞有凋亡小体(apoptoic bodies)。
, http://www.100md.com 2.SRB法筛选奥替普拉剂量:奥替普拉稀释成50、100、150、200、250 μg/ml,加到96孔板培养的GLC细胞中加奥替普拉后第1~4天,每天取1板用SRB法测定GLC细胞相对存活率,由此作出奥替普拉作用于GLC细胞的剂量/时间-反应曲线(图1)。由图1可见奥替普拉短期和低剂量作用细胞,可刺激CLC生长,提高细胞成活率。在24~28小时之间细胞存活率的变化较平缓。取48小时实验结果,作奥替普拉浓度与细胞相对生存率关系图(图2)。用作图法可求出ID20(20%致死量)对应的浓度为140 μg/ml,ID5对应的浓度为95 μg/ml。从而认定95~140 μg/ml是奥替普拉诱导GLC凋亡的大致范围。

图1 奥替普拉作用于GLC细胞的剂量-时间反应曲线

, http://www.100md.com
图2 奥替普拉浓度与GLC细胞相对生存率关系图
3.流式细胞仪分析细胞凋亡:奥替普拉配成90~140 μg/ml的系列浓度,分别作用于GLC细胞,并设对照。用流式细胞仪分析奥替普拉诱导GLC细胞凋亡的百分数(n=5),对照组为(3.1±0.2)%、90 μg/ml组(3.3±0.3)%、100 μg/ml组(3.4±0.3)%、110 μg/ml组(8.7±1.4)%、120 μg/ml组(18.1±3.7)%、130 μg/ml组(11.9±3.2)%、140 μg/ml组(4.5±0.5)%。在流式细胞拟合图上,发生凋亡时出现亚G1峰,即亚二倍体峰(图3),对照组无亚G1峰(图4)。

图3 用120 μg/ml奥替普拉处理的GLC细胞
经流式细胞仪分析

, 百拇医药
图4 正常GLC细胞经流式细胞仪分析
4.DNA “Ladder”:凋亡发生过程中会出现细胞核DNA的降解,降解后产生的DNA片段由185 bp的多聚体组成。在1.5%琼脂糖凝胶电泳上表现出具特征性的凋亡DNA“梯形”。如图5所示,120 μg/ml奥替普拉诱导了GLC细胞出现DNA梯状物。

①用120 μg/ml 奥替普拉处理GLC细胞,②用110 μg/ml
奥替普拉处理GLC细胞,③正常GLC细胞(对照)
图5 琼脂糖凝胶电泳分析各处理组细胞DNA
5.细胞周期分析:以不同浓度的奥替普拉处理GLC细胞,用FCM仪分析,随着奥替普拉浓度增加,逐步达到诱导凋亡剂量时,G0/G1期细胞比值增大。S+G2/M期细胞比值下降(表1)。
, http://www.100md.com
表1 奥替普拉诱导GLC细胞凋亡时对细胞
周期的影响(
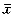 ±s,n=5) 剂量组
±s,n=5) 剂量组G0/G1
(S+G2)/M
对照组
45.3±2.4
54.7±2.5
80 μg/ml
50.9±2.1
49.1±2.2
, http://www.100md.com
100 μg/ml
54.6±2.9
45.4±1.9
120 μg/ml
63.2±2.7
36.8±1.6
6.活细胞变化视频记录:奥替普拉(120 μg/ml)处理GLC细胞后,细胞逐渐变圆,折光性增强,核染色质浓缩,表明细胞进入分裂期阻滞状态;其后细胞有芽状突起,胞体破裂,细胞固缩,发生凋亡。
讨论
奥替普拉是1,2-二羟基-3硫酮的衍生物,其结构中烯羟基同一个电疏散性硫酮的偶联对活化一些脱氧化酶是必要的。最早它仅用于血吸虫病治疗,后来发现奥替普拉有防癌抑癌作用,因而1993年美国NCI倡议用它作为临床Ⅰ期抗癌药物试用[2]。它的抗癌机制是否与凋亡相关是值得探索的问题。我们先用SRB法筛选了奥替普拉的有效剂量范围,通过初筛、复筛,发现奥替普拉在120 μg/ml的浓度,能诱导GLC细胞出现较典型的凋亡征象。通过流式细胞术还测定了凋亡细胞的百分数,观察了细胞周期的变化,发现奥替普拉在诱导GLC细胞凋亡时能使G0/G1期细胞百分比增加,结合活细胞变化视频记录提示奥替普拉的抑癌作用与诱使细胞周期的分裂中期阻滞相关。这种阻滞是否是通过某种蛋白质因子诱使某些基因表达值得探索。
, 百拇医药
凋亡是细胞主动参与的在某些基因调控下进行的程序化细胞死亡。细胞凋亡与肿瘤的发生、发展和转归有密切的关系,放射、化疗、抗体、淋巴因子等均可促进癌细胞的凋亡。许多学者已经用某些抗癌药物成功地诱导了体外培养细胞的凋亡,他们发现这种细胞死亡过程不导致溶酶体及细胞膜破裂,没有细胞内涵物外泄,故不引起炎症反应和次级损伤,它的结局是被吞噬细胞或邻周细胞所识别、吞噬、或自然脱落而离开生物体[3]。细胞凋亡受一系列相关基因调控,目前认为c-myc、EIA、APO-1/Fas等基因可促进凋亡,bcl-2、p53、IAP、EIB等基因可抑制凋亡,越来越多的凋亡相关基因已被发现或克隆[4],奥替普拉与凋亡相关基因有何联系是我们需要进一步探讨的问题。
奥替普拉的防癌抑癌作用与酪氨酸蛋白激酶、黄曲霉素B1醛还原酶(AFAR)、GST、环氧化脱氢酶活性及p53、c-myc、c-H-ras基因等异常表达均关系密切,奥替普拉通过使GST mRNA稳定性增大和转录水平的效率增加而影响GST-π基因的表达调控[5]。我们曾用奥替普拉作用于导入了反义GST-π基因的转化Rat-1细胞,发现它能通过诱导某种蛋白质因子与DSE(一种基因调控元件)结合而影响c-fos基因表达,这种结合有一定特异性[6]。上述资料还难以揭示奥替普拉诱导肿瘤细胞凋亡的机制,我们推测,它可能作用于已经存在的蛋白,通过改变它们的稳定性或磷酸化状态来影响凋亡;它还可能通过负调节一些影响凋亡的转录因子而使细胞易于凋亡。
, 百拇医药
参考文献
1 Egner PA, Kensler TW, Prestera T, et al. Regulation of phase 2 enzyme induction by oltipraz and other dithiolethione. Carcinogenesis, 1994,15:177-181.
2 Rao CV, Rivenson A, Katiwalla M, et al. Chemopreventive effect of oltipraz during different stages of experimental colon carcinogenesis induced by azoxymethane in male F344 rats. Cancer Res, 1993;53:2502-2506.
3 Tormanen U, Erola AK, Rainnio P, et al. Enhanced apoptosis predicts shortened survival in non-small cell lung cardinoma. Cancer Res, 1995,55:5595-5602.
, 百拇医药
4 Ellis RE. Mechanisms and functions of cell death. Annu Rev Cell Biol, 1991,7:663-698.
5 Davidson NE, Egner PA, Kensler TW. Transcriptional control of glutathione S-transferase gene expression by the chemoprotective agent 5-(2-pyrazinyl)-4-methyl-1, 2-dithiole-3-thione(oltipraz) in rat liver. Cancer Res, 1990,50:2251-2255
6 柏华.人肺癌变早期阻断及其分子机制研究.生理科学进展,1998,29:235-238
收稿日期:1998-10-08 修回日期:1999-02-24, http://www.100md.com