采用灌流分离的成年大鼠心肌细胞作为心肌肥厚基因水平研究的材料*
作者:
单位:中国医学科学院 中国协和医科大学 阜外医院生化研究室(北京 100037)
关键词:
中国病理生理杂志991035 潘德思 田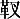 陈兰英
陈兰英
心肌肥厚是心血管疾病常见的临床症状,它与冠心病,心衰,脑卒中等疾病均密切相关,对其发生机制的探讨将为心肌肥厚及相关疾病的研究和治疗提供有益的线索。本实验以腹主动脉缩窄的左心室肥厚大鼠为模型,采用体外灌流分离心肌细胞,同时提取RNA并通过反转录来检查所得RNA的质量,并探讨其应用于心肌肥厚基因表达水平研究的可能性。
材料与方法
一、动物模型的建立:
, 百拇医药
压力负荷左心肥厚大鼠模型的建立采用常规的腹主动脉缩窄法[1]:雄性健康Wistar大鼠(体重180~220 g)分为两组,每组10只。模型组大鼠绑扎腹主动脉使其保留直径约0.7 mm的残腔,造成狭窄;假手术对照组除了不绑扎腹主动脉外其它操作步骤均同模型组。大鼠血压测量采用颈动脉插管法。实验取材时记录下每只动物的心重比(心脏重量与体重的比值,g/kg),以作比较和参考。
二、心脏离体灌流分离左心室心肌细胞:
离体灌流在手术后4周时进行,采用Langendorff恒流灌流装置[2]。大鼠处死前0.5 h腹腔注射肝素(3 000 U/kg体重),称量体重后麻醉,开胸取心脏,立即放入盛有预冷无钙灌流液的平皿中,经主动脉将心脏悬于灌流装置上行逆行恒温(37℃)恒流(蠕动泵维持5~6 mL/min)灌流。灌流液预先以纯氧饱和,灌流过程中同时通以纯氧,不同灌流液(溶液A,溶液B,溶液C)成份见文献[3]。灌流过程大致如下:先以溶液A灌流4~5 min使心脏停跳,再以溶液B循环灌流30 min左右,以心脏变软为度。弃除心房及其它血管组织,称重后将左心室剪成若干小块,置5 mL溶液C中,通氧并温和搅拌,水浴37℃,10 min后去上清,加5 mL溶液C继续消化,换新溶液,重复3次,去除未消化组织块,细胞悬液22×g(≈350 r/min)离心5 min,收集细胞沉淀,取少量细胞染色镜检。
, 百拇医药
三、RNA提取及cDNA反转录合成:
分离的心肌细胞立即进行RNA提取,mRNA分离及cDNA合成按试剂盒说明进行操作(Poly(A)Tract megnetic mRNA isolation system; Riboclone cDNA synthesis system; Promega)。cDNA合成后两端补平并加上接头(接头序列为:5’>CTCTTGCTTGAATTCGGACT<3';5'>AGTCCGAATTCAAGCAA<3'),以接头的一条链(5’>CTCTTGCTTGAATTCGGACT<3')作为引物进行PCR扩增。PCR条件为:95℃预变性2 min,然后进入循环扩增,95℃ 30s/50℃ 1 min/70℃ 1 min,共30个循环。作为比较另取部分新鲜的心肌组织按上述步骤进行同样的操作。
结果
(一)按本实验方法,腹主动脉缩窄大鼠和对照组大鼠在手术4周后的颈动脉血压分别为(20.66±0.67) kPa和(16.00±1.07) kPa(P<0.01),灌流后全心重量与体重的比值平均为(6.08±1.02) g/kg和(4.22±0.33) g/kg (P<0.05)。结合相关的文献经验,这种模型的建立方法是比较理想的。
, http://www.100md.com
(二)灌流分离的心肌细胞经伊红染色后镜检证实得到的细胞中绝大部分为心肌细胞(图1)。以1%台盼蓝染色检查细胞活性,在有效时间(3~5 min)内大部分细胞不着色或仅着浅色,计数统计其存活率为70%。
Fig 1 Perfusion isolated cardiomyocytes
The rod-shaped cells are cardiomyocytes ×250
图1 灌流分离的心肌细胞
(三) RNA提取后反转录合成cDNA,并进行电泳检查(图2)。结果显示从心肌细胞来源的RNA有清晰的18 s和28 s条带,其质量完全可以满足常规的分子生物学实验需要;与心肌组织来源的RNA相比仍有一定程度的降解,这与收集的细胞中还存在部分死细胞有关;但是从合成的cDNA来看,两者之间在产量及分子大小范围上没有明显差异。合成的cDNA分子大小介于3 kb至300 bp之间,大量的分子集中在500 bp左右。从提取的总RNA及反转录合成的cDNA以及随后对cDNA进行PCR扩增所得的产物进行分析,表明采用本实验方法得到的RNA完全可以用于分离的心肌细胞中基因表达水平的研究。
, http://www.100md.com
Fig 2 Electrophoresis of total RNA and reversal-transcripted cDNA
1:λDNA/HindⅢ marker; 2:Total RNA extracted from myocardium; 3: Synthesized cDNA from myocardium after PCR; 4:Synthesized cDNA from perfusion isolated cardiomyocytes after PCR;5:Total RNA extracted from perfusion isolated cardiomyocytes
图2 RNA及反转录合成的cDNA的电泳图(0.8%琼脂糖凝胶)
讨论
当前有关重大疾病相关基因的分离是医学分子生物学研究的热点之一,心肌肥厚作为重要的心血管疾病临床症状亦受到格外关注。研究疾病发生的分子机制首先需要有合适的实验材料,目前研究心肌肥厚所用的材料大多为心肌组织或培养的乳鼠心肌细胞,在心肌组织中心肌细胞仅占其细胞总数的25%,考虑到心肌肥厚发生过程中各种因素作用的复杂性,为研究其中心肌细胞所发生的变化,本实验采用从动物模型中灌流分离心肌细胞有其特殊的意义:首先它来源于模型动物,能较真实地反映心肌细胞在体内受到的各种刺激,而在体外培养的心肌细胞所受的外界刺激并不能完全模拟体内的情况;其次采用灌流分离的心肌细胞避免了其它类型的细胞如成纤维细胞或内皮细胞对实验结果的干扰,使结果分析简单化。通过本实验表明采用灌流分离的心肌细胞其纯度和存活率完全可以满足实验设计要求,所提取的RNA质量适用于大多数分子生物学研究。但是需要注意的是灌流分离操作应尽可能快地完成,因为灌流过程多少会改变心肌细胞最初在体内所维持的生理状况,而且时间越长其变化的程度越高,这种变化对于以研究细胞内基因表达水平的变化为目的的各种实验的结果无疑会产生一些影响,同时也将影响到所提取的RNA的产量和质量。在本实验中,灌流分离的过程大约为1小时,短于绝大多数RNA降解的半衰期[4],细胞的存活率为70%,应该说这样短时间的处理过程不会影响最后结果的可靠性。利用灌流分离的心肌细胞作为研究心肌肥厚中心肌细胞基因表达水平的变化的实验材料是一种新的尝试,还需要进一步的实验检验和完善。
, http://www.100md.com
* 国家自然科学基金资助(No.39670299)
参考文献
1 Wiesner RJ, Ehmke H, Faulhaber J, et al.l Dissociation of left ventricular hypertrophy, β-myosin heavy chain gene expression, and myosin isoform switch in rats after asending aortic stenosis. J Mol Cell Cardiol, 1997, 95:1253.
2 Farmer BB, Mancina M, Williams ES, et al. Isolation of calcium tolerant myocytes form adult rat hearts: review of the literature and discription of a method. Life Sci, 1983, 33(1):1.
, 百拇医药
3 Powell T, Twist VW. A rapid technique for the isolation and purification of adult cardiac muscle cells having respiratory control and a tolerance to calcium. Biochem Biophys Res Commun, 1976, 72(1):327.
4 孙乃恩,孙东旭,朱德煦.翻译水平的调控-mRNA的稳定性.见:孙乃恩,孙东旭,朱德煦,编著.《分子遗传学》第1版.南京:南京大学出版社,1990. 368~369.
(1998年10月20日收稿,1999年3月19日修回), 百拇医药
单位:中国医学科学院 中国协和医科大学 阜外医院生化研究室(北京 100037)
关键词:
中国病理生理杂志991035 潘德思 田
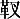 陈兰英
陈兰英心肌肥厚是心血管疾病常见的临床症状,它与冠心病,心衰,脑卒中等疾病均密切相关,对其发生机制的探讨将为心肌肥厚及相关疾病的研究和治疗提供有益的线索。本实验以腹主动脉缩窄的左心室肥厚大鼠为模型,采用体外灌流分离心肌细胞,同时提取RNA并通过反转录来检查所得RNA的质量,并探讨其应用于心肌肥厚基因表达水平研究的可能性。
材料与方法
一、动物模型的建立:
, 百拇医药
压力负荷左心肥厚大鼠模型的建立采用常规的腹主动脉缩窄法[1]:雄性健康Wistar大鼠(体重180~220 g)分为两组,每组10只。模型组大鼠绑扎腹主动脉使其保留直径约0.7 mm的残腔,造成狭窄;假手术对照组除了不绑扎腹主动脉外其它操作步骤均同模型组。大鼠血压测量采用颈动脉插管法。实验取材时记录下每只动物的心重比(心脏重量与体重的比值,g/kg),以作比较和参考。
二、心脏离体灌流分离左心室心肌细胞:
离体灌流在手术后4周时进行,采用Langendorff恒流灌流装置[2]。大鼠处死前0.5 h腹腔注射肝素(3 000 U/kg体重),称量体重后麻醉,开胸取心脏,立即放入盛有预冷无钙灌流液的平皿中,经主动脉将心脏悬于灌流装置上行逆行恒温(37℃)恒流(蠕动泵维持5~6 mL/min)灌流。灌流液预先以纯氧饱和,灌流过程中同时通以纯氧,不同灌流液(溶液A,溶液B,溶液C)成份见文献[3]。灌流过程大致如下:先以溶液A灌流4~5 min使心脏停跳,再以溶液B循环灌流30 min左右,以心脏变软为度。弃除心房及其它血管组织,称重后将左心室剪成若干小块,置5 mL溶液C中,通氧并温和搅拌,水浴37℃,10 min后去上清,加5 mL溶液C继续消化,换新溶液,重复3次,去除未消化组织块,细胞悬液22×g(≈350 r/min)离心5 min,收集细胞沉淀,取少量细胞染色镜检。
, 百拇医药
三、RNA提取及cDNA反转录合成:
分离的心肌细胞立即进行RNA提取,mRNA分离及cDNA合成按试剂盒说明进行操作(Poly(A)Tract megnetic mRNA isolation system; Riboclone cDNA synthesis system; Promega)。cDNA合成后两端补平并加上接头(接头序列为:5’>CTCTTGCTTGAATTCGGACT<3';5'>AGTCCGAATTCAAGCAA<3'),以接头的一条链(5’>CTCTTGCTTGAATTCGGACT<3')作为引物进行PCR扩增。PCR条件为:95℃预变性2 min,然后进入循环扩增,95℃ 30s/50℃ 1 min/70℃ 1 min,共30个循环。作为比较另取部分新鲜的心肌组织按上述步骤进行同样的操作。
结果
(一)按本实验方法,腹主动脉缩窄大鼠和对照组大鼠在手术4周后的颈动脉血压分别为(20.66±0.67) kPa和(16.00±1.07) kPa(P<0.01),灌流后全心重量与体重的比值平均为(6.08±1.02) g/kg和(4.22±0.33) g/kg (P<0.05)。结合相关的文献经验,这种模型的建立方法是比较理想的。
, http://www.100md.com
(二)灌流分离的心肌细胞经伊红染色后镜检证实得到的细胞中绝大部分为心肌细胞(图1)。以1%台盼蓝染色检查细胞活性,在有效时间(3~5 min)内大部分细胞不着色或仅着浅色,计数统计其存活率为70%。

Fig 1 Perfusion isolated cardiomyocytes
The rod-shaped cells are cardiomyocytes ×250
图1 灌流分离的心肌细胞
(三) RNA提取后反转录合成cDNA,并进行电泳检查(图2)。结果显示从心肌细胞来源的RNA有清晰的18 s和28 s条带,其质量完全可以满足常规的分子生物学实验需要;与心肌组织来源的RNA相比仍有一定程度的降解,这与收集的细胞中还存在部分死细胞有关;但是从合成的cDNA来看,两者之间在产量及分子大小范围上没有明显差异。合成的cDNA分子大小介于3 kb至300 bp之间,大量的分子集中在500 bp左右。从提取的总RNA及反转录合成的cDNA以及随后对cDNA进行PCR扩增所得的产物进行分析,表明采用本实验方法得到的RNA完全可以用于分离的心肌细胞中基因表达水平的研究。

, http://www.100md.com
Fig 2 Electrophoresis of total RNA and reversal-transcripted cDNA
1:λDNA/HindⅢ marker; 2:Total RNA extracted from myocardium; 3: Synthesized cDNA from myocardium after PCR; 4:Synthesized cDNA from perfusion isolated cardiomyocytes after PCR;5:Total RNA extracted from perfusion isolated cardiomyocytes
图2 RNA及反转录合成的cDNA的电泳图(0.8%琼脂糖凝胶)
讨论
当前有关重大疾病相关基因的分离是医学分子生物学研究的热点之一,心肌肥厚作为重要的心血管疾病临床症状亦受到格外关注。研究疾病发生的分子机制首先需要有合适的实验材料,目前研究心肌肥厚所用的材料大多为心肌组织或培养的乳鼠心肌细胞,在心肌组织中心肌细胞仅占其细胞总数的25%,考虑到心肌肥厚发生过程中各种因素作用的复杂性,为研究其中心肌细胞所发生的变化,本实验采用从动物模型中灌流分离心肌细胞有其特殊的意义:首先它来源于模型动物,能较真实地反映心肌细胞在体内受到的各种刺激,而在体外培养的心肌细胞所受的外界刺激并不能完全模拟体内的情况;其次采用灌流分离的心肌细胞避免了其它类型的细胞如成纤维细胞或内皮细胞对实验结果的干扰,使结果分析简单化。通过本实验表明采用灌流分离的心肌细胞其纯度和存活率完全可以满足实验设计要求,所提取的RNA质量适用于大多数分子生物学研究。但是需要注意的是灌流分离操作应尽可能快地完成,因为灌流过程多少会改变心肌细胞最初在体内所维持的生理状况,而且时间越长其变化的程度越高,这种变化对于以研究细胞内基因表达水平的变化为目的的各种实验的结果无疑会产生一些影响,同时也将影响到所提取的RNA的产量和质量。在本实验中,灌流分离的过程大约为1小时,短于绝大多数RNA降解的半衰期[4],细胞的存活率为70%,应该说这样短时间的处理过程不会影响最后结果的可靠性。利用灌流分离的心肌细胞作为研究心肌肥厚中心肌细胞基因表达水平的变化的实验材料是一种新的尝试,还需要进一步的实验检验和完善。
, http://www.100md.com
* 国家自然科学基金资助(No.39670299)
参考文献
1 Wiesner RJ, Ehmke H, Faulhaber J, et al.l Dissociation of left ventricular hypertrophy, β-myosin heavy chain gene expression, and myosin isoform switch in rats after asending aortic stenosis. J Mol Cell Cardiol, 1997, 95:1253.
2 Farmer BB, Mancina M, Williams ES, et al. Isolation of calcium tolerant myocytes form adult rat hearts: review of the literature and discription of a method. Life Sci, 1983, 33(1):1.
, 百拇医药
3 Powell T, Twist VW. A rapid technique for the isolation and purification of adult cardiac muscle cells having respiratory control and a tolerance to calcium. Biochem Biophys Res Commun, 1976, 72(1):327.
4 孙乃恩,孙东旭,朱德煦.翻译水平的调控-mRNA的稳定性.见:孙乃恩,孙东旭,朱德煦,编著.《分子遗传学》第1版.南京:南京大学出版社,1990. 368~369.
(1998年10月20日收稿,1999年3月19日修回), 百拇医药