变形链球菌表面蛋白真核表达载体pcDNA3-Pac的构建Ⅱ.玻璃纤维质粒分离纯化层析柱重复利用有效性的验证
作者:刘建国 刘天佳 谭红 周学东 黄晓晶 郭丽宏
单位:610041 华西医科大学口腔医学院
关键词:柱层析法;质粒DNA;分离与纯化
华西口腔学杂志990422 摘要 目的:寻找一种成本较低又可获得较高纯度质粒DNA的方法。方法:根据玻璃纤维质粒纯化层析柱分离纯化核酸的原理,对其使用方法进行改进。使一次性使用的玻璃纤维层析柱能够重复使用。利用分光光度法测定12次重复使用获得的质粒DNA浓度和纯度。进一步利用酶切实验、体外连接和转化实验对重复使用玻璃纤维层析柱获取的质粒DNA进行检测。结果:重复使用玻璃纤维层析柱12次获得的质粒DNA在浓度和纯度上均无明显差异(P>0.05),并且均能被内切酶充分酶切,重新连接后能够很好地被转化。结论:重复使用玻璃纤维层析柱分离纯化质粒DNA的方法能制备出大量高纯度的质粒DNA,不影响质粒的酶切、体外连接和转化,大大降低了成本,在分子克隆和基因免疫研究中具有一定意义。
, 百拇医药
Construction of Streptococcu s mu tans Surface Protein Antigen Eukaryotic Expression Vector pcDNA3-PAcⅡ.Testified Efficiency of Repeated Using Glass Fiber Chromatographic Column
Liu Jianguo, Liu Tianjia, Tan Hong,et al
College of Stomatology, West China University of Medical Sciences
Abstract
Objective: To explore one method getting highly purified plasmid DNA and costing low.Methods: According to principle of extraction and purification plasmid DNA of glass fiber chromatographic column, its operation sequence was improved so that disposable glass fiber chromatographic column could be used repeatedly. The concentration and purity of plasmid DNA obtained by 12 times repeated using glass fiber chromatographic column were determined by spectrophotometry. Moreover, Those plasmid DNA obtained were tested by restriction enzyme and agarose gel electrophoresis, Ligation in vitro and transformation test. Results: 12 times repeated use of glass fiber chromatographic column made no significant difference to the concentration and purity of obtained plasmid DNA(P>0.05), and plasmid DNA was completely digested by restriction enzyme. The digested fragments were well ligated together by the action of T4 DNA Ligase in ATP ligating buffer in vitro and ligated DNA was well transformed into E.coli. Conclusion: Repeated use glass fiber chromatographic column can obtain a lot of highly purified plasmid DNA and cost is low. Digestion, ligation and transformation of those plasmid DNA are not affected. The results may be significant in molecular cloning and study of gene vaccination.
, 百拇医药
Key words: column chromatography plasmid DNA extraction and purification
分离纯化质粒DNA的方法较多,各有其优缺点。在转基因动物、真核细胞转染及DNA外切酶删切缺失等实验,对闭合环状双链DNA的要求较高[1]。一般需采用成本较高的氯化铯-溴化乙锭梯度平衡超速离心法或柱层析洗脱法。为了获取基因免疫所需的高纯度质粒DNA,本实验根据玻璃纤维质粒纯化层析柱分离纯化核酸的原理,对层析柱的使用方法进行改进,力图找到一种成本较低又可获取较高纯度质粒DNA的方法。
1 材料和方法
1.1 菌种
E.coli HB101(含质粒 RSV-BL)(华西医科大学微生物学教研室贾文祥教授提供),E.coli XL-1 blue(四川大学生命学院分子生物学实验中心张义正教授提供)。
, 百拇医药
1.2 试剂
悬浮缓冲液(suspension buffer),裂解缓冲液(lysis buffer),连接缓冲液(binding buffer),清洗缓冲液Ⅰ(wash buffer Ⅰ),清洗缓冲液Ⅱ,Tris/EDTA(TE)缓冲液,TB缓冲液。RNase A,玻璃纤维质粒分离纯化层析柱和收集管,限制性内切酶EcoRI,T4 DNA连接酶和连接缓冲液(以上试剂均购于德国BM公司)。其余试剂为国产分析纯级(AR)产品。
1.3 质粒RSV-BL的分离纯化
参照文献[2,3]和产品说明书按如下步骤进行:①将甘油保存的菌种HB101(含质粒 RSV-BL)接种于3 ml含100 μg/ml氨苄青霉素的Luria-Bertani(LB)培养基中,37℃振荡过夜,取1 ml菌液转种于30 ml含相同抗生素的LB培养基中, 37℃剧烈振荡培养至A600=1.5~2.0;②取1.5 ml菌液分别装入12只Eppendorf(EP)管中(编号1~12)离心(5000 g×5 min),弃上清、控干;③每管加250 μl含0.1 mg/ml(w/v)RNase A的悬浮缓冲液,在振荡器上振荡10~20 s使菌体均匀分布。④每管加250 μl裂解缓冲液,倒置数次混匀,室温下放置4~5 min。⑤每管加350 μl预冷的连接缓冲液,倒置数次混匀,冰浴5 min后离心(13000 g×10 min)。⑥将玻璃纤维质粒分离纯化层析柱与收集管连接好后将1号管内的上清转移至层析管中,离心(13000g×1 min);⑦加500 μl清洗缓冲液Ⅰ,离心(13000g×1 min),700 μl清洗缓冲液Ⅱ,离心(13000g×1 min);⑧将层析管插入干净的EP管中,加100 μl TE缓冲液离心(13000g×1 min),EP管内的液体即为纯化的核酸样品;⑨将2~12号管内上清使用同一个层析柱按步骤⑥⑦⑧重复。每次加样前用TE缓冲液洗柱2次。将所得核酸样品编号1~12号。
, 百拇医药
1.4 纯度、浓度测定
将各样品在紫外分光光度计上测A260值,计算各管内DNA的量。采用多样本均数间的方差分析(F检验)比较12次重复抽提质粒DNA的浓度差异。测A280值,计算A260/A280比值,判断其纯度。
1.5 酶切分析[5]
每个样品各取2 μl,加16 μl双蒸水,2 μl 10倍酶切缓冲液和2 μl(10 u/μl)的EcoRI内切酶,37℃温育2 h,反应液在65℃温育10 min灭活内切酶终止反应。各取10 μl电泳。照相记录结果。
1.6 连接、转化实验
1.6.1 酶切RSV-BL片段的再连接[4] 取9 μl酶切反应液,加10 μl T4 DNA连接缓冲液,充分混匀后加1 μl T4 DNA连接酶,16℃反应12 h。
, 百拇医药
1.6.2 感受态细胞的制备[5,6] 取甘油保种的大肠杆菌XL-1 blue接种于2 ml SOC培养基中,37℃,过夜培养,取0.5 ml过夜培养菌液转种于50 ml SOB培养基,18℃剧烈振荡培养至A600=0.6。将菌液冰浴10 min后转入50 ml离心管,离心(3500 g×5 min,4℃),用16 ml冰TB缓冲液悬浮沉淀细胞,再次冰浴10 min,离心(5000 g×5 min),沉淀用4 ml含7%二甲基亚枫(dimethylsulfoxide,DMSO)的TB缓冲液悬浮,冰浴10 min,分装至EP管中(每管0.5~1 ml),迅速放入液氮中速冻,保存。
1.6.3 转化[5,6] 从液氮中取1管大肠杆菌XL-1 blue感受态细胞于室温下解冻分装至新的EP管中(200 μl/管),取2 μl连接反应液与之混匀,冰浴30 min,42℃热冲击30 s后迅速放置于冰上,加 0.8 ml SOC充分混匀,37℃剧烈振摇培养1 h后,取出液体涂布含100 μg/ml氨苄青霉素的SOB琼脂平板。30℃过夜培养。随机挑取数个菌落按前述方法抽提质粒并电泳。
, 百拇医药
2 结 果
2.1 质粒RSV-BL的浓度和纯度
12次抽提纯化获得的质粒RSV-BL A260值、 A260/A280比值及浓度见图1和表1。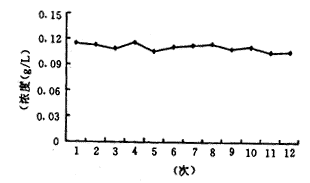
图1 质粒RSV-BL浓度测定曲线
2.2 RSV-BL酶切检测
RSV-BL为双链环状闭合分子,大小为4.4 kb。分子中存在两个EcoRI酶切位点,酶切后可获得 1.4 kb和 3.0 kb两个大小的片段(图 2)。
, http://www.100md.com
图2 质粒RSV-BL酶切分析
M:λDNA3/HinD酶切Ⅲ,1:质粒RSV-BL,2~11:代表1~10次抽提样品经EcoRⅠ酶切
2.3 连接、转化检测
经EcoRI酶切的RSV-BL在T4 DNA连接酶作用下重新连接呈闭合环形双链DNA和少量线性双链DNA,转化大肠杆菌XL-1 blue后,从克隆中抽提到质粒RSV(图3)。
图3 质粒RSV-BL电泳图
M:λDNA3/HinD酶切Ⅲ,1~11:代表1~11次抽提样品
表1 12次抽提质粒RSV-BL的浓度与纯度测定 序号
, 百拇医药
A260均值
A260/A280比值
浓度(g/L)
1
0.1741
2.6
0.1149
2
0.1709
2.6
0.1128
3
, http://www.100md.com
0.1644
2.0
0.1085
4
0.1762
2.5
0.1163
5
0.1598
2.6
0.1055
6
0.1683
, http://www.100md.com
2.4
0.1111
7
0.1711
2.3
0.1129
8
0.1736
2.5
0.1146
9
0.1652
2.1
, http://www.100md.com
0.1090
10
0.1689
2.1
0.1115
11
0.1586
2.2
0.1047
12
0.1601
2.3
0.1057
, 百拇医药
P>0.053 讨 论
分离纯化质粒的方法主要有聚乙二醇沉淀法[3]、柱层析法[2,3]、透析袋电洗脱法[1]、低溶点胶回收法[7]、氯化铯-溴乙锭超速离心法[1,3]。聚乙二醇沉淀法较费时,透析袋洗脱法、低溶点胶回收法受电泳限制,不便大量纯化DNA。这3种方法在纯化过程中均使用酚、氯仿等有机溶剂,在操作时,如果经验欠缺或吸上清时不细心,容易混杂残余的酚等溶剂在样品中,从而影响下一步的克隆等工作。氯化铯-溴乙锭超速离心法需要超速冷冻离心机,纯化的样品需要去除溴化乙锭,虽然可获得较纯的核酸溶液,但成本较高。柱层析洗脱法是近十年来迅速发展起来的有效替代氯化铯-溴乙锭超速离心法的方法,根据层析柱中充填的材料不同,又分为Sepharose 4B柱层析法、生物凝胶A-150柱层析法、玻璃纤维柱层析法。虽然层析柱的制备使质粒纯化的成本较高,但该法避免了使用酚等溶剂,不需要从样品中去除溴化乙锭,短时间内可获得高纯度的核酸溶液。
, 百拇医药
玻璃纤维柱层析法分离纯化质粒DNA的原理是:用碱裂解法将质粒从细菌细胞中分离出来后(同时用RNaseA破坏细菌RNA),用带有离液序列高的阴离子(chaotrophic anions)的盐类(如盐酸胍)调整己裂解的反应液为高盐结合状态(high salt binding condition),通过离心去除染色体DNA和细胞残余。由于存在离液序列高的阴离子,上清中的质粒DNA在通过玻璃纤维层析柱时能特异性地结合到羊毛绒状的玻璃纤维上,而且,这种结合在水分子有序结构的分解和核酸分子间的相互作用下几秒钟内就可以完成。未能结合的蛋白质、盐等成分通过离心被去除掉。最后用低盐缓冲液或水将结合在玻璃纤维上的DNA洗脱下来[2,8]。
核酸的分离纯化要求保证被分离纯化的DNA具有完整的一级结构,无其它分子污染。即需要去除掉对酶有抑制作用的有机溶剂、高浓度的金属离子、生物大分子(如蛋白质、脂类等)和其它核酸分子(如RNA)。不同的实验对核酸纯度的要求不同,对用于真核转染和转基因动物的质粒纯度要求极高。获得高纯度的质粒DNA对基因免疫具有重要意义。
, 百拇医药
本实验重复使用玻璃纤维层析柱12次抽提质粒,获得的质粒在浓度和纯度上均无明显差异,并且均能被内切酶充分酶切,重新连接后能较好地被转化。结果表明,玻璃纤维层析柱能够多次重复使用。成品质粒纯化试剂盒和厂商出售的玻璃纤维层析柱为一次性用品而且较贵,对需要大量高纯度质粒DNA做基因免疫的研究者来说,使用上受到一定的限制。多次重复使用玻璃纤维层析柱,能有效地降低成本,充分合理地利用课题经费。
重复使用玻璃纤维层析柱需要注意以下几点:①每次用于抽提质粒的菌液量勿过大。成品出售的该类产品每个能吸附15μg左右的核酸,使用菌液量在2 ml左右。②建议使用分析纯级试剂配制溶液。③重复使用层析柱前,应用TE缓冲液充分洗柱2~3次。④重复抽提的质粒应为同一质粒,以避免混杂其它DNA。
本课题为国家自然科学基金资助项目(编号 39770797)
(本文图2,3见中心插页16)
, 百拇医药
4 参考文献
1 卢圣栋主编.现代分子生物学实验技术.北京:高等教育出版社,1993:105~106
2 Chen CW, Thomas LA. Recovery of DNA segments from agarose gels.Anal Biochem, 1980,101(6):339~341
3 Sambrook J,Fritsch EF, Maniatis T Molecular Cloning:A Laboratory Manual. 2nd ed, New York:Cold Spring Harbor Laboratory Press,1989:21(PartⅠ)
4 姜 泊,张亚历,周殿云主编.分子生物学常用实验方法.北京:人民军医出版社,1996:12~18
, 百拇医药
5 Inoue H, Nojima H, Okayama M. High efficiency transformation of Escherichia coli with plasmids. Gene, 1990,86(1):23~28
6 Hanahan D. Studies on transformation of Escherichia coli with plasmid. J Mol Biol, 1983, 166(8):495~509
7 Wieslander LA. Simple method to recover intact high molecular weight RNA and DNA after electrophoretic separation in low gelling temperature agarose gels. Anal Biochem, 1979,98(3):305~309
8 Vogelstein B, Gillespie D. Preparative and analytical purification of DNA from agarose. Proc Natl Acad Sci USA, 1979,76(2):615~619
(1999-07-01收稿), 百拇医药
单位:610041 华西医科大学口腔医学院
关键词:柱层析法;质粒DNA;分离与纯化
华西口腔学杂志990422 摘要 目的:寻找一种成本较低又可获得较高纯度质粒DNA的方法。方法:根据玻璃纤维质粒纯化层析柱分离纯化核酸的原理,对其使用方法进行改进。使一次性使用的玻璃纤维层析柱能够重复使用。利用分光光度法测定12次重复使用获得的质粒DNA浓度和纯度。进一步利用酶切实验、体外连接和转化实验对重复使用玻璃纤维层析柱获取的质粒DNA进行检测。结果:重复使用玻璃纤维层析柱12次获得的质粒DNA在浓度和纯度上均无明显差异(P>0.05),并且均能被内切酶充分酶切,重新连接后能够很好地被转化。结论:重复使用玻璃纤维层析柱分离纯化质粒DNA的方法能制备出大量高纯度的质粒DNA,不影响质粒的酶切、体外连接和转化,大大降低了成本,在分子克隆和基因免疫研究中具有一定意义。
, 百拇医药
Construction of Streptococcu s mu tans Surface Protein Antigen Eukaryotic Expression Vector pcDNA3-PAcⅡ.Testified Efficiency of Repeated Using Glass Fiber Chromatographic Column
Liu Jianguo, Liu Tianjia, Tan Hong,et al
College of Stomatology, West China University of Medical Sciences
Abstract
Objective: To explore one method getting highly purified plasmid DNA and costing low.Methods: According to principle of extraction and purification plasmid DNA of glass fiber chromatographic column, its operation sequence was improved so that disposable glass fiber chromatographic column could be used repeatedly. The concentration and purity of plasmid DNA obtained by 12 times repeated using glass fiber chromatographic column were determined by spectrophotometry. Moreover, Those plasmid DNA obtained were tested by restriction enzyme and agarose gel electrophoresis, Ligation in vitro and transformation test. Results: 12 times repeated use of glass fiber chromatographic column made no significant difference to the concentration and purity of obtained plasmid DNA(P>0.05), and plasmid DNA was completely digested by restriction enzyme. The digested fragments were well ligated together by the action of T4 DNA Ligase in ATP ligating buffer in vitro and ligated DNA was well transformed into E.coli. Conclusion: Repeated use glass fiber chromatographic column can obtain a lot of highly purified plasmid DNA and cost is low. Digestion, ligation and transformation of those plasmid DNA are not affected. The results may be significant in molecular cloning and study of gene vaccination.
, 百拇医药
Key words: column chromatography plasmid DNA extraction and purification
分离纯化质粒DNA的方法较多,各有其优缺点。在转基因动物、真核细胞转染及DNA外切酶删切缺失等实验,对闭合环状双链DNA的要求较高[1]。一般需采用成本较高的氯化铯-溴化乙锭梯度平衡超速离心法或柱层析洗脱法。为了获取基因免疫所需的高纯度质粒DNA,本实验根据玻璃纤维质粒纯化层析柱分离纯化核酸的原理,对层析柱的使用方法进行改进,力图找到一种成本较低又可获取较高纯度质粒DNA的方法。
1 材料和方法
1.1 菌种
E.coli HB101(含质粒 RSV-BL)(华西医科大学微生物学教研室贾文祥教授提供),E.coli XL-1 blue(四川大学生命学院分子生物学实验中心张义正教授提供)。
, 百拇医药
1.2 试剂
悬浮缓冲液(suspension buffer),裂解缓冲液(lysis buffer),连接缓冲液(binding buffer),清洗缓冲液Ⅰ(wash buffer Ⅰ),清洗缓冲液Ⅱ,Tris/EDTA(TE)缓冲液,TB缓冲液。RNase A,玻璃纤维质粒分离纯化层析柱和收集管,限制性内切酶EcoRI,T4 DNA连接酶和连接缓冲液(以上试剂均购于德国BM公司)。其余试剂为国产分析纯级(AR)产品。
1.3 质粒RSV-BL的分离纯化
参照文献[2,3]和产品说明书按如下步骤进行:①将甘油保存的菌种HB101(含质粒 RSV-BL)接种于3 ml含100 μg/ml氨苄青霉素的Luria-Bertani(LB)培养基中,37℃振荡过夜,取1 ml菌液转种于30 ml含相同抗生素的LB培养基中, 37℃剧烈振荡培养至A600=1.5~2.0;②取1.5 ml菌液分别装入12只Eppendorf(EP)管中(编号1~12)离心(5000 g×5 min),弃上清、控干;③每管加250 μl含0.1 mg/ml(w/v)RNase A的悬浮缓冲液,在振荡器上振荡10~20 s使菌体均匀分布。④每管加250 μl裂解缓冲液,倒置数次混匀,室温下放置4~5 min。⑤每管加350 μl预冷的连接缓冲液,倒置数次混匀,冰浴5 min后离心(13000 g×10 min)。⑥将玻璃纤维质粒分离纯化层析柱与收集管连接好后将1号管内的上清转移至层析管中,离心(13000g×1 min);⑦加500 μl清洗缓冲液Ⅰ,离心(13000g×1 min),700 μl清洗缓冲液Ⅱ,离心(13000g×1 min);⑧将层析管插入干净的EP管中,加100 μl TE缓冲液离心(13000g×1 min),EP管内的液体即为纯化的核酸样品;⑨将2~12号管内上清使用同一个层析柱按步骤⑥⑦⑧重复。每次加样前用TE缓冲液洗柱2次。将所得核酸样品编号1~12号。
, 百拇医药
1.4 纯度、浓度测定
将各样品在紫外分光光度计上测A260值,计算各管内DNA的量。采用多样本均数间的方差分析(F检验)比较12次重复抽提质粒DNA的浓度差异。测A280值,计算A260/A280比值,判断其纯度。
1.5 酶切分析[5]
每个样品各取2 μl,加16 μl双蒸水,2 μl 10倍酶切缓冲液和2 μl(10 u/μl)的EcoRI内切酶,37℃温育2 h,反应液在65℃温育10 min灭活内切酶终止反应。各取10 μl电泳。照相记录结果。
1.6 连接、转化实验
1.6.1 酶切RSV-BL片段的再连接[4] 取9 μl酶切反应液,加10 μl T4 DNA连接缓冲液,充分混匀后加1 μl T4 DNA连接酶,16℃反应12 h。
, 百拇医药
1.6.2 感受态细胞的制备[5,6] 取甘油保种的大肠杆菌XL-1 blue接种于2 ml SOC培养基中,37℃,过夜培养,取0.5 ml过夜培养菌液转种于50 ml SOB培养基,18℃剧烈振荡培养至A600=0.6。将菌液冰浴10 min后转入50 ml离心管,离心(3500 g×5 min,4℃),用16 ml冰TB缓冲液悬浮沉淀细胞,再次冰浴10 min,离心(5000 g×5 min),沉淀用4 ml含7%二甲基亚枫(dimethylsulfoxide,DMSO)的TB缓冲液悬浮,冰浴10 min,分装至EP管中(每管0.5~1 ml),迅速放入液氮中速冻,保存。
1.6.3 转化[5,6] 从液氮中取1管大肠杆菌XL-1 blue感受态细胞于室温下解冻分装至新的EP管中(200 μl/管),取2 μl连接反应液与之混匀,冰浴30 min,42℃热冲击30 s后迅速放置于冰上,加 0.8 ml SOC充分混匀,37℃剧烈振摇培养1 h后,取出液体涂布含100 μg/ml氨苄青霉素的SOB琼脂平板。30℃过夜培养。随机挑取数个菌落按前述方法抽提质粒并电泳。
, 百拇医药
2 结 果
2.1 质粒RSV-BL的浓度和纯度
12次抽提纯化获得的质粒RSV-BL A260值、 A260/A280比值及浓度见图1和表1。

图1 质粒RSV-BL浓度测定曲线
2.2 RSV-BL酶切检测
RSV-BL为双链环状闭合分子,大小为4.4 kb。分子中存在两个EcoRI酶切位点,酶切后可获得 1.4 kb和 3.0 kb两个大小的片段(图 2)。

, http://www.100md.com
图2 质粒RSV-BL酶切分析
M:λDNA3/HinD酶切Ⅲ,1:质粒RSV-BL,2~11:代表1~10次抽提样品经EcoRⅠ酶切
2.3 连接、转化检测
经EcoRI酶切的RSV-BL在T4 DNA连接酶作用下重新连接呈闭合环形双链DNA和少量线性双链DNA,转化大肠杆菌XL-1 blue后,从克隆中抽提到质粒RSV(图3)。

图3 质粒RSV-BL电泳图
M:λDNA3/HinD酶切Ⅲ,1~11:代表1~11次抽提样品
表1 12次抽提质粒RSV-BL的浓度与纯度测定 序号
, 百拇医药
A260均值
A260/A280比值
浓度(g/L)
1
0.1741
2.6
0.1149
2
0.1709
2.6
0.1128
3
, http://www.100md.com
0.1644
2.0
0.1085
4
0.1762
2.5
0.1163
5
0.1598
2.6
0.1055
6
0.1683
, http://www.100md.com
2.4
0.1111
7
0.1711
2.3
0.1129
8
0.1736
2.5
0.1146
9
0.1652
2.1
, http://www.100md.com
0.1090
10
0.1689
2.1
0.1115
11
0.1586
2.2
0.1047
12
0.1601
2.3
0.1057
, 百拇医药
P>0.053 讨 论
分离纯化质粒的方法主要有聚乙二醇沉淀法[3]、柱层析法[2,3]、透析袋电洗脱法[1]、低溶点胶回收法[7]、氯化铯-溴乙锭超速离心法[1,3]。聚乙二醇沉淀法较费时,透析袋洗脱法、低溶点胶回收法受电泳限制,不便大量纯化DNA。这3种方法在纯化过程中均使用酚、氯仿等有机溶剂,在操作时,如果经验欠缺或吸上清时不细心,容易混杂残余的酚等溶剂在样品中,从而影响下一步的克隆等工作。氯化铯-溴乙锭超速离心法需要超速冷冻离心机,纯化的样品需要去除溴化乙锭,虽然可获得较纯的核酸溶液,但成本较高。柱层析洗脱法是近十年来迅速发展起来的有效替代氯化铯-溴乙锭超速离心法的方法,根据层析柱中充填的材料不同,又分为Sepharose 4B柱层析法、生物凝胶A-150柱层析法、玻璃纤维柱层析法。虽然层析柱的制备使质粒纯化的成本较高,但该法避免了使用酚等溶剂,不需要从样品中去除溴化乙锭,短时间内可获得高纯度的核酸溶液。
, 百拇医药
玻璃纤维柱层析法分离纯化质粒DNA的原理是:用碱裂解法将质粒从细菌细胞中分离出来后(同时用RNaseA破坏细菌RNA),用带有离液序列高的阴离子(chaotrophic anions)的盐类(如盐酸胍)调整己裂解的反应液为高盐结合状态(high salt binding condition),通过离心去除染色体DNA和细胞残余。由于存在离液序列高的阴离子,上清中的质粒DNA在通过玻璃纤维层析柱时能特异性地结合到羊毛绒状的玻璃纤维上,而且,这种结合在水分子有序结构的分解和核酸分子间的相互作用下几秒钟内就可以完成。未能结合的蛋白质、盐等成分通过离心被去除掉。最后用低盐缓冲液或水将结合在玻璃纤维上的DNA洗脱下来[2,8]。
核酸的分离纯化要求保证被分离纯化的DNA具有完整的一级结构,无其它分子污染。即需要去除掉对酶有抑制作用的有机溶剂、高浓度的金属离子、生物大分子(如蛋白质、脂类等)和其它核酸分子(如RNA)。不同的实验对核酸纯度的要求不同,对用于真核转染和转基因动物的质粒纯度要求极高。获得高纯度的质粒DNA对基因免疫具有重要意义。
, 百拇医药
本实验重复使用玻璃纤维层析柱12次抽提质粒,获得的质粒在浓度和纯度上均无明显差异,并且均能被内切酶充分酶切,重新连接后能较好地被转化。结果表明,玻璃纤维层析柱能够多次重复使用。成品质粒纯化试剂盒和厂商出售的玻璃纤维层析柱为一次性用品而且较贵,对需要大量高纯度质粒DNA做基因免疫的研究者来说,使用上受到一定的限制。多次重复使用玻璃纤维层析柱,能有效地降低成本,充分合理地利用课题经费。
重复使用玻璃纤维层析柱需要注意以下几点:①每次用于抽提质粒的菌液量勿过大。成品出售的该类产品每个能吸附15μg左右的核酸,使用菌液量在2 ml左右。②建议使用分析纯级试剂配制溶液。③重复使用层析柱前,应用TE缓冲液充分洗柱2~3次。④重复抽提的质粒应为同一质粒,以避免混杂其它DNA。
本课题为国家自然科学基金资助项目(编号 39770797)
(本文图2,3见中心插页16)
, 百拇医药
4 参考文献
1 卢圣栋主编.现代分子生物学实验技术.北京:高等教育出版社,1993:105~106
2 Chen CW, Thomas LA. Recovery of DNA segments from agarose gels.Anal Biochem, 1980,101(6):339~341
3 Sambrook J,Fritsch EF, Maniatis T Molecular Cloning:A Laboratory Manual. 2nd ed, New York:Cold Spring Harbor Laboratory Press,1989:21(PartⅠ)
4 姜 泊,张亚历,周殿云主编.分子生物学常用实验方法.北京:人民军医出版社,1996:12~18
, 百拇医药
5 Inoue H, Nojima H, Okayama M. High efficiency transformation of Escherichia coli with plasmids. Gene, 1990,86(1):23~28
6 Hanahan D. Studies on transformation of Escherichia coli with plasmid. J Mol Biol, 1983, 166(8):495~509
7 Wieslander LA. Simple method to recover intact high molecular weight RNA and DNA after electrophoretic separation in low gelling temperature agarose gels. Anal Biochem, 1979,98(3):305~309
8 Vogelstein B, Gillespie D. Preparative and analytical purification of DNA from agarose. Proc Natl Acad Sci USA, 1979,76(2):615~619
(1999-07-01收稿), 百拇医药