重组腺病毒介导人野生型p53,GM-CSF和B7-1基因对肿瘤化疗耐药细胞生物学行为的影响
作者:范国昌 吴祖泽 王艳飞 吴世凯 邱兆华
单位:范国昌 吴祖泽 王艳飞 邱兆华(军事医学科学院放射医学研究所三室,);吴世凯(附属医院肿瘤科,北京100850)
关键词:肿瘤基因治疗;多药耐药;腺病毒载体
癌症000103 摘 要:目的:探讨重组腺病毒介导人野生型p53,GM-CSF和B7-1基因对肿瘤化疗耐药细胞生物学行为的影响,为临床使用该重组腺病毒治疗多药耐药的肿瘤提供实验基础。方法:选用p53异常的KB-s(VCR敏感)和KB-v200(VCR耐药)细胞作为肿瘤化疗药物敏感和耐药的模式细胞,感染携带人野生型p53,GM-CSF和B7-1基因的重组腺病毒后,观察这两种转基因癌细胞的生物学行为(包括药物敏感性)的变化,结果:药物敏感和耐药细胞都对腺病毒易感,重组腺病毒携带的三个外源基因(p53、GM-CSF、B7-1基因)在两种细胞中都能得到有效表达,并且能抑制它们的生长及诱导其凋亡。耐药细胞KB-v200在转染该重组腺病毒48h后,其细胞膜上Pgp糖蛋白的泵出药物的功能却受到显著影响,表现为罗丹明123在其细胞内的积累增加。MTT的实验结果也显示出其对VCR药物敏感性的增加,裸鼠体内实验证实了感染上述重组腺病毒的KB-v200细胞的致瘤性降低,同时能增加对化疗药物VCR的敏感性。结论:实验研究结果提示,使用该重组腺病毒并结合化疗药物,对临床治疗多药耐药的肿瘤可能会更有效。
, 百拇医药
分类号:R735.5 文献标识码:A
文章编号:1000-467X(2000)01-0010-07
Effect of human wild-type p53, GM-CSF and B7-1 genes
on biological behavior of chemotherapy-resistant
tumor cells via recombinant adenovirus vector
FAN Guo-chang, WU Chu-tse* , WANG Yan-fei, et al.
Department of Experimental Hematology, Beijing Institute of
, 百拇医药
Radiation Medicine, Beijing 100850, P.R.China
Abstract:Objective:To explore the effect on biological behavior of chemotherapy-resistant tumor cells by human wild-type p53, GM-CSF and B7-1 genes mediated via recombinant adenovirus. Methods: p53-abnormal KB-v200 (VCR resistant) and KB-s (VCR sensitive) cell lines were used as model tumor cells, which are resistant and sensitive to chemotherapeutic drugs, respectively. After infected with recombinant adenovirus carrying human wild-type p53, GM-CSF and B7-1 genes, changes in biological behavior (including drug sensitivity) of these two kinds of gene-transduced cancer cells were observed.Results: Both of the cell lines were susceptible to adenovirus, all of the three exogenous genes (p53, GM-CSF and B7-1) could be effectively expressed in these cell lines. Their growth was suppressed, and apoptosis was induced. The drug-pumping-out function of Pgp glycoprotein on the cytomembrane of drug-resistant KB-v200 cells was markedly affected 48h after transfection of the recombinant adenovirus, as revealed by increase of the amount of rhodamine 123 accumulation in the cells. The MTT assay also indicated the reversal of their sensitivity to VCR drugs. In vivo experiment in nude mice demonstrated reduction of tumorigenicity of the KB-v200 cells or KB-s cells infected with the recombinant adenovirus, and increase of their sensitivity to VCR. Conclusion: These study results suggest that clinical application of this recombinant adenovirus carrying multiple genes in combination with chemotherapeutic agents might be more effective in treatment of tumors with MDR.
, http://www.100md.com
Key words: Tumor gene therapy; Multidrug resistance; Adenoviral vector ▲
在肿瘤的临床化疗过程中,肿瘤细胞耐药性的产生常常导致化疗的失败。最初对化疗敏感的细胞,多次接受同一种化疗药物后,往往会获得对多种抗癌药物的抗性[1]。目前已经阐明了一系列耐药机制,其中一种是与mdr1基因的表达产物——170kDa,Pgp(P-glycoprotein)糖蛋白上升有关[2,3]。近年来研究表明,p53基因在多种抗癌药物诱导的凋亡过程中起着十分重要的作用[4]。
腺病毒介导的基因治疗对于临床控制肿瘤的发生、发展和消退,提供了一种新的治疗手段[5,6]。本实验室构建了携带人野生型p53基因和肿瘤免疫相关基因GM-CSF、B7-1的重组腺病毒(命名为BB-102),并将其感染喉癌原代细胞,结果表明:腺病毒介导的人野生型p53基因能抑制喉癌细胞的增殖并诱导其凋亡;GM-CSF、B7-1基因可提高喉癌细胞的免疫原性,刺激自体肿瘤浸润淋巴细胞(TIL)增殖,而且体外能诱导自体外周血淋巴细胞生成肿瘤杀伤性的CTL[7]。显示出此重组腺病毒在肿瘤基因治疗中具有很好的应用前景。
, 百拇医药
本研究则选用p53异常的KB-s(VCR敏感)和KB-v200(VCR耐药)细胞作为肿瘤化疗药物敏感和耐药的模式细胞,观察腺病毒载体对这两种细胞的转染效率,及重组腺病毒介导的人野生型p53,GM-CSF和B7-1基因在这两种细胞中的表达情况,并进一步检测KB-v200细胞转染此重组腺病毒后,药物敏感性以及在裸鼠体内的致瘤性的变化,为基因治疗的临床应用提供此方面的实验依据。
1 材料与方法
1.1 细胞系
整合了人5型腺病毒E1区的人胚胎肾细胞293细胞系由美国百特医疗用品公司基因治疗部(GeneTherapyUnit,BaxterHealthcareCompany,USA)惠赠,在含10%小牛血清的高糖DMEM,37℃,5%CO2条件下培养。
p53异常的人KB-s(VCR敏感)和KB-v200(VCR耐药)细胞系由中国医学科学院肿瘤研究所惠赠。其培养液为含10%小牛血清的RPMI-1640,在37℃,5%CO2条件下培养。
, 百拇医药
1.2 重组腺病毒
携带绿色荧光蛋白基因的重组腺病毒(Ad-GFP),由美国百特医疗用品公司基因治疗部(GeneTherapyUnit,BaxterHealthcareCompany,USA)惠赠,;E1、E3区缺失的复制缺陷型Ad5重组腺病毒载体BB102含CMV启动子驱动的人野生型p53cDNA和人GM-CSFcDNA(两目的基因间由脑心肌炎病毒内部核糖体进入位点,EMC-IRES相连),以及SV40启动子驱动的人B7-1cDNA,由本实验室邱兆华博士构建[7]。
1.3 重组腺病毒的扩增,纯化和滴度测定
按文献报告方法进行[8]。
1.4 重组腺病毒介导p53,B7-1和GM-CSF基因在药物敏感和耐药细胞中的表达
, http://www.100md.com
1.4.1 腺病毒载体对药物敏感和耐药细胞的转染率:将人KB-s和KB-v200细胞种于6孔板,每孔为5×105细胞,12h后将培养液吸出,分别用0、12.5、25、50和100MOI的Ad-GFP(稀释于0.8ml培养液)感染细胞,1~2h后吸去病毒液,每孔加2ml培养液,12h后,在荧光显微镜下计数GFP表达阳性的细胞数,重复3次,计算转染率。
1.4.2 免疫组织化学方法检测BB-102介导的人野生型p53基因的表达:KB-s和KB-v200细胞分别以5×104细胞/孔的量接种于12孔培养板,每孔底部加一小块盖玻片,使细胞能够自然生长于玻片上,24h后分别以50MOI的BB-102和Ad-GFP感染细胞,48h后将玻片取出,以丙酮固定细胞,通过anti-human p53 monoclonal antibody Pab240(PharMingen)免疫组化法检测p53在细胞中的表达。
1.4.3 流式细胞分析检测BB-102介导的B7-1基因的表达:KB-s和KB-v200细胞以1×106细胞/皿的量分别接种于60mm平皿中,24h后以50MOI的BB-102感染细胞,48h后消化细胞,用Hanks液洗两遍,重悬于100×200μlHanks液中,加20μlFITC标记的鼠抗人B7-1单克隆抗体(PharMingen),4℃孵育30min,用Hanks液洗两遍,重悬于1mlHanks液中,通过流式细胞分析检测BB-102介导的B7-1基因在两种细胞膜上的表达。
, http://www.100md.com
1.4.4 ELISA检测BB-102介导的GM-CSF基因在两种细胞中的表达:KB-s和KB-v200细胞以5×105细胞/皿的量各自接种于60mm平皿中,24h后以50MOI的BB-102感染细胞,此后每24h收集上清,更换新鲜培养液,连续6天。GM-CSFELISAkit(Zymed)检测BB-102介导的GM-CSF在两种细胞中的表达。
1.4.5 BB-102介导的外源基因对药物敏感和耐药细胞生长的抑制作用:两种细胞以1×104细胞/孔的量接种于24孔培养板,24h后以50MOI的BB-102或Ad-GFP感染细胞,此后每天观察细胞生长状况,随后将细胞消化下来,经台盼蓝染色后计数活细胞,并绘制细胞生长曲线。
1.5 BB-102介导的外源基因对药物敏感和耐药细胞凋亡的诱导
采用末端转移标记检测DNA[9]。两种细胞以5×104细胞/孔的量接种于12孔培养板,每孔底部加一小块盖玻片,使细胞能够自然生长于玻片上,24h后分别以50MOI的BB-102或Ad-GFP分别感染细胞,72h后将玻片取出,以中性福尔马林固定细胞,通过3’末端标记法原位检测细胞凋亡(TdTFragELTM DNA Fragmentation Detection Kit,Oncogene)。
, http://www.100md.com
1.6 多药耐药性检测
1.6.1 MTT实验:按文献[10]描述的方法进行。
1.6.2 流式细胞仪测定药物在细胞中的积累[11]:罗丹明(Rhodamine123)荧光染料,能有效的被mdr1基因产物——Pgp糖蛋白排出细胞外。BB-102感染KB-v200细胞12h,24h和48h后,用0.25%胰蛋白酶消化后离心收集细胞,用无血清RPMI1640漂洗并调整细胞浓度为1×106/ml,然后通过1ml注射器以分散细胞,加入终浓度为2.5μg/ml的罗丹明,37℃孵育30min,1500rpm离心2min后,再用无血清RPMI1640漂洗细胞2次,37℃孵育10min后,再用培养液漂洗1次,加入终浓度为5μg/ml的异博定(isoptin)。
用流式细胞仪488nm的激发光,测试细胞荧光强度。
, http://www.100md.com
1.7 裸鼠致瘤性改变
雌性裸鼠,体重20~24g,4~6周龄,购自中国医学科学院实验动物中心。随机分组,每组10只,KB-v200和KB-s细胞接种于150mm2的培养瓶中,12h后分别感染50MOI的BB102,37℃,5%CO2培养24h后,用0.25%胰蛋白酶消化细胞,PBS洗细胞2次,用无血清RPMI1640调整细胞浓度为1.5×107/ml,每只裸鼠接种0.2ml于肩胛部皮下,5天后肿瘤长出,比绿豆略大。然后每组再分为两小组,每组5只,一组每天腹腔注射0.2mlVCR(5μg/ml),另一组注射0.2ml生理盐水。同时,每2天用游标卡尺测量肿瘤大小。计算方法:肿瘤体积[mm3]=(长径×宽径2)/2,13天后剥离肿瘤称重。
1.8 统计学处理
使用POMS统计软件分析结果。
, 百拇医药
2 结果
2.1 高滴度重组腺病毒的制备
经氯化铯密度梯度超速离心,获得高度浓缩的腺病毒带.根据1O.D.260=1.1×1012particles,计算所提病毒的浓度高于1012particles/ml,且纯度较高(O.D.260/O.D.280大于1.3).空斑实验确定其滴度分别为:BB-102:3×1010pfu/ml;AdGFP:4×1011pfu/ml.
2.2 腺病毒对药物敏感和耐药细胞具有较高感染效率
药物敏感和耐药细胞都对腺病毒载体易感,随着病毒量的加大,各自的转染率提高,当病毒量为50MOI时,转染率达90%以上(图1).当病毒量继续加大时,细胞生长会受到一定程度的抑制,且死亡细胞数也增多。

, http://www.100md.com
图1 感染50MOI重组腺病毒Ad-GFP48h后的KB-v200细胞和KB-s细胞。
A,B为荧光显微镜同一视野下的KB-v200细胞;C,D则为KB-s细胞。
2.3 腺病毒载体介导的三种外源基因在药物敏感和耐药细胞中的表达
免疫组化结果(图2)表明:BB-102所介导的p53在药物敏感和耐药细胞中均可表达。

图2 免疫组化检测重组腺病毒BB-102介导的p53在KB-v200细胞(A,B)
和KB-s(C,D)细胞中的表达。(A,C)感染Ad-GFP作为对照;(B,D)感染BB-102。
, 百拇医药
ELISA结果(图3)表明:以50MOI的BB-102感染KB-s和KB-v200细胞,1天后培养液中即可检测到较高水平的GM-CSF,2~3天时达高峰,随后呈下降趋势,直至6天后仍可检测到较高水平的GM-CSF。
图3 ELISA检测BB-102介导的GM-CSF在KB-s细胞和KB-v200细胞中的表达。
图中显示数值为三孔的平均值。
流式细胞分析结果表明(图4):没有感染重组腺病毒BB-102的KB-s和KB-v200细胞都不表达B7-1;当以50MOI的BB-102感染细胞时,2天后80%以上的细胞表面有较高水平的B7-1的表达。

, 百拇医药
图4 流式细胞仪测定BB-102介导的B7-1基因在KB-v200细胞和KB-s细胞中的表达。
2.4 腺病毒载体介导的外源基因抑制药物敏感和耐药细胞生长并对细胞产生杀伤作用与未感染病毒的细胞相比,以50MOIBB-102感染的KB-s和KB-v200细胞,其生长都受到明显抑制(图5),其中KB-s比KB-v200细胞更为明显,光镜下可见:第4天时,KB-s细胞间隙就逐渐加大,细胞变圆.KB-v200细胞则在第6天时才出现这种现象(图6)。而该剂量的对照病毒Ad-GFP则对细胞生长影响不大。

图5 重组腺病毒介导的外源基因对KB-v200细胞和KB-s细胞生长的影响。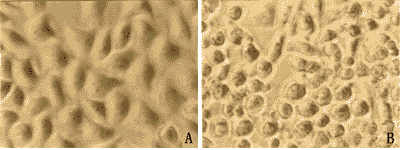

, 百拇医药
图6 重组腺病毒介导的外源基因对KB-v200细胞和KB-s细胞生长的抑制作用,图中显示感染重组腺病毒第6天的细胞形态。(A,C)AdGFP;(B,D)BB-102,(A,B)KB-v200细胞;(C,D)KB-s细胞。
2.5 腺病毒载体介导的外源基因可诱导药物敏感和耐药细胞发生凋亡
以50MOIBB-102和Ad-GFP感染KB-s和KB-v200细胞,72小时后固定细胞,以3'末端标记法原位检测细胞凋亡,结果如图7所示:感染BB-102细胞大量发生凋亡(呈棕色),而感染Ad-GFP的细胞则无凋亡发生(呈浅绿色)。

图 7TdT法原位检测感染重组腺病毒72h后细胞的凋亡。
, http://www.100md.com
(A,C)感染AdGFP;(B,D)感染BB102,(A)和(B)KB-v200细胞;(C)和(D)KB-s细胞。
2.6 腺病毒介导的人野生型p53基因对KB-v200细胞药物敏感性的影响
MTT实验结果(表1)显示,感染重组腺病毒BB102的KB-v200细胞对VCR的敏感性增加。
表1 感染重组腺病毒的KB-v200细胞对化疗药物VCR的敏感性(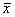 ±s) 细胞系
±s) 细胞系
(长春新碱VCR,μg)IC50
KB-v200
4.65±0.22
, 百拇医药
KB-v200+Ad-GFP
3.80±0.28
KB-v200+BB-102
0.78±0.35
罗丹明123的累积实验则显示:其细胞膜上Pgp糖蛋白的泵出药物的功能却受到显著影响,表现为罗丹明123在其细胞内的积累增加(图8)。由此提示,野生型p53基因增加耐药肿瘤细胞的药物敏感性,与其细胞膜上的糖蛋白泵出药物的活性有关。

图8 KB-v200细胞感染重组腺病毒后的罗丹明123积累的变化。
, 百拇医药
(1)KB-s细胞空白对照;(2)罗丹明123在KB-s细胞中的积累;
(3)KB-v200细胞空白对照;(4)罗丹明123在KB-v200细胞中的积累;
(5,6,7)感染重组腺病毒BB10212h,24h,48h后的罗丹明123在细胞内的积累。
2.7 裸鼠体内致瘤性的改变
如图9所示,感染重组腺病毒BB-102的KB-v200以及KB-s细胞的裸鼠体内致瘤性降低,到第13天时,接种感染重组腺病毒BB-102的KB-v200以及KB-s细胞的裸鼠,与接种正常肿瘤细胞的裸鼠相比较,肿瘤大小(图9)和重量(表2)有显著差异。并且能增加KB-v200细胞对化疗药物VCR的敏感性。
, 百拇医药
图9 肿瘤化疗耐药细胞和敏感细胞感染重组腺病毒后裸鼠体内致瘤性的变化。腹腔注射3×106(■),KB-s细胞;(●),BB102感染的KB-s细胞;(▲),KB-v200细胞;( ),BB102感染的KB-v200细胞;(◆)KB-v200细胞+长春新碱(1μg.d-1.mouse-1);(
),BB102感染的KB-v200细胞;(◆)KB-v200细胞+长春新碱(1μg.d-1.mouse-1);( )BB102感染的KB-v200细胞+长春新碱(1μg.d-1.mouse-1)。
)BB102感染的KB-v200细胞+长春新碱(1μg.d-1.mouse-1)。
表2 接种BB-102感染的肿瘤化疗耐药细胞或敏感细胞13天后,裸鼠体内瘤的重量(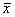 ±s) 接种的肿瘤细胞
±s) 接种的肿瘤细胞
, 百拇医药
对照
腹腔注射长春新碱
(1μg.d-1.mouse-1)
KB-s
0.573g± 0.092g
ND
BB-102感染的
0.337g± 0.034g
ND
KB-s 细胞
p0* = 0.048<0.05
, 百拇医药
KB-v200
0.615g± 0.105g
0.582μg± 0.093μg
p1*=0.839>0.05
BB-102感染的
0.363g± 0.055g
0.108μg± 0.014μg
KB-v200细胞
p1* =0.839>0.05
p1=0.005* <0.01
, 百拇医药
p2=0.007**<0.01
p0*,与KB-s细胞相比;p1*,与KB-v200细胞对照相比;
p2**,与BB102感染的KB-v200细胞对照相比
3 讨论
腺病毒载体是继逆转录病毒载体后在基因治疗方面应用开发得较早的一种基因转移系统,由于其制备简单,宿主范围广,感染率高,理化性质稳定,无整合性等优点,近年来已发展成基因治疗临床试验中的常用载体[5,6]。尤其在以invivo为基因转导途径时,腺病毒载体为病毒载体中的首选[12]。
化疗药物和放疗被广泛用于癌症治疗,并认为是通过p53依赖性途径而诱导细胞凋亡来实现对肿瘤的杀伤[4]。当细胞对环境刺激(包括化疗和放疗)所致的损伤作出反应时,可诱导野生型p53蛋白表达水平迅速升高,从而使细胞进入G1期生长抑制而有利于细胞修复损伤或在损伤严重不能修复时诱导细胞进入凋亡状态[13]。实验研究表明,p53基因失活或缺失可促使多种肿瘤的发生,并可使细胞出现耐药性和降低放疗敏感性.而在人类肿瘤发生过程中p53功能的丧失是目前常检查到的变化之一,在大约200多种不同的肿瘤中,有50%的肿瘤带有p53异常。以p53为目的基因的肿瘤抑制基因治疗即是通过向肿瘤细胞中导入野生型p53基因,恢复其抑癌功能,从而达到治疗肿瘤的目的[14]。肿瘤免疫基因治疗是通过向患者体内导入肿瘤免疫相关分子的基因而增强肿瘤细胞的免疫原性以及抗原提呈细胞对肿瘤抗原的提呈能力,从而激起机体的抗肿瘤免疫反应。目前研究较多的有细胞因子、MHC类分子和共刺激信号分子B7家族等[15~16]。T细胞在接受抗原提呈细胞提呈的抗原成分的同时,必须接受共刺激信号分子B7家族成员的共同刺激,才能被有效激活、增殖,进而发挥抗肿瘤作用,此即肿瘤免疫反应中的双信号学说。研究表明,肿瘤细胞表面往往缺乏B7类分子的表达,这使得T细胞因缺乏共刺激作用而处于克隆无反应状态。应用转B7基因的肿瘤细胞做为免疫原可诱导产生全身性的抗肿瘤免疫反应,包括增强CD8+的细胞毒性T淋巴细胞(Cytotoxic T lymphocyte,CTL)对肿瘤的特异性杀伤作用和CD4+T细胞的辅助作用[16]。
, 百拇医药
GM-CSF是近年来在肿瘤免疫中倍受人们关注的一种细胞因子[15,17],其在抗原提呈细胞的成熟和功能发挥中起重要作用:局部高浓度的GM-CSF通过作用于宿主的抗原提呈细胞而特异性地提高其提呈肿瘤抗原的能力,进而诱发宿主产生特异性抗肿瘤免疫。Dranoff等人[17]的研究结果认为,在众多已知细胞因子中,GM-CSF是最具潜力的能长期激活机体特异性抗肿瘤免疫的因子。
我们通过以上实验,评价重组腺病毒对肿瘤化疗耐药细胞和敏感细胞的治疗作用,实验结果表明药物敏感和耐药细胞都对腺病毒易感,重组腺病毒携带的三个外源基因(p53、GM-CSF、B7-1基因)在两种细胞中都能得到有效表达,并且能抑制它们的生长及诱导其凋亡。由此提示,该重组腺病毒对化疗药物抗性的肿瘤同样具有治疗作用。
耐药细胞KB-v200在转染该重组腺病毒48h后,其细胞膜上Pgp糖蛋白的泵出药物的功能却受到显著影响,表现为罗丹明123在其细胞内的积累增加.MTT的实验结果也显示出其对VCR药物敏感性的增加。由此提示,对于p53异常的肿瘤耐药细胞,转入野生型p53基因后,其对化疗药物敏感性的增加,与细胞膜上Pgp糖蛋白的功能活性下降有关。
, 百拇医药
我们的研究提示,携带人野生型p53基因和肿瘤免疫相关基因GM-CSF、B7-1的重组腺病毒对肿瘤化疗耐药细胞和敏感细胞都一样有效。裸鼠体内实验证实了感染上述重组腺病毒的KB-v200细胞的致瘤性降低,同时能增加化疗药物VCR的敏感性。提示临床使用携带多基因的重组腺病毒并结合化疗药物,对治疗多药耐药的肿瘤会更有效。
*通讯作者:Tel:86-10-66930008
Fax:86-10-68158311
Emal:wuct@nic.bmi.ac.cn
参考文献:
[1]Hamaguchi K, Godwin A K, Yakushiji M, et al. Cross-resistance to diverse drugs is associated with primary cisplatin resistance in ovarian cancer cell lines [J]. Cancer Res, 1993, 53: 5225~ 5232.
, 百拇医药
[2]Endicott J A, Ling V. The biochemistry of P-glycoprotein-me-diated multidrug resistance [J]. Annu Rev Biochem, 1989, 58: 137~ 171.
[3]Gottesman M M, Pastan I. Biochemistry of multidrug resistance mediated by the multidrug transporter [J]. Annu Rev Biochem, 1993, 62: 385~ 427.
[4]Weller M. Predicting response to cancer chemotherapy: the role of p53 [J]. Cell Tissue Res, 1998, 292: 435~ 445.
, 百拇医药 [5]Robbins PD, Tahara H, Ghivizzani SC. Viral vectors for gene therapy [J]. Trends Biotechonol, 1998, 16: 35~ 40.
[6]Trapnell BC. Adenoviral vectors for gene transfer [J]. Advanced Drug Delivery Reviews, 1993, 12: 185~ 199.
[7]邱兆华.重组腺病毒介导人野生型p53,GM CSF和B7 1基因对喉癌基因治疗的实验研究[D].博士学位论文,中国人民解放军军事医学科学院,1999年6月.
[8]Graham, FL, Prevec L. Manipulation of adenovirus vectors [M]. In: Murray EJ(ed). Methods of Molecular Biology, Volume 7, Humana Press, Clifton, 1991: 109~ 128.
, 百拇医药
[9]Gavrieli Y, Sherman Y,Ben-Sasson SA. Identification of programmed cell death in situ via specific labeling of nuclear DNA fragrmentation. J Cell Biol, 1992, 119: 493~ 501.
[10]鄂征,主编.组织培养和分子细胞学技术[M].北京:北京出版社(第二版),1997:438~ 39.
[11]Utz I, Gekeler V, Ise W, et al. Protein kinase C isoenzymes, p53, accumulation of rhodamine 123, glutathione-S-transferase, topoisomerase II and MRP in multidrug resistant cell lines [J]. Anticancer Res, 1996, 16: 289~ 96.
, 百拇医药
[12]Verma IM, Somia N. Gene therapy— — promises, problems and prospects [J]. Nature, 1997, 389: 239~ 242.
[13]Agarwal ML, Taylor WR, Chernov MV, et al. The p53 network[J]. J Biol Chem, 1998, 273: 1~ 4.
[14]Hollstein M, Sidransky D, Vogelstein B, et al. P53 mutations in human cancers [J]. Science, 1991, 253: 49~ 53.
[15]Miller AR, McBride WH, Hunt K, et al. Cytokine-mediated gene therapy for cancer [J]. Ann Surg Oncol, 1994, 1: 436~ 450.
, http://www.100md.com
[16]Schultze J, Nadler LM, Gribben JG. B7-mediated costimulation and the immune response [J]. Blood Rev, 1996, 10: 111~ 127.
[17]Dranoff G, Jaffee E, Lazenby A, et al. Vaccination with irradiated tumor cells engineered to secrete murine granulocyte-macrophage colony-stimulating factor stimulate potent, specific, and long-lasting antitumor immunity [J]. Proc Natl Acad Sci USA, 1993, 90: 3539~ 3543.
收稿日期:1999-09-08, 百拇医药
单位:范国昌 吴祖泽 王艳飞 邱兆华(军事医学科学院放射医学研究所三室,);吴世凯(附属医院肿瘤科,北京100850)
关键词:肿瘤基因治疗;多药耐药;腺病毒载体
癌症000103 摘 要:目的:探讨重组腺病毒介导人野生型p53,GM-CSF和B7-1基因对肿瘤化疗耐药细胞生物学行为的影响,为临床使用该重组腺病毒治疗多药耐药的肿瘤提供实验基础。方法:选用p53异常的KB-s(VCR敏感)和KB-v200(VCR耐药)细胞作为肿瘤化疗药物敏感和耐药的模式细胞,感染携带人野生型p53,GM-CSF和B7-1基因的重组腺病毒后,观察这两种转基因癌细胞的生物学行为(包括药物敏感性)的变化,结果:药物敏感和耐药细胞都对腺病毒易感,重组腺病毒携带的三个外源基因(p53、GM-CSF、B7-1基因)在两种细胞中都能得到有效表达,并且能抑制它们的生长及诱导其凋亡。耐药细胞KB-v200在转染该重组腺病毒48h后,其细胞膜上Pgp糖蛋白的泵出药物的功能却受到显著影响,表现为罗丹明123在其细胞内的积累增加。MTT的实验结果也显示出其对VCR药物敏感性的增加,裸鼠体内实验证实了感染上述重组腺病毒的KB-v200细胞的致瘤性降低,同时能增加对化疗药物VCR的敏感性。结论:实验研究结果提示,使用该重组腺病毒并结合化疗药物,对临床治疗多药耐药的肿瘤可能会更有效。
, 百拇医药
分类号:R735.5 文献标识码:A
文章编号:1000-467X(2000)01-0010-07
Effect of human wild-type p53, GM-CSF and B7-1 genes
on biological behavior of chemotherapy-resistant
tumor cells via recombinant adenovirus vector
FAN Guo-chang, WU Chu-tse* , WANG Yan-fei, et al.
Department of Experimental Hematology, Beijing Institute of
, 百拇医药
Radiation Medicine, Beijing 100850, P.R.China
Abstract:Objective:To explore the effect on biological behavior of chemotherapy-resistant tumor cells by human wild-type p53, GM-CSF and B7-1 genes mediated via recombinant adenovirus. Methods: p53-abnormal KB-v200 (VCR resistant) and KB-s (VCR sensitive) cell lines were used as model tumor cells, which are resistant and sensitive to chemotherapeutic drugs, respectively. After infected with recombinant adenovirus carrying human wild-type p53, GM-CSF and B7-1 genes, changes in biological behavior (including drug sensitivity) of these two kinds of gene-transduced cancer cells were observed.Results: Both of the cell lines were susceptible to adenovirus, all of the three exogenous genes (p53, GM-CSF and B7-1) could be effectively expressed in these cell lines. Their growth was suppressed, and apoptosis was induced. The drug-pumping-out function of Pgp glycoprotein on the cytomembrane of drug-resistant KB-v200 cells was markedly affected 48h after transfection of the recombinant adenovirus, as revealed by increase of the amount of rhodamine 123 accumulation in the cells. The MTT assay also indicated the reversal of their sensitivity to VCR drugs. In vivo experiment in nude mice demonstrated reduction of tumorigenicity of the KB-v200 cells or KB-s cells infected with the recombinant adenovirus, and increase of their sensitivity to VCR. Conclusion: These study results suggest that clinical application of this recombinant adenovirus carrying multiple genes in combination with chemotherapeutic agents might be more effective in treatment of tumors with MDR.
, http://www.100md.com
Key words: Tumor gene therapy; Multidrug resistance; Adenoviral vector ▲
在肿瘤的临床化疗过程中,肿瘤细胞耐药性的产生常常导致化疗的失败。最初对化疗敏感的细胞,多次接受同一种化疗药物后,往往会获得对多种抗癌药物的抗性[1]。目前已经阐明了一系列耐药机制,其中一种是与mdr1基因的表达产物——170kDa,Pgp(P-glycoprotein)糖蛋白上升有关[2,3]。近年来研究表明,p53基因在多种抗癌药物诱导的凋亡过程中起着十分重要的作用[4]。
腺病毒介导的基因治疗对于临床控制肿瘤的发生、发展和消退,提供了一种新的治疗手段[5,6]。本实验室构建了携带人野生型p53基因和肿瘤免疫相关基因GM-CSF、B7-1的重组腺病毒(命名为BB-102),并将其感染喉癌原代细胞,结果表明:腺病毒介导的人野生型p53基因能抑制喉癌细胞的增殖并诱导其凋亡;GM-CSF、B7-1基因可提高喉癌细胞的免疫原性,刺激自体肿瘤浸润淋巴细胞(TIL)增殖,而且体外能诱导自体外周血淋巴细胞生成肿瘤杀伤性的CTL[7]。显示出此重组腺病毒在肿瘤基因治疗中具有很好的应用前景。
, 百拇医药
本研究则选用p53异常的KB-s(VCR敏感)和KB-v200(VCR耐药)细胞作为肿瘤化疗药物敏感和耐药的模式细胞,观察腺病毒载体对这两种细胞的转染效率,及重组腺病毒介导的人野生型p53,GM-CSF和B7-1基因在这两种细胞中的表达情况,并进一步检测KB-v200细胞转染此重组腺病毒后,药物敏感性以及在裸鼠体内的致瘤性的变化,为基因治疗的临床应用提供此方面的实验依据。
1 材料与方法
1.1 细胞系
整合了人5型腺病毒E1区的人胚胎肾细胞293细胞系由美国百特医疗用品公司基因治疗部(GeneTherapyUnit,BaxterHealthcareCompany,USA)惠赠,在含10%小牛血清的高糖DMEM,37℃,5%CO2条件下培养。
p53异常的人KB-s(VCR敏感)和KB-v200(VCR耐药)细胞系由中国医学科学院肿瘤研究所惠赠。其培养液为含10%小牛血清的RPMI-1640,在37℃,5%CO2条件下培养。
, 百拇医药
1.2 重组腺病毒
携带绿色荧光蛋白基因的重组腺病毒(Ad-GFP),由美国百特医疗用品公司基因治疗部(GeneTherapyUnit,BaxterHealthcareCompany,USA)惠赠,;E1、E3区缺失的复制缺陷型Ad5重组腺病毒载体BB102含CMV启动子驱动的人野生型p53cDNA和人GM-CSFcDNA(两目的基因间由脑心肌炎病毒内部核糖体进入位点,EMC-IRES相连),以及SV40启动子驱动的人B7-1cDNA,由本实验室邱兆华博士构建[7]。
1.3 重组腺病毒的扩增,纯化和滴度测定
按文献报告方法进行[8]。
1.4 重组腺病毒介导p53,B7-1和GM-CSF基因在药物敏感和耐药细胞中的表达
, http://www.100md.com
1.4.1 腺病毒载体对药物敏感和耐药细胞的转染率:将人KB-s和KB-v200细胞种于6孔板,每孔为5×105细胞,12h后将培养液吸出,分别用0、12.5、25、50和100MOI的Ad-GFP(稀释于0.8ml培养液)感染细胞,1~2h后吸去病毒液,每孔加2ml培养液,12h后,在荧光显微镜下计数GFP表达阳性的细胞数,重复3次,计算转染率。
1.4.2 免疫组织化学方法检测BB-102介导的人野生型p53基因的表达:KB-s和KB-v200细胞分别以5×104细胞/孔的量接种于12孔培养板,每孔底部加一小块盖玻片,使细胞能够自然生长于玻片上,24h后分别以50MOI的BB-102和Ad-GFP感染细胞,48h后将玻片取出,以丙酮固定细胞,通过anti-human p53 monoclonal antibody Pab240(PharMingen)免疫组化法检测p53在细胞中的表达。
1.4.3 流式细胞分析检测BB-102介导的B7-1基因的表达:KB-s和KB-v200细胞以1×106细胞/皿的量分别接种于60mm平皿中,24h后以50MOI的BB-102感染细胞,48h后消化细胞,用Hanks液洗两遍,重悬于100×200μlHanks液中,加20μlFITC标记的鼠抗人B7-1单克隆抗体(PharMingen),4℃孵育30min,用Hanks液洗两遍,重悬于1mlHanks液中,通过流式细胞分析检测BB-102介导的B7-1基因在两种细胞膜上的表达。
, http://www.100md.com
1.4.4 ELISA检测BB-102介导的GM-CSF基因在两种细胞中的表达:KB-s和KB-v200细胞以5×105细胞/皿的量各自接种于60mm平皿中,24h后以50MOI的BB-102感染细胞,此后每24h收集上清,更换新鲜培养液,连续6天。GM-CSFELISAkit(Zymed)检测BB-102介导的GM-CSF在两种细胞中的表达。
1.4.5 BB-102介导的外源基因对药物敏感和耐药细胞生长的抑制作用:两种细胞以1×104细胞/孔的量接种于24孔培养板,24h后以50MOI的BB-102或Ad-GFP感染细胞,此后每天观察细胞生长状况,随后将细胞消化下来,经台盼蓝染色后计数活细胞,并绘制细胞生长曲线。
1.5 BB-102介导的外源基因对药物敏感和耐药细胞凋亡的诱导
采用末端转移标记检测DNA[9]。两种细胞以5×104细胞/孔的量接种于12孔培养板,每孔底部加一小块盖玻片,使细胞能够自然生长于玻片上,24h后分别以50MOI的BB-102或Ad-GFP分别感染细胞,72h后将玻片取出,以中性福尔马林固定细胞,通过3’末端标记法原位检测细胞凋亡(TdTFragELTM DNA Fragmentation Detection Kit,Oncogene)。
, http://www.100md.com
1.6 多药耐药性检测
1.6.1 MTT实验:按文献[10]描述的方法进行。
1.6.2 流式细胞仪测定药物在细胞中的积累[11]:罗丹明(Rhodamine123)荧光染料,能有效的被mdr1基因产物——Pgp糖蛋白排出细胞外。BB-102感染KB-v200细胞12h,24h和48h后,用0.25%胰蛋白酶消化后离心收集细胞,用无血清RPMI1640漂洗并调整细胞浓度为1×106/ml,然后通过1ml注射器以分散细胞,加入终浓度为2.5μg/ml的罗丹明,37℃孵育30min,1500rpm离心2min后,再用无血清RPMI1640漂洗细胞2次,37℃孵育10min后,再用培养液漂洗1次,加入终浓度为5μg/ml的异博定(isoptin)。
用流式细胞仪488nm的激发光,测试细胞荧光强度。
, http://www.100md.com
1.7 裸鼠致瘤性改变
雌性裸鼠,体重20~24g,4~6周龄,购自中国医学科学院实验动物中心。随机分组,每组10只,KB-v200和KB-s细胞接种于150mm2的培养瓶中,12h后分别感染50MOI的BB102,37℃,5%CO2培养24h后,用0.25%胰蛋白酶消化细胞,PBS洗细胞2次,用无血清RPMI1640调整细胞浓度为1.5×107/ml,每只裸鼠接种0.2ml于肩胛部皮下,5天后肿瘤长出,比绿豆略大。然后每组再分为两小组,每组5只,一组每天腹腔注射0.2mlVCR(5μg/ml),另一组注射0.2ml生理盐水。同时,每2天用游标卡尺测量肿瘤大小。计算方法:肿瘤体积[mm3]=(长径×宽径2)/2,13天后剥离肿瘤称重。
1.8 统计学处理
使用POMS统计软件分析结果。
, 百拇医药
2 结果
2.1 高滴度重组腺病毒的制备
经氯化铯密度梯度超速离心,获得高度浓缩的腺病毒带.根据1O.D.260=1.1×1012particles,计算所提病毒的浓度高于1012particles/ml,且纯度较高(O.D.260/O.D.280大于1.3).空斑实验确定其滴度分别为:BB-102:3×1010pfu/ml;AdGFP:4×1011pfu/ml.
2.2 腺病毒对药物敏感和耐药细胞具有较高感染效率
药物敏感和耐药细胞都对腺病毒载体易感,随着病毒量的加大,各自的转染率提高,当病毒量为50MOI时,转染率达90%以上(图1).当病毒量继续加大时,细胞生长会受到一定程度的抑制,且死亡细胞数也增多。


, http://www.100md.com
图1 感染50MOI重组腺病毒Ad-GFP48h后的KB-v200细胞和KB-s细胞。
A,B为荧光显微镜同一视野下的KB-v200细胞;C,D则为KB-s细胞。
2.3 腺病毒载体介导的三种外源基因在药物敏感和耐药细胞中的表达
免疫组化结果(图2)表明:BB-102所介导的p53在药物敏感和耐药细胞中均可表达。


图2 免疫组化检测重组腺病毒BB-102介导的p53在KB-v200细胞(A,B)
和KB-s(C,D)细胞中的表达。(A,C)感染Ad-GFP作为对照;(B,D)感染BB-102。
, 百拇医药
ELISA结果(图3)表明:以50MOI的BB-102感染KB-s和KB-v200细胞,1天后培养液中即可检测到较高水平的GM-CSF,2~3天时达高峰,随后呈下降趋势,直至6天后仍可检测到较高水平的GM-CSF。

图3 ELISA检测BB-102介导的GM-CSF在KB-s细胞和KB-v200细胞中的表达。
图中显示数值为三孔的平均值。
流式细胞分析结果表明(图4):没有感染重组腺病毒BB-102的KB-s和KB-v200细胞都不表达B7-1;当以50MOI的BB-102感染细胞时,2天后80%以上的细胞表面有较高水平的B7-1的表达。


, 百拇医药
图4 流式细胞仪测定BB-102介导的B7-1基因在KB-v200细胞和KB-s细胞中的表达。
2.4 腺病毒载体介导的外源基因抑制药物敏感和耐药细胞生长并对细胞产生杀伤作用与未感染病毒的细胞相比,以50MOIBB-102感染的KB-s和KB-v200细胞,其生长都受到明显抑制(图5),其中KB-s比KB-v200细胞更为明显,光镜下可见:第4天时,KB-s细胞间隙就逐渐加大,细胞变圆.KB-v200细胞则在第6天时才出现这种现象(图6)。而该剂量的对照病毒Ad-GFP则对细胞生长影响不大。


图5 重组腺病毒介导的外源基因对KB-v200细胞和KB-s细胞生长的影响。


, 百拇医药
图6 重组腺病毒介导的外源基因对KB-v200细胞和KB-s细胞生长的抑制作用,图中显示感染重组腺病毒第6天的细胞形态。(A,C)AdGFP;(B,D)BB-102,(A,B)KB-v200细胞;(C,D)KB-s细胞。
2.5 腺病毒载体介导的外源基因可诱导药物敏感和耐药细胞发生凋亡
以50MOIBB-102和Ad-GFP感染KB-s和KB-v200细胞,72小时后固定细胞,以3'末端标记法原位检测细胞凋亡,结果如图7所示:感染BB-102细胞大量发生凋亡(呈棕色),而感染Ad-GFP的细胞则无凋亡发生(呈浅绿色)。


图 7TdT法原位检测感染重组腺病毒72h后细胞的凋亡。
, http://www.100md.com
(A,C)感染AdGFP;(B,D)感染BB102,(A)和(B)KB-v200细胞;(C)和(D)KB-s细胞。
2.6 腺病毒介导的人野生型p53基因对KB-v200细胞药物敏感性的影响
MTT实验结果(表1)显示,感染重组腺病毒BB102的KB-v200细胞对VCR的敏感性增加。
表1 感染重组腺病毒的KB-v200细胞对化疗药物VCR的敏感性(
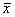 ±s) 细胞系
±s) 细胞系(长春新碱VCR,μg)IC50
KB-v200
4.65±0.22
, 百拇医药
KB-v200+Ad-GFP
3.80±0.28
KB-v200+BB-102
0.78±0.35
罗丹明123的累积实验则显示:其细胞膜上Pgp糖蛋白的泵出药物的功能却受到显著影响,表现为罗丹明123在其细胞内的积累增加(图8)。由此提示,野生型p53基因增加耐药肿瘤细胞的药物敏感性,与其细胞膜上的糖蛋白泵出药物的活性有关。


图8 KB-v200细胞感染重组腺病毒后的罗丹明123积累的变化。
, 百拇医药
(1)KB-s细胞空白对照;(2)罗丹明123在KB-s细胞中的积累;
(3)KB-v200细胞空白对照;(4)罗丹明123在KB-v200细胞中的积累;
(5,6,7)感染重组腺病毒BB10212h,24h,48h后的罗丹明123在细胞内的积累。
2.7 裸鼠体内致瘤性的改变
如图9所示,感染重组腺病毒BB-102的KB-v200以及KB-s细胞的裸鼠体内致瘤性降低,到第13天时,接种感染重组腺病毒BB-102的KB-v200以及KB-s细胞的裸鼠,与接种正常肿瘤细胞的裸鼠相比较,肿瘤大小(图9)和重量(表2)有显著差异。并且能增加KB-v200细胞对化疗药物VCR的敏感性。

, 百拇医药
图9 肿瘤化疗耐药细胞和敏感细胞感染重组腺病毒后裸鼠体内致瘤性的变化。腹腔注射3×106(■),KB-s细胞;(●),BB102感染的KB-s细胞;(▲),KB-v200细胞;(
 ),BB102感染的KB-v200细胞;(◆)KB-v200细胞+长春新碱(1μg.d-1.mouse-1);(
),BB102感染的KB-v200细胞;(◆)KB-v200细胞+长春新碱(1μg.d-1.mouse-1);( )BB102感染的KB-v200细胞+长春新碱(1μg.d-1.mouse-1)。
)BB102感染的KB-v200细胞+长春新碱(1μg.d-1.mouse-1)。表2 接种BB-102感染的肿瘤化疗耐药细胞或敏感细胞13天后,裸鼠体内瘤的重量(
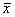 ±s) 接种的肿瘤细胞
±s) 接种的肿瘤细胞, 百拇医药
对照
腹腔注射长春新碱
(1μg.d-1.mouse-1)
KB-s
0.573g± 0.092g
ND
BB-102感染的
0.337g± 0.034g
ND
KB-s 细胞
p0* = 0.048<0.05
, 百拇医药
KB-v200
0.615g± 0.105g
0.582μg± 0.093μg
p1*=0.839>0.05
BB-102感染的
0.363g± 0.055g
0.108μg± 0.014μg
KB-v200细胞
p1* =0.839>0.05
p1=0.005* <0.01
, 百拇医药
p2=0.007**<0.01
p0*,与KB-s细胞相比;p1*,与KB-v200细胞对照相比;
p2**,与BB102感染的KB-v200细胞对照相比
3 讨论
腺病毒载体是继逆转录病毒载体后在基因治疗方面应用开发得较早的一种基因转移系统,由于其制备简单,宿主范围广,感染率高,理化性质稳定,无整合性等优点,近年来已发展成基因治疗临床试验中的常用载体[5,6]。尤其在以invivo为基因转导途径时,腺病毒载体为病毒载体中的首选[12]。
化疗药物和放疗被广泛用于癌症治疗,并认为是通过p53依赖性途径而诱导细胞凋亡来实现对肿瘤的杀伤[4]。当细胞对环境刺激(包括化疗和放疗)所致的损伤作出反应时,可诱导野生型p53蛋白表达水平迅速升高,从而使细胞进入G1期生长抑制而有利于细胞修复损伤或在损伤严重不能修复时诱导细胞进入凋亡状态[13]。实验研究表明,p53基因失活或缺失可促使多种肿瘤的发生,并可使细胞出现耐药性和降低放疗敏感性.而在人类肿瘤发生过程中p53功能的丧失是目前常检查到的变化之一,在大约200多种不同的肿瘤中,有50%的肿瘤带有p53异常。以p53为目的基因的肿瘤抑制基因治疗即是通过向肿瘤细胞中导入野生型p53基因,恢复其抑癌功能,从而达到治疗肿瘤的目的[14]。肿瘤免疫基因治疗是通过向患者体内导入肿瘤免疫相关分子的基因而增强肿瘤细胞的免疫原性以及抗原提呈细胞对肿瘤抗原的提呈能力,从而激起机体的抗肿瘤免疫反应。目前研究较多的有细胞因子、MHC类分子和共刺激信号分子B7家族等[15~16]。T细胞在接受抗原提呈细胞提呈的抗原成分的同时,必须接受共刺激信号分子B7家族成员的共同刺激,才能被有效激活、增殖,进而发挥抗肿瘤作用,此即肿瘤免疫反应中的双信号学说。研究表明,肿瘤细胞表面往往缺乏B7类分子的表达,这使得T细胞因缺乏共刺激作用而处于克隆无反应状态。应用转B7基因的肿瘤细胞做为免疫原可诱导产生全身性的抗肿瘤免疫反应,包括增强CD8+的细胞毒性T淋巴细胞(Cytotoxic T lymphocyte,CTL)对肿瘤的特异性杀伤作用和CD4+T细胞的辅助作用[16]。
, 百拇医药
GM-CSF是近年来在肿瘤免疫中倍受人们关注的一种细胞因子[15,17],其在抗原提呈细胞的成熟和功能发挥中起重要作用:局部高浓度的GM-CSF通过作用于宿主的抗原提呈细胞而特异性地提高其提呈肿瘤抗原的能力,进而诱发宿主产生特异性抗肿瘤免疫。Dranoff等人[17]的研究结果认为,在众多已知细胞因子中,GM-CSF是最具潜力的能长期激活机体特异性抗肿瘤免疫的因子。
我们通过以上实验,评价重组腺病毒对肿瘤化疗耐药细胞和敏感细胞的治疗作用,实验结果表明药物敏感和耐药细胞都对腺病毒易感,重组腺病毒携带的三个外源基因(p53、GM-CSF、B7-1基因)在两种细胞中都能得到有效表达,并且能抑制它们的生长及诱导其凋亡。由此提示,该重组腺病毒对化疗药物抗性的肿瘤同样具有治疗作用。
耐药细胞KB-v200在转染该重组腺病毒48h后,其细胞膜上Pgp糖蛋白的泵出药物的功能却受到显著影响,表现为罗丹明123在其细胞内的积累增加.MTT的实验结果也显示出其对VCR药物敏感性的增加。由此提示,对于p53异常的肿瘤耐药细胞,转入野生型p53基因后,其对化疗药物敏感性的增加,与细胞膜上Pgp糖蛋白的功能活性下降有关。
, 百拇医药
我们的研究提示,携带人野生型p53基因和肿瘤免疫相关基因GM-CSF、B7-1的重组腺病毒对肿瘤化疗耐药细胞和敏感细胞都一样有效。裸鼠体内实验证实了感染上述重组腺病毒的KB-v200细胞的致瘤性降低,同时能增加化疗药物VCR的敏感性。提示临床使用携带多基因的重组腺病毒并结合化疗药物,对治疗多药耐药的肿瘤会更有效。
*通讯作者:Tel:86-10-66930008
Fax:86-10-68158311
Emal:wuct@nic.bmi.ac.cn
参考文献:
[1]Hamaguchi K, Godwin A K, Yakushiji M, et al. Cross-resistance to diverse drugs is associated with primary cisplatin resistance in ovarian cancer cell lines [J]. Cancer Res, 1993, 53: 5225~ 5232.
, 百拇医药
[2]Endicott J A, Ling V. The biochemistry of P-glycoprotein-me-diated multidrug resistance [J]. Annu Rev Biochem, 1989, 58: 137~ 171.
[3]Gottesman M M, Pastan I. Biochemistry of multidrug resistance mediated by the multidrug transporter [J]. Annu Rev Biochem, 1993, 62: 385~ 427.
[4]Weller M. Predicting response to cancer chemotherapy: the role of p53 [J]. Cell Tissue Res, 1998, 292: 435~ 445.
, 百拇医药 [5]Robbins PD, Tahara H, Ghivizzani SC. Viral vectors for gene therapy [J]. Trends Biotechonol, 1998, 16: 35~ 40.
[6]Trapnell BC. Adenoviral vectors for gene transfer [J]. Advanced Drug Delivery Reviews, 1993, 12: 185~ 199.
[7]邱兆华.重组腺病毒介导人野生型p53,GM CSF和B7 1基因对喉癌基因治疗的实验研究[D].博士学位论文,中国人民解放军军事医学科学院,1999年6月.
[8]Graham, FL, Prevec L. Manipulation of adenovirus vectors [M]. In: Murray EJ(ed). Methods of Molecular Biology, Volume 7, Humana Press, Clifton, 1991: 109~ 128.
, 百拇医药
[9]Gavrieli Y, Sherman Y,Ben-Sasson SA. Identification of programmed cell death in situ via specific labeling of nuclear DNA fragrmentation. J Cell Biol, 1992, 119: 493~ 501.
[10]鄂征,主编.组织培养和分子细胞学技术[M].北京:北京出版社(第二版),1997:438~ 39.
[11]Utz I, Gekeler V, Ise W, et al. Protein kinase C isoenzymes, p53, accumulation of rhodamine 123, glutathione-S-transferase, topoisomerase II and MRP in multidrug resistant cell lines [J]. Anticancer Res, 1996, 16: 289~ 96.
, 百拇医药
[12]Verma IM, Somia N. Gene therapy— — promises, problems and prospects [J]. Nature, 1997, 389: 239~ 242.
[13]Agarwal ML, Taylor WR, Chernov MV, et al. The p53 network[J]. J Biol Chem, 1998, 273: 1~ 4.
[14]Hollstein M, Sidransky D, Vogelstein B, et al. P53 mutations in human cancers [J]. Science, 1991, 253: 49~ 53.
[15]Miller AR, McBride WH, Hunt K, et al. Cytokine-mediated gene therapy for cancer [J]. Ann Surg Oncol, 1994, 1: 436~ 450.
, http://www.100md.com
[16]Schultze J, Nadler LM, Gribben JG. B7-mediated costimulation and the immune response [J]. Blood Rev, 1996, 10: 111~ 127.
[17]Dranoff G, Jaffee E, Lazenby A, et al. Vaccination with irradiated tumor cells engineered to secrete murine granulocyte-macrophage colony-stimulating factor stimulate potent, specific, and long-lasting antitumor immunity [J]. Proc Natl Acad Sci USA, 1993, 90: 3539~ 3543.
收稿日期:1999-09-08, 百拇医药