神经肽Y刺激血管平滑肌增殖和losartan的干预作用
作者:刘建康 黄少华 陈敏生
单位:刘建康(广州医学院组织胚胎学教研室,广东 广州 510182);黄少华(广州医学院第一附属医院心脏病研究室);陈敏生(广州医学院第二附属医院心内科)
关键词:神经肽Y;肌,平滑,血管;细胞;免疫组织化学
中国病理生理杂志000113
[摘 要] 目的:探讨神经肽Y和肾素-血管紧张素系统之间的相互作用与高血压疾病发生之间的关系。方法:应用快速微量MTT比色法和荧光免疫组化定量技术,观察神经肽Y对体外培养血管平滑肌细胞增殖活度和血管平滑肌细胞核细胞增殖抗原表达的影响以及血管紧张素Ⅱ受体拮抗剂losartan对其影响的干预作用。结果:神经肽Y可刺激体外培养血管平滑肌细胞的增殖、使其增殖活度(MTT-OD值)和细胞内核增殖抗原(PCNA)的表达明显高于对照组(P<0.01)。而losartan则可降低神经肽Y对血管平滑肌细胞增殖活度(MTT-OD值)的刺激作用,减少细胞内核增殖抗原(PCNA)的表达。结论:神经肽Y可促进体外培养的血管平滑肌细胞的增殖,并部分通过血管紧张素Ⅱ受体起作用。
, 百拇医药
[中图分类号] Q253 [文献标识码] A
[文章编号]1000-4718(2000)01-0046-04
The stimulating effects of neuropeptide Y on cultured arterial smooth muscle cell proliferation and losartan treatment
LIU Jian-kang, HUANG Shao-hua, CHEN Min-sheng
(Department of Histology and Embryology, Guangzhou Medical College, Guangzhou 510182, China)
[Abstract] AIM:To investigate the interplay between the neuropeptide Y(NPY) and renin-angiotensin system, and relationship to the pathogenesis of hypertension. METHODS: The method of cellular culture, MTT colorimetric assay and quantitative immunocytochemistry through ACAS570 were performed for the effect of neuropeptide Y on proliferation of cultured rat vascular smooth muscle cell (VSMC) and losartan treatment. RESULTS:It was observed that exposure of VSMC to neuropeptide Y could stimulate the proliferation of VSMC and caused increase respectively in MTT OD values and expression of proliferating cell nulear antigen(PCNA) but losartan interfered with NPY stimulating effects on VSMC and decreased MTT OD values and expression of PCNA. CONCLUSION:These results demonstrated that the NPY could promote proliferation of VSMC, this effect was partly preformed through angiotensin Ⅱ receptor.
, 百拇医药
[MeSH] Neuropeptide Y; Muscle, smooth, vascular; Cells; Immunohistochemistry
神经体液因素中神经肽Y(neuropeptide Y, NPY)对心血管系统生理调节作用与多种心血管疾病的发生密切相关。我们研究发现:NPY不仅影响血管内皮细胞的形态特征[1],而且可改变内皮细胞源性血管收缩与舒张功能间的平衡[2]。但神经肽Y是否可直接刺激血管平滑肌细胞(vascular smooth muscle cell, VSMC)发生增殖或肥大?对血管的调节作用是否与血管局部的肾素-血管紧张素系统活性高低密切相关?并由此在导致高血压血管重塑中发挥重要的作用,研究证据并不充分。本研究运用快速微量MTT比色法(MTT colorimetric assay)和荧光免疫组化定量技术观察NPY作用下VSMC增殖活度和细胞增殖核抗原(proliferating cell nuclear antigen, PCNA)的表达以及losartan对NPY作用的干预,以探讨NPY和肾素-血管紧张素系统在高血压疾病发生中的作用。
, http://www.100md.com
材 料 和 方 法
一、VSMC的体外培养:
组织贴块法培养VSMC。无菌条件下分离SD大鼠的胸主动脉,剪碎后加入适量含10%胎牛血清的DMEM(GiBco公司产品)培养液,37℃、5%CO2培养箱中静置培养。用光镜和免疫化学方法进行鉴定。细胞传代后,选择生长良好的第6~7代VSMC用于实验。
二、实验分组及NPY和losartan条件培养液的配制:
实验共分三组,对照组、NPY组和NPY+losartan组。实验组分别加入NPY(10-6 mol/L)和NPY+losartan(10-5 g/L)条件培养液,而对照组为无血清DMEM培养液。
三、VSMC增殖活性的测定(自动微量MTT比色法)[3]:
, 百拇医药
选择第6代生长良好的VSMC,消化传代至96孔培养板上,传代细胞密度为5.0×107/L。细胞经18 h的预培养和6 h的预处理后,分别将NPY、NPY+losartan条件培养液和无血清、无酚红DMEM培养液加入实验组和对照组,37℃、5%CO2培养24 h,再加入0.5%四甲基偶氮唑盐(Sigma,美国,简称MTT)50 μL,继续培养4 h后,加入二甲基亚枫(dimethyl sulfoxide, DMSO北京化工厂)150 μL终止培养,震摇2 min后,以550 nm波长在自动酶标仪下检测每孔样品中MTT结晶所形成的光密度值(OD值)。
四、VSMC核增殖抗原的表达:
细胞消化传代至24孔培养板,细胞处理与方法三相同。吸去培养液后,用pH7.3的PBS洗板3次,3%多聚甲醛固定30 min,PBS洗3次。
已固定样品按常规免疫组织化学方法处理。首先,5%正常山羊血清封闭,室温孵育30 min;倾去血清,滴加稀释度为1∶50鼠抗大鼠PCNA单克隆抗体(美国Santa Cruz公司产品),4℃冰箱过夜。样品倾去抗体孵育液,PBS洗3次,换加1∶10 FITC荧光标记兔抗鼠抗体(天象人公司产品),室温孵育40 min后,PBS充分洗板,每待测样品加入100 μL PBS后,分别置带电脑激光扫描共焦显微细胞仪(ACAS570UVC型,美国MERIDIAN公司)下,选用40×物镜,7%滤光片,确定激发光波长为488 nm,进入Kinetics-Image Scan程序,预扫描后选定最佳细胞扫描参数,选定视野激光扫描并存储所采集的各项实验数据。细胞扫描总数在200个以上。
, 百拇医药
五、统计处理:
数据采集完成以后,进入Kinetics-Image Analysis程序,分析和处理各次实验存储数据,自动得出统计结果。数据均以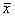 ±s表示,均数差异显著性用t检验判定。
±s表示,均数差异显著性用t检验判定。
结 果
一、VSMC的鉴定:
倒置显微镜下可见细胞生长呈典型的“谷与峰”结构特征,a-actin单克隆抗体免疫细胞化学显示95%为阳性VSMC。
二、NPY对VSMC增殖活度的影响及losartan的干预作用:
自动微量MTT比色法检测结果显示:NPY组MTT-OD值显著高于对照组(P<0.01);NPY+losartan组MTT-OD值则低于对照组(P<0.05)(见表1)。
, http://www.100md.com
三、NPY对VSMC中PCNA表达的影响及losartan的干预作用:
激光扫描共焦显微细胞仪借助免疫荧光显示技术对单个粘附式细胞内的各种动态参数进行图像分析处理,准确地定量细胞内核酸、蛋白质等被标记物质的变化。因此,检测细胞内被标记PCNA的平均荧光值即可反映其表达。在激光扫描共焦显微细胞仪下见NPY组被标记细胞的荧光强于对照组;而NPY+losartan组的荧光则弱于对照组(见图1~3)。各组平均荧光值的统计分析结果显示:NPY组PCNA平均荧光值高于对照组(P<0.05),NPY+losartan组与对照组无显著差异(见表1)。
讨 论
VSMC的异常增殖或肥大是高血压发病早期血管构型改变重要的形态学特征,其发生与NPY和血管局部肾素-血管紧张素系统的功能改变密切相关[4,5]。我们曾研究发现NPY不仅改变体外培养VSMC的形态特征[1],而且,通过影响血管内皮细胞源性的舒缩平衡以调节血管的功能状态[2],从而在高血压的发病中发挥重要作用。本实验研究用MTT比色法和激光扫描共焦显微细胞仪证实,NPY可刺激体外培养VSMC的增殖活性,提高细胞中PCNA的表达水平。其中,MTT比色-OD值较对照组增加14.7%。MTT比色法是通过显示细胞线粒体代谢酶活性的高低,间接反映细胞的增殖活性;而PCNA则是细胞核中DNA聚合酶的附属蛋白,其主要生物学作用是促进细胞核中DNA链的合成与延伸,促进细胞的生长和增殖[6];MTT-OD值和PCNA表达水平的变化说明NPY可引起VSMC增殖或肥大。但是,实验结果中MTT-OD值和PCNA平均荧光值升高的幅度并不很大,这似乎提示NPY对VSMC增殖或肥大的刺激作用存在着一定差异。我们推测NPY的这种刺激作用很可能与NPY促进VSMC中DNA或蛋白质的合成,促使VSMC发生肥大。这一推测也与吴翠环等的研究结果基本吻合[7]。这也可解释高血压阻力性动脉中层的增厚很可能是由于VSMC在NPY或其他神经体液因素作用下发生肥大的结果[8]。
, http://www.100md.com
表1 NPY刺激平滑肌细胞增殖和losartan的干预
Tab 1 The stimulating effects of NPY on cultured
vascular smooth muscle cell proliferation and losartan treatment (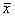 ±s, n=36) Group
±s, n=36) Group
MTT-OD
PCNA
Control
0.2239±0.0010
1542.71±200.04
, http://www.100md.com
NPY
0.2626±0.0025**
1648.56±232.71*
NPY+losartan
0.2440±0.0013*
1544.86±256.06
*P<0.05, **P<0.01, vs control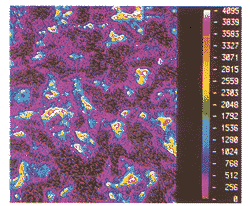
Fig 1 The PCNA expressions of VSMC in control group
, 百拇医药
图1 对照组体外培养VSMC中PCNA表达的平均荧光值
Fig 2 The PCNA expressions of VSMC in NPY group
图2 NPY组体外培养VSMC中PCNA表达的平均荧光值
Fig 3 The PCNA expressions of VSMC in Losartan+NPY group
图3 Losartan+NPY组体外培养VSMC中PCNA表达的平均荧光值
在外周神经系统中,NPY主要和去甲肾上腺素共存于分布于血管壁上的交感神经纤维末梢,直接引起VSMC的收缩,并增强血管对缩血管物质的敏感性。已发现去甲肾上腺素在交感神经纤维末梢中的释放受突触前膜受体的影响,激动突触前膜血管紧张素Ⅱ受体、β受体都可促进去甲肾上腺素的释放,血管紧张素转换酶抑制剂通过抑制血管紧张素Ⅱ的产生也可产生抑制去甲肾上腺素释放的结果[9]。但是有关NPY在肾素-血管紧张素系统中的作用研究尚较少见,对这一机制的研究有助于阐明NPY与肾素-血管紧张素系统在血管调节过程中的相互作用关系。血管紧张素Ⅱ受体拮抗剂losartan是90年代以来新合成的AT1受体阻断剂,和其他非肽类受体阻断剂如saralasin相比,losartan的显著特点是没有部分激动作用,与AT1受体具有较高的亲和力,低浓度时仍不与其它受体发生亲合作用,特异性强;且losartan和其主要活性代谢产物EXP3174对AT1受体均有明显的拮抗作用[10]。本实验将losartan加入到NPY作用的培养体系中,其目的就是要观察肾素-血管紧张素系统对NPY刺激VSMC增殖作用的影响。结果显示:在低于正常用药的血药浓度(losartan为10-5 g/L)时,即可抑制NPY对VSMC增殖的刺激作用,降低MTT比色的OD值和PCNA表达的平均荧光值。说明肾素-血管紧张素系统可影响NPY的血管调节作用;同时也提示losartan不仅通过阻断血管紧张素Ⅱ受体的作用降低血压,而且也影响NPY的血管调节机制而参与高血压的治疗。
, 百拇医药
[参 考 文 献]
[1] 刘建康,邓漪平.神经肽Y和血管活性肠肽对培养内皮细胞形态特征的影响 [J]. 广州医学院学报,1997,25(5):1~6.
[2] 刘建康,邓漪平. 神经肽Y和血管活性肠肽对内皮源性血管舒缩功能的调节作用 [J]. 中国动脉硬化杂志,1998,6(1):42~45.
[3] 郑永唐,贲昆龙. 测定细胞存活和增殖的MTT方法的建立 [J]. 免疫学杂志,1992, 8(4):266~268.
[4] 刘健康,邓漪平. 内皮细胞和神经系统间相互作用与动脉粥样硬化 [J]. 中国动脉硬化杂志,1997,5(3):272~276.
[5] Beck BC, Corson MA. Angiotensin Ⅱ signal transduction in vascular smooth muscle: role of tryosine kinases [J]. Circ Res, 1997, 80(5):607~616.
, 百拇医药
[6] Siltonen SM, Isola JJ, Rantala IS, et al. Intratumour variation in cell proliferation in breast carcinoma as determined by antiproliferating cell nuclear antigen monoclonal antibody and automated image analysis [J]. Am J Clin Pathol, 1993, 99:226~231.
[7] 吴翠环,任大宏, 陈多恩. 神经肽Y对培养的自发性高血压大鼠动脉平滑肌细胞的影响[J]. 同济医科大学学报,1998, 27(1):19~21.
[8] Chen H, Felscher C, Schafer RF, et al. Effects of noradrenaline and neuropeptide Y on rat mesenteric microvessle contraction[J]. Nauny Schmiedebergs Arch Pharmacol, 1996, 353(3):314~332.
, 百拇医药
[9] Van Valdhuissen DJ, Brodde OE, van Gilst WH, et al. Relation between myocardial beta-adrenoceptor density and hemodynamic and neurohumoral changes in a rat model of chronic myocardial infarction: effects ibopamine and captopril [J]. Cardiovasc Res, 1995, 30:346~351.
[10] Wong PC, Price WA, Chiu AT, et al. Nonpeptide angiotensin Ⅱ receptor antagonist:studies with EXP9270 and Du 753 [J]. Hypertension, 1990, 15:823~830.
[收稿日期] 1999-03-31 [修回日期] 1999-10-07, 百拇医药
单位:刘建康(广州医学院组织胚胎学教研室,广东 广州 510182);黄少华(广州医学院第一附属医院心脏病研究室);陈敏生(广州医学院第二附属医院心内科)
关键词:神经肽Y;肌,平滑,血管;细胞;免疫组织化学
中国病理生理杂志000113
[摘 要] 目的:探讨神经肽Y和肾素-血管紧张素系统之间的相互作用与高血压疾病发生之间的关系。方法:应用快速微量MTT比色法和荧光免疫组化定量技术,观察神经肽Y对体外培养血管平滑肌细胞增殖活度和血管平滑肌细胞核细胞增殖抗原表达的影响以及血管紧张素Ⅱ受体拮抗剂losartan对其影响的干预作用。结果:神经肽Y可刺激体外培养血管平滑肌细胞的增殖、使其增殖活度(MTT-OD值)和细胞内核增殖抗原(PCNA)的表达明显高于对照组(P<0.01)。而losartan则可降低神经肽Y对血管平滑肌细胞增殖活度(MTT-OD值)的刺激作用,减少细胞内核增殖抗原(PCNA)的表达。结论:神经肽Y可促进体外培养的血管平滑肌细胞的增殖,并部分通过血管紧张素Ⅱ受体起作用。
, 百拇医药
[中图分类号] Q253 [文献标识码] A
[文章编号]1000-4718(2000)01-0046-04
The stimulating effects of neuropeptide Y on cultured arterial smooth muscle cell proliferation and losartan treatment
LIU Jian-kang, HUANG Shao-hua, CHEN Min-sheng
(Department of Histology and Embryology, Guangzhou Medical College, Guangzhou 510182, China)
[Abstract] AIM:To investigate the interplay between the neuropeptide Y(NPY) and renin-angiotensin system, and relationship to the pathogenesis of hypertension. METHODS: The method of cellular culture, MTT colorimetric assay and quantitative immunocytochemistry through ACAS570 were performed for the effect of neuropeptide Y on proliferation of cultured rat vascular smooth muscle cell (VSMC) and losartan treatment. RESULTS:It was observed that exposure of VSMC to neuropeptide Y could stimulate the proliferation of VSMC and caused increase respectively in MTT OD values and expression of proliferating cell nulear antigen(PCNA) but losartan interfered with NPY stimulating effects on VSMC and decreased MTT OD values and expression of PCNA. CONCLUSION:These results demonstrated that the NPY could promote proliferation of VSMC, this effect was partly preformed through angiotensin Ⅱ receptor.
, 百拇医药
[MeSH] Neuropeptide Y; Muscle, smooth, vascular; Cells; Immunohistochemistry
神经体液因素中神经肽Y(neuropeptide Y, NPY)对心血管系统生理调节作用与多种心血管疾病的发生密切相关。我们研究发现:NPY不仅影响血管内皮细胞的形态特征[1],而且可改变内皮细胞源性血管收缩与舒张功能间的平衡[2]。但神经肽Y是否可直接刺激血管平滑肌细胞(vascular smooth muscle cell, VSMC)发生增殖或肥大?对血管的调节作用是否与血管局部的肾素-血管紧张素系统活性高低密切相关?并由此在导致高血压血管重塑中发挥重要的作用,研究证据并不充分。本研究运用快速微量MTT比色法(MTT colorimetric assay)和荧光免疫组化定量技术观察NPY作用下VSMC增殖活度和细胞增殖核抗原(proliferating cell nuclear antigen, PCNA)的表达以及losartan对NPY作用的干预,以探讨NPY和肾素-血管紧张素系统在高血压疾病发生中的作用。
, http://www.100md.com
材 料 和 方 法
一、VSMC的体外培养:
组织贴块法培养VSMC。无菌条件下分离SD大鼠的胸主动脉,剪碎后加入适量含10%胎牛血清的DMEM(GiBco公司产品)培养液,37℃、5%CO2培养箱中静置培养。用光镜和免疫化学方法进行鉴定。细胞传代后,选择生长良好的第6~7代VSMC用于实验。
二、实验分组及NPY和losartan条件培养液的配制:
实验共分三组,对照组、NPY组和NPY+losartan组。实验组分别加入NPY(10-6 mol/L)和NPY+losartan(10-5 g/L)条件培养液,而对照组为无血清DMEM培养液。
三、VSMC增殖活性的测定(自动微量MTT比色法)[3]:
, 百拇医药
选择第6代生长良好的VSMC,消化传代至96孔培养板上,传代细胞密度为5.0×107/L。细胞经18 h的预培养和6 h的预处理后,分别将NPY、NPY+losartan条件培养液和无血清、无酚红DMEM培养液加入实验组和对照组,37℃、5%CO2培养24 h,再加入0.5%四甲基偶氮唑盐(Sigma,美国,简称MTT)50 μL,继续培养4 h后,加入二甲基亚枫(dimethyl sulfoxide, DMSO北京化工厂)150 μL终止培养,震摇2 min后,以550 nm波长在自动酶标仪下检测每孔样品中MTT结晶所形成的光密度值(OD值)。
四、VSMC核增殖抗原的表达:
细胞消化传代至24孔培养板,细胞处理与方法三相同。吸去培养液后,用pH7.3的PBS洗板3次,3%多聚甲醛固定30 min,PBS洗3次。
已固定样品按常规免疫组织化学方法处理。首先,5%正常山羊血清封闭,室温孵育30 min;倾去血清,滴加稀释度为1∶50鼠抗大鼠PCNA单克隆抗体(美国Santa Cruz公司产品),4℃冰箱过夜。样品倾去抗体孵育液,PBS洗3次,换加1∶10 FITC荧光标记兔抗鼠抗体(天象人公司产品),室温孵育40 min后,PBS充分洗板,每待测样品加入100 μL PBS后,分别置带电脑激光扫描共焦显微细胞仪(ACAS570UVC型,美国MERIDIAN公司)下,选用40×物镜,7%滤光片,确定激发光波长为488 nm,进入Kinetics-Image Scan程序,预扫描后选定最佳细胞扫描参数,选定视野激光扫描并存储所采集的各项实验数据。细胞扫描总数在200个以上。
, 百拇医药
五、统计处理:
数据采集完成以后,进入Kinetics-Image Analysis程序,分析和处理各次实验存储数据,自动得出统计结果。数据均以
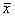 ±s表示,均数差异显著性用t检验判定。
±s表示,均数差异显著性用t检验判定。结 果
一、VSMC的鉴定:
倒置显微镜下可见细胞生长呈典型的“谷与峰”结构特征,a-actin单克隆抗体免疫细胞化学显示95%为阳性VSMC。
二、NPY对VSMC增殖活度的影响及losartan的干预作用:
自动微量MTT比色法检测结果显示:NPY组MTT-OD值显著高于对照组(P<0.01);NPY+losartan组MTT-OD值则低于对照组(P<0.05)(见表1)。
, http://www.100md.com
三、NPY对VSMC中PCNA表达的影响及losartan的干预作用:
激光扫描共焦显微细胞仪借助免疫荧光显示技术对单个粘附式细胞内的各种动态参数进行图像分析处理,准确地定量细胞内核酸、蛋白质等被标记物质的变化。因此,检测细胞内被标记PCNA的平均荧光值即可反映其表达。在激光扫描共焦显微细胞仪下见NPY组被标记细胞的荧光强于对照组;而NPY+losartan组的荧光则弱于对照组(见图1~3)。各组平均荧光值的统计分析结果显示:NPY组PCNA平均荧光值高于对照组(P<0.05),NPY+losartan组与对照组无显著差异(见表1)。
讨 论
VSMC的异常增殖或肥大是高血压发病早期血管构型改变重要的形态学特征,其发生与NPY和血管局部肾素-血管紧张素系统的功能改变密切相关[4,5]。我们曾研究发现NPY不仅改变体外培养VSMC的形态特征[1],而且,通过影响血管内皮细胞源性的舒缩平衡以调节血管的功能状态[2],从而在高血压的发病中发挥重要作用。本实验研究用MTT比色法和激光扫描共焦显微细胞仪证实,NPY可刺激体外培养VSMC的增殖活性,提高细胞中PCNA的表达水平。其中,MTT比色-OD值较对照组增加14.7%。MTT比色法是通过显示细胞线粒体代谢酶活性的高低,间接反映细胞的增殖活性;而PCNA则是细胞核中DNA聚合酶的附属蛋白,其主要生物学作用是促进细胞核中DNA链的合成与延伸,促进细胞的生长和增殖[6];MTT-OD值和PCNA表达水平的变化说明NPY可引起VSMC增殖或肥大。但是,实验结果中MTT-OD值和PCNA平均荧光值升高的幅度并不很大,这似乎提示NPY对VSMC增殖或肥大的刺激作用存在着一定差异。我们推测NPY的这种刺激作用很可能与NPY促进VSMC中DNA或蛋白质的合成,促使VSMC发生肥大。这一推测也与吴翠环等的研究结果基本吻合[7]。这也可解释高血压阻力性动脉中层的增厚很可能是由于VSMC在NPY或其他神经体液因素作用下发生肥大的结果[8]。
, http://www.100md.com
表1 NPY刺激平滑肌细胞增殖和losartan的干预
Tab 1 The stimulating effects of NPY on cultured
vascular smooth muscle cell proliferation and losartan treatment (
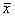 ±s, n=36) Group
±s, n=36) GroupMTT-OD
PCNA
Control
0.2239±0.0010
1542.71±200.04
, http://www.100md.com
NPY
0.2626±0.0025**
1648.56±232.71*
NPY+losartan
0.2440±0.0013*
1544.86±256.06
*P<0.05, **P<0.01, vs control

Fig 1 The PCNA expressions of VSMC in control group
, 百拇医药
图1 对照组体外培养VSMC中PCNA表达的平均荧光值

Fig 2 The PCNA expressions of VSMC in NPY group
图2 NPY组体外培养VSMC中PCNA表达的平均荧光值

Fig 3 The PCNA expressions of VSMC in Losartan+NPY group
图3 Losartan+NPY组体外培养VSMC中PCNA表达的平均荧光值
在外周神经系统中,NPY主要和去甲肾上腺素共存于分布于血管壁上的交感神经纤维末梢,直接引起VSMC的收缩,并增强血管对缩血管物质的敏感性。已发现去甲肾上腺素在交感神经纤维末梢中的释放受突触前膜受体的影响,激动突触前膜血管紧张素Ⅱ受体、β受体都可促进去甲肾上腺素的释放,血管紧张素转换酶抑制剂通过抑制血管紧张素Ⅱ的产生也可产生抑制去甲肾上腺素释放的结果[9]。但是有关NPY在肾素-血管紧张素系统中的作用研究尚较少见,对这一机制的研究有助于阐明NPY与肾素-血管紧张素系统在血管调节过程中的相互作用关系。血管紧张素Ⅱ受体拮抗剂losartan是90年代以来新合成的AT1受体阻断剂,和其他非肽类受体阻断剂如saralasin相比,losartan的显著特点是没有部分激动作用,与AT1受体具有较高的亲和力,低浓度时仍不与其它受体发生亲合作用,特异性强;且losartan和其主要活性代谢产物EXP3174对AT1受体均有明显的拮抗作用[10]。本实验将losartan加入到NPY作用的培养体系中,其目的就是要观察肾素-血管紧张素系统对NPY刺激VSMC增殖作用的影响。结果显示:在低于正常用药的血药浓度(losartan为10-5 g/L)时,即可抑制NPY对VSMC增殖的刺激作用,降低MTT比色的OD值和PCNA表达的平均荧光值。说明肾素-血管紧张素系统可影响NPY的血管调节作用;同时也提示losartan不仅通过阻断血管紧张素Ⅱ受体的作用降低血压,而且也影响NPY的血管调节机制而参与高血压的治疗。
, 百拇医药
[参 考 文 献]
[1] 刘建康,邓漪平.神经肽Y和血管活性肠肽对培养内皮细胞形态特征的影响 [J]. 广州医学院学报,1997,25(5):1~6.
[2] 刘建康,邓漪平. 神经肽Y和血管活性肠肽对内皮源性血管舒缩功能的调节作用 [J]. 中国动脉硬化杂志,1998,6(1):42~45.
[3] 郑永唐,贲昆龙. 测定细胞存活和增殖的MTT方法的建立 [J]. 免疫学杂志,1992, 8(4):266~268.
[4] 刘健康,邓漪平. 内皮细胞和神经系统间相互作用与动脉粥样硬化 [J]. 中国动脉硬化杂志,1997,5(3):272~276.
[5] Beck BC, Corson MA. Angiotensin Ⅱ signal transduction in vascular smooth muscle: role of tryosine kinases [J]. Circ Res, 1997, 80(5):607~616.
, 百拇医药
[6] Siltonen SM, Isola JJ, Rantala IS, et al. Intratumour variation in cell proliferation in breast carcinoma as determined by antiproliferating cell nuclear antigen monoclonal antibody and automated image analysis [J]. Am J Clin Pathol, 1993, 99:226~231.
[7] 吴翠环,任大宏, 陈多恩. 神经肽Y对培养的自发性高血压大鼠动脉平滑肌细胞的影响[J]. 同济医科大学学报,1998, 27(1):19~21.
[8] Chen H, Felscher C, Schafer RF, et al. Effects of noradrenaline and neuropeptide Y on rat mesenteric microvessle contraction[J]. Nauny Schmiedebergs Arch Pharmacol, 1996, 353(3):314~332.
, 百拇医药
[9] Van Valdhuissen DJ, Brodde OE, van Gilst WH, et al. Relation between myocardial beta-adrenoceptor density and hemodynamic and neurohumoral changes in a rat model of chronic myocardial infarction: effects ibopamine and captopril [J]. Cardiovasc Res, 1995, 30:346~351.
[10] Wong PC, Price WA, Chiu AT, et al. Nonpeptide angiotensin Ⅱ receptor antagonist:studies with EXP9270 and Du 753 [J]. Hypertension, 1990, 15:823~830.
[收稿日期] 1999-03-31 [修回日期] 1999-10-07, 百拇医药