鼠伤寒沙门菌L型变异引起细菌质粒和外膜蛋白的丢失
作者:骆卫锋 胡志荣 赵凤兰 胡 军 徐友梅
单位:骆卫锋 胡志荣 赵凤兰 胡军 徐友梅(河南医科大学微生物学与免疫学教研室 郑州 450052)
关键词:鼠伤寒沙门菌;细菌L型;质粒;外膜蛋白
河南医科大学学报990224 摘要 目的:了解鼠伤寒沙门菌L型变异对细菌质粒和外膜蛋白的影响。方法:在鼠伤寒沙门菌L型的诱导传代过程中,取传不同代的L型细菌提取质粒,观察质粒图谱的变化。提取鼠伤寒沙门菌稳定L型的外膜蛋白,通过聚丙烯酰胺凝胶电泳观察外膜蛋白的变化。结果:鼠伤寒沙门菌L型在诱导传代过程中原菌的质粒逐渐以致全部丢失,大多数外膜蛋白亦丢失。结论:鼠伤寒沙门菌发生L型变异后,原菌的质粒不能稳定遗传,且有外膜蛋白的丢失。
中图分类号 R378.2
L-Forms variation of Salmonella typhimurium causes the loss of plasmids and outer membrane proteins
, http://www.100md.com
Luo Weifeng,Hu Zhirong,Zhao Fenglan,Hu Jun,Xu Youmei
Department of Microbiology and Immunology,Henan Medical University,Zhengzhou 450052
Abstract Aim:To investigate the influence of the L-forms variation of Salmonella typhimurium on their plasmids and outer membrane proteins.Methods:In the process of induction and regeneration of Salmonella typhimurium L-forms,plasmid profiles of different generations were screened,and outer membrane proteins of the stable L-forms were extracted and examined by SDS-PAGE.Results:The plasmids of the parents were gradually and at last completely lost in the process of regeneration of L-forms,and most outer membrane proteins were also lost.Conclusion:With the L-forms variation of Salmonella typhimurium the plasmids could not be inherited constantly and most outer membrane proteins were lost.
, 百拇医药
Key words Salmonella typhimurium;bactarial L-form; plasmid;outer membrane protein
细菌质粒的稳定遗传有赖于细菌分裂时子代细菌之间隔膜的形成,细胞壁的合成是隔膜形成的基础[1,2]。L型细菌的细胞壁合成障碍对其质粒遗传的影响目前尚不清楚。革兰阴性细菌发生L型变异后,对外膜蛋白的影响也不清楚。本研究旨在了解鼠伤寒沙门菌L型变异对其质粒和外膜蛋白的影响,以期有助于对鼠伤寒沙门菌L型感染的诊断和治疗,并为其他革兰阴性细菌L型质粒和外膜蛋白的研究提供参考。
1 材料与方法
1.1 菌株 鼠伤寒沙门菌标准株STM50115,购自北京生物制品研究所;鼠伤寒沙门菌野生株STM16和STM69,分离自腹泻患者;3株鼠伤寒沙门菌L型STM50115L型、STM16L型和STM69L型,分别由以上3株鼠伤寒沙门菌用羧苄青霉素诱导获得。
, 百拇医药
1.2 培养基 改良Kagan培养基;LB培养基。
1.3 质粒检测 取改良Kagan平板上的L型菌落和LB平板上的原菌菌落,用Kado-Liu法[3]提取质粒,提取液以7g/L琼脂糖凝胶电泳。质粒相对分子质量计算参照Hausen和Olson[4]方法进行。
1.4 外膜蛋白提取和SDS-PAGE 取用改良Kagan液体培养基培养的鼠伤寒沙门菌L型及其原菌的培养物沉淀,以3g/LNaCl调整细菌浓度至300亿/ml。取30ml离心,弃去上清,沉淀物加10mmol/LTris.HCl至30ml。按文献[5]方法,超声破碎15min;12000r/min离心10min;取上清40000r/min离心2h;20g/LTritonX-100溶解沉淀,室温作用30min,40000r/min离心2h,双蒸水溶解沉淀。SDS-PAGE参照Leammli[6]方法,分离胶浓度为100g/L,浓缩胶浓度为50g/L,考马斯亮蓝R250染色。
, 百拇医药
2 结果
2.1 鼠伤寒沙门菌L型质粒图谱的变化 所用的3株鼠伤寒沙门菌有2株携带质粒,STM16携带相对分子质量为62.5×106的质粒,STM69携带相对分子质量为4.6×106、3.0×106、2.7×106和1.6×106的4种质粒。在L型诱导初期,2株L型菌在改良Kagan平板传至5代时,STM16L型仍有相对分子质量为62.5×106的质粒,STM69L型只显示相对分子质量为1.6×106的质粒,丢失了相对分子质量为4.6×106、3.0×106和2.7×106的质粒(图1)。当2株L型菌传至第20代时,二者的质粒均全部丢失(图2)。其间取STM16L型第5代的1个菌落传第6代,取第6代的20个菌落分别扩增后提取质粒。结果11个菌落的扩增菌检出相对分子质量为62.5×106的质粒,其余9个菌落的扩增菌未检出质粒。

, http://www.100md.com
图1 第5代STML型及其原菌的质粒图谱
A:大肠埃希菌V517;B:STM16原菌,携带相对分子质量为62.5×106的质粒;C:STM16L型第5代,相对分子质量为62.5×106质粒未丢失;D:STM69原菌,携带相对分子质量为4.6×106、3.0×106、2.7×106和1.6×106质粒;E:STM69L型第5代,只有相对分子质量为1.6×106质粒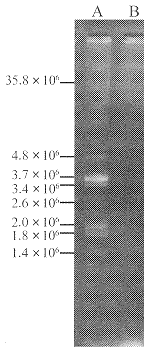

图2 第20代STM L型及其原菌的质粒图谱
A:大肠埃希菌V517;B:STM16原菌;C:STM16L型第20代,质粒丢失;D:STM69原菌;E:STM69L型第20代,质粒全部丢失
, http://www.100md.com
2.2 外膜蛋白SDS-PAGE图谱 3株鼠伤寒沙门菌的主要外膜蛋白相同,相对分子质量位于36×106~41×106之间,次要外膜蛋白3株间略有不同。3株STML型均只显示较弱的相对分子质量为36×106、37×106和38×106的微孔蛋白(porins)带,缺失原菌的其他外膜蛋白带(图3)。
图3 3株STML型及其原菌的外膜蛋白SDS-PAGE
A:低相对分子质量标准蛋白;B:STM50115原菌;C:STM50115L型;D:STM16原菌;E:STM16L型;F:STM69原菌;G:STM69L型
3 讨论
, 百拇医药 细菌质粒稳定遗传的机制目前尚不清楚。一些研究发现质粒上有一段DNA序列与质粒的遗传有关,称之为par基因。正常细菌进行二分裂时,子代细菌间形成一隔膜(septum),质粒par区须与隔膜起始处的细胞膜结合,质粒才能分配到两个子代细菌中[1,2]。细胞壁的合成是隔膜形成的基础。L型细菌的细胞壁缺陷,细菌分裂异常,质粒的遗传有可能受到影响。有研究发现金黄色萄萄球菌和乳链球菌的原生质体在传代过程中有质粒的丢失[7,8]。本研究发现鼠伤寒沙门菌L型在传代过程中,原菌携带的质粒逐渐以致全部丢失,且同一菌落中的细菌可以携带或不携带某一质粒。由此推测鼠伤寒沙门菌L型可能由于细胞壁缺陷,细菌分裂异常,从而影响了质粒的稳定遗传。质粒的丢失将导致质粒编码的生物学性状随之丢失。这一现象在细菌L型的研究中应当引起重视。STM16携带的相对分子质量62.5×106质粒已知与细菌的毒力有关[9],STM69携带的4种质粒的功能不清。基于细菌的L型变异可导致质粒的丢失,作者认为可通过将细菌诱导为L型,然后进行筛选,获得携带和不携带某一质粒的菌株,从而对单个质粒的功能进行研究。
, http://www.100md.com
革兰阴性细菌的外膜蛋白在维持外膜结构、保证物质转运和抗感染免疫中起重要作用。本研究中外膜蛋白电泳显示,STML型的porins蛋白明显减弱,其他外膜蛋白均不能显示。作者所用STML型以透射电镜行超微结构观察时见到少数L型细菌有部分细胞壁残留,分析认为电泳显示的较弱的porins蛋白可能系这部分残留细胞壁中所含,其他外膜蛋白因含量太少而不能显示,而完全缺壁的细菌则可能完全缺失外膜蛋白。外膜蛋白缺失的原因有两种可能性,一是编码外膜蛋白的基因缺失或被抑制,另一种是细菌能合成外膜蛋白,但由于细胞壁缺陷,合成的外膜蛋白分泌到细胞外,在提取时不能提出。作者认为后者的可能性较大。鼠伤寒沙门菌L型外膜蛋白的缺失对其代谢、致病性和免疫原性的影响有待进一步研究。
参考文献
[1] Austin S,Abeles A. Partition of unit-copy miniplasmids to daughter cells. Pl and F miniplasmids contain discrete,interchangable sequences sufficient to promote equipartition. J Mol Biol,1983,169:353
, http://www.100md.com
[2] Gustatsson P,Walf-watz H,Lind L,et al. Binding between the par region of plasmid R1 and pSc101 and the outer membrane fraction of the host bacteria. EMBO J,1983,2:27
[3] Kado CI,Liu ST. Rapid procedure for detection and isolation of large and small plasmids. J Bacteriol,1981,145(3):1365
[4] 陈永南.DNA体外重组技术.见:吴鹤龄,林锦湖主编.遗传学实验方法.北京:高等教育出版社,1983.42
[5] Schraitman CA. Solubization of the cytoplasmic membrane of Escherichia coli by Triton X-100. J Bacteriol,171,108(1):545
, 百拇医药
[6] Laemmli UK. Cleavage of structural proteins during assembly of the head of bacteriophage T4. Nature,1970,227:680
[7] Novick R,Sanchez-Riva SC,Gruss A,et al. Involvement of the cell envcelope in plasmid curing during the regenerating of protoplasts. Plasmid,1980,3:348
[8] Grusson MJ. Plasmid complement of Streptococcus lactis NCDO712 and other lactis streptococci after protoplast-induced curing. J Bacterrol,1983,154(1):1
[9] Jones GW,Rabert DK,Svinarich DM,et al. Association of adhesive,invasive and virulent phenotypes of Salmonella typhimurium with autonomous 60-Megodalton plasmid. Infect Immun,1985,148(1):175
(1998-08-31收稿), 百拇医药
单位:骆卫锋 胡志荣 赵凤兰 胡军 徐友梅(河南医科大学微生物学与免疫学教研室 郑州 450052)
关键词:鼠伤寒沙门菌;细菌L型;质粒;外膜蛋白
河南医科大学学报990224 摘要 目的:了解鼠伤寒沙门菌L型变异对细菌质粒和外膜蛋白的影响。方法:在鼠伤寒沙门菌L型的诱导传代过程中,取传不同代的L型细菌提取质粒,观察质粒图谱的变化。提取鼠伤寒沙门菌稳定L型的外膜蛋白,通过聚丙烯酰胺凝胶电泳观察外膜蛋白的变化。结果:鼠伤寒沙门菌L型在诱导传代过程中原菌的质粒逐渐以致全部丢失,大多数外膜蛋白亦丢失。结论:鼠伤寒沙门菌发生L型变异后,原菌的质粒不能稳定遗传,且有外膜蛋白的丢失。
中图分类号 R378.2
L-Forms variation of Salmonella typhimurium causes the loss of plasmids and outer membrane proteins
, http://www.100md.com
Luo Weifeng,Hu Zhirong,Zhao Fenglan,Hu Jun,Xu Youmei
Department of Microbiology and Immunology,Henan Medical University,Zhengzhou 450052
Abstract Aim:To investigate the influence of the L-forms variation of Salmonella typhimurium on their plasmids and outer membrane proteins.Methods:In the process of induction and regeneration of Salmonella typhimurium L-forms,plasmid profiles of different generations were screened,and outer membrane proteins of the stable L-forms were extracted and examined by SDS-PAGE.Results:The plasmids of the parents were gradually and at last completely lost in the process of regeneration of L-forms,and most outer membrane proteins were also lost.Conclusion:With the L-forms variation of Salmonella typhimurium the plasmids could not be inherited constantly and most outer membrane proteins were lost.
, 百拇医药
Key words Salmonella typhimurium;bactarial L-form; plasmid;outer membrane protein
细菌质粒的稳定遗传有赖于细菌分裂时子代细菌之间隔膜的形成,细胞壁的合成是隔膜形成的基础[1,2]。L型细菌的细胞壁合成障碍对其质粒遗传的影响目前尚不清楚。革兰阴性细菌发生L型变异后,对外膜蛋白的影响也不清楚。本研究旨在了解鼠伤寒沙门菌L型变异对其质粒和外膜蛋白的影响,以期有助于对鼠伤寒沙门菌L型感染的诊断和治疗,并为其他革兰阴性细菌L型质粒和外膜蛋白的研究提供参考。
1 材料与方法
1.1 菌株 鼠伤寒沙门菌标准株STM50115,购自北京生物制品研究所;鼠伤寒沙门菌野生株STM16和STM69,分离自腹泻患者;3株鼠伤寒沙门菌L型STM50115L型、STM16L型和STM69L型,分别由以上3株鼠伤寒沙门菌用羧苄青霉素诱导获得。
, 百拇医药
1.2 培养基 改良Kagan培养基;LB培养基。
1.3 质粒检测 取改良Kagan平板上的L型菌落和LB平板上的原菌菌落,用Kado-Liu法[3]提取质粒,提取液以7g/L琼脂糖凝胶电泳。质粒相对分子质量计算参照Hausen和Olson[4]方法进行。
1.4 外膜蛋白提取和SDS-PAGE 取用改良Kagan液体培养基培养的鼠伤寒沙门菌L型及其原菌的培养物沉淀,以3g/LNaCl调整细菌浓度至300亿/ml。取30ml离心,弃去上清,沉淀物加10mmol/LTris.HCl至30ml。按文献[5]方法,超声破碎15min;12000r/min离心10min;取上清40000r/min离心2h;20g/LTritonX-100溶解沉淀,室温作用30min,40000r/min离心2h,双蒸水溶解沉淀。SDS-PAGE参照Leammli[6]方法,分离胶浓度为100g/L,浓缩胶浓度为50g/L,考马斯亮蓝R250染色。
, 百拇医药
2 结果
2.1 鼠伤寒沙门菌L型质粒图谱的变化 所用的3株鼠伤寒沙门菌有2株携带质粒,STM16携带相对分子质量为62.5×106的质粒,STM69携带相对分子质量为4.6×106、3.0×106、2.7×106和1.6×106的4种质粒。在L型诱导初期,2株L型菌在改良Kagan平板传至5代时,STM16L型仍有相对分子质量为62.5×106的质粒,STM69L型只显示相对分子质量为1.6×106的质粒,丢失了相对分子质量为4.6×106、3.0×106和2.7×106的质粒(图1)。当2株L型菌传至第20代时,二者的质粒均全部丢失(图2)。其间取STM16L型第5代的1个菌落传第6代,取第6代的20个菌落分别扩增后提取质粒。结果11个菌落的扩增菌检出相对分子质量为62.5×106的质粒,其余9个菌落的扩增菌未检出质粒。


, http://www.100md.com
图1 第5代STML型及其原菌的质粒图谱
A:大肠埃希菌V517;B:STM16原菌,携带相对分子质量为62.5×106的质粒;C:STM16L型第5代,相对分子质量为62.5×106质粒未丢失;D:STM69原菌,携带相对分子质量为4.6×106、3.0×106、2.7×106和1.6×106质粒;E:STM69L型第5代,只有相对分子质量为1.6×106质粒


图2 第20代STM L型及其原菌的质粒图谱
A:大肠埃希菌V517;B:STM16原菌;C:STM16L型第20代,质粒丢失;D:STM69原菌;E:STM69L型第20代,质粒全部丢失
, http://www.100md.com
2.2 外膜蛋白SDS-PAGE图谱 3株鼠伤寒沙门菌的主要外膜蛋白相同,相对分子质量位于36×106~41×106之间,次要外膜蛋白3株间略有不同。3株STML型均只显示较弱的相对分子质量为36×106、37×106和38×106的微孔蛋白(porins)带,缺失原菌的其他外膜蛋白带(图3)。

图3 3株STML型及其原菌的外膜蛋白SDS-PAGE
A:低相对分子质量标准蛋白;B:STM50115原菌;C:STM50115L型;D:STM16原菌;E:STM16L型;F:STM69原菌;G:STM69L型
3 讨论
, 百拇医药 细菌质粒稳定遗传的机制目前尚不清楚。一些研究发现质粒上有一段DNA序列与质粒的遗传有关,称之为par基因。正常细菌进行二分裂时,子代细菌间形成一隔膜(septum),质粒par区须与隔膜起始处的细胞膜结合,质粒才能分配到两个子代细菌中[1,2]。细胞壁的合成是隔膜形成的基础。L型细菌的细胞壁缺陷,细菌分裂异常,质粒的遗传有可能受到影响。有研究发现金黄色萄萄球菌和乳链球菌的原生质体在传代过程中有质粒的丢失[7,8]。本研究发现鼠伤寒沙门菌L型在传代过程中,原菌携带的质粒逐渐以致全部丢失,且同一菌落中的细菌可以携带或不携带某一质粒。由此推测鼠伤寒沙门菌L型可能由于细胞壁缺陷,细菌分裂异常,从而影响了质粒的稳定遗传。质粒的丢失将导致质粒编码的生物学性状随之丢失。这一现象在细菌L型的研究中应当引起重视。STM16携带的相对分子质量62.5×106质粒已知与细菌的毒力有关[9],STM69携带的4种质粒的功能不清。基于细菌的L型变异可导致质粒的丢失,作者认为可通过将细菌诱导为L型,然后进行筛选,获得携带和不携带某一质粒的菌株,从而对单个质粒的功能进行研究。
, http://www.100md.com
革兰阴性细菌的外膜蛋白在维持外膜结构、保证物质转运和抗感染免疫中起重要作用。本研究中外膜蛋白电泳显示,STML型的porins蛋白明显减弱,其他外膜蛋白均不能显示。作者所用STML型以透射电镜行超微结构观察时见到少数L型细菌有部分细胞壁残留,分析认为电泳显示的较弱的porins蛋白可能系这部分残留细胞壁中所含,其他外膜蛋白因含量太少而不能显示,而完全缺壁的细菌则可能完全缺失外膜蛋白。外膜蛋白缺失的原因有两种可能性,一是编码外膜蛋白的基因缺失或被抑制,另一种是细菌能合成外膜蛋白,但由于细胞壁缺陷,合成的外膜蛋白分泌到细胞外,在提取时不能提出。作者认为后者的可能性较大。鼠伤寒沙门菌L型外膜蛋白的缺失对其代谢、致病性和免疫原性的影响有待进一步研究。
参考文献
[1] Austin S,Abeles A. Partition of unit-copy miniplasmids to daughter cells. Pl and F miniplasmids contain discrete,interchangable sequences sufficient to promote equipartition. J Mol Biol,1983,169:353
, http://www.100md.com
[2] Gustatsson P,Walf-watz H,Lind L,et al. Binding between the par region of plasmid R1 and pSc101 and the outer membrane fraction of the host bacteria. EMBO J,1983,2:27
[3] Kado CI,Liu ST. Rapid procedure for detection and isolation of large and small plasmids. J Bacteriol,1981,145(3):1365
[4] 陈永南.DNA体外重组技术.见:吴鹤龄,林锦湖主编.遗传学实验方法.北京:高等教育出版社,1983.42
[5] Schraitman CA. Solubization of the cytoplasmic membrane of Escherichia coli by Triton X-100. J Bacteriol,171,108(1):545
, 百拇医药
[6] Laemmli UK. Cleavage of structural proteins during assembly of the head of bacteriophage T4. Nature,1970,227:680
[7] Novick R,Sanchez-Riva SC,Gruss A,et al. Involvement of the cell envcelope in plasmid curing during the regenerating of protoplasts. Plasmid,1980,3:348
[8] Grusson MJ. Plasmid complement of Streptococcus lactis NCDO712 and other lactis streptococci after protoplast-induced curing. J Bacterrol,1983,154(1):1
[9] Jones GW,Rabert DK,Svinarich DM,et al. Association of adhesive,invasive and virulent phenotypes of Salmonella typhimurium with autonomous 60-Megodalton plasmid. Infect Immun,1985,148(1):175
(1998-08-31收稿), 百拇医药