MxA抗病毒蛋白的研究进展
作者:杨吉成
单位:苏州医学院基因工程研究室,苏州,215007
关键词:
苏州医学院学报000601 MxA是新发现的由Ⅰ型干扰素(IFNα/β)诱导人细胞所产生的78kd的新型抗病毒蛋白。开展MxA蛋白研究很有医学价值,现综述如下。
1 Mx基因及其蛋白的发现与命名
1964年,Lindenmann发现A2G小鼠能耐受对其它小鼠致死剂量的流感病毒感染。这种特性是从小鼠16号染色体上单一显性等位基因遗传获得的,因能抵抗粘液病毒(流感)而命名为Mx基因。体内外研究表明,这种抗流感病毒作用是受IFNα/β调节,而不受IFN-γ调节。Horisberger等发现,Mx+细胞经IFNα诱导后与Mx-细胞的差别是多出一条75kd的多肽,而且这种多肽也只有在IFNα/β诱导后产生,IFNγ不能产生,将这种多肽统一命名为Mx蛋白[1]。
, http://www.100md.com
2 Mx基因类型和蛋白的诱导表达
近来研究发现,小鼠的Mx基因有Mx1、Mx2两类,也有Mx3的报告,但能发挥抗病毒作用的是由Mx1基因编码的75kd的Mx1蛋白,能于体内外抵抗流感病毒感染。Mx2、Mx3在实验鼠中未发现有抗病毒功能[2]。人的Mx基因包括MxA和MxB两类。MxA基因位于人21号染色体长臂上,经IFNα/β处理可诱导产生78kd的MxA蛋白,分布于细胞的胞浆内,这种胞浆蛋白可直接发挥对流感病毒和滤泡性口腔炎病毒(VSV)的抗病毒效应,而MxB未发现有抗病毒活性。
除小鼠和人的Mx基因可表达抗病毒作用的Mx蛋白外,在其它哺乳类动物细胞,甚至在鱼、蛙、禽类的细胞中也发现了类似的Mx基因的表达,并且有抗病毒活性[3]。
猪细胞经IFNα或双股RNA诱导后可产生76kd的Mx1蛋白,并具有抗流感病毒和VSV活性;另一种73kd的Mx2无此活性。牛和马的Mx基因已被克隆,经分析牛的Mx蛋白与人、鼠、羊的Mx蛋白相比,分别有73%、63%、93%的同源性[4,5]。
, 百拇医药
鸡的Mx蛋白含有705个氨基酸,可以抗流感病毒、VSV、Thogoto病毒、Sendai病毒(Bernasconi D,1995)。此外在鸭胚细胞培养时,用新城鸡瘟病毒(NDV)或双股RNA处理后,可表达鸭Mx mRNA及72~82kd的Mx蛋白,并呈现由IFNα诱导哺乳类细胞所产生的Mx蛋白的结构和抗病毒活性[6]。
3 MxA蛋白对病毒的敏感性及其抗病毒机理
国外大量的研究资料表明,MxA蛋白主要对RNA病毒敏感,其中负股RNA病毒包括弹状病毒(VSV),副粘病毒(RSV、麻疹病毒、3型副流感病毒),布尼亚病毒〔汉坦(Hantavirus)病毒、Thogoto病毒、白蛉病毒〕,正粘病毒(流感病毒)。正股RNA病毒包括披膜病毒(塞姆利基森林病毒和sindbis病毒),黄病毒(壁虱脑炎病毒、黄热病毒)。我们的实验证明,10ng/ml的纯品MxA可以抵抗20 TCID50的HSV-I和Ad3 DNA病毒对细胞的感染,说明MxA对DNA病毒也有抑制作用(待发表资料)。
, 百拇医药
Koshs等认为,由IFNα/β诱导产生的人MxA蛋白属于大分子(78kd)GTP酶,能抵抗各种RNA病毒,如:Thogoto病毒、类流感病毒、正粘病毒等感染细胞。实验证明,纯品MxA蛋白能识别病毒新合成的核糖核蛋白复合物(vRNPs),并能紧密结合,通过MxA的GTP酶活性对病毒核衣壳发挥水解作用,进而可阻止上述病毒核衣壳转运至细胞核内,阻止病毒基因组的核内复制[7~9]。现以MxA蛋白抗Thogoto病毒为例,其抗病毒机理见附图。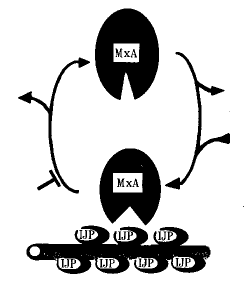
附图 MxA蛋白的抗病毒作用机理
MxA蛋白有两种构型,一种是非活性的GDP结合形式,另一种是活性的GTP结合形式,MxA和Mx1基因均具有与GTP结构中G××××GKs、D××G和TKD×(×代表某种氨基酸位点)3个相一致的结合位点,MxA蛋白只有在与病毒的核糖核蛋白体(RNP)中的NP(核蛋白)紧密结合后,方可使MxA的构型发生改变,而使MxA蛋白活化,活化的构型又可受到GTPγs的稳定作用(GTPγs是GTP的非水解类似物),活化的MxA发挥对核衣壳的水解作用是发生在MxA蛋白 羧基端。GTP发挥水解作用后又可转换成非活化的GDP形式,GTP/GDP的转换率约为40次/min,Km值约为700mmol/L。
, 百拇医药
若从MxA蛋白羧基端去除7个氨基酸,使纯品MxA蛋白的GTP酶活性隆至14%,从羧基端去除63个氨基酸,结果完全失去水解GTP的能力,而且不能与鸟嘌呤核苷酸酶结合。相反从氨基端缺乏301个氨基酸,羧基端缺失87个氨基酸的MxA蛋白,大约可保持野生型GTP酶活性的9%。其中羧基端缺失起关键作用。用蛋白酶K水解野生型MxA所形成的60kd和10kd的两种多肽,其P60~P10稳定复合体可呈现高度的GTP酶活性。序列分析图表明,60kd多肽氨基端41位为亮氨酸,10kd多肽氨基端564位为谷氨酰胺,这些与GTP酶相一致的结合成分可通过羧基端氨基酸强有力的相互作用而保持在MxA蛋白活性构型中[10]。
大量实验证明,纯品MxA蛋白在体内外可抗RNA病毒感染,如抗大地布尼亚病毒及其它病毒的致死性感染等,说明MxA蛋白本身是独立的,并能发挥强有力的抗病毒效应,此时无需IFN诱导和协同[11]。
, 百拇医药
MxA蛋白对流感病毒的抗病毒效应及其机理如同上述对Thogoto病毒的抗病毒机理,不是抑制mRNA病毒合成及早期转录,而是在胞浆内阻止病毒核衣壳进入核内,进而阻止病毒在核内的复制。
汉坦病毒、白蛉病毒(Phleboviruses)、布尼亚病毒(Bunyaviruses)、Puumala病毒(PUU)是引起发热、脑炎、出血热的病原体,MxA蛋白对上述病毒的抗病毒机理不同于Thogoto病毒和流感病毒,而与MxA蛋白抗VSV机理一致。主要是通过抑制病毒早期转录的起始阶段,抑制RNA引物及mRNA合成来发挥作用,若切除MxA蛋白羧基末端也会失去抗VSV活性[12]。有关MxA蛋白的抗病毒机理有待进一步研究。
4 MxA蛋白的生物工程
4.1 MxA蛋白在细胞中的诱导表达
4.1.1 诱导细胞的种类 用IFNα/β(而不是IFNγ)处理人胚肺细胞(如HEL)或A549肺癌细胞、Wish细胞、Dandi细胞、CESS细胞、人眼角膜细胞、人神经细胞等均可表达MxA蛋白。
, 百拇医药
在用人外周血单核细胞或A549肺癌细胞时,用1 IU/ml的IFNα,即可诱导产生可测出的MxA蛋白(采用免疫印迹法)。用高剂量(100~300IU/ml)的IFNα处理单核细胞,4h后MxA mRNA水平可提高10倍,24~48h后MxA蛋白表达量也可提高10倍以上,说明MxA基因可反复被诱导表达。MxA蛋白非常稳定,其半衰期约为2.3d[3]。
在人胚肺细胞(HEL)中,用300IU/ml IFNα诱导8h,MxA mRNA可达高峰;诱导16h,MxA蛋白水平达高峰,且可持续维持36h。提示,若获取mRNA,以IFNα诱导8h为宜;获取MxA蛋白,以诱导16h为宜。为MxA基因克隆和MxA蛋白收获提取及研究其分子结构和功能创造了条件。
4.1.2 MxA蛋白的诱导剂 MxA蛋白的诱导剂除IFNα/β(I型干扰素)外,还有病毒及双股RNA。实验证明,1pfu/ml的病毒或1IU/ml的干扰素(IFNα/β)均可诱导产生可测出的MxA蛋白。但TNFα、IL-6单独或与IFNα联合应用均不能影响MxA mRNA水平在细胞中的表达[7],但IL-12、G-CSF、M-CSF、GM-CSF也能诱导外周血单核细胞表达MxA蛋白[8]。
, 百拇医药
4.2 MxA基因的转基因表达 MxA基因转染3T3细胞后在3T3细胞中可表达MxA蛋白,并可抵抗流感病毒感染。Schnorr JJ的研究表明,在MxA基因转染的3T3细胞中也能抵抗VSV和流感病毒的感染;在转染的U937人单核细胞中,既可显著抑制麻疹病毒和VSV病毒的感染,又可在细胞中持续表达MxA蛋白,正是由于MxA蛋白的产生,使麻疹病毒和VSV病毒从感染细胞中所释放出的病毒效价比未转染MxA基因的对照组下降100倍。
4.3 MxA蛋白的基因克隆和重组表达
4.3.1 原核细胞表达系统 Staehll于1986年克隆了鼠Mx1 cDNA,并公布了序列,将Mx1 cDNA转染Mx-细胞中,获得了Mx蛋白表达,并能发挥抗流感病毒作用,为Mx基因的表达提供了实验依据。4年后,Nakayma等将克隆的Mx1 cDNA在大肠杆菌中获得了表达,并用纯化的Mx1蛋白开展了抗病毒效应的研究。
, 百拇医药
MxA cDNA克隆和序列分析是由Horisberger等[13]完成的。随后在大肠杆菌中获得了重组表达,一种是以带有组氨酸(His)分泌型形式进行表达,纯化的His-MxA蛋白可呈现特异的GTP水解酶活性,并具有抗病毒效应[14];另一种是以包涵体形式表达,可将MxA蛋白包涵体经几步层析纯化后获得纯品,经特异抗体的鉴别试验证明,该蛋白能与抗MxA单抗发生特异结合,并呈现抗病毒活性。这样为采用酶标法(ELISA法)测定病毒患者全血细胞或由干扰素诱导的细胞产生的人MxA蛋白量,为临床诊断试剂盒的开发和应用打下了基础。
4.3.2 真核表达系统 真核表达的MxA cDNA是来源于IFNα诱导人单核细胞和A549肺癌细胞的mRNA,并经RT-PCR克隆出MxA cDNA。并用棒状病毒载体在昆虫细胞中进行了表达,通过纯化制备出MxA蛋白纯品,该纯品MxA蛋白对抗MxA的单抗具有高度特异性[5]。
, http://www.100md.com 有关MxA单抗的制备是采用IFNα诱导细胞后,提取胞浆中的MxA蛋白,通过免疫动物后制备多抗或采用细胞融合法制备单克隆抗体,只见在文献资料有应用,未见详细研制资料,可能与方法的常规化有关。我们实验中所用的MxA蛋白纯品及单抗是Horisberger惠赠的,国外已有产品,但尚未投放市场。商品化问题还有待进一步研究和开发。
5 MxA蛋白与临床应用的关系及其展望
5.1 病毒活疫苗接种与MxA蛋白表达的关系 将黄热病毒17-D株减毒活疫苗接种11名健康志愿者后第5d取外周血单核细胞进行测定,其MxA RNA水平比接种前提高8~10倍,而MxA蛋白量平均增加约50倍;3名模拟接种对照组未能测出MxA RNA或MxA蛋白。但免疫接种组和非免疫组单核细胞对Ⅰ型或Ⅱ型干扰素诱导产生的2′~5′A(2~5A)合成酶没有差异[15]。因此可见,病毒活疫苗接种不仅产生特异性免疫功能,而且还有可能诱生出内源性Ⅰ型干扰素,并随之由IFN诱导细胞表达MxA抗病毒蛋白,MxA蛋白的产生进一步强化了机体抗病毒能力。
, 百拇医药
5.2 病毒感染与MxA表达水平的关系
5.2.1 MxA表达与HIV感染的关系 HIV是人类免疫缺陷病的病原体。体外试验证明,HIV单独感染人单核细胞后,一般在6h可产生MxA蛋白,14d可达高峰。而且这种表达往往不依赖于IFNα的存在,由HIV诱导体外培养的单核细胞所产生的MxA蛋白,体外也能发挥抗病毒作用[16]。体内研究表明,将20例HIV-Ⅰ感染者和24名健康对照者的全血细胞体外培养,经Sendai病毒诱导的上清,经测定,HIV-Ⅰ患者细胞诱导上清中IFNα水平低于健康对照组(P<0.0001)。HIV-Ⅰ患者细胞诱导上清中的IFNα虽能在Wish细胞上诱导表达MxA蛋白,但这种IFNα不能体外抑制VSV引起的CPE。推测由HIV-Ⅰ病毒感染者所产生的IFNα与健康者产生的IFNα的生物学特性可能不同,有待进一步研究[17]。
5.2.2 HBV与MxA表达的关系 由HBV引起的慢性乙型肝炎,由于可削弱免疫细胞活性和影响对IFNα的反应能力而直接影响IFNα的疗效[18],后来研究发现,这可能与由HBV所产生的缺陷性颗粒(病毒衣壳蛋白)有关。有人用完整的或缺陷的HBV基因组转染Huh7细胞,结果缺陷基因组转染的细胞MxA蛋白表达水平下降,而且大大降低了IFN的抗病毒(VSV)活性。这是由于缺陷HBV基因组所表达的缺陷颗粒在细胞内大量集聚,选择性地抑制了MxA基因的启动子,进而抑制了MxA蛋白的表达及其抗病毒能力[19]。由此可见,HBV患者体内MxA蛋白表达水平可能与慢性乙型肝炎转归有关。
, 百拇医药
5.2.3 HCV与MxA表达的关系 IFNα治疗慢性丙型肝炎有较好的疗效,而且常与患者外周血的单核细胞MxA蛋白表达密切相关。
研究报告表明,在19例HCV患者和11名健康对照者的外周血单核细胞中,用IFNα的刺激组细胞或用IL-2的刺激组细胞所产生的MxA蛋白的水平明显高于非刺激组(P<0.05);40例用IFNα2b治疗组血细胞中MxA蛋白水平均高于健康对照组,而且治疗1个月后,MxA表达水平比原先显著升高,这种MxA表达水平的升高又与患者血清中丙氨酸转氨酶水平的降低呈负相关。说明HCV患者在病毒感染期间的MxA表达力较强可能与患者IFN系统被激活有关。但当体内HCV大量集聚时,MxA表达呈现对IFNα无效反应,MxA蛋白的水平与IFNα对慢性乙型肝炎的疗效判定也有密切的关系[20]。
27例慢性HCV患者在IFNα治疗期间,其外周血单核细胞(PBMC)MxA mRNA水平也明显增高,与上述结果一致[21]。
, http://www.100md.com
5.2.4 MxA表达与病毒感染的早期诊断和鉴别诊断的关系 MxA在细胞内的表达不仅与Ⅰ型干扰素有关,而且与病毒的感染密切相关。对病毒反应也非常敏感,甚至1pfu/ml的病毒量即可使细胞表达可测出的MxA蛋白,因此可用于病毒的早期和急性感染的诊断。鉴于细菌及其它微生物感染细胞并不能诱导表达MxA蛋白,唯有病毒感染方可表达,可见病毒感染可引起MxA蛋白的特异性表达,因此MxA表达水平的测定也可用于病毒感染与细菌等其它微生物感染的鉴别诊断。随着大量MxA蛋白纯品和抗MxA单克隆抗体制备技术的成功,标准化ELISA及免疫化学发光技术的成熟,为临床推广应用创造了条件。
最初是在急性病毒性皮肤病中测出了MxA蛋白的表达,而在非病毒感染(细菌、真菌、寄生虫)中均未测出MxA蛋白。Chieus等采用免疫化学发光技术检测患者外周血细胞溶解物中的MxA蛋白水平,发现急性病毒感染者,如轮状病毒、腺病毒、呼吸道合胞病毒(RSV)和巨细胞病毒(CMV)的MxA蛋白呈现高表达,但在细菌感染者中未测出。由此可见,MxA蛋白检测可作为病毒感染的特异性标志。由于此法在临床上难以推广,后来Towbin建立了MxA蛋白的ELISA检测法,并验证了其稳定性、可靠性,并进行了标准化测试[22]。
, http://www.100md.com
在ELISA法推广应用中,Forster等对18例婴幼儿及儿童呼吸道感染者的鼻咽分泌物和92例的全血标本进行了MxA蛋白测定(另有73例对照),发现健康儿童的MxA水平高于成人。92例全血标本MxA阳性率为76%,鼻咽分泌物MxA阳性率为91%,此法明显优于淋巴细胞计数和C反应蛋白测定[23]。
在病毒与细菌感染的鉴别诊断中,Halminen等对患有RSV(21例)、腺病毒(10例)、轮状病毒(5例)及流感、疱疹或EBV(7例)患儿外周血淋巴细胞溶解物进行了MxA蛋白表达水平的测定,发现明显高于细菌感染者(12例)(P<0.002)。在41例患儿血细胞培养中,用IFNα诱导后细胞中所表达的MxA蛋白水平,其病毒感染者也显著高于细菌感染者(P<0.005)[24]。
为了解决婴幼儿取血困难的问题,Chieux等改为从手指取血,将指血细胞溶解物采用免疫化学发光技术测定MxA蛋白,其中5例腺病毒、15例轮状病毒、28例RSV感染患者血细胞溶解物中MxA蛋白水平明显高于细菌感染者(n=6)和健康对照者(n=20)。实验证明,取手指毛细血管血细胞测定MxA蛋白水平与抽外周血细胞测定的结果高度相关(r=0.86,P<0.0001,n=48)。此法将有助于对婴儿血标本的采集,开展MxA蛋白的检测,利于婴儿病毒感染的诊断[25]。
, 百拇医药
5.3 自身免疫性疾病与MxA表达的关系 常见可变免疫缺陷病(CVID)被认为是慢性病毒感染或自身免疫性疾病,但缺乏病毒感染的依据。系统性红斑狼疮(SLE)为病毒感染和自身免疫性疾病,经测定SLE患者外周血细胞均可大量表达MxA蛋白,有病毒感染的可能性。但在15例CVID的长期低丙球血症患者外周血细胞中,经测定MxA蛋白表达均为阴性,后经IFNα诱导,细胞中可产生正常量的MxA蛋白。因此对CVID患者的病毒感染或自身免疫的致病机理产生了争议[26]。
在帕金森斯病(PD)及在黑质体(SN)中的Lewyet小体(LBs)患者中,其MxA蛋白表达呈现阳性,因此MxA在帕金森斯病LBs的形成和神经元肿胀过程中可起重要作用[27]。
5.4 MxA蛋白测定与IFNα效价测定和疗效判定的关系 Liberati等[28]用6×106IU的自然IFN-β对12名志愿者进行静脉输注,在10~48h其单核细胞内的2′~5′ A合成酶升高;在10~96h内其MxA蛋白水平也显著增加。该作者后来用IFNα长期治疗慢性淋巴细胞白血病(CLL)时,发现从治疗第2周到12个月期间,细胞内的2′~5′ A和MxA蛋白表达水平呈现高水平,而且采用IFNα2a和IFNα2b二者也无差异性[29]。
, 百拇医药
Bezeres等[30]通过对采用IFNα治疗的21例CLL患者血清TNF水平和细胞内MxA蛋白表达量的测定,经统计学分析发现在低TNF水平与MxA的表达之间及在高TNF水平和无MxA表达之间有显著相关性,早期CLL患者为高TNF水平和无MxA表达,这些患者非常乐意接受IFN治疗,且强烈要求测定MxA表达水平和TNF浓度,以评价IFNα治疗效果。此两项指标可作为IFN治疗CLL是否有效的一个预指标。
在用IFNα对122例神经内分泌患者治疗中,采用MxA cDNA片断探针杂交法测定全血细胞中MxA RNA水平,结果均可表达MxA mRNA,其表达水平在不同的病程期均无差异,用重组IFNα和自然IFNα也无差异。尽管有的患者体内产生了IFNα中和抗体,但并不影响MxA mRNA的表达,但高效价IFNα中和抗体的产生,往往会影响肿瘤疗效[31]。
鉴于MxA蛋白在细胞内的表达量与IFNα/β呈剂量依赖性,因此采用免疫法,如用ELISA法测定MxA蛋白含量,可用来代替当今繁琐的IFN生物活性检测法。因MxA蛋白ELISA免疫检测法简便、快速,且敏感性高,可测出0.1~30IU/ml的IFNα活性。但此法只能用于测Ⅰ型IFN(IFNα/β),不能用于测定Ⅱ型IFN(IFNr)[32,33]。
, 百拇医药
5.5 MxA抗病毒蛋白制剂的应用前景 鉴于低浓度(1IU/ml)IFNα/β诱导细胞可产生较高浓度的MxA蛋白,MxA蛋白在体外又具有广谱的抗病毒效应,特别是对RNA病毒作用显著,且比IFN抗病毒作用更为直接。此外MxA的GTP酶抗病毒活性呈现GTPGDPGTP重复转换效率,具放大效应,加之国外MxA蛋白的基因重组均已获得成功,蛋白本身又很稳定,因此MxA抗病毒蛋白制剂的开发和利用不是没有可能。但十多年来未见应用于临床治疗疾病的资料,其原因有待考证和深入研究。
5.6 展望 MxA基因和MxA蛋白的发现不仅对进一步阐明IFNα/β的抗病毒机理有理论的意义,而且随着重组人MxA蛋白纯品及抗MxA单抗的研究成功和MxA ELISA法的建立,为临床病毒性疾病的诊断、病毒和细菌感染的鉴别诊断、IFNα/β效价测定及IFNα/β临床疗效判定、MxA蛋白表达与疾病发生和发展的相关性等提供了快速、简便、敏感的测定方法;在临床应用和研究中具有广阔的应用前景,而且MxA抗病毒蛋白制剂本身也具有开发利用的潜能。
, 百拇医药
参考文献
[1]Stachll P,Haller O,Lindenmann L,et al.Mx protein∶Constitutive expression in 3T3 cells transformed with cloned Mx cDNA confers selective resistance to influenza virus.Cell,1986,44∶147
[2] Jin HK,Takada A,Haller O,et al.Identification of murine Mx2 gene∶interferon-induced expression of the Mx2 protein from the feral mouse gene confers resistance to vesicular stumatitis virus.J Virol,1999,73(6)∶4925
, 百拇医药
[3] Ronni T,Melen K,Malygin A,et al.Control of IFN-inducible MxA gene expression in human cells.J Immunol,1993,150(5)∶1715
[4] Ellinwood NM,Mc Cue JM,Gordy P V,et al.Cloning and characterization of cDNAs for bovine Mx protein.J Interferon Cytokine Res,1998,18(9)∶745
[5] Chesters PM,Steele M,Purewal A,et al.Nucleotide sequence of equine MxA cDNA.seq 1997, 7(3-4)∶239
[6] Bazzigher L,Schwarz A,staehll P,et al.No enhanced influenza virus resistance of murine and avian cells expressing cloned dnck Mx protein.Virology,1993,195(1)∶100
, 百拇医药
[7] Kochs G,Haller O.Interferon-indueed human MxA GTPase blocks nuclear import of Thogoto virus nucleocapsids.Proc Natl A cad Sci USA,1999,96(5)∶2082
[8] Weber,F Haller O,Kochs G.MxA GTPase Blocks reporter gene expression of reconstituted Thogoto virus ribonueleoprotein complexes.J virol,2000,74(1)∶560
[9] Kocks G,Haller O.GTP-blound Human MxA Interacts with the nucleocapside of Thogoto virus (cortho my xo viridae).J Biol chem,1999,274(7)∶4370
, 百拇医药
[10] Schwennle M,Richter M F,Herrmann C,et al.Unexpected structural requirements for GTPase activity of the interferon-induced MxA protein.J Biol chem,1995,270(22)∶13518
[11] Hefti HP,Frese M,Landis H,et al.Human MxA protein protects lacking a functional α/β IFN system against La erosse virus and other lethal viral infections.J virol,1999,73(8)∶6984
[12] Schwemmle M,weining KC,Richter MF,et al.Vesicular stomatitis virus transcription inhibited by purified MxA protein.Virology,1995,206(1)∶545
, http://www.100md.com
[13] Horisberger MA,Mcnaseer GK,Zeller H,et al.Cloning and Sequence analyses of cDNAs for IFN and virus induced Human Mx proteins reveal that they contain putative corresponding gene promoter.J Virol,1990,64(3)∶1171
[14] Richer MF,Schwemmle M,Herrmann C,et al.Interferon-induced MxA protein GTP binding and GTP hydrolysis properties.J Biol chem,1995,270(22)∶13512
[15] Rores A,Hochkeppel HK,Horisberger MA,et al.Mx gene expression after live virus vaccination a sensitive marker for endogenons type Interferon.J Infect Dis,1994,169(4)∶807
, http://www.100md.com
[16] Baca LM,Genis P,kalvakolanu D,et al.Regulation of interferon-α-inducible cellular genes in human immunodeficiency virus-infected monocytes.J leukoc Biol,1994,55(3)∶299
[17] Chehadeh W,Hober D,Chieux V,et al.Biological properties of IFN-α produced Ex viro by whole blood of patients infected by human immunodeficiency virus-1.Scand J Immunol,1999,49(6)∶660
[18] Fernandez M,Quiroga JA,Martin J,et al.Impaired interferon induction of human MxA protein in chronic hepatitis B virus infection.J Med virol,1997,51(4)∶332
, http://www.100md.com
[19] Rosmordue O,Sirma H,Soussan P,et al.Inhibition of interferon-inducible MxA protein expression by hepatitis B virus capsid protein.J Gen virol,1999,80(Pt5)∶1253
[20] Fernandez M,Quiroga JA,Martin J,et al.In vivo and invitro induction of MxA protein in periheral blood mononuclear cells from patients chronically infected with hepatitis C virus.J Infect Dis,1999,180(2)∶262
[21] Antonelli G,Simeoni E,Turriziani O,et al.Correlation of interferon-induced experession of MxA mRNA in peripheral blood mononuclear cells with the response of patients with chronic active hepatitis C to IFN-α therapy.J Interferon cytokine Res,1999,19(3)∶243
, 百拇医药
[22] Towbin H,Schmizy A,Jakschies D,et al.A whole blood immunoassay for the interferon-inducible human Mx protein.J Interferon Res,1992,12(2)∶67
[23] Forseer J,Schweizer M,Schumacher RF,et al.MxA protein in infacts and children with respriratory tract infection.Acta paediatr,1996,85(2)∶163
[24] Halminen M,Ilonen J,Julkunen I,et al.Expression of MxA protein in blood lymphocyels discriminates between viral and bacterial infections in febrile children.Pediatr Res,1997,41(5)∶647
, http://www.100md.com
[25] Chieux V,Hober D,Chehadeh W,et al.MxA Protein in capillary blood of children with viral infections.J Med virol,1999,59(4)∶547
[26] Rump JA,Jakschies D,Walker V,et al.Common variable immunodeficiency.(CVID) and MxA-protein expression in blood leucocytes.Clin Exp Immunol,1995,101(1)∶89
[27] Yamada J.Further observations on MxA-positive Lewy bodies in parkinson's disease brain tissues.Neurosci Lett,1995,195(1)∶41
, 百拇医药
[28] Liberati AM,Garofani P,DeAngelis V,et al.Double-blind randomized phase I study on the clinical tolerance and pharmacodynamics of natural and recombinant interferon-beta given intravenously.J Interferon Res,1994,14(2)∶61
[29] Liberati AM,Horisberger MA,Garofani P,et al.Interferon-mduced biologic modifications in patients with chronic myelogenous leukemia.J Interferon Res,1994,14(6)∶349
[30] Bezares F,Kohan S,Sacerdote de lusting E,et al.Treatment strategies for early-stage chronic lymphocytic leukemia can interferon-inducible MxA protein and tumor necrosis factor play a role as predictive markers for response to interferon therapy.J Interferon Cytokine,1996,16(7)∶501
, 百拇医药
[31] Imam H,Janson ET,Gobl A,et al.Induction of MxA mRNA in patients with neuroendocrine tumors after interferon treatment,Lack of correlation with antitumor response.Anticancer Res,1995,15(5b)∶2191
[32] Chieux V,Hober D,Chehadeh W,et al.Alpha interferon,antiviral,proteins and their value in clinical medicine.Ann Biol Clin (Paris),1999,57(6)∶659
[33] Files JG,Gray JL,DOLT,et al.A novel sensitive and selective bioassay for human type I interferons.J Interferon Cytokine Res,1998,18(12)∶1019
(2000年3月10日收稿), http://www.100md.com
单位:苏州医学院基因工程研究室,苏州,215007
关键词:
苏州医学院学报000601 MxA是新发现的由Ⅰ型干扰素(IFNα/β)诱导人细胞所产生的78kd的新型抗病毒蛋白。开展MxA蛋白研究很有医学价值,现综述如下。
1 Mx基因及其蛋白的发现与命名
1964年,Lindenmann发现A2G小鼠能耐受对其它小鼠致死剂量的流感病毒感染。这种特性是从小鼠16号染色体上单一显性等位基因遗传获得的,因能抵抗粘液病毒(流感)而命名为Mx基因。体内外研究表明,这种抗流感病毒作用是受IFNα/β调节,而不受IFN-γ调节。Horisberger等发现,Mx+细胞经IFNα诱导后与Mx-细胞的差别是多出一条75kd的多肽,而且这种多肽也只有在IFNα/β诱导后产生,IFNγ不能产生,将这种多肽统一命名为Mx蛋白[1]。
, http://www.100md.com
2 Mx基因类型和蛋白的诱导表达
近来研究发现,小鼠的Mx基因有Mx1、Mx2两类,也有Mx3的报告,但能发挥抗病毒作用的是由Mx1基因编码的75kd的Mx1蛋白,能于体内外抵抗流感病毒感染。Mx2、Mx3在实验鼠中未发现有抗病毒功能[2]。人的Mx基因包括MxA和MxB两类。MxA基因位于人21号染色体长臂上,经IFNα/β处理可诱导产生78kd的MxA蛋白,分布于细胞的胞浆内,这种胞浆蛋白可直接发挥对流感病毒和滤泡性口腔炎病毒(VSV)的抗病毒效应,而MxB未发现有抗病毒活性。
除小鼠和人的Mx基因可表达抗病毒作用的Mx蛋白外,在其它哺乳类动物细胞,甚至在鱼、蛙、禽类的细胞中也发现了类似的Mx基因的表达,并且有抗病毒活性[3]。
猪细胞经IFNα或双股RNA诱导后可产生76kd的Mx1蛋白,并具有抗流感病毒和VSV活性;另一种73kd的Mx2无此活性。牛和马的Mx基因已被克隆,经分析牛的Mx蛋白与人、鼠、羊的Mx蛋白相比,分别有73%、63%、93%的同源性[4,5]。
, 百拇医药
鸡的Mx蛋白含有705个氨基酸,可以抗流感病毒、VSV、Thogoto病毒、Sendai病毒(Bernasconi D,1995)。此外在鸭胚细胞培养时,用新城鸡瘟病毒(NDV)或双股RNA处理后,可表达鸭Mx mRNA及72~82kd的Mx蛋白,并呈现由IFNα诱导哺乳类细胞所产生的Mx蛋白的结构和抗病毒活性[6]。
3 MxA蛋白对病毒的敏感性及其抗病毒机理
国外大量的研究资料表明,MxA蛋白主要对RNA病毒敏感,其中负股RNA病毒包括弹状病毒(VSV),副粘病毒(RSV、麻疹病毒、3型副流感病毒),布尼亚病毒〔汉坦(Hantavirus)病毒、Thogoto病毒、白蛉病毒〕,正粘病毒(流感病毒)。正股RNA病毒包括披膜病毒(塞姆利基森林病毒和sindbis病毒),黄病毒(壁虱脑炎病毒、黄热病毒)。我们的实验证明,10ng/ml的纯品MxA可以抵抗20 TCID50的HSV-I和Ad3 DNA病毒对细胞的感染,说明MxA对DNA病毒也有抑制作用(待发表资料)。
, 百拇医药
Koshs等认为,由IFNα/β诱导产生的人MxA蛋白属于大分子(78kd)GTP酶,能抵抗各种RNA病毒,如:Thogoto病毒、类流感病毒、正粘病毒等感染细胞。实验证明,纯品MxA蛋白能识别病毒新合成的核糖核蛋白复合物(vRNPs),并能紧密结合,通过MxA的GTP酶活性对病毒核衣壳发挥水解作用,进而可阻止上述病毒核衣壳转运至细胞核内,阻止病毒基因组的核内复制[7~9]。现以MxA蛋白抗Thogoto病毒为例,其抗病毒机理见附图。

附图 MxA蛋白的抗病毒作用机理
MxA蛋白有两种构型,一种是非活性的GDP结合形式,另一种是活性的GTP结合形式,MxA和Mx1基因均具有与GTP结构中G××××GKs、D××G和TKD×(×代表某种氨基酸位点)3个相一致的结合位点,MxA蛋白只有在与病毒的核糖核蛋白体(RNP)中的NP(核蛋白)紧密结合后,方可使MxA的构型发生改变,而使MxA蛋白活化,活化的构型又可受到GTPγs的稳定作用(GTPγs是GTP的非水解类似物),活化的MxA发挥对核衣壳的水解作用是发生在MxA蛋白 羧基端。GTP发挥水解作用后又可转换成非活化的GDP形式,GTP/GDP的转换率约为40次/min,Km值约为700mmol/L。
, 百拇医药
若从MxA蛋白羧基端去除7个氨基酸,使纯品MxA蛋白的GTP酶活性隆至14%,从羧基端去除63个氨基酸,结果完全失去水解GTP的能力,而且不能与鸟嘌呤核苷酸酶结合。相反从氨基端缺乏301个氨基酸,羧基端缺失87个氨基酸的MxA蛋白,大约可保持野生型GTP酶活性的9%。其中羧基端缺失起关键作用。用蛋白酶K水解野生型MxA所形成的60kd和10kd的两种多肽,其P60~P10稳定复合体可呈现高度的GTP酶活性。序列分析图表明,60kd多肽氨基端41位为亮氨酸,10kd多肽氨基端564位为谷氨酰胺,这些与GTP酶相一致的结合成分可通过羧基端氨基酸强有力的相互作用而保持在MxA蛋白活性构型中[10]。
大量实验证明,纯品MxA蛋白在体内外可抗RNA病毒感染,如抗大地布尼亚病毒及其它病毒的致死性感染等,说明MxA蛋白本身是独立的,并能发挥强有力的抗病毒效应,此时无需IFN诱导和协同[11]。
, 百拇医药
MxA蛋白对流感病毒的抗病毒效应及其机理如同上述对Thogoto病毒的抗病毒机理,不是抑制mRNA病毒合成及早期转录,而是在胞浆内阻止病毒核衣壳进入核内,进而阻止病毒在核内的复制。
汉坦病毒、白蛉病毒(Phleboviruses)、布尼亚病毒(Bunyaviruses)、Puumala病毒(PUU)是引起发热、脑炎、出血热的病原体,MxA蛋白对上述病毒的抗病毒机理不同于Thogoto病毒和流感病毒,而与MxA蛋白抗VSV机理一致。主要是通过抑制病毒早期转录的起始阶段,抑制RNA引物及mRNA合成来发挥作用,若切除MxA蛋白羧基末端也会失去抗VSV活性[12]。有关MxA蛋白的抗病毒机理有待进一步研究。
4 MxA蛋白的生物工程
4.1 MxA蛋白在细胞中的诱导表达
4.1.1 诱导细胞的种类 用IFNα/β(而不是IFNγ)处理人胚肺细胞(如HEL)或A549肺癌细胞、Wish细胞、Dandi细胞、CESS细胞、人眼角膜细胞、人神经细胞等均可表达MxA蛋白。
, 百拇医药
在用人外周血单核细胞或A549肺癌细胞时,用1 IU/ml的IFNα,即可诱导产生可测出的MxA蛋白(采用免疫印迹法)。用高剂量(100~300IU/ml)的IFNα处理单核细胞,4h后MxA mRNA水平可提高10倍,24~48h后MxA蛋白表达量也可提高10倍以上,说明MxA基因可反复被诱导表达。MxA蛋白非常稳定,其半衰期约为2.3d[3]。
在人胚肺细胞(HEL)中,用300IU/ml IFNα诱导8h,MxA mRNA可达高峰;诱导16h,MxA蛋白水平达高峰,且可持续维持36h。提示,若获取mRNA,以IFNα诱导8h为宜;获取MxA蛋白,以诱导16h为宜。为MxA基因克隆和MxA蛋白收获提取及研究其分子结构和功能创造了条件。
4.1.2 MxA蛋白的诱导剂 MxA蛋白的诱导剂除IFNα/β(I型干扰素)外,还有病毒及双股RNA。实验证明,1pfu/ml的病毒或1IU/ml的干扰素(IFNα/β)均可诱导产生可测出的MxA蛋白。但TNFα、IL-6单独或与IFNα联合应用均不能影响MxA mRNA水平在细胞中的表达[7],但IL-12、G-CSF、M-CSF、GM-CSF也能诱导外周血单核细胞表达MxA蛋白[8]。
, 百拇医药
4.2 MxA基因的转基因表达 MxA基因转染3T3细胞后在3T3细胞中可表达MxA蛋白,并可抵抗流感病毒感染。Schnorr JJ的研究表明,在MxA基因转染的3T3细胞中也能抵抗VSV和流感病毒的感染;在转染的U937人单核细胞中,既可显著抑制麻疹病毒和VSV病毒的感染,又可在细胞中持续表达MxA蛋白,正是由于MxA蛋白的产生,使麻疹病毒和VSV病毒从感染细胞中所释放出的病毒效价比未转染MxA基因的对照组下降100倍。
4.3 MxA蛋白的基因克隆和重组表达
4.3.1 原核细胞表达系统 Staehll于1986年克隆了鼠Mx1 cDNA,并公布了序列,将Mx1 cDNA转染Mx-细胞中,获得了Mx蛋白表达,并能发挥抗流感病毒作用,为Mx基因的表达提供了实验依据。4年后,Nakayma等将克隆的Mx1 cDNA在大肠杆菌中获得了表达,并用纯化的Mx1蛋白开展了抗病毒效应的研究。
, 百拇医药
MxA cDNA克隆和序列分析是由Horisberger等[13]完成的。随后在大肠杆菌中获得了重组表达,一种是以带有组氨酸(His)分泌型形式进行表达,纯化的His-MxA蛋白可呈现特异的GTP水解酶活性,并具有抗病毒效应[14];另一种是以包涵体形式表达,可将MxA蛋白包涵体经几步层析纯化后获得纯品,经特异抗体的鉴别试验证明,该蛋白能与抗MxA单抗发生特异结合,并呈现抗病毒活性。这样为采用酶标法(ELISA法)测定病毒患者全血细胞或由干扰素诱导的细胞产生的人MxA蛋白量,为临床诊断试剂盒的开发和应用打下了基础。
4.3.2 真核表达系统 真核表达的MxA cDNA是来源于IFNα诱导人单核细胞和A549肺癌细胞的mRNA,并经RT-PCR克隆出MxA cDNA。并用棒状病毒载体在昆虫细胞中进行了表达,通过纯化制备出MxA蛋白纯品,该纯品MxA蛋白对抗MxA的单抗具有高度特异性[5]。
, http://www.100md.com 有关MxA单抗的制备是采用IFNα诱导细胞后,提取胞浆中的MxA蛋白,通过免疫动物后制备多抗或采用细胞融合法制备单克隆抗体,只见在文献资料有应用,未见详细研制资料,可能与方法的常规化有关。我们实验中所用的MxA蛋白纯品及单抗是Horisberger惠赠的,国外已有产品,但尚未投放市场。商品化问题还有待进一步研究和开发。
5 MxA蛋白与临床应用的关系及其展望
5.1 病毒活疫苗接种与MxA蛋白表达的关系 将黄热病毒17-D株减毒活疫苗接种11名健康志愿者后第5d取外周血单核细胞进行测定,其MxA RNA水平比接种前提高8~10倍,而MxA蛋白量平均增加约50倍;3名模拟接种对照组未能测出MxA RNA或MxA蛋白。但免疫接种组和非免疫组单核细胞对Ⅰ型或Ⅱ型干扰素诱导产生的2′~5′A(2~5A)合成酶没有差异[15]。因此可见,病毒活疫苗接种不仅产生特异性免疫功能,而且还有可能诱生出内源性Ⅰ型干扰素,并随之由IFN诱导细胞表达MxA抗病毒蛋白,MxA蛋白的产生进一步强化了机体抗病毒能力。
, 百拇医药
5.2 病毒感染与MxA表达水平的关系
5.2.1 MxA表达与HIV感染的关系 HIV是人类免疫缺陷病的病原体。体外试验证明,HIV单独感染人单核细胞后,一般在6h可产生MxA蛋白,14d可达高峰。而且这种表达往往不依赖于IFNα的存在,由HIV诱导体外培养的单核细胞所产生的MxA蛋白,体外也能发挥抗病毒作用[16]。体内研究表明,将20例HIV-Ⅰ感染者和24名健康对照者的全血细胞体外培养,经Sendai病毒诱导的上清,经测定,HIV-Ⅰ患者细胞诱导上清中IFNα水平低于健康对照组(P<0.0001)。HIV-Ⅰ患者细胞诱导上清中的IFNα虽能在Wish细胞上诱导表达MxA蛋白,但这种IFNα不能体外抑制VSV引起的CPE。推测由HIV-Ⅰ病毒感染者所产生的IFNα与健康者产生的IFNα的生物学特性可能不同,有待进一步研究[17]。
5.2.2 HBV与MxA表达的关系 由HBV引起的慢性乙型肝炎,由于可削弱免疫细胞活性和影响对IFNα的反应能力而直接影响IFNα的疗效[18],后来研究发现,这可能与由HBV所产生的缺陷性颗粒(病毒衣壳蛋白)有关。有人用完整的或缺陷的HBV基因组转染Huh7细胞,结果缺陷基因组转染的细胞MxA蛋白表达水平下降,而且大大降低了IFN的抗病毒(VSV)活性。这是由于缺陷HBV基因组所表达的缺陷颗粒在细胞内大量集聚,选择性地抑制了MxA基因的启动子,进而抑制了MxA蛋白的表达及其抗病毒能力[19]。由此可见,HBV患者体内MxA蛋白表达水平可能与慢性乙型肝炎转归有关。
, 百拇医药
5.2.3 HCV与MxA表达的关系 IFNα治疗慢性丙型肝炎有较好的疗效,而且常与患者外周血的单核细胞MxA蛋白表达密切相关。
研究报告表明,在19例HCV患者和11名健康对照者的外周血单核细胞中,用IFNα的刺激组细胞或用IL-2的刺激组细胞所产生的MxA蛋白的水平明显高于非刺激组(P<0.05);40例用IFNα2b治疗组血细胞中MxA蛋白水平均高于健康对照组,而且治疗1个月后,MxA表达水平比原先显著升高,这种MxA表达水平的升高又与患者血清中丙氨酸转氨酶水平的降低呈负相关。说明HCV患者在病毒感染期间的MxA表达力较强可能与患者IFN系统被激活有关。但当体内HCV大量集聚时,MxA表达呈现对IFNα无效反应,MxA蛋白的水平与IFNα对慢性乙型肝炎的疗效判定也有密切的关系[20]。
27例慢性HCV患者在IFNα治疗期间,其外周血单核细胞(PBMC)MxA mRNA水平也明显增高,与上述结果一致[21]。
, http://www.100md.com
5.2.4 MxA表达与病毒感染的早期诊断和鉴别诊断的关系 MxA在细胞内的表达不仅与Ⅰ型干扰素有关,而且与病毒的感染密切相关。对病毒反应也非常敏感,甚至1pfu/ml的病毒量即可使细胞表达可测出的MxA蛋白,因此可用于病毒的早期和急性感染的诊断。鉴于细菌及其它微生物感染细胞并不能诱导表达MxA蛋白,唯有病毒感染方可表达,可见病毒感染可引起MxA蛋白的特异性表达,因此MxA表达水平的测定也可用于病毒感染与细菌等其它微生物感染的鉴别诊断。随着大量MxA蛋白纯品和抗MxA单克隆抗体制备技术的成功,标准化ELISA及免疫化学发光技术的成熟,为临床推广应用创造了条件。
最初是在急性病毒性皮肤病中测出了MxA蛋白的表达,而在非病毒感染(细菌、真菌、寄生虫)中均未测出MxA蛋白。Chieus等采用免疫化学发光技术检测患者外周血细胞溶解物中的MxA蛋白水平,发现急性病毒感染者,如轮状病毒、腺病毒、呼吸道合胞病毒(RSV)和巨细胞病毒(CMV)的MxA蛋白呈现高表达,但在细菌感染者中未测出。由此可见,MxA蛋白检测可作为病毒感染的特异性标志。由于此法在临床上难以推广,后来Towbin建立了MxA蛋白的ELISA检测法,并验证了其稳定性、可靠性,并进行了标准化测试[22]。
, http://www.100md.com
在ELISA法推广应用中,Forster等对18例婴幼儿及儿童呼吸道感染者的鼻咽分泌物和92例的全血标本进行了MxA蛋白测定(另有73例对照),发现健康儿童的MxA水平高于成人。92例全血标本MxA阳性率为76%,鼻咽分泌物MxA阳性率为91%,此法明显优于淋巴细胞计数和C反应蛋白测定[23]。
在病毒与细菌感染的鉴别诊断中,Halminen等对患有RSV(21例)、腺病毒(10例)、轮状病毒(5例)及流感、疱疹或EBV(7例)患儿外周血淋巴细胞溶解物进行了MxA蛋白表达水平的测定,发现明显高于细菌感染者(12例)(P<0.002)。在41例患儿血细胞培养中,用IFNα诱导后细胞中所表达的MxA蛋白水平,其病毒感染者也显著高于细菌感染者(P<0.005)[24]。
为了解决婴幼儿取血困难的问题,Chieux等改为从手指取血,将指血细胞溶解物采用免疫化学发光技术测定MxA蛋白,其中5例腺病毒、15例轮状病毒、28例RSV感染患者血细胞溶解物中MxA蛋白水平明显高于细菌感染者(n=6)和健康对照者(n=20)。实验证明,取手指毛细血管血细胞测定MxA蛋白水平与抽外周血细胞测定的结果高度相关(r=0.86,P<0.0001,n=48)。此法将有助于对婴儿血标本的采集,开展MxA蛋白的检测,利于婴儿病毒感染的诊断[25]。
, 百拇医药
5.3 自身免疫性疾病与MxA表达的关系 常见可变免疫缺陷病(CVID)被认为是慢性病毒感染或自身免疫性疾病,但缺乏病毒感染的依据。系统性红斑狼疮(SLE)为病毒感染和自身免疫性疾病,经测定SLE患者外周血细胞均可大量表达MxA蛋白,有病毒感染的可能性。但在15例CVID的长期低丙球血症患者外周血细胞中,经测定MxA蛋白表达均为阴性,后经IFNα诱导,细胞中可产生正常量的MxA蛋白。因此对CVID患者的病毒感染或自身免疫的致病机理产生了争议[26]。
在帕金森斯病(PD)及在黑质体(SN)中的Lewyet小体(LBs)患者中,其MxA蛋白表达呈现阳性,因此MxA在帕金森斯病LBs的形成和神经元肿胀过程中可起重要作用[27]。
5.4 MxA蛋白测定与IFNα效价测定和疗效判定的关系 Liberati等[28]用6×106IU的自然IFN-β对12名志愿者进行静脉输注,在10~48h其单核细胞内的2′~5′ A合成酶升高;在10~96h内其MxA蛋白水平也显著增加。该作者后来用IFNα长期治疗慢性淋巴细胞白血病(CLL)时,发现从治疗第2周到12个月期间,细胞内的2′~5′ A和MxA蛋白表达水平呈现高水平,而且采用IFNα2a和IFNα2b二者也无差异性[29]。
, 百拇医药
Bezeres等[30]通过对采用IFNα治疗的21例CLL患者血清TNF水平和细胞内MxA蛋白表达量的测定,经统计学分析发现在低TNF水平与MxA的表达之间及在高TNF水平和无MxA表达之间有显著相关性,早期CLL患者为高TNF水平和无MxA表达,这些患者非常乐意接受IFN治疗,且强烈要求测定MxA表达水平和TNF浓度,以评价IFNα治疗效果。此两项指标可作为IFN治疗CLL是否有效的一个预指标。
在用IFNα对122例神经内分泌患者治疗中,采用MxA cDNA片断探针杂交法测定全血细胞中MxA RNA水平,结果均可表达MxA mRNA,其表达水平在不同的病程期均无差异,用重组IFNα和自然IFNα也无差异。尽管有的患者体内产生了IFNα中和抗体,但并不影响MxA mRNA的表达,但高效价IFNα中和抗体的产生,往往会影响肿瘤疗效[31]。
鉴于MxA蛋白在细胞内的表达量与IFNα/β呈剂量依赖性,因此采用免疫法,如用ELISA法测定MxA蛋白含量,可用来代替当今繁琐的IFN生物活性检测法。因MxA蛋白ELISA免疫检测法简便、快速,且敏感性高,可测出0.1~30IU/ml的IFNα活性。但此法只能用于测Ⅰ型IFN(IFNα/β),不能用于测定Ⅱ型IFN(IFNr)[32,33]。
, 百拇医药
5.5 MxA抗病毒蛋白制剂的应用前景 鉴于低浓度(1IU/ml)IFNα/β诱导细胞可产生较高浓度的MxA蛋白,MxA蛋白在体外又具有广谱的抗病毒效应,特别是对RNA病毒作用显著,且比IFN抗病毒作用更为直接。此外MxA的GTP酶抗病毒活性呈现GTPGDPGTP重复转换效率,具放大效应,加之国外MxA蛋白的基因重组均已获得成功,蛋白本身又很稳定,因此MxA抗病毒蛋白制剂的开发和利用不是没有可能。但十多年来未见应用于临床治疗疾病的资料,其原因有待考证和深入研究。
5.6 展望 MxA基因和MxA蛋白的发现不仅对进一步阐明IFNα/β的抗病毒机理有理论的意义,而且随着重组人MxA蛋白纯品及抗MxA单抗的研究成功和MxA ELISA法的建立,为临床病毒性疾病的诊断、病毒和细菌感染的鉴别诊断、IFNα/β效价测定及IFNα/β临床疗效判定、MxA蛋白表达与疾病发生和发展的相关性等提供了快速、简便、敏感的测定方法;在临床应用和研究中具有广阔的应用前景,而且MxA抗病毒蛋白制剂本身也具有开发利用的潜能。
, 百拇医药
参考文献
[1]Stachll P,Haller O,Lindenmann L,et al.Mx protein∶Constitutive expression in 3T3 cells transformed with cloned Mx cDNA confers selective resistance to influenza virus.Cell,1986,44∶147
[2] Jin HK,Takada A,Haller O,et al.Identification of murine Mx2 gene∶interferon-induced expression of the Mx2 protein from the feral mouse gene confers resistance to vesicular stumatitis virus.J Virol,1999,73(6)∶4925
, 百拇医药
[3] Ronni T,Melen K,Malygin A,et al.Control of IFN-inducible MxA gene expression in human cells.J Immunol,1993,150(5)∶1715
[4] Ellinwood NM,Mc Cue JM,Gordy P V,et al.Cloning and characterization of cDNAs for bovine Mx protein.J Interferon Cytokine Res,1998,18(9)∶745
[5] Chesters PM,Steele M,Purewal A,et al.Nucleotide sequence of equine MxA cDNA.seq 1997, 7(3-4)∶239
[6] Bazzigher L,Schwarz A,staehll P,et al.No enhanced influenza virus resistance of murine and avian cells expressing cloned dnck Mx protein.Virology,1993,195(1)∶100
, 百拇医药
[7] Kochs G,Haller O.Interferon-indueed human MxA GTPase blocks nuclear import of Thogoto virus nucleocapsids.Proc Natl A cad Sci USA,1999,96(5)∶2082
[8] Weber,F Haller O,Kochs G.MxA GTPase Blocks reporter gene expression of reconstituted Thogoto virus ribonueleoprotein complexes.J virol,2000,74(1)∶560
[9] Kocks G,Haller O.GTP-blound Human MxA Interacts with the nucleocapside of Thogoto virus (cortho my xo viridae).J Biol chem,1999,274(7)∶4370
, 百拇医药
[10] Schwennle M,Richter M F,Herrmann C,et al.Unexpected structural requirements for GTPase activity of the interferon-induced MxA protein.J Biol chem,1995,270(22)∶13518
[11] Hefti HP,Frese M,Landis H,et al.Human MxA protein protects lacking a functional α/β IFN system against La erosse virus and other lethal viral infections.J virol,1999,73(8)∶6984
[12] Schwemmle M,weining KC,Richter MF,et al.Vesicular stomatitis virus transcription inhibited by purified MxA protein.Virology,1995,206(1)∶545
, http://www.100md.com
[13] Horisberger MA,Mcnaseer GK,Zeller H,et al.Cloning and Sequence analyses of cDNAs for IFN and virus induced Human Mx proteins reveal that they contain putative corresponding gene promoter.J Virol,1990,64(3)∶1171
[14] Richer MF,Schwemmle M,Herrmann C,et al.Interferon-induced MxA protein GTP binding and GTP hydrolysis properties.J Biol chem,1995,270(22)∶13512
[15] Rores A,Hochkeppel HK,Horisberger MA,et al.Mx gene expression after live virus vaccination a sensitive marker for endogenons type Interferon.J Infect Dis,1994,169(4)∶807
, http://www.100md.com
[16] Baca LM,Genis P,kalvakolanu D,et al.Regulation of interferon-α-inducible cellular genes in human immunodeficiency virus-infected monocytes.J leukoc Biol,1994,55(3)∶299
[17] Chehadeh W,Hober D,Chieux V,et al.Biological properties of IFN-α produced Ex viro by whole blood of patients infected by human immunodeficiency virus-1.Scand J Immunol,1999,49(6)∶660
[18] Fernandez M,Quiroga JA,Martin J,et al.Impaired interferon induction of human MxA protein in chronic hepatitis B virus infection.J Med virol,1997,51(4)∶332
, http://www.100md.com
[19] Rosmordue O,Sirma H,Soussan P,et al.Inhibition of interferon-inducible MxA protein expression by hepatitis B virus capsid protein.J Gen virol,1999,80(Pt5)∶1253
[20] Fernandez M,Quiroga JA,Martin J,et al.In vivo and invitro induction of MxA protein in periheral blood mononuclear cells from patients chronically infected with hepatitis C virus.J Infect Dis,1999,180(2)∶262
[21] Antonelli G,Simeoni E,Turriziani O,et al.Correlation of interferon-induced experession of MxA mRNA in peripheral blood mononuclear cells with the response of patients with chronic active hepatitis C to IFN-α therapy.J Interferon cytokine Res,1999,19(3)∶243
, 百拇医药
[22] Towbin H,Schmizy A,Jakschies D,et al.A whole blood immunoassay for the interferon-inducible human Mx protein.J Interferon Res,1992,12(2)∶67
[23] Forseer J,Schweizer M,Schumacher RF,et al.MxA protein in infacts and children with respriratory tract infection.Acta paediatr,1996,85(2)∶163
[24] Halminen M,Ilonen J,Julkunen I,et al.Expression of MxA protein in blood lymphocyels discriminates between viral and bacterial infections in febrile children.Pediatr Res,1997,41(5)∶647
, http://www.100md.com
[25] Chieux V,Hober D,Chehadeh W,et al.MxA Protein in capillary blood of children with viral infections.J Med virol,1999,59(4)∶547
[26] Rump JA,Jakschies D,Walker V,et al.Common variable immunodeficiency.(CVID) and MxA-protein expression in blood leucocytes.Clin Exp Immunol,1995,101(1)∶89
[27] Yamada J.Further observations on MxA-positive Lewy bodies in parkinson's disease brain tissues.Neurosci Lett,1995,195(1)∶41
, 百拇医药
[28] Liberati AM,Garofani P,DeAngelis V,et al.Double-blind randomized phase I study on the clinical tolerance and pharmacodynamics of natural and recombinant interferon-beta given intravenously.J Interferon Res,1994,14(2)∶61
[29] Liberati AM,Horisberger MA,Garofani P,et al.Interferon-mduced biologic modifications in patients with chronic myelogenous leukemia.J Interferon Res,1994,14(6)∶349
[30] Bezares F,Kohan S,Sacerdote de lusting E,et al.Treatment strategies for early-stage chronic lymphocytic leukemia can interferon-inducible MxA protein and tumor necrosis factor play a role as predictive markers for response to interferon therapy.J Interferon Cytokine,1996,16(7)∶501
, 百拇医药
[31] Imam H,Janson ET,Gobl A,et al.Induction of MxA mRNA in patients with neuroendocrine tumors after interferon treatment,Lack of correlation with antitumor response.Anticancer Res,1995,15(5b)∶2191
[32] Chieux V,Hober D,Chehadeh W,et al.Alpha interferon,antiviral,proteins and their value in clinical medicine.Ann Biol Clin (Paris),1999,57(6)∶659
[33] Files JG,Gray JL,DOLT,et al.A novel sensitive and selective bioassay for human type I interferons.J Interferon Cytokine Res,1998,18(12)∶1019
(2000年3月10日收稿), http://www.100md.com