人源抗-HAV Fab真核表达载体的构建及表达
作者:徐静 刘国奇 童贻刚 宋宏斌 徐志凯 王海涛
单位:于长明(第四军医大学微生物学教研室,陕西西安710032);徐志凯(第四军医大学微生物学教研室,陕西西安710032);徐静(军事医学科学院微生物流行病研究所11室,北京);刘国奇(军事医学科学院微生物流行病研究所11室,北京);童贻刚(军事医学科学院微生物流行病研究所11室,北京);宋宏斌(军事医学科学院微生物流行病研究所11室,北京);王海涛(军事医学科学院微生物流行病研究所11室,北京)
关键词:甲型肝炎病毒;基因表达;中华仓鼠卵巢细胞;Fab
细胞与分子免疫学杂志000303
摘要:目的构建人源抗HAVFab真核表达载体并进行表达。方法采用DNA重组技术将抗体重轻链基因与信号肽基因连接,并分别插入真核表达载体pCdhfr1和pCDNA3.1;以脂质体介导法转染CHO细胞,经G418筛选细胞,ELISA检测Fab基因的表达。结果成功地构建了Fab表达载体。转染细胞后,经ELISA检测,细胞培养上清中有抗原结合活性的Fab片段。结论Fab真核表达载体的构建及其在CHO细胞中的表达,为抗体编码基因在CHO细胞中稳定表达奠定了基础。
, http://www.100md.com
中图号:Q786 文献标识码:A 文章编号:1007-8738(2000)03-0193-03
Construction and expression of human anti-HAV Fab
eukaryotic expression vector
YU Chang-ming XU Zhi-kai
(Department of Microbiology, Fourth Military Medical University, Xi'an 710032, Shaanxi Province)
XU jing LIU Guo-qi TONG Yi-gang SONG Hong-bin Wang Hai-tao
, http://www.100md.com
(Institute of Microbiology & Epidemology, Academy of Military Medical Sciences, Beijing 100071, China.)
Abstract: Aim To construct a eukaryotic expression vector of human anti HAV Fab and to detect its expression in CHO cells. Methods Fd and light chain genes were ligated to their signal peptide sequences and inserted into pCdhfr1 or pCDNA3.1, respectively. The recombinant plasmids were co transfected into CHO cells, and resistant clones were obtained by G418 selection. The expression of Fab gene was detected by ELISA. Results Recombinant plasmids were successfully constructed. The plasmid transfected CHO cells were obtained by co transfection and G418 selection. ELISA confirmed the expression of anti HAV Fab in culture medium. Conclusion The construction of human anti HAV Fab eukaryotic expression vector and its expression in CHO cells lay the foundation for stable expression of antibody coding gene in CHO cells.
, http://www.100md.com
Keywords: HAV; gene expression; CHO; Fab ▲ ▲
抗HAV抗体可用于甲型肝炎易感人群的被动免疫。人源抗体可避免鼠源抗体引起的HAMA反应,有良好的应用前景。另外,哺乳动物细胞表达的抗体具有能正确装配、折叠与糖基化等功能,且易于大规模生产及分泌水平高等优点。我们在从抗体组合文库中筛选到人源抗HAV噬菌体抗体的基础上〔1〕,分别构建了含人抗HAV重链Fd、轻链基因的真核表达载体,共转染CHO/dhfr-细胞后,从培养上清中检测到有抗HAV活性的抗体片段。
1 材料和方法
1.1材料E.coliXL1Blue由本室保存。含重链信号肽序列的质粒HSB(pBSIIKS的SalI和XhoI之间),含轻链信号肽序列的质粒LSB(pBSIIKS的HindIII和SacI之间),及表达载体pCdhfr1等,均由军事医学科学院五所11室构建。含重链基因的质粒pBSH(pBSIISK的XhoI和SpeI之间),含轻链基因的质粒pBSL(pBSIISK的SacI和XbaI之间)购自Invitrogen公司。CHO(dhfr)细胞株购自ATCC公司。IMDM培养基和胎牛血清,购自Hyclone公司。DNA限制性内切酶、T4DNA连接酶和Klenow酶,购自Takara公司;PwoDNA多聚酶为宝灵曼公司产品。G418购自上海华联制药公司。抗人κ链单抗(mAb)为Pharmingen公司产品。HAV抗原(效价1:40),购自302医院。
, 百拇医药
1.2方法
1.2.1质粒连接、转化和基因克隆参见文献〔2〕进行。
1.2.2Fd基因的扩增以pBSHS为模板进行PCR。引物的序列为:Fd3:5′-CGGAATTCTTAACTAGTTTTGTCACAA3′(划线处为EcoRI切点);HSN5:5′-GCGTCGACCACCATGGAGTTTGGGCTGAGCCTG3′(划线处为SalI切点)。反应条件:质粒DNA5ng,引物各100ng,PwoDNA多聚酶2U,dNTPs2.5mmol/L,10×buffer5μL,加水至50μL;扩增条件:于94℃预变性3min,然后94℃1min,55℃退火1min,72℃延伸1min,共30个循环,最后于72℃总延伸10min。加等体积酚:氯仿抽提PCR产物用乙醇沉淀。回收DNA,经SalI和EcoRI双酶切,低熔点胶纯化回收,与经同样酶切的pBluescriptIISK连接,转化E.coliXL1Blue,在含XGal和IPTG的LB平板上,37℃培养过夜,挑取白色菌落,筛选阳性克隆。
, 百拇医药
1.2.3阳性克隆的筛选CHO细胞的转染采用脂质体法(详见LifeTechnologies公司的转染试剂使用说明)。转染24h后,换新鲜IMDM培养液(含100mL/L的透析胎牛血清,500mg/L的G418,50mg/L的青霉素及50μg/L的链霉素),之后每4d换液1次。经2wk培养,待细胞形成克隆,用tip挑取单个克隆于24孔板中继续培养,收集上清检测Fab的表达,阳性克隆用氨甲喋呤(MTX)进行加压筛选〔3〕。
1.2.4Fab表达的检测以抗人κ链mAb(1mg/L)包板,依次加入细胞培养上清(37℃孵育1h)、HAV抗原(37℃孵育1h)和HRP抗HAVmAb(37℃孵育40min),每步均洗板。最后加底物显色,于490nm波长测定光吸收(A)值。
2 结果
2.1重组质粒pBSHS和pBSLS的构建用ScaI和XhoI双酶切pBSH,回收长片段与经同样酶切的HSN的短片段连接,转化、筛选重链与其信号肽基因相连接的克隆pBSHS(图1)。同样,用ScaI和SacI双酶切LSB,回收长片段,与经同样酶切的pBSL连接,转化XL1Blue,筛选轻链与其信号肽基因相连的克隆pBSLS(图2)。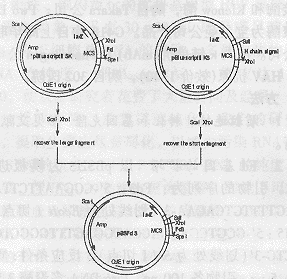
, 百拇医药
图1Fd基因与其信号肽基因序列的连接
Fig1LigationofFdgenetothesignalpeptidgenesequence
图2轻链与其信号肽基因序列的连接
Fig2LigationofLchaingenetothesignalpeptide
genesequence
2.2Fd基因的扩增琼脂糖凝胶电泳显示,用HSN5′端和Fd3′端可扩增出750bp左右的产物(图3)。SalI和EcoRI酶切后,与经同样酶切的pBluescriptIISK连接、转化,筛选出阳性克隆pBSFdS。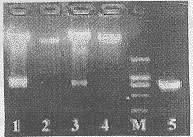
, 百拇医药
图3Fd基因的扩增及重组表达质粒的酶切鉴定
Fig3AmplificationofFdgeneandrestrictionenzymeanalysis
ofrecombinantexpressionplasmid
M:markerDL2000;1:pCdFd/XhoI+NotI;2:pCdhfr1/XhoI+NotI;3:pCDLS/HindIII+XbaI;4:pCDNA3.1/HindIII+XbaI;5:PCRamplifiedFdgene.
2.3真核表达载体的构建及序列测定用SalI和SmaI将Fd基因及其信号肽基因从pBSFdS切下,与经XhoI和SmaI酶切的pCdhfr1载体连接、转化,筛选阳性克隆pCdFd,并在ABI377型DNA全自动测序仪上测序。用HindIII和XbaI从pBSLS上切出轻链及其信号肽基因,与经同样酶切的pCDNA3.1载体连接、转化,筛选阳性克隆pCDLS,并酶切鉴定及测序(图3,4)。结果表明,Fd基因、轻链基因的序列与我们以往测序的结果一致〔1〕;Fd基因、轻链基因与各自的信号肽基因序列连接正确;Fd在3′端引入了终止密码子,表明轻、重链基因表达载体的构建成功。
, 百拇医药
图4Fd基因、轻链基因部分序列及其信号肽基因序列的测定
Fig4PartialsequencingofFdgene,Lchaingeneandtheirsignalpeptidegenes
A:PartialsequencingofpartialsequenceofFdgeneanditssignalpeptidegene;
B:PartialsequencingofpartialsequenceofLchainanditssignalpeptidegene.
2.4Fab片段在CHO细胞中的表达用Qiagen公司的试剂盒提取并纯化质粒,以脂质体法转染CHO/dhfr-细胞,以G418(500mg/L)作为选择药物,并由于培养液中不含HT,故必须同时含有DHFR与NEO两种基因的克隆才能存活。经2wk培养,细胞形成克隆,用ELISA法检出培养上清中含有可与HAV抗原结合的Fab片段(以分泌抗乙型肝炎病毒表面抗体的CHO细胞上清作为对照)。挑取部分细胞克隆,进行氨甲喋呤(MTX)药物加压培养(图5),当药物浓度为1×108mol/L时,细胞培养上清中抗-HAV抗体的最高滴度为1∶50。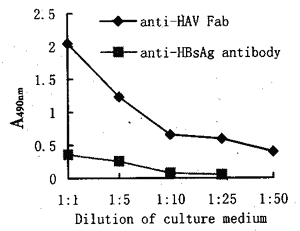
, 百拇医药
图5ELISA检测共转染CHO细胞培养上清中抗HAVFab
Fig5DetectionofantiHAVFabinthesupernatantofcotrans
fectedCHOcellsbyELISA
3 讨论
为了使抗体基因能够分泌表达,我们分别在抗体轻、重链基因前连接了人抗体基因轻、重链信号肽基因,这样抗体合成后便可经内质网、高尔基体,完成其正确折叠。重、轻链基因与其信号肽基因连接过程中,在不破坏载体完整性的前提下,利用载体上多克隆位点以外的ScaI位点,成功地将信号肽基因与重、轻链基因正确连接,可免去操作短片段基因(信号肽基因)的困难。为确保起始密码子的起始效率,我们在信号肽序列前引入了真核核糖体进行翻译起始部位的共同序列—KOZAK,以确保mRNA翻译的有效进行〔4〕。
, 百拇医药
抗体基因的表达不同于一般外源蛋白,需要同时考虑重、轻链基因。Kaufman等〔5〕将筛选标记基因DHFR与目的基因克隆于两个载体共转染CHO细胞。结果表明,这两个基因都整合于染色体的相同区域并共扩增。Bender等〔6〕发现,共转染的CHO细胞中无单独表达重链基因的克隆存在,推测单独表达的重链对细胞具有毒性。我们分别将重、轻链基因克隆至两个不同的表达载体,然后共转染,实验证明该技术路线是可行的。
为了高效地表达抗体分子,我们采用了两个高效表达载体(它们含有CMV早期启动子和增强子),并分别采用BGH和SV40晚期poly(A)信号,保证了转录的终止及RNA的加工;所用新霉素磷酸转移酶(Neo)基因和二氢叶酸还原(DHFR)酶基因,有利于稳定转染细胞株的筛选,并可用氨甲喋呤(MTX)对细胞进行加压筛选。在加压的条件下,DHFR酶基因可扩增至每个细胞2000个拷贝,从而使与之共扩增的目的基因达到高拷贝。pCdhfr1在启动子和目的基因之间引入了内含子序列,有利于提高基因的转录或RNA的加工〔7〕。
, 百拇医药
总之,我们利用CHO表达系统表达的Fab,经ELISA验证其与HAV抗原具有良好的结合活性,但由于细胞还没有克隆化和进一步用MTX加压,因而表达量较低。■
基金项目:国家“863”课题资助,NO.Z18-01
作者简介:于长明,男,28,博士生北京市丰台区东大街20号,Tel.(010)669485632000 by JCell Mol Immunol Press www.immunology.net/jcmi;Email.immuedit@fmmu.edu.cn
参 考 文 献 :
〔1〕 于长明,杜桂鑫,毛春生,等.人源抗HAV抗体的筛选及序列分析〔J〕.中华肝脏病杂志,1999: 7: 162-164.
〔2〕 萨姆布鲁克J, 弗里奇EF, 曼尼阿蒂T,等.分子克隆实验指南〔J〕.第2版 .北京:科学技术出版社,1996; 42-59.
, 百拇医药
〔3〕 Frederick A, Roger B, Robert E K, et al. Current protocols in molecular biology〔M〕 . John Wiley & Sons, Inc.1992: 2: 16.14. 3-5.
〔4〕 Kozak, M. The scanning model for translation: an update〔J〕 . J Cell Biol, 1989; 108: 229-232.
〔5〕 Kaufman RJ, Sharp PA. Construction of modular dihydrofolate reductase cDNA gene: analysis of signals utilized for efficient expression〔J〕 . Mol Cell Biol, 1982; 2: 1304-1319.
, 百拇医药
〔6〕 Bender E, Woof JM, Atkin JD, et al. Recombinant human antibodies: linkage of an Fab fragment from a combinatorial library to an Fc fragment for expression in mammalian cell cultrue〔J〕 . Human Antibody Hybridomas, 1993; 4: 74-79.
〔7〕 Chung S, Perry RP. Importance of introns for expression of mouse ribosomal protein gene rpL32〔J〕 . Mol Cell Biol, 1989; 9: 2075 2082.
收稿日期:1999-11-15
修回日期:1999-01-20, http://www.100md.com
单位:于长明(第四军医大学微生物学教研室,陕西西安710032);徐志凯(第四军医大学微生物学教研室,陕西西安710032);徐静(军事医学科学院微生物流行病研究所11室,北京);刘国奇(军事医学科学院微生物流行病研究所11室,北京);童贻刚(军事医学科学院微生物流行病研究所11室,北京);宋宏斌(军事医学科学院微生物流行病研究所11室,北京);王海涛(军事医学科学院微生物流行病研究所11室,北京)
关键词:甲型肝炎病毒;基因表达;中华仓鼠卵巢细胞;Fab
细胞与分子免疫学杂志000303
摘要:目的构建人源抗HAVFab真核表达载体并进行表达。方法采用DNA重组技术将抗体重轻链基因与信号肽基因连接,并分别插入真核表达载体pCdhfr1和pCDNA3.1;以脂质体介导法转染CHO细胞,经G418筛选细胞,ELISA检测Fab基因的表达。结果成功地构建了Fab表达载体。转染细胞后,经ELISA检测,细胞培养上清中有抗原结合活性的Fab片段。结论Fab真核表达载体的构建及其在CHO细胞中的表达,为抗体编码基因在CHO细胞中稳定表达奠定了基础。
, http://www.100md.com
中图号:Q786 文献标识码:A 文章编号:1007-8738(2000)03-0193-03
Construction and expression of human anti-HAV Fab
eukaryotic expression vector
YU Chang-ming XU Zhi-kai
(Department of Microbiology, Fourth Military Medical University, Xi'an 710032, Shaanxi Province)
XU jing LIU Guo-qi TONG Yi-gang SONG Hong-bin Wang Hai-tao
, http://www.100md.com
(Institute of Microbiology & Epidemology, Academy of Military Medical Sciences, Beijing 100071, China.)
Abstract: Aim To construct a eukaryotic expression vector of human anti HAV Fab and to detect its expression in CHO cells. Methods Fd and light chain genes were ligated to their signal peptide sequences and inserted into pCdhfr1 or pCDNA3.1, respectively. The recombinant plasmids were co transfected into CHO cells, and resistant clones were obtained by G418 selection. The expression of Fab gene was detected by ELISA. Results Recombinant plasmids were successfully constructed. The plasmid transfected CHO cells were obtained by co transfection and G418 selection. ELISA confirmed the expression of anti HAV Fab in culture medium. Conclusion The construction of human anti HAV Fab eukaryotic expression vector and its expression in CHO cells lay the foundation for stable expression of antibody coding gene in CHO cells.
, http://www.100md.com
Keywords: HAV; gene expression; CHO; Fab ▲ ▲
抗HAV抗体可用于甲型肝炎易感人群的被动免疫。人源抗体可避免鼠源抗体引起的HAMA反应,有良好的应用前景。另外,哺乳动物细胞表达的抗体具有能正确装配、折叠与糖基化等功能,且易于大规模生产及分泌水平高等优点。我们在从抗体组合文库中筛选到人源抗HAV噬菌体抗体的基础上〔1〕,分别构建了含人抗HAV重链Fd、轻链基因的真核表达载体,共转染CHO/dhfr-细胞后,从培养上清中检测到有抗HAV活性的抗体片段。
1 材料和方法
1.1材料E.coliXL1Blue由本室保存。含重链信号肽序列的质粒HSB(pBSIIKS的SalI和XhoI之间),含轻链信号肽序列的质粒LSB(pBSIIKS的HindIII和SacI之间),及表达载体pCdhfr1等,均由军事医学科学院五所11室构建。含重链基因的质粒pBSH(pBSIISK的XhoI和SpeI之间),含轻链基因的质粒pBSL(pBSIISK的SacI和XbaI之间)购自Invitrogen公司。CHO(dhfr)细胞株购自ATCC公司。IMDM培养基和胎牛血清,购自Hyclone公司。DNA限制性内切酶、T4DNA连接酶和Klenow酶,购自Takara公司;PwoDNA多聚酶为宝灵曼公司产品。G418购自上海华联制药公司。抗人κ链单抗(mAb)为Pharmingen公司产品。HAV抗原(效价1:40),购自302医院。
, 百拇医药
1.2方法
1.2.1质粒连接、转化和基因克隆参见文献〔2〕进行。
1.2.2Fd基因的扩增以pBSHS为模板进行PCR。引物的序列为:Fd3:5′-CGGAATTCTTAACTAGTTTTGTCACAA3′(划线处为EcoRI切点);HSN5:5′-GCGTCGACCACCATGGAGTTTGGGCTGAGCCTG3′(划线处为SalI切点)。反应条件:质粒DNA5ng,引物各100ng,PwoDNA多聚酶2U,dNTPs2.5mmol/L,10×buffer5μL,加水至50μL;扩增条件:于94℃预变性3min,然后94℃1min,55℃退火1min,72℃延伸1min,共30个循环,最后于72℃总延伸10min。加等体积酚:氯仿抽提PCR产物用乙醇沉淀。回收DNA,经SalI和EcoRI双酶切,低熔点胶纯化回收,与经同样酶切的pBluescriptIISK连接,转化E.coliXL1Blue,在含XGal和IPTG的LB平板上,37℃培养过夜,挑取白色菌落,筛选阳性克隆。
, 百拇医药
1.2.3阳性克隆的筛选CHO细胞的转染采用脂质体法(详见LifeTechnologies公司的转染试剂使用说明)。转染24h后,换新鲜IMDM培养液(含100mL/L的透析胎牛血清,500mg/L的G418,50mg/L的青霉素及50μg/L的链霉素),之后每4d换液1次。经2wk培养,待细胞形成克隆,用tip挑取单个克隆于24孔板中继续培养,收集上清检测Fab的表达,阳性克隆用氨甲喋呤(MTX)进行加压筛选〔3〕。
1.2.4Fab表达的检测以抗人κ链mAb(1mg/L)包板,依次加入细胞培养上清(37℃孵育1h)、HAV抗原(37℃孵育1h)和HRP抗HAVmAb(37℃孵育40min),每步均洗板。最后加底物显色,于490nm波长测定光吸收(A)值。
2 结果
2.1重组质粒pBSHS和pBSLS的构建用ScaI和XhoI双酶切pBSH,回收长片段与经同样酶切的HSN的短片段连接,转化、筛选重链与其信号肽基因相连接的克隆pBSHS(图1)。同样,用ScaI和SacI双酶切LSB,回收长片段,与经同样酶切的pBSL连接,转化XL1Blue,筛选轻链与其信号肽基因相连的克隆pBSLS(图2)。

, 百拇医药
图1Fd基因与其信号肽基因序列的连接
Fig1LigationofFdgenetothesignalpeptidgenesequence

图2轻链与其信号肽基因序列的连接
Fig2LigationofLchaingenetothesignalpeptide
genesequence
2.2Fd基因的扩增琼脂糖凝胶电泳显示,用HSN5′端和Fd3′端可扩增出750bp左右的产物(图3)。SalI和EcoRI酶切后,与经同样酶切的pBluescriptIISK连接、转化,筛选出阳性克隆pBSFdS。

, 百拇医药
图3Fd基因的扩增及重组表达质粒的酶切鉴定
Fig3AmplificationofFdgeneandrestrictionenzymeanalysis
ofrecombinantexpressionplasmid
M:markerDL2000;1:pCdFd/XhoI+NotI;2:pCdhfr1/XhoI+NotI;3:pCDLS/HindIII+XbaI;4:pCDNA3.1/HindIII+XbaI;5:PCRamplifiedFdgene.
2.3真核表达载体的构建及序列测定用SalI和SmaI将Fd基因及其信号肽基因从pBSFdS切下,与经XhoI和SmaI酶切的pCdhfr1载体连接、转化,筛选阳性克隆pCdFd,并在ABI377型DNA全自动测序仪上测序。用HindIII和XbaI从pBSLS上切出轻链及其信号肽基因,与经同样酶切的pCDNA3.1载体连接、转化,筛选阳性克隆pCDLS,并酶切鉴定及测序(图3,4)。结果表明,Fd基因、轻链基因的序列与我们以往测序的结果一致〔1〕;Fd基因、轻链基因与各自的信号肽基因序列连接正确;Fd在3′端引入了终止密码子,表明轻、重链基因表达载体的构建成功。

, 百拇医药
图4Fd基因、轻链基因部分序列及其信号肽基因序列的测定
Fig4PartialsequencingofFdgene,Lchaingeneandtheirsignalpeptidegenes
A:PartialsequencingofpartialsequenceofFdgeneanditssignalpeptidegene;
B:PartialsequencingofpartialsequenceofLchainanditssignalpeptidegene.
2.4Fab片段在CHO细胞中的表达用Qiagen公司的试剂盒提取并纯化质粒,以脂质体法转染CHO/dhfr-细胞,以G418(500mg/L)作为选择药物,并由于培养液中不含HT,故必须同时含有DHFR与NEO两种基因的克隆才能存活。经2wk培养,细胞形成克隆,用ELISA法检出培养上清中含有可与HAV抗原结合的Fab片段(以分泌抗乙型肝炎病毒表面抗体的CHO细胞上清作为对照)。挑取部分细胞克隆,进行氨甲喋呤(MTX)药物加压培养(图5),当药物浓度为1×108mol/L时,细胞培养上清中抗-HAV抗体的最高滴度为1∶50。

, 百拇医药
图5ELISA检测共转染CHO细胞培养上清中抗HAVFab
Fig5DetectionofantiHAVFabinthesupernatantofcotrans
fectedCHOcellsbyELISA
3 讨论
为了使抗体基因能够分泌表达,我们分别在抗体轻、重链基因前连接了人抗体基因轻、重链信号肽基因,这样抗体合成后便可经内质网、高尔基体,完成其正确折叠。重、轻链基因与其信号肽基因连接过程中,在不破坏载体完整性的前提下,利用载体上多克隆位点以外的ScaI位点,成功地将信号肽基因与重、轻链基因正确连接,可免去操作短片段基因(信号肽基因)的困难。为确保起始密码子的起始效率,我们在信号肽序列前引入了真核核糖体进行翻译起始部位的共同序列—KOZAK,以确保mRNA翻译的有效进行〔4〕。
, 百拇医药
抗体基因的表达不同于一般外源蛋白,需要同时考虑重、轻链基因。Kaufman等〔5〕将筛选标记基因DHFR与目的基因克隆于两个载体共转染CHO细胞。结果表明,这两个基因都整合于染色体的相同区域并共扩增。Bender等〔6〕发现,共转染的CHO细胞中无单独表达重链基因的克隆存在,推测单独表达的重链对细胞具有毒性。我们分别将重、轻链基因克隆至两个不同的表达载体,然后共转染,实验证明该技术路线是可行的。
为了高效地表达抗体分子,我们采用了两个高效表达载体(它们含有CMV早期启动子和增强子),并分别采用BGH和SV40晚期poly(A)信号,保证了转录的终止及RNA的加工;所用新霉素磷酸转移酶(Neo)基因和二氢叶酸还原(DHFR)酶基因,有利于稳定转染细胞株的筛选,并可用氨甲喋呤(MTX)对细胞进行加压筛选。在加压的条件下,DHFR酶基因可扩增至每个细胞2000个拷贝,从而使与之共扩增的目的基因达到高拷贝。pCdhfr1在启动子和目的基因之间引入了内含子序列,有利于提高基因的转录或RNA的加工〔7〕。
, 百拇医药
总之,我们利用CHO表达系统表达的Fab,经ELISA验证其与HAV抗原具有良好的结合活性,但由于细胞还没有克隆化和进一步用MTX加压,因而表达量较低。■
基金项目:国家“863”课题资助,NO.Z18-01
作者简介:于长明,男,28,博士生北京市丰台区东大街20号,Tel.(010)669485632000 by JCell Mol Immunol Press www.immunology.net/jcmi;Email.immuedit@fmmu.edu.cn
参 考 文 献 :
〔1〕 于长明,杜桂鑫,毛春生,等.人源抗HAV抗体的筛选及序列分析〔J〕.中华肝脏病杂志,1999: 7: 162-164.
〔2〕 萨姆布鲁克J, 弗里奇EF, 曼尼阿蒂T,等.分子克隆实验指南〔J〕.第2版 .北京:科学技术出版社,1996; 42-59.
, 百拇医药
〔3〕 Frederick A, Roger B, Robert E K, et al. Current protocols in molecular biology〔M〕 . John Wiley & Sons, Inc.1992: 2: 16.14. 3-5.
〔4〕 Kozak, M. The scanning model for translation: an update〔J〕 . J Cell Biol, 1989; 108: 229-232.
〔5〕 Kaufman RJ, Sharp PA. Construction of modular dihydrofolate reductase cDNA gene: analysis of signals utilized for efficient expression〔J〕 . Mol Cell Biol, 1982; 2: 1304-1319.
, 百拇医药
〔6〕 Bender E, Woof JM, Atkin JD, et al. Recombinant human antibodies: linkage of an Fab fragment from a combinatorial library to an Fc fragment for expression in mammalian cell cultrue〔J〕 . Human Antibody Hybridomas, 1993; 4: 74-79.
〔7〕 Chung S, Perry RP. Importance of introns for expression of mouse ribosomal protein gene rpL32〔J〕 . Mol Cell Biol, 1989; 9: 2075 2082.
收稿日期:1999-11-15
修回日期:1999-01-20, http://www.100md.com