不同培养时间软骨细胞的生物学特性
作者:林建华 吴朝阳 许卫红
单位:福建医科大学附属第一医院骨科,福州 350005
关键词:组织学技术;软骨;细胞;培养的;兔
福建医科大学学报000209
摘要:目的 探讨软骨细胞在体外不同培养时间的生物学特性。方法 把软骨细胞置盖玻片上培养,观察不同培养时间细胞的形态学变化和增殖能力;应用阿新蓝和三色染色,观察细胞在培养过程中酸性粘多糖(GAG)和胶原分泌情况。结果 软骨细胞经体外单层培养,传代4~5代后,细胞形态逐渐由多角形变为梭形,基质分泌减少,GAG和胶原染色变浅。结论 软骨细胞在体外培养3周左右是作为软骨组织工程的最佳种子细胞。
中图分类号:R336;R318.01;R329.2 文献标识码:A
, 百拇医药
文章编号:1000-2235(2000)02-0123-03
Cell Biological Characteristics of Chondrocytes Cultured in vitro
LIN Jian-hua,WU Zhao-yang,XU Wei-hong
(Department of Orthopaedics,The First Affiliated Hospital,Fujian Medical University,Fuzhou 350005,China)
ABSTRACT:Objective Investigation of the biomechanical properties of chondrocytes in vitro cultured in different time.Methods Cultures of chondrocytes on small cover-slide(miniculture) were used to observe the variation of morphology and proliferation of chondrocytes in different time.Meanwhile,glycosaminoglycan(GAG) and collagen synthesis were determined by Alician Blue and Masson 3 staining.Results The proliferation of chondrocytes were very capable in the third to fourth generation and polyhedral angle-shaped chondrocytes gradually changed into "spindle-shape" cells after the fourth when propagated in monolayer culture.The synthesis of cartilage extracellular,as defined by Alcian Blue and Masson 3 staining,appeared a decrease with time.Conclusion The chondrocytes cultured about 3 weeks are the best cells for cartilage tissue engineering.
, 百拇医药
KEY WORDS:histology method;chondrocytes;cell,cultured;rat
软骨细胞体外培养的研究是近几十年来国内外学者研究的热点,但过去的研究大多基于软骨病理和药物反应的目的[1],近年来软骨组织工程的问世对体外软骨细胞的培养和研究提出更高的要求[2]。笔者于1999年1~12月对关节软骨细胞进行培养,观察细胞在体外长期培养过程中的生长曲线、形态学变化、酸性粘多糖(GAG)和胶原分泌情况,探讨其规律。
1 材料与方法
1.1 仪器、材料和试剂 CO2培养箱(D-63450,美国Heraens Ins GmbH & Co KG),超净工作台(兰州净化设备厂),Olympus倒置显微镜(IX50,日本奥林巴斯光学工业株式会社),其他常规培养设备和液体;F12培养基(美国Sigma公司),小牛血清(北京欣经科试剂公司),青霉素(华北制药股份有限公司),链霉素(河南新乡华星药厂),阿新蓝和MASSON三色染料(本院病理科提供)。
, http://www.100md.com
1.2 软骨细胞培养 取3月龄健康新西兰大白兔10只,体重1.51~2.07 kg,75%酒精溺死,刷毛,常规消毒、铺巾。取每只兔子双侧膝、髋关节面软骨,操作中仔细剥离关节周围软组织。切下的软骨立即置于含500 U/ml青霉素、500 μg/ml链霉素PBS中清洗,然后剪成1 mm×1 mm×1 mm的软骨块,经0.25%胰酶消化0.5 h后,0.2%胶原酶摇床上消化。2 h收集一次细胞,计数,按1.5×105/ml密度培养。培养液F12培养基含15%小牛血清、青霉素100 U/ml、链霉素100 μg/ml、维生素C 50 μg/ml,培养条件为5% CO2、37 ℃、饱和湿度, 一周换液两次、传代一次。
1.3 软骨细胞的形态学观察 在倒置显微镜下观察软骨细胞的存活、贴壁、生长情况及各代软骨细胞在不同培养时间的形态学变化。
1.4 软骨细胞的体外生长曲线 用胰酶消化细胞后计数,以培养天数为横坐标,取10只兔子软骨各代细胞平均数量为纵坐标,作生长曲线。
, 百拇医药
1.5 各代软骨细胞GAG分泌情况 将细胞按一致细胞密度(1.5×105/ml)接种在盖玻片上,6天后取出盖玻片,应用阿新蓝(Alician Blue)染色,观察细胞GAG分泌情况。
1.6 各代软骨细胞胶原分泌情况 将细胞按一致细胞密度(1.5×105/ml)接种在盖玻片上,6天后取出盖玻片,应用MASSON三色染色,观察体外胶原分泌情况。
2 结 果
2.1 生长曲线(图1) 软骨细胞在体外培养,原代基本不增殖;第2,3,4代为快速增殖期,第5代后细胞增殖逐渐变慢,第7代后细胞基本不增殖。
2.2 形态学变化 软骨细胞初培养时为多角形的上皮样细胞,随着培养代次的增加、时间的延长,细胞形态逐渐变长,胞体变薄,到第六代后基本成为成纤维样细胞(图2,3)。
, 百拇医药
2.3 GAG染色结果 前4代软骨细胞GAG分泌旺盛,细胞周围被阿新蓝染成蓝色,颜色较深,随着代次增加染色逐渐变浅,到第七代基本不着色(图4,5)。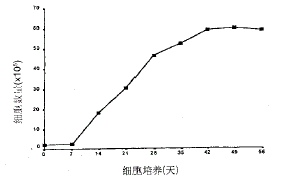
图1 软骨细胞生长曲线
2.4 胶原染色结果 前4代软骨细胞分泌的胶原可被染成绿色,第五代后基本不着色(图6,7)。
3 讨 论
3.1 软骨细胞增殖问题 关节面软骨组织损伤后难以修复,是因为软骨细胞在体内缺乏增殖能力[3]。软骨细胞在体外单层培养时,于培养的前几天出现延滞生长,然后才开始大量增殖。笔者认为可能是软骨细胞在体外培养时有一个适应培养环境的过程,到19~22天,细胞可达到原来的8~12倍,传代到第4代,细胞增殖达到高峰。然后细胞增殖逐渐变慢,到第8代后,细胞基本不增殖。因此就细胞增殖而言,第4代的软骨细胞增殖能力最强。
, http://www.100md.com
3.2 软骨细胞的形态学变化 关节软骨细胞在体内大多呈圆形或椭圆形,体外单层培养的细胞起初为多角形,传代培养后,软骨细胞形态逐渐发生改变。第5代后表现为长梭形,类似成纤维细胞,这种现象与国外许多学者报道一致[4]。Watt等人认为,软骨细胞梭形变与细胞表型上的去分化(dedifferertiation)有关,是判断软骨细胞表型是否改变的主要指标[5]。笔者也观察到,单层培养的细胞密度越低,去分化速度越快。文献报道高密度或立体三维培养可维持软骨细胞形态和表型,但密度过高不利细胞增殖[6,7]。软骨细胞的去分化过程是逐渐发生的,细胞表型的改变和功能的丧失速度与培养密度、传代方式等密切相关。所以,如何选择适当的细胞密度和改变细胞的培养环境是优化种子细胞的有效途径,值得进一步研究。
3.3 软骨细胞GAG和胶原分泌情况 软骨由软骨细胞和基质组成,软骨细胞的主要功能是分泌基质,软骨基质主要由胶原和GAG组成,是软骨组织功能的最主要部分。笔者的研究发现,软骨细胞在体外培养时可维持其分泌基质功能,原代软骨细胞在3~4天开始分泌GAG和胶原,第4代细胞在培养的第二天即可分泌基质,第2代软骨细胞的分泌基质能力最强。笔者认为,这是因为原代细胞需要一个适应培养环境的过程。从第5代开始,随着培养时间的延长,软骨细胞逐渐衰老,分泌基质能力下降,到第7代完全丧失分泌基质能力。所以从分泌基质情况分析,体外培养的时间越短,软骨细胞的质量越好。
, http://www.100md.com
3.4 组织工程对软骨种子细胞的要求 软骨组织工程的基本思路,是通过体外分离培养获取大量扩增的软骨细胞,然后与具一定结构的三维骨架共同培养后植入体内,通过细胞间的相互粘附、生长繁殖、分泌基质,形成软骨组织。它要求有一定数量的软骨细胞,细胞表型不变,而且应具有较强的基质分泌能力[8]。
3.5 软骨细胞最佳培养时间和条件 笔者的研究显示,软骨细胞在体外培养3周左右是作为软骨组织工程的种子细胞的最佳时机。从上述软骨细胞体外培养的生长曲线、形态学变化及基质分泌情况得以证明,此时软骨细胞既得到一定扩增,又具有较强的基质分泌能力,并且细胞表型尚未丧失。笔者将对此作进一步研究。
图2 原代软骨细胞呈多角形上皮样,细胞百积小,胞体厚.×100
图3第五低软骨细胞部分变为长梭形,细胞面积变大,胞体变薄。×100
, http://www.100md.com
图4 第二代软骨细胞GAG染色,胞体及细胞周围被阿新蓝染成蓝色,颜色深。×100
图5 第五代软骨细胞GAG染色,细胞核被染成淡蓝色,细胞质和细胞周围基本不着色,×100
图6 第二代软骨细胞胶原染色,细胞核被染成绿色,细胞质浅染,×100
图7 第五代软骨细胞胶原染色 软骨细胞被染成红色×100
基金项目:福建省教委科研基金资助项目(K96038)
作者简介:林建华(1955~),男,主任医师,副教授.
参考文献
[1]Qi WN,Sclly SP.Effect of type Ⅱ collagen in chondrocyte response to TGF-betal regulation[J].Exp Cell Res,1998,241(1):142.
, 百拇医药
[2]Kittlick PO,Engelman D.The glycosaminoglycan metabolism of chondrocyte monolayer cultures under number and pathological conditions,A methodic study[J].Exp Pathol,1991,41(2):98.
[3]Vonder Mark K,Gauss V,Vonder Mark H,et al.Relationship between cell shape and type of collagen phenotype in culture[J].Nature,1977,267:531.
[4]Vonder Mark K.Differentiation,modulation and dedifferentiation of chondrocytes[J].Rheumatology,1986,10:272.
, http://www.100md.com
[5]Watt F.Effect of seeding density on stability of the dedifferentiated phenotype of pig articular chondrocytes in culture[J].J Cell Sci,1988,89:373.
[6]Caplan AI.Cell-based technologies for cartilage repair[J].Am Acad Orthop Surg,1992,111:122.
[7]Ahapiro F,Koide S.Cell origination and differentiation in the repair of full-thickness defects of articular cartilage[J].J Bone Joint Surg,1993,75:532.
[8]Vancanti,Langer R.Synthetic polymers seeded with chondrocytes provided a template for new cartilage formation[J].Plast Reconstr Surg,1991,88(5):753.
收稿日期:2000-01-31, 百拇医药
单位:福建医科大学附属第一医院骨科,福州 350005
关键词:组织学技术;软骨;细胞;培养的;兔
福建医科大学学报000209
摘要:目的 探讨软骨细胞在体外不同培养时间的生物学特性。方法 把软骨细胞置盖玻片上培养,观察不同培养时间细胞的形态学变化和增殖能力;应用阿新蓝和三色染色,观察细胞在培养过程中酸性粘多糖(GAG)和胶原分泌情况。结果 软骨细胞经体外单层培养,传代4~5代后,细胞形态逐渐由多角形变为梭形,基质分泌减少,GAG和胶原染色变浅。结论 软骨细胞在体外培养3周左右是作为软骨组织工程的最佳种子细胞。
中图分类号:R336;R318.01;R329.2 文献标识码:A
, 百拇医药
文章编号:1000-2235(2000)02-0123-03
Cell Biological Characteristics of Chondrocytes Cultured in vitro
LIN Jian-hua,WU Zhao-yang,XU Wei-hong
(Department of Orthopaedics,The First Affiliated Hospital,Fujian Medical University,Fuzhou 350005,China)
ABSTRACT:Objective Investigation of the biomechanical properties of chondrocytes in vitro cultured in different time.Methods Cultures of chondrocytes on small cover-slide(miniculture) were used to observe the variation of morphology and proliferation of chondrocytes in different time.Meanwhile,glycosaminoglycan(GAG) and collagen synthesis were determined by Alician Blue and Masson 3 staining.Results The proliferation of chondrocytes were very capable in the third to fourth generation and polyhedral angle-shaped chondrocytes gradually changed into "spindle-shape" cells after the fourth when propagated in monolayer culture.The synthesis of cartilage extracellular,as defined by Alcian Blue and Masson 3 staining,appeared a decrease with time.Conclusion The chondrocytes cultured about 3 weeks are the best cells for cartilage tissue engineering.
, 百拇医药
KEY WORDS:histology method;chondrocytes;cell,cultured;rat
软骨细胞体外培养的研究是近几十年来国内外学者研究的热点,但过去的研究大多基于软骨病理和药物反应的目的[1],近年来软骨组织工程的问世对体外软骨细胞的培养和研究提出更高的要求[2]。笔者于1999年1~12月对关节软骨细胞进行培养,观察细胞在体外长期培养过程中的生长曲线、形态学变化、酸性粘多糖(GAG)和胶原分泌情况,探讨其规律。
1 材料与方法
1.1 仪器、材料和试剂 CO2培养箱(D-63450,美国Heraens Ins GmbH & Co KG),超净工作台(兰州净化设备厂),Olympus倒置显微镜(IX50,日本奥林巴斯光学工业株式会社),其他常规培养设备和液体;F12培养基(美国Sigma公司),小牛血清(北京欣经科试剂公司),青霉素(华北制药股份有限公司),链霉素(河南新乡华星药厂),阿新蓝和MASSON三色染料(本院病理科提供)。
, http://www.100md.com
1.2 软骨细胞培养 取3月龄健康新西兰大白兔10只,体重1.51~2.07 kg,75%酒精溺死,刷毛,常规消毒、铺巾。取每只兔子双侧膝、髋关节面软骨,操作中仔细剥离关节周围软组织。切下的软骨立即置于含500 U/ml青霉素、500 μg/ml链霉素PBS中清洗,然后剪成1 mm×1 mm×1 mm的软骨块,经0.25%胰酶消化0.5 h后,0.2%胶原酶摇床上消化。2 h收集一次细胞,计数,按1.5×105/ml密度培养。培养液F12培养基含15%小牛血清、青霉素100 U/ml、链霉素100 μg/ml、维生素C 50 μg/ml,培养条件为5% CO2、37 ℃、饱和湿度, 一周换液两次、传代一次。
1.3 软骨细胞的形态学观察 在倒置显微镜下观察软骨细胞的存活、贴壁、生长情况及各代软骨细胞在不同培养时间的形态学变化。
1.4 软骨细胞的体外生长曲线 用胰酶消化细胞后计数,以培养天数为横坐标,取10只兔子软骨各代细胞平均数量为纵坐标,作生长曲线。
, 百拇医药
1.5 各代软骨细胞GAG分泌情况 将细胞按一致细胞密度(1.5×105/ml)接种在盖玻片上,6天后取出盖玻片,应用阿新蓝(Alician Blue)染色,观察细胞GAG分泌情况。
1.6 各代软骨细胞胶原分泌情况 将细胞按一致细胞密度(1.5×105/ml)接种在盖玻片上,6天后取出盖玻片,应用MASSON三色染色,观察体外胶原分泌情况。
2 结 果
2.1 生长曲线(图1) 软骨细胞在体外培养,原代基本不增殖;第2,3,4代为快速增殖期,第5代后细胞增殖逐渐变慢,第7代后细胞基本不增殖。
2.2 形态学变化 软骨细胞初培养时为多角形的上皮样细胞,随着培养代次的增加、时间的延长,细胞形态逐渐变长,胞体变薄,到第六代后基本成为成纤维样细胞(图2,3)。
, 百拇医药
2.3 GAG染色结果 前4代软骨细胞GAG分泌旺盛,细胞周围被阿新蓝染成蓝色,颜色较深,随着代次增加染色逐渐变浅,到第七代基本不着色(图4,5)。

图1 软骨细胞生长曲线
2.4 胶原染色结果 前4代软骨细胞分泌的胶原可被染成绿色,第五代后基本不着色(图6,7)。
3 讨 论
3.1 软骨细胞增殖问题 关节面软骨组织损伤后难以修复,是因为软骨细胞在体内缺乏增殖能力[3]。软骨细胞在体外单层培养时,于培养的前几天出现延滞生长,然后才开始大量增殖。笔者认为可能是软骨细胞在体外培养时有一个适应培养环境的过程,到19~22天,细胞可达到原来的8~12倍,传代到第4代,细胞增殖达到高峰。然后细胞增殖逐渐变慢,到第8代后,细胞基本不增殖。因此就细胞增殖而言,第4代的软骨细胞增殖能力最强。
, http://www.100md.com
3.2 软骨细胞的形态学变化 关节软骨细胞在体内大多呈圆形或椭圆形,体外单层培养的细胞起初为多角形,传代培养后,软骨细胞形态逐渐发生改变。第5代后表现为长梭形,类似成纤维细胞,这种现象与国外许多学者报道一致[4]。Watt等人认为,软骨细胞梭形变与细胞表型上的去分化(dedifferertiation)有关,是判断软骨细胞表型是否改变的主要指标[5]。笔者也观察到,单层培养的细胞密度越低,去分化速度越快。文献报道高密度或立体三维培养可维持软骨细胞形态和表型,但密度过高不利细胞增殖[6,7]。软骨细胞的去分化过程是逐渐发生的,细胞表型的改变和功能的丧失速度与培养密度、传代方式等密切相关。所以,如何选择适当的细胞密度和改变细胞的培养环境是优化种子细胞的有效途径,值得进一步研究。
3.3 软骨细胞GAG和胶原分泌情况 软骨由软骨细胞和基质组成,软骨细胞的主要功能是分泌基质,软骨基质主要由胶原和GAG组成,是软骨组织功能的最主要部分。笔者的研究发现,软骨细胞在体外培养时可维持其分泌基质功能,原代软骨细胞在3~4天开始分泌GAG和胶原,第4代细胞在培养的第二天即可分泌基质,第2代软骨细胞的分泌基质能力最强。笔者认为,这是因为原代细胞需要一个适应培养环境的过程。从第5代开始,随着培养时间的延长,软骨细胞逐渐衰老,分泌基质能力下降,到第7代完全丧失分泌基质能力。所以从分泌基质情况分析,体外培养的时间越短,软骨细胞的质量越好。
, http://www.100md.com
3.4 组织工程对软骨种子细胞的要求 软骨组织工程的基本思路,是通过体外分离培养获取大量扩增的软骨细胞,然后与具一定结构的三维骨架共同培养后植入体内,通过细胞间的相互粘附、生长繁殖、分泌基质,形成软骨组织。它要求有一定数量的软骨细胞,细胞表型不变,而且应具有较强的基质分泌能力[8]。
3.5 软骨细胞最佳培养时间和条件 笔者的研究显示,软骨细胞在体外培养3周左右是作为软骨组织工程的种子细胞的最佳时机。从上述软骨细胞体外培养的生长曲线、形态学变化及基质分泌情况得以证明,此时软骨细胞既得到一定扩增,又具有较强的基质分泌能力,并且细胞表型尚未丧失。笔者将对此作进一步研究。

图2 原代软骨细胞呈多角形上皮样,细胞百积小,胞体厚.×100
图3第五低软骨细胞部分变为长梭形,细胞面积变大,胞体变薄。×100
, http://www.100md.com
图4 第二代软骨细胞GAG染色,胞体及细胞周围被阿新蓝染成蓝色,颜色深。×100
图5 第五代软骨细胞GAG染色,细胞核被染成淡蓝色,细胞质和细胞周围基本不着色,×100
图6 第二代软骨细胞胶原染色,细胞核被染成绿色,细胞质浅染,×100
图7 第五代软骨细胞胶原染色 软骨细胞被染成红色×100
基金项目:福建省教委科研基金资助项目(K96038)
作者简介:林建华(1955~),男,主任医师,副教授.
参考文献
[1]Qi WN,Sclly SP.Effect of type Ⅱ collagen in chondrocyte response to TGF-betal regulation[J].Exp Cell Res,1998,241(1):142.
, 百拇医药
[2]Kittlick PO,Engelman D.The glycosaminoglycan metabolism of chondrocyte monolayer cultures under number and pathological conditions,A methodic study[J].Exp Pathol,1991,41(2):98.
[3]Vonder Mark K,Gauss V,Vonder Mark H,et al.Relationship between cell shape and type of collagen phenotype in culture[J].Nature,1977,267:531.
[4]Vonder Mark K.Differentiation,modulation and dedifferentiation of chondrocytes[J].Rheumatology,1986,10:272.
, http://www.100md.com
[5]Watt F.Effect of seeding density on stability of the dedifferentiated phenotype of pig articular chondrocytes in culture[J].J Cell Sci,1988,89:373.
[6]Caplan AI.Cell-based technologies for cartilage repair[J].Am Acad Orthop Surg,1992,111:122.
[7]Ahapiro F,Koide S.Cell origination and differentiation in the repair of full-thickness defects of articular cartilage[J].J Bone Joint Surg,1993,75:532.
[8]Vancanti,Langer R.Synthetic polymers seeded with chondrocytes provided a template for new cartilage formation[J].Plast Reconstr Surg,1991,88(5):753.
收稿日期:2000-01-31, 百拇医药