放射损伤及烧伤血清对小鼠骨髓基质细胞的影响
作者:何佩 彭力宏 丁振华 罗成基
单位:何佩(450042 郑州,解放军第153中心医院核医学科);彭力宏(450042 郑州,解放军第153中心医院核医学科);丁振华(第一军医大学防原医学教研室);罗成基(第三军医大学复合伤研究所)
关键词:
中华放射医学与防护杂志000519 为了探讨骨髓基质细胞与放烧复合伤所致造血功能障碍之间的关系,观察了不同剂量的γ射线体外照射及照射后培养不同时间对骨髓基质细胞损伤的影响。同种小鼠烧伤后不同时间的血清对基质细胞贴壁率和基质祖细胞(CFU-F)集落形成的影响,以及放射损伤复合烧伤血清对体外培养的骨髓基质细胞的作用。
一、材料和方法
1.实验动物:昆明种健康小鼠,雌雄各半,体重(18~22) g,由第一军医大学实验动物中心提供。
, 百拇医药
2.烧伤小鼠血清的制备:根据公式S(cm)2=9.13W2/3(W=体重,g)计算动物体表面积,背部剪毛后,3%凝固汽油烧7 s,致15% Ⅲ度烧伤(病理切片证实),并立即腹腔注射生理盐水2 ml,分别于伤后第1、3、5、7、9、11、13、15 d取血、分出血清,于-20℃冰箱内保存待用。
3.骨髓基质细胞培养:参照Dexter培养体系[1]。
4.实验分组:培养好的细胞随机分为:1.正常对照组;2.不同剂量照射组:分加血清组和不加血清组(照射总剂量分别为:10、30、50、70、100 Gy,60Co γ射线剂量率6 Gy*min-1;照后培养时间分别为0、3、6、12、24 h);每个剂量组的每个时间点为一个观察组(6瓶细胞),每个照射剂量组设正常对照组。
5.不同照射剂量及照后培养不同时间对骨髓基质细胞损伤(包括凋亡和坏死)的测试:培养好的骨髓基质细胞,照射前换成无血清培养基,60Co γ射线(6 Gy*min-1)照射至所需剂量,然后分别培养0、3、6、12、24 h,分两部分处理:①HE染色前处理,HE染色镜下(计数5个视野,取其平均值)分出凋亡、坏死所占计数的比例。②FCM测试前细胞处理:PI单染测定照射后的细胞死亡率。
, 百拇医药
6.烧伤小鼠血清复合放射损伤对骨髓基质细胞作用的测试:培养好的骨髓基质细胞,照前6 h按培养瓶内的液体总量加入10%小鼠烧伤后第15 d的血清,照射前换成无血清培养基,60Co γ射线照射至所需剂量,换成以前的含烧伤小鼠血清的培养基分别培养0、3、6、12、24 h,(测试指标同上)。
7.烧伤小鼠血清对骨髓基质细胞24 h贴壁率的影响:按“骨髓基质细胞的培养方法”加入10%预先制备的小鼠烧伤后不同时间的血清,然后接种于12孔培养板中,每孔2 ml。每个观察指标不少于6孔并设相等的不加血清的正常对照,置37℃、5%CO2、饱和湿度的培养箱内培养24 h取出培养板,置混合器上震荡1 min,倾去液体,PBS洗涤两次,加入适量0.25%的胰蛋白酶消化液消化2 min,倾去消化液,精确加入1.5 ml PBS,用吸管吹打,计数板镜下计数算出其占接种细胞数的百分率即为贴壁率。
8.烧伤小鼠血清对骨髓基质祖细胞(CFU-F)集落形成的影响:按“贴壁率”培养方法培养2周(中间半量换液)终止培养,PBS洗涤,Wright-Giemsa染色后计算含50个以上非圆形细胞的细胞团(CFU-F集落)的数量,结果以“CFU-F/106BMC”表示。
, 百拇医药
9.统计方法:应用SPSS统计软件的单因素和多因素方差分析对结果进行处理,结果以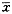 ±s表示。
±s表示。
二、结果
1.不同体外照射剂量及照后培养不同时间对BMSC凋亡和坏死的影响
电离辐射可以引起BMSC的坏死和凋亡。照射剂量小于50 Gy时,BMSC的凋亡和坏死要较长时间才能表现出来且增加的幅度比较小;当剂量从50 Gy增加到70 Gy照射时,其增加幅度比较大且损伤在照射后较短时间表现出来;当剂量大于70 Gy时,BMSC的损伤主要表现为坏死率的相对增高。放射损伤复合烧伤血清对BMSC的影响有以放射损伤为主的特点,血清只在50、70 Gy照射组对BMSC表现
表1 不同体外照射剂量的放射损伤及照后培养不同时间对BMSC凋亡率(%)的影响(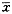 ±s) 剂量组
±s) 剂量组
, 百拇医药
(Gy)
伤 后 不 同 时 间(h)
0
3
6
12
24
0
0.73±0.31
0.8±0.20
0.80±0.20
0.80±0.20
0.78±0.21
, 百拇医药
10
0.60±0.34
0.67±0.30
0.83±0.25
0.93±0.23
0.90±0.45
30
0.83±0.06
1.47±0.32**##
1.23±0.15*#
1.90±0.36**##
, 百拇医药
2.70±0.36**##
50
1.67±0.25*
2.50±0.45**##
4.53±0.45**##
4.00±1.13**##
5.42±0.76**##
70
6.63±0.51**
16.31±1.91**##
, 百拇医药
11.92±2.03**##
9.67±1.60**##
13.47±1.71**##
100
9.33±1.57**
12.52±0.75**##
11.23±2.06**##
11.43±1.88**##
10.77±1.10**##
, http://www.100md.com
注:同一时间组与相应0(Gy)组比,*P<0.05,**P<0.01;同一剂量组与相应0(时)组比,#P<0.05,##P<0.01表2 不同体外照射剂量的放射损伤及照后培养不同时间对BMSC坏死率(%)的影响(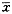 ±s) 剂量组
±s) 剂量组
(Gy)
伤 后 不 同 时 间(h)
0
3
6
12
24
, 百拇医药
0
0.97±0.31
1.23±0.21
0.98±0.20
1.11±0.20
1.07±0.31
10
0.60±0.20
1.37±0.25
1.47±0.21*#
1.00±0.06
0.97±0.12
, http://www.100md.com
30
0.81±0.20*
1.47±0.31*#
1.93±0.06**##
2.77±0.21**##
2.86±0.21**##
50
1.93±0.15*
2.67±0.49**##
4.27±0.47**##
, 百拇医药
5.20±1.25**##
4.90±0.44**##
70
11.93±0.76**
11.03±0.99**##
12.03±0.98**##
19.50±3.24**##
18.03±1.86**##
100
, http://www.100md.com 16.33±2.72**
24.03±2.39**##
33.83±1.70**##
28.03±1.40**##
30.83±1.30**##
注:同一时间组与相应0(Gy)组比,*P<0.05,**P<0.01;同一剂量组与相应0(时)组比,#P<0.05,##P<0.01表3 烧伤血清对BMSC凋亡和坏死率(%)的影响(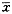 ±s) 剂量组
±s) 剂量组
, 百拇医药
(Gy)
伤 后 不 同 时 间(h)
0
3
6
12
24
50(S)
凋亡
1.47±0.41
1.84±0.51
2.76±0.83**
, 百拇医药
3.12±0.46**
3.64±0.61**
50
凋亡
1.67±0.25
2.50±0.45
4.53±0.45
4.00±1.13
5.42±0.76
50(S)
坏死
1.42±0.21*
, 百拇医药
2.12±0.30*
3.00±0.37*
4.10±0.24**
3.06±0.77**
50
坏死
1.93±0.15
2.67±0.49
4.27±0.47
5.20±1.25
4.90±0.44
, 百拇医药
70(S)
凋亡
5.76±1.01
12.01±0.96**
8.42±1.04**
9.04±0.97
12.18±2.02
70
凋亡
6.63±0.51
16.31±1.91
11.92±2.03
, http://www.100md.com
9.67±1.60
13.47±1.71
70(S)
坏死
8.42±1.03**
9.02±0.84**
9.31±1.21**
13.45±1.62**
14.36±1.72**
70
, 百拇医药 坏死
11.93±0.76
11.03±0.99
12.03±0.98
19.50±3.24
18.03±1.16
注:与相应不加血清组比,*P<0.05,**P<0.01 出保护作用(P<0.01)。
2.小鼠烧伤血清对放射损伤后的BMSC凋亡及坏死的影响
50 Gy照射组加入血清后,0时观察组同其相应的不加血清组比较,凋亡率无差别,坏死率有所下降(P<0.05);3 h观察组同其相应的不加血清组比较,凋亡率和坏死率有所下降(P<0.05);6、12、24 h观察组同其相应的不加血清组比较,凋亡率和坏死率下降明显(P<0.01)。70 Gy照射组加入血清后,0、12、24 h观察组的凋亡率同其相应的不加血清组比较无差异,坏死率下降明显(P<0.01),3、6 h观察组同其相应的不加血清组比较,凋亡率和坏死率明显下降(P<0.01)。
, 百拇医药
3 烧伤小鼠血清对骨髓基质细胞24 h贴壁率(%)及骨髓基质祖细胞(CFU-F/106BMC)集落形成的影响
骨髓基质细胞贴壁率1~15 d加血清组与不加血清组比较,除第1、9天外,其余各点均有差异(P<0.05或0.01);加血清组第3、5天的贴壁率同不加血清组相应的时间点比较明显降低,第11~15天同相应的不加血清组比较明显升高(P<0.01);加血清组骨髓基质细胞的贴壁率第5天最低。1~15 d的CFU-F集落形成数量加血清与不加血清各时间点观察组进行比较,1~11天加血清组的CFU-F数量比相应的不加血清组明显减少(P<0.01),13~15 d无差异;加血清组CFU-F数量第1、5天最低,第7天开始有所增加,至第13天与相应的不加血清组无差异。表4 不同时间的烧伤血清对BMSC贴壁率(AR)及CFU-F形成的影响(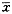 ±s) 组别
±s) 组别
, 百拇医药 伤 后 不 同 时 间(d)
1
3
5
7
9
11
13
15
AR*
3.35±0.50
4.13±0.54
4.68±0.18
, http://www.100md.com
3.92±0.37
3.56±0.24
3.67±0.28
4.47±0.31
3.72±0.54
AR-S
3.32±0.22
3.25±0.76#
2.78±0.42##
5.02±0.96##
3.29±0.14
, 百拇医药
4.98±0.05#
5.69±0.19#
5.69±0.13#
CFU-F
28.7±1.5
32.7±2.1
28.0±2.0
30.7±2.1
28.7±2.1
31.0±1.7
31.7±2.1
, http://www.100md.com
32.7±4.2
CFU-F-S
16.0±2.0##
19.0±2.0##
16.3±1.2##
21.7±2.1##
20.0±2.0##
26.0±3.6##
28.7±2.5
32.0±2.6
, http://www.100md.com
注:AR*,CFU-F-S*分别为BMSC 24 h贴壁率(%)和骨髓基质祖细胞(CFU-F/106BMC)集落形成数,S代表加入相同时间点的烧伤血清,加血清与不加血清组比较#P<0.05,##P<0.01 三、讨论
有关骨髓基质细胞对辐射的敏感性仍是一个有争议的问题。活体动物照射后,对其骨髓基质细胞辐射效应的研究表明,骨髓基质细胞具有较高的辐射敏感性,引起轻度骨髓型急性放射病的γ射线照射剂量即引起造血微环境的功能缺陷[2];而对体外培养的骨髓基质细胞层照射后的研究表明,骨髓基质细胞具有较强的抗放射能力,经40 Gy γ射线照射不影响其集落刺激因子生成;经100 Gy γ射线照射仍保持其主要的粘附结构缝隙连接[3]。本实验表明:体外培养的骨髓基质细胞就其细胞本身而言具有较强的抗放能力,剂量小于50 Gy的γ射线照射后24 h,其凋亡和坏死率仅为观察细胞的十分之一,这样的细胞损伤可能还不足以影响基质细胞分泌细胞因子和支持造血的功能。
, 百拇医药
目前认为,细胞死亡主要有两种方式即坏死和凋亡。凋亡的诱发存在多条途径,如电离辐射、生长因子等均可诱发细胞的凋亡[4]。凋亡的过程涉及到死亡信号的传递,若干基因的激活(如c-fos、c-jun、p53、c-myc等基因的激活),是一个多步骤的过程。本实验结果表明:电离辐射可以引起体外培养的骨髓基质细胞的凋亡和坏死,其机理尚不清楚,目前认为可能与下列因素有关:(1)ROS:ROS(reactive oxygen species)是氧的活性中间体,来源于线粒体氧化磷酸化、微粒体细胞色素P450系统和质膜NAD(P)H氧化酶,它很容易与大分子反应,从而直接损害大分子或通过链式反应使自由基从一个大分子传递到另外一个大分子,导致对细胞结构的广泛破坏。γ射线能增加ROS的产生,这可能是辐射引起骨髓基质细胞凋亡的原因之一。(2)细胞因子:目前认为,肿瘤坏死因子-α(TNF-α)是诱导多种类型的组织细胞发生凋亡的重要因素,TNF-α是骨髓基质细胞自发分泌的造血抑制因子之一,其是否参与辐射引起的骨髓基质细胞的凋亡过程尚待进一步证实。
, http://www.100md.com
骨髓基质细胞可分泌造血刺激因子,如干细胞因子(SCF)等和造血抑制因子,如β型生长转化因子(TGF-β)等[5]。小鼠骨髓基质细胞辐射损伤后,其分泌SCF、TGF-β等细胞因子都会发生相应的变化[6]。研究表明:TGF-β可以抑制SCF的表达[7];SCF有促进机体抗放和抑制肥大细胞凋亡的作用[8];体外培养的骨髓基质细胞的抗辐射损伤(包括凋亡和坏死)是否同这些因子的变化有待进一步研究。由于细胞凋亡是一个主动的、受基因控制的过程,必须合成新的大分子(如蛋白质),所以放射损伤所致凋亡的表现需要一定的时间。本实验中,低于50 Gy的吸收剂量,基质细胞的损伤同照射后培养时间的关系也支持这一观点;剂量大于70 Gy照射基质细胞时,也许是由于辐射对细胞的损伤过于强烈,细胞来不及合成同凋亡有关的物质就解体了,所以表现为凋亡率的相对降低和坏死率的相对增高。
烧伤小鼠血清是一种具有多种活性成分的复合物,其成分在一定的时间内随伤后的时间而变化。体外培养的骨髓基质细胞本身是一个平衡体系,低于50 Gy的照射剂量照射基质细胞,细胞通过自身抗放细胞因子的分泌变化,可以抵抗外界的辐射损伤,不需要外界的细胞因子参与。基质细胞的这种分泌细胞因子的限度可能就是外界辐射损伤的剂量范围,大于这个剂量范围(如70 Gy),由于损伤剧烈,细胞本身就难以通过自身的调节变化而存活,即使有外界抗放因子的参与也不能改变细胞死亡的命运。50~70 Gy的吸收量范围,也许基质细胞正处于对外界抗放因子的敏感阶段,所以血清表现出对辐射损伤的保护作用,这种保护作用与血清中的何种成分有关有待进一步证实。
, 百拇医药
IL-3可以促进骨髓基质细胞贴壁生长[9,10],小鼠烧伤后不同时间的血清对基质细胞贴壁率和CFU-F集落形成的影响是否同血清中的变化有关有待研究。
基金项目:全军九五指令性课题资助项目(96L045)
参考文献
1,Dexter TM.Conditions controlling the proliferation of hamopoidetic stem cells in vitro.J Cell Physiol,1977, 91:335-338.
2,陈幸华,罗成基,郭朝华,等.放射损伤骨髓微环境中基质细胞的周期,DNA含量与形态变化的观察.解放军医学杂志,1999,24:10-14.
3,Greenber TS.Toxic effects on the hematopoietic microenvironment.Exp-Hematol,1991,19:1101-1109.
, 百拇医药
4,戴育成.肿瘤研究的热点-细胞凋亡.实验血液学杂志,1996,4:113-117.
5,胡维明,陈家佩.造血基质细胞与造血因子.中国实验血液学杂志,1993,1:97-99.
6,Richard J.Consequence of extremely high dose of irradiation on bone marrow stromal cells and the release of hematopoietic growth factors.Exp-Hematol,1987,15:952-957.
7,By Michael C,Heinrich,Douglas C,et al. Transforming Growth Factor beta 1 inhibits expression of the gene products for Steel Factor and its Receptor(c-kit).Blood,1995,85:1769-1780.
, 百拇医药
8,Yee-NS,Peak-Ⅰ,Besmer-P.Role of kit-ligand in proliferation and supression of apoptosis in mast cells.J-Exp-Med 1994,176:1777-1787.
9,Collins MK,Marvel J,Malde P,et al.Interleukin-3 protects murine bone marrow cells from apoptosis induced by DNA damaging agents.J-Exp-Med,1992,176:1043-1051.
10,龙晓霞,唐军民,唐岩,等.含白细胞介素-3上清液促进小鼠骨髓基质细胞生长的体外观察.解剖学报,1993,24:305-309.
(收稿日期:1999-04-10), http://www.100md.com
单位:何佩(450042 郑州,解放军第153中心医院核医学科);彭力宏(450042 郑州,解放军第153中心医院核医学科);丁振华(第一军医大学防原医学教研室);罗成基(第三军医大学复合伤研究所)
关键词:
中华放射医学与防护杂志000519 为了探讨骨髓基质细胞与放烧复合伤所致造血功能障碍之间的关系,观察了不同剂量的γ射线体外照射及照射后培养不同时间对骨髓基质细胞损伤的影响。同种小鼠烧伤后不同时间的血清对基质细胞贴壁率和基质祖细胞(CFU-F)集落形成的影响,以及放射损伤复合烧伤血清对体外培养的骨髓基质细胞的作用。
一、材料和方法
1.实验动物:昆明种健康小鼠,雌雄各半,体重(18~22) g,由第一军医大学实验动物中心提供。
, 百拇医药
2.烧伤小鼠血清的制备:根据公式S(cm)2=9.13W2/3(W=体重,g)计算动物体表面积,背部剪毛后,3%凝固汽油烧7 s,致15% Ⅲ度烧伤(病理切片证实),并立即腹腔注射生理盐水2 ml,分别于伤后第1、3、5、7、9、11、13、15 d取血、分出血清,于-20℃冰箱内保存待用。
3.骨髓基质细胞培养:参照Dexter培养体系[1]。
4.实验分组:培养好的细胞随机分为:1.正常对照组;2.不同剂量照射组:分加血清组和不加血清组(照射总剂量分别为:10、30、50、70、100 Gy,60Co γ射线剂量率6 Gy*min-1;照后培养时间分别为0、3、6、12、24 h);每个剂量组的每个时间点为一个观察组(6瓶细胞),每个照射剂量组设正常对照组。
5.不同照射剂量及照后培养不同时间对骨髓基质细胞损伤(包括凋亡和坏死)的测试:培养好的骨髓基质细胞,照射前换成无血清培养基,60Co γ射线(6 Gy*min-1)照射至所需剂量,然后分别培养0、3、6、12、24 h,分两部分处理:①HE染色前处理,HE染色镜下(计数5个视野,取其平均值)分出凋亡、坏死所占计数的比例。②FCM测试前细胞处理:PI单染测定照射后的细胞死亡率。
, 百拇医药
6.烧伤小鼠血清复合放射损伤对骨髓基质细胞作用的测试:培养好的骨髓基质细胞,照前6 h按培养瓶内的液体总量加入10%小鼠烧伤后第15 d的血清,照射前换成无血清培养基,60Co γ射线照射至所需剂量,换成以前的含烧伤小鼠血清的培养基分别培养0、3、6、12、24 h,(测试指标同上)。
7.烧伤小鼠血清对骨髓基质细胞24 h贴壁率的影响:按“骨髓基质细胞的培养方法”加入10%预先制备的小鼠烧伤后不同时间的血清,然后接种于12孔培养板中,每孔2 ml。每个观察指标不少于6孔并设相等的不加血清的正常对照,置37℃、5%CO2、饱和湿度的培养箱内培养24 h取出培养板,置混合器上震荡1 min,倾去液体,PBS洗涤两次,加入适量0.25%的胰蛋白酶消化液消化2 min,倾去消化液,精确加入1.5 ml PBS,用吸管吹打,计数板镜下计数算出其占接种细胞数的百分率即为贴壁率。
8.烧伤小鼠血清对骨髓基质祖细胞(CFU-F)集落形成的影响:按“贴壁率”培养方法培养2周(中间半量换液)终止培养,PBS洗涤,Wright-Giemsa染色后计算含50个以上非圆形细胞的细胞团(CFU-F集落)的数量,结果以“CFU-F/106BMC”表示。
, 百拇医药
9.统计方法:应用SPSS统计软件的单因素和多因素方差分析对结果进行处理,结果以
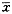 ±s表示。
±s表示。二、结果
1.不同体外照射剂量及照后培养不同时间对BMSC凋亡和坏死的影响
电离辐射可以引起BMSC的坏死和凋亡。照射剂量小于50 Gy时,BMSC的凋亡和坏死要较长时间才能表现出来且增加的幅度比较小;当剂量从50 Gy增加到70 Gy照射时,其增加幅度比较大且损伤在照射后较短时间表现出来;当剂量大于70 Gy时,BMSC的损伤主要表现为坏死率的相对增高。放射损伤复合烧伤血清对BMSC的影响有以放射损伤为主的特点,血清只在50、70 Gy照射组对BMSC表现
表1 不同体外照射剂量的放射损伤及照后培养不同时间对BMSC凋亡率(%)的影响(
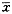 ±s) 剂量组
±s) 剂量组, 百拇医药
(Gy)
伤 后 不 同 时 间(h)
0
3
6
12
24
0
0.73±0.31
0.8±0.20
0.80±0.20
0.80±0.20
0.78±0.21
, 百拇医药
10
0.60±0.34
0.67±0.30
0.83±0.25
0.93±0.23
0.90±0.45
30
0.83±0.06
1.47±0.32**##
1.23±0.15*#
1.90±0.36**##
, 百拇医药
2.70±0.36**##
50
1.67±0.25*
2.50±0.45**##
4.53±0.45**##
4.00±1.13**##
5.42±0.76**##
70
6.63±0.51**
16.31±1.91**##
, 百拇医药
11.92±2.03**##
9.67±1.60**##
13.47±1.71**##
100
9.33±1.57**
12.52±0.75**##
11.23±2.06**##
11.43±1.88**##
10.77±1.10**##
, http://www.100md.com
注:同一时间组与相应0(Gy)组比,*P<0.05,**P<0.01;同一剂量组与相应0(时)组比,#P<0.05,##P<0.01表2 不同体外照射剂量的放射损伤及照后培养不同时间对BMSC坏死率(%)的影响(
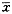 ±s) 剂量组
±s) 剂量组(Gy)
伤 后 不 同 时 间(h)
0
3
6
12
24
, 百拇医药
0
0.97±0.31
1.23±0.21
0.98±0.20
1.11±0.20
1.07±0.31
10
0.60±0.20
1.37±0.25
1.47±0.21*#
1.00±0.06
0.97±0.12
, http://www.100md.com
30
0.81±0.20*
1.47±0.31*#
1.93±0.06**##
2.77±0.21**##
2.86±0.21**##
50
1.93±0.15*
2.67±0.49**##
4.27±0.47**##
, 百拇医药
5.20±1.25**##
4.90±0.44**##
70
11.93±0.76**
11.03±0.99**##
12.03±0.98**##
19.50±3.24**##
18.03±1.86**##
100
, http://www.100md.com 16.33±2.72**
24.03±2.39**##
33.83±1.70**##
28.03±1.40**##
30.83±1.30**##
注:同一时间组与相应0(Gy)组比,*P<0.05,**P<0.01;同一剂量组与相应0(时)组比,#P<0.05,##P<0.01表3 烧伤血清对BMSC凋亡和坏死率(%)的影响(
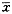 ±s) 剂量组
±s) 剂量组, 百拇医药
(Gy)
伤 后 不 同 时 间(h)
0
3
6
12
24
50(S)
凋亡
1.47±0.41
1.84±0.51
2.76±0.83**
, 百拇医药
3.12±0.46**
3.64±0.61**
50
凋亡
1.67±0.25
2.50±0.45
4.53±0.45
4.00±1.13
5.42±0.76
50(S)
坏死
1.42±0.21*
, 百拇医药
2.12±0.30*
3.00±0.37*
4.10±0.24**
3.06±0.77**
50
坏死
1.93±0.15
2.67±0.49
4.27±0.47
5.20±1.25
4.90±0.44
, 百拇医药
70(S)
凋亡
5.76±1.01
12.01±0.96**
8.42±1.04**
9.04±0.97
12.18±2.02
70
凋亡
6.63±0.51
16.31±1.91
11.92±2.03
, http://www.100md.com
9.67±1.60
13.47±1.71
70(S)
坏死
8.42±1.03**
9.02±0.84**
9.31±1.21**
13.45±1.62**
14.36±1.72**
70
, 百拇医药 坏死
11.93±0.76
11.03±0.99
12.03±0.98
19.50±3.24
18.03±1.16
注:与相应不加血清组比,*P<0.05,**P<0.01 出保护作用(P<0.01)。
2.小鼠烧伤血清对放射损伤后的BMSC凋亡及坏死的影响
50 Gy照射组加入血清后,0时观察组同其相应的不加血清组比较,凋亡率无差别,坏死率有所下降(P<0.05);3 h观察组同其相应的不加血清组比较,凋亡率和坏死率有所下降(P<0.05);6、12、24 h观察组同其相应的不加血清组比较,凋亡率和坏死率下降明显(P<0.01)。70 Gy照射组加入血清后,0、12、24 h观察组的凋亡率同其相应的不加血清组比较无差异,坏死率下降明显(P<0.01),3、6 h观察组同其相应的不加血清组比较,凋亡率和坏死率明显下降(P<0.01)。
, 百拇医药
3 烧伤小鼠血清对骨髓基质细胞24 h贴壁率(%)及骨髓基质祖细胞(CFU-F/106BMC)集落形成的影响
骨髓基质细胞贴壁率1~15 d加血清组与不加血清组比较,除第1、9天外,其余各点均有差异(P<0.05或0.01);加血清组第3、5天的贴壁率同不加血清组相应的时间点比较明显降低,第11~15天同相应的不加血清组比较明显升高(P<0.01);加血清组骨髓基质细胞的贴壁率第5天最低。1~15 d的CFU-F集落形成数量加血清与不加血清各时间点观察组进行比较,1~11天加血清组的CFU-F数量比相应的不加血清组明显减少(P<0.01),13~15 d无差异;加血清组CFU-F数量第1、5天最低,第7天开始有所增加,至第13天与相应的不加血清组无差异。表4 不同时间的烧伤血清对BMSC贴壁率(AR)及CFU-F形成的影响(
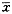 ±s) 组别
±s) 组别, 百拇医药 伤 后 不 同 时 间(d)
1
3
5
7
9
11
13
15
AR*
3.35±0.50
4.13±0.54
4.68±0.18
, http://www.100md.com
3.92±0.37
3.56±0.24
3.67±0.28
4.47±0.31
3.72±0.54
AR-S
3.32±0.22
3.25±0.76#
2.78±0.42##
5.02±0.96##
3.29±0.14
, 百拇医药
4.98±0.05#
5.69±0.19#
5.69±0.13#
CFU-F
28.7±1.5
32.7±2.1
28.0±2.0
30.7±2.1
28.7±2.1
31.0±1.7
31.7±2.1
, http://www.100md.com
32.7±4.2
CFU-F-S
16.0±2.0##
19.0±2.0##
16.3±1.2##
21.7±2.1##
20.0±2.0##
26.0±3.6##
28.7±2.5
32.0±2.6
, http://www.100md.com
注:AR*,CFU-F-S*分别为BMSC 24 h贴壁率(%)和骨髓基质祖细胞(CFU-F/106BMC)集落形成数,S代表加入相同时间点的烧伤血清,加血清与不加血清组比较#P<0.05,##P<0.01 三、讨论
有关骨髓基质细胞对辐射的敏感性仍是一个有争议的问题。活体动物照射后,对其骨髓基质细胞辐射效应的研究表明,骨髓基质细胞具有较高的辐射敏感性,引起轻度骨髓型急性放射病的γ射线照射剂量即引起造血微环境的功能缺陷[2];而对体外培养的骨髓基质细胞层照射后的研究表明,骨髓基质细胞具有较强的抗放射能力,经40 Gy γ射线照射不影响其集落刺激因子生成;经100 Gy γ射线照射仍保持其主要的粘附结构缝隙连接[3]。本实验表明:体外培养的骨髓基质细胞就其细胞本身而言具有较强的抗放能力,剂量小于50 Gy的γ射线照射后24 h,其凋亡和坏死率仅为观察细胞的十分之一,这样的细胞损伤可能还不足以影响基质细胞分泌细胞因子和支持造血的功能。
, 百拇医药
目前认为,细胞死亡主要有两种方式即坏死和凋亡。凋亡的诱发存在多条途径,如电离辐射、生长因子等均可诱发细胞的凋亡[4]。凋亡的过程涉及到死亡信号的传递,若干基因的激活(如c-fos、c-jun、p53、c-myc等基因的激活),是一个多步骤的过程。本实验结果表明:电离辐射可以引起体外培养的骨髓基质细胞的凋亡和坏死,其机理尚不清楚,目前认为可能与下列因素有关:(1)ROS:ROS(reactive oxygen species)是氧的活性中间体,来源于线粒体氧化磷酸化、微粒体细胞色素P450系统和质膜NAD(P)H氧化酶,它很容易与大分子反应,从而直接损害大分子或通过链式反应使自由基从一个大分子传递到另外一个大分子,导致对细胞结构的广泛破坏。γ射线能增加ROS的产生,这可能是辐射引起骨髓基质细胞凋亡的原因之一。(2)细胞因子:目前认为,肿瘤坏死因子-α(TNF-α)是诱导多种类型的组织细胞发生凋亡的重要因素,TNF-α是骨髓基质细胞自发分泌的造血抑制因子之一,其是否参与辐射引起的骨髓基质细胞的凋亡过程尚待进一步证实。
, http://www.100md.com
骨髓基质细胞可分泌造血刺激因子,如干细胞因子(SCF)等和造血抑制因子,如β型生长转化因子(TGF-β)等[5]。小鼠骨髓基质细胞辐射损伤后,其分泌SCF、TGF-β等细胞因子都会发生相应的变化[6]。研究表明:TGF-β可以抑制SCF的表达[7];SCF有促进机体抗放和抑制肥大细胞凋亡的作用[8];体外培养的骨髓基质细胞的抗辐射损伤(包括凋亡和坏死)是否同这些因子的变化有待进一步研究。由于细胞凋亡是一个主动的、受基因控制的过程,必须合成新的大分子(如蛋白质),所以放射损伤所致凋亡的表现需要一定的时间。本实验中,低于50 Gy的吸收剂量,基质细胞的损伤同照射后培养时间的关系也支持这一观点;剂量大于70 Gy照射基质细胞时,也许是由于辐射对细胞的损伤过于强烈,细胞来不及合成同凋亡有关的物质就解体了,所以表现为凋亡率的相对降低和坏死率的相对增高。
烧伤小鼠血清是一种具有多种活性成分的复合物,其成分在一定的时间内随伤后的时间而变化。体外培养的骨髓基质细胞本身是一个平衡体系,低于50 Gy的照射剂量照射基质细胞,细胞通过自身抗放细胞因子的分泌变化,可以抵抗外界的辐射损伤,不需要外界的细胞因子参与。基质细胞的这种分泌细胞因子的限度可能就是外界辐射损伤的剂量范围,大于这个剂量范围(如70 Gy),由于损伤剧烈,细胞本身就难以通过自身的调节变化而存活,即使有外界抗放因子的参与也不能改变细胞死亡的命运。50~70 Gy的吸收量范围,也许基质细胞正处于对外界抗放因子的敏感阶段,所以血清表现出对辐射损伤的保护作用,这种保护作用与血清中的何种成分有关有待进一步证实。
, 百拇医药
IL-3可以促进骨髓基质细胞贴壁生长[9,10],小鼠烧伤后不同时间的血清对基质细胞贴壁率和CFU-F集落形成的影响是否同血清中的变化有关有待研究。
基金项目:全军九五指令性课题资助项目(96L045)
参考文献
1,Dexter TM.Conditions controlling the proliferation of hamopoidetic stem cells in vitro.J Cell Physiol,1977, 91:335-338.
2,陈幸华,罗成基,郭朝华,等.放射损伤骨髓微环境中基质细胞的周期,DNA含量与形态变化的观察.解放军医学杂志,1999,24:10-14.
3,Greenber TS.Toxic effects on the hematopoietic microenvironment.Exp-Hematol,1991,19:1101-1109.
, 百拇医药
4,戴育成.肿瘤研究的热点-细胞凋亡.实验血液学杂志,1996,4:113-117.
5,胡维明,陈家佩.造血基质细胞与造血因子.中国实验血液学杂志,1993,1:97-99.
6,Richard J.Consequence of extremely high dose of irradiation on bone marrow stromal cells and the release of hematopoietic growth factors.Exp-Hematol,1987,15:952-957.
7,By Michael C,Heinrich,Douglas C,et al. Transforming Growth Factor beta 1 inhibits expression of the gene products for Steel Factor and its Receptor(c-kit).Blood,1995,85:1769-1780.
, 百拇医药
8,Yee-NS,Peak-Ⅰ,Besmer-P.Role of kit-ligand in proliferation and supression of apoptosis in mast cells.J-Exp-Med 1994,176:1777-1787.
9,Collins MK,Marvel J,Malde P,et al.Interleukin-3 protects murine bone marrow cells from apoptosis induced by DNA damaging agents.J-Exp-Med,1992,176:1043-1051.
10,龙晓霞,唐军民,唐岩,等.含白细胞介素-3上清液促进小鼠骨髓基质细胞生长的体外观察.解剖学报,1993,24:305-309.
(收稿日期:1999-04-10), http://www.100md.com