重组牛碱性成纤维细胞生长因子对体外培养人角质形成细胞促增殖作用
作者:王宝玺 左亚刚 袁兆庄
单位:王宝玺 袁兆庄(100730 北京,中国协和医科大学北京协和医院皮肤科);左亚刚(河北医科大学第五医院)
关键词:
中华皮肤科杂志000224
碱性成纤维细胞生长因子(bFGF)的主要作用是促进成纤维细胞的增殖。有文献报道bFGF可以促进角质形成细胞(KC)的生长和分化过程[1],且在伤口愈合过程中出现bFGF和角质形成细胞生长因(KGF)的表达[2,3]。噻唑蓝(MTT)染色光吸收实验法是近年来在国内外广泛用于分析药物对细胞作用的方法,具有简便、准确和快速等优点[4]。我们用体外培养正常人KC,MTT法和细胞直接计数法观察了基因重组牛bFGF对体外培养正常人KC增殖作用的影响。
, http://www.100md.com
一、材料和方法
1.主要仪器和试剂:M154无血清培养基(美国Cascade公司),重组牛bFGF(珠海东大生物制药有限公司,批号980313)。CO2孵箱(NAPCO,美国),相差倒置显微镜(Olympus,日本),酶标仪(CliniBio128型,澳大利亚)。
2.正常人KC培养:取正常新生儿切除的包皮,参照文献用无血清培养基进行KC培养[1]。第2、3代细胞用于实验。
3.MTT法测定bFGF对KC的影响:MTT溶液配制:PBS(pH7.2)配制成5mg/mL的溶液,0.2μm微孔滤膜无菌过滤分装,-20℃保存备用。bFGF溶液配制:M154培养基基质(不含KC生长因子与牛垂体提取物)配制成不同浓度溶液。
bFGF对人KC增生影响的预实验:以每孔5×103个活细胞将KC铺于96孔板。次日换为M154培养液基质,加入定量bFGF使终浓度分别为0.01、0.1、1、10、100和1000U/mL。每个浓度重复4孔。另有1组细胞为对照(不加bFGF)。37℃5%CO2孵箱中培养72h后每孔中加入20μLMTT溶液,继续培养3h后吸出液体,各孔中分别加入100μL10%SDS(十二烷基硫酸钠)溶液。放置30min后在550nm酶标仪上比色,记录吸光值。
, 百拇医药
bFGF对人KC促增生作用的最低作用浓度测定:初步实验证明bFGF在浓度为0.01~10U/mL时细胞增生速度均较对照细胞快,MTT吸光度值明显升高。在此基础上我们分别选择1×10-6、1×10-5、1×10-4、1×10-3、1×10-2U/mL浓度的bFGF,测定对KC促增生作用的最低有效浓度。按3000个/孔的细胞密度将第2代KC种在一96孔板中,次日换培养基,同法测定,其中每个浓度重复6孔,另选一组细胞作为正常对照(不加bFGF)。
4.直接计数观察bFGF对KC生长曲线的影响:将第3代KC以每孔2×104细胞分别种于24孔板。次日更换为不含EGF和牛垂体提取物M154培养基,每孔0.5mL。然后定量加入不同浓度的bFGF,使其终浓度分别为:0.0001、0.01和1U/mL。每个浓度重复做3孔。另选1组细胞作为对照(不加bFGF)。37℃5%CO2孵箱培养。分别于加入bFGF之后24、48、72、96、120、144h,选择一组细胞用HBSS洗后每孔加入200μL胰蛋白酶消化,加入100μL胎牛血清中和胰蛋白酶,将细胞悬液移入离心管,用100μLHBSS洗脱板孔,收集全部细胞悬液。吸10μL细胞悬液加入血细胞计数盘,在10×显微镜下计数4个角大方格内细胞数(N),N/4×104即为每毫升中所含细胞数。每孔细胞计数4次,计算平均值。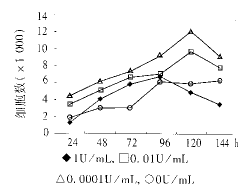
, http://www.100md.com
图1 bFGF对角质形成细胞生长曲线的影响
二、结果
1.MTT法测定bFGF对细胞增生速度的影响:bFGF在0.01U/mL、0.1U/mL、1U/mL、10U/mL时与不加bFGF的对照组相比较,其MTT吸光度值明显升高,具有统计学意义,说明bFGF具有促进KC增生作用。然而在高浓度(100U/mL和1000U/mL)时的吸光度反而降低,P值分别<0.05和<0.01。各组浓度与对照组细胞差异均有显著性,见表12.bFGF对人KC促增生作用的最低有效浓度:结果显示bFGF在浓度为1×10-5U/mL时即具有促进KC增殖的作用,与不加bFGF的细胞相比P<0.01,差异有显著性。而且在1×10-4U/mL时促增殖作用最明显,峰值为0.35±0.07。此后随着浓度的增加促增殖减弱呈递减趋势。可见bFGF对人KC促增生作用的最低作用浓度为1×10-5U/mL(表2)。3.直接计数观察bFGF对KC生长曲线的影响:bFGF在1×10-4和1×10-2U/mL时与不加bFGF的对照组相比细胞增殖速度明显提高,使细胞生长曲线呈现逐渐增高现象。其中1×10-4和1×10-2U/mL组增加明显,至第5天达高峰,此后开始下降。而1U/mL组细胞的增殖速度加快与不加bFGF的细胞相比并不显著,并且在第4天达高峰之后开始下降,第5、6天细胞数较未加bFGF组少。可见本结果与前述MTT实验结果基本相符,表现为在0.0001U/mL浓度时具有促进人KC增生作用。结果见图1。
, 百拇医药
表1 MTT测定牛碱性成纤维细胞生长因子对人角质形成细胞增殖的影响
牛碱性成纤维细胞生长因子浓度(U/mL)
1×10-2
1×10-1
1×100
1×101
1×102
1×103
0
MTT值(A值)
, http://www.100md.com
0.46±0.07
0.41±0.02
0.42±0.09
0.39±0.03
0.26±0.02
0.18±0.03
0.29±0.02
t值
7.73
24.23
3.34
8.46
, http://www.100md.com
4.43
13.09
-
P值
<0.01
<0.01
<0.05
<0.01
<0.05
<0.01
-
表2 MTT测定牛碱性成纤维细胞生长因子对人角质形成细胞促增殖作用的最低有效浓度
, 百拇医药
牛碱性成纤维细胞生长因子浓度(U/mL)
1×10-2
1×10-3
1×103
1×10-5
1×10-6
0
MTT值(A值)
0.31±0.03
0.33±0.04
0.35±0.07
, 百拇医药
0.28±0.02
0.12±0.02
0.18±0.02
t值
15.57
15.35
8.92
18.48
6.12
-
P值
<0.01
<0.01
, 百拇医药
<0.01
<0.01
<0.01
-
三、讨论
bFGF在体内分布广泛,并且具有广泛的生物学效应,对成纤维细胞、KC以及成骨细胞等均具有促增生作用。我们的研究证明了此点,同时发现bFGF对体外培养的人KC具有促进增生的最低作用浓度为1×10-5U/mL。随着药物浓度的增加,这种促增生作用随之增加,示意bFGF的促KC增生作用逐渐增强,出现剂量依赖现象。直接细胞计数实验同样观察到相同现象,在培养基中加入bFGF后人KC的增生速度明显提高,并且在浓度为1×10-4U/mL时即显著增高,与MTT实验结果基本一致。然而,我们发现将bFGF的浓度进一步增加,至1×102U/mL以上时KC生长出现增生抑制现象,其机制尚不清楚,可能与制剂中含有的其它成分对细胞产生抑制作用有关。
, 百拇医药
活细胞可以摄取在培养基内定量加入的噻唑蓝(MTT),并且由细胞内线粒体中的琥珀酸脱氢酶将MTT转化为蓝色的甲瓒,其颜色的深浅与活细胞数成正比。我们利用MTT法证实重组牛bFGF对体外培养KC具有促增殖作用的结果,与直接细胞计数实验所见基本一致,证明重组牛bFGF可以使人KC增殖速度提高,具有一定的临床应用前景。
参 考 文 献
1.O′ Keefe EJ, Chin ML, Payne RE Jr. Stimulation of growth of keratinocytes of basic fibroblast growth factor. J Invest Dermatol,1988,90:767- 769.
2.Yaguchi H, Tsuboi R, Ueki R, et al. Immuno-hisochemical localization of basic fibroblast growth factor in skin diseases.Acta Derm Venereol, 1993,73:81- 83.
, 百拇医药
3.Hebda PA, Klingbeil CK, Abraham JA, et al. Basic fibroblast growth stimulation of epidermal wound healing in pigs.J Invest Dermatol, 1990, 95:626- 631.
4.Marionnet AV, Lizard G, Chardonnet Y, et al. Comparative evaluation of the antiproliferative effect of cyclosporin A and gamma interferon on normal and HPV transformed keratinocytes by cell counting, MTT assay and tritiated thymidine incorporation. Cell Biol Toxicol,1997,13: 115- 123.
收稿日期:1999-04-05, 百拇医药
单位:王宝玺 袁兆庄(100730 北京,中国协和医科大学北京协和医院皮肤科);左亚刚(河北医科大学第五医院)
关键词:
中华皮肤科杂志000224
碱性成纤维细胞生长因子(bFGF)的主要作用是促进成纤维细胞的增殖。有文献报道bFGF可以促进角质形成细胞(KC)的生长和分化过程[1],且在伤口愈合过程中出现bFGF和角质形成细胞生长因(KGF)的表达[2,3]。噻唑蓝(MTT)染色光吸收实验法是近年来在国内外广泛用于分析药物对细胞作用的方法,具有简便、准确和快速等优点[4]。我们用体外培养正常人KC,MTT法和细胞直接计数法观察了基因重组牛bFGF对体外培养正常人KC增殖作用的影响。
, http://www.100md.com
一、材料和方法
1.主要仪器和试剂:M154无血清培养基(美国Cascade公司),重组牛bFGF(珠海东大生物制药有限公司,批号980313)。CO2孵箱(NAPCO,美国),相差倒置显微镜(Olympus,日本),酶标仪(CliniBio128型,澳大利亚)。
2.正常人KC培养:取正常新生儿切除的包皮,参照文献用无血清培养基进行KC培养[1]。第2、3代细胞用于实验。
3.MTT法测定bFGF对KC的影响:MTT溶液配制:PBS(pH7.2)配制成5mg/mL的溶液,0.2μm微孔滤膜无菌过滤分装,-20℃保存备用。bFGF溶液配制:M154培养基基质(不含KC生长因子与牛垂体提取物)配制成不同浓度溶液。
bFGF对人KC增生影响的预实验:以每孔5×103个活细胞将KC铺于96孔板。次日换为M154培养液基质,加入定量bFGF使终浓度分别为0.01、0.1、1、10、100和1000U/mL。每个浓度重复4孔。另有1组细胞为对照(不加bFGF)。37℃5%CO2孵箱中培养72h后每孔中加入20μLMTT溶液,继续培养3h后吸出液体,各孔中分别加入100μL10%SDS(十二烷基硫酸钠)溶液。放置30min后在550nm酶标仪上比色,记录吸光值。
, 百拇医药
bFGF对人KC促增生作用的最低作用浓度测定:初步实验证明bFGF在浓度为0.01~10U/mL时细胞增生速度均较对照细胞快,MTT吸光度值明显升高。在此基础上我们分别选择1×10-6、1×10-5、1×10-4、1×10-3、1×10-2U/mL浓度的bFGF,测定对KC促增生作用的最低有效浓度。按3000个/孔的细胞密度将第2代KC种在一96孔板中,次日换培养基,同法测定,其中每个浓度重复6孔,另选一组细胞作为正常对照(不加bFGF)。
4.直接计数观察bFGF对KC生长曲线的影响:将第3代KC以每孔2×104细胞分别种于24孔板。次日更换为不含EGF和牛垂体提取物M154培养基,每孔0.5mL。然后定量加入不同浓度的bFGF,使其终浓度分别为:0.0001、0.01和1U/mL。每个浓度重复做3孔。另选1组细胞作为对照(不加bFGF)。37℃5%CO2孵箱培养。分别于加入bFGF之后24、48、72、96、120、144h,选择一组细胞用HBSS洗后每孔加入200μL胰蛋白酶消化,加入100μL胎牛血清中和胰蛋白酶,将细胞悬液移入离心管,用100μLHBSS洗脱板孔,收集全部细胞悬液。吸10μL细胞悬液加入血细胞计数盘,在10×显微镜下计数4个角大方格内细胞数(N),N/4×104即为每毫升中所含细胞数。每孔细胞计数4次,计算平均值。

, http://www.100md.com
图1 bFGF对角质形成细胞生长曲线的影响
二、结果
1.MTT法测定bFGF对细胞增生速度的影响:bFGF在0.01U/mL、0.1U/mL、1U/mL、10U/mL时与不加bFGF的对照组相比较,其MTT吸光度值明显升高,具有统计学意义,说明bFGF具有促进KC增生作用。然而在高浓度(100U/mL和1000U/mL)时的吸光度反而降低,P值分别<0.05和<0.01。各组浓度与对照组细胞差异均有显著性,见表12.bFGF对人KC促增生作用的最低有效浓度:结果显示bFGF在浓度为1×10-5U/mL时即具有促进KC增殖的作用,与不加bFGF的细胞相比P<0.01,差异有显著性。而且在1×10-4U/mL时促增殖作用最明显,峰值为0.35±0.07。此后随着浓度的增加促增殖减弱呈递减趋势。可见bFGF对人KC促增生作用的最低作用浓度为1×10-5U/mL(表2)。3.直接计数观察bFGF对KC生长曲线的影响:bFGF在1×10-4和1×10-2U/mL时与不加bFGF的对照组相比细胞增殖速度明显提高,使细胞生长曲线呈现逐渐增高现象。其中1×10-4和1×10-2U/mL组增加明显,至第5天达高峰,此后开始下降。而1U/mL组细胞的增殖速度加快与不加bFGF的细胞相比并不显著,并且在第4天达高峰之后开始下降,第5、6天细胞数较未加bFGF组少。可见本结果与前述MTT实验结果基本相符,表现为在0.0001U/mL浓度时具有促进人KC增生作用。结果见图1。
, 百拇医药
表1 MTT测定牛碱性成纤维细胞生长因子对人角质形成细胞增殖的影响
牛碱性成纤维细胞生长因子浓度(U/mL)
1×10-2
1×10-1
1×100
1×101
1×102
1×103
0
MTT值(A值)
, http://www.100md.com
0.46±0.07
0.41±0.02
0.42±0.09
0.39±0.03
0.26±0.02
0.18±0.03
0.29±0.02
t值
7.73
24.23
3.34
8.46
, http://www.100md.com
4.43
13.09
-
P值
<0.01
<0.01
<0.05
<0.01
<0.05
<0.01
-
表2 MTT测定牛碱性成纤维细胞生长因子对人角质形成细胞促增殖作用的最低有效浓度
, 百拇医药
牛碱性成纤维细胞生长因子浓度(U/mL)
1×10-2
1×10-3
1×103
1×10-5
1×10-6
0
MTT值(A值)
0.31±0.03
0.33±0.04
0.35±0.07
, 百拇医药
0.28±0.02
0.12±0.02
0.18±0.02
t值
15.57
15.35
8.92
18.48
6.12
-
P值
<0.01
<0.01
, 百拇医药
<0.01
<0.01
<0.01
-
三、讨论
bFGF在体内分布广泛,并且具有广泛的生物学效应,对成纤维细胞、KC以及成骨细胞等均具有促增生作用。我们的研究证明了此点,同时发现bFGF对体外培养的人KC具有促进增生的最低作用浓度为1×10-5U/mL。随着药物浓度的增加,这种促增生作用随之增加,示意bFGF的促KC增生作用逐渐增强,出现剂量依赖现象。直接细胞计数实验同样观察到相同现象,在培养基中加入bFGF后人KC的增生速度明显提高,并且在浓度为1×10-4U/mL时即显著增高,与MTT实验结果基本一致。然而,我们发现将bFGF的浓度进一步增加,至1×102U/mL以上时KC生长出现增生抑制现象,其机制尚不清楚,可能与制剂中含有的其它成分对细胞产生抑制作用有关。
, 百拇医药
活细胞可以摄取在培养基内定量加入的噻唑蓝(MTT),并且由细胞内线粒体中的琥珀酸脱氢酶将MTT转化为蓝色的甲瓒,其颜色的深浅与活细胞数成正比。我们利用MTT法证实重组牛bFGF对体外培养KC具有促增殖作用的结果,与直接细胞计数实验所见基本一致,证明重组牛bFGF可以使人KC增殖速度提高,具有一定的临床应用前景。
参 考 文 献
1.O′ Keefe EJ, Chin ML, Payne RE Jr. Stimulation of growth of keratinocytes of basic fibroblast growth factor. J Invest Dermatol,1988,90:767- 769.
2.Yaguchi H, Tsuboi R, Ueki R, et al. Immuno-hisochemical localization of basic fibroblast growth factor in skin diseases.Acta Derm Venereol, 1993,73:81- 83.
, 百拇医药
3.Hebda PA, Klingbeil CK, Abraham JA, et al. Basic fibroblast growth stimulation of epidermal wound healing in pigs.J Invest Dermatol, 1990, 95:626- 631.
4.Marionnet AV, Lizard G, Chardonnet Y, et al. Comparative evaluation of the antiproliferative effect of cyclosporin A and gamma interferon on normal and HPV transformed keratinocytes by cell counting, MTT assay and tritiated thymidine incorporation. Cell Biol Toxicol,1997,13: 115- 123.
收稿日期:1999-04-05, 百拇医药