靶敏感脂质体的研究进展
作者:王黎 侯新朴
单位:北京医科大学药学院物理药学研究室,北京 100083
关键词:靶敏感脂质体;药物传输;体外免疫测定
中国新药杂志000802 【摘要】 靶敏感脂质体是自80年代中期发展起来的一种新型脂质体,它不但具有靶向性,而且在与靶部位结合能自动释放内容物,因此有着显著优点。本文着重讨论了实现其靶敏感性的方法及影响因素,并对靶敏感脂质体的发展以及在药物传输、体外免疫测定等方面的应用进行了综述。
【中图分类号】R944.15 【文献标识码】A 【文章编号】1003-3734(2000)08-0516-03
Target-sensitive liposomes
WANG Li HOU Xin-pu
, 百拇医药
(Department of Physical Pharmacy, School of Pharmaceutical Sciences,Beijing Medical University, Beijing 100083)
【Abstract】 Target-sensitive liposome siare a new kind of liposomes developed in the middle of the eighties.They not only own orienting property but also spontaneously release their contents once come into contact with target membrane/surface.The approaches to realize the target-sensitive goal and the factors affecting them were discussed,and their development and applications in areas of site-specific drug delivery system and in vitro immunoassay were also reviewed.
, 百拇医药
【Key words】 target-sensitive liposomes;drug delivery;in vitro immunoassay
靶敏感脂质体(target-sensitive liposomes, TS-liposomes)是脂质体在与靶部位结合后能自动去稳定,将内容物释放出来。对于内吞能力比较弱或没有内吞能力的靶细胞来说,普通的免疫脂质体通常不能有效地释放药物。这时,靶敏感脂质体可能更有效,释放的药物通过跨膜转运进入靶细胞内。
1 实现靶敏感的方法
见图1。
图1 靶敏感脂质体去稳定的两种不同机制
靶敏感脂质体在靶部位去稳定的两种可能的机制[1]为:①脂质体与一个多价靶结合后,配体侧向运动,在脂质体与靶的接触区聚集,造成脂质体表面上的配体由平均分布变为不平均分配,故而在脂质体膜上形成了非双层结构,引起内容物泄露,即“contact capping”效应(图1A);②结合于同一靶的脂质体[图1B(a)],或与多个两价抗体结合的脂质体[图1B(b)],相邻脂质体之间紧密接触,在接触区形成非双层结构,引起内容物泄露。
, 百拇医药
2 磷脂分子的多形性
两亲性磷脂分子分散于水中时,由于疏水效应而自动聚集,形成各种各样的相,不同动态分子形态(dynamic molecular shape)的脂质有不同的优势相(phase preference)。
磷脂酰乙醇胺(phosphatidylethanol-amines, PE)头部小,而碳氢链所占面积比较大,呈正相的圆锥形,因而容易形成六角相(HⅡ相);并且PE的氨基与相邻PE分子的磷脂键形成分子间氢键,降低了PE分子的水化能力,进一步有利于HⅡ相的形成。
PE的DSC图谱见图2。由图2看出,PE从双层结构向六角相转变(Lα→HⅡ)时只发生很小的焓变,而结构发生了巨大的重组,说明HⅡ中的酰基链与双层中的酰基链的混乱程度并无十分显着的差异。双层相与六角相之间相互转换的能垒很低,这就暗示了PE作为靶敏感脂质体主要脂质的可行性。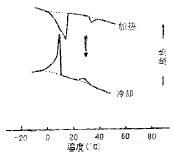
, 百拇医药
图2 PE的DSC图谱
加热和冷却速率为5℃/min,双箭头表示Lα→HⅡ的转变温度
3 影响因素
3.1 有效的头部面积 头部面积增加有利于形成双层结构。例如,二油酰磷脂酰胆碱(dioleoyl-phosphatidylcholine, DOPC)易于形成双层结构,而二油酰磷脂酰乙醇胺(dioleoyl-phosphatidylethanolamine, DOPE)易于形成六角相。
3.2 静电斥力、氢键 由盐、二价阳离子、pH降低所引起的头部离子化,均有利于双层结构的形成。而分子间氢键则有利于六角相的形成。
3.3 水化程度 去水化有利于HⅡ相。
, 百拇医药
3.4 碳氢链长度及饱和度 降低碳氢链长度及饱和度有利于形成HⅡ相。如二硬脂酰磷脂酰乙醇胺(DSPE) 由双层结构转变为六角相的相转变温度(TH)为101℃[2];DOPE有一顺式不饱和双键,TH为10℃[3]。
3.5 温度 升高温度,碳氢链混乱程度增加,HⅡ相形成的可能性增加。
3.6 双层结构稳定剂 带电荷的或高度可水化的两亲性分子均可作为双层结构的稳定剂。磷脂酰胆碱(phosphatidylcholine, PC)、磷脂酰丝胺酸(phosphatidylserine, PS)、磷脂酰肌醇(phosphatidylinositol, PI)、磷脂酰甘油(phosphatidylglycerol, PG)在含量高于20mol%时,均可稳定PE双层。这主要是由于它们降低了PE分子间的氢键,同时增加了界面水化度[4,5]。寡糖通过增加DOPE双层界面水化度、负电排斥及空间位阻防止双层之间的接触而稳定双层结构[6]。
, 百拇医药
4 靶敏感脂质体的发展
4.1 衍生化的抗体既作为双层结构的稳定剂,又作为寻靶的配体 早期研究[7]将抗简单疱疹病毒HSV糖蛋白gD的单抗用棕榈酸酯化(pIgG)后,稳定脂质体所需的最小浓度为pIgG: PE = 2.5×10-4 (mol/mol)。研究发现,抗体衍生化主要发生在Fc段(可结晶段,fragment crystallizable),而Fab段(抗原结合段,fragment of antigen binding)暴露在外,不但能被gD抗原识别结合,而且易于水化,从而稳定PE双层。pIgG在双层中能自由扩散,当抗原-抗体发生反应时,pIgG集中于抗原-脂质体的接触区,从而引起脂质体中的PE富集区去稳定,释放内容物,即所谓的“contact capping”效应。
另外,有人用共振能量转换技术研究发现[8],脂质体去稳定的程度和表观速率强烈地依赖于脂质体的浓度。当脂质体浓度低时(0.1μmol/L),一个病毒子只去稳定1~2个脂质体;而高浓度时(1~10μmol/L),一个病毒子可结合34~104个脂质体,此时,一个病毒子上结合的脂质体双层之间相互接触,从而诱导HⅡ相的形成。
, 百拇医药
这种早期的靶敏感脂质体稳定性较差,并且不是所有的单抗都有双层结构的稳定作用。
4.2 酰基化的抗体只作为寻靶配体,带电荷的或可水化的双亲性分子作为双层结构稳定剂 研究发现[9],组成为80%DOPE,20%二油酰磷脂酸(dioleoyl phosphatidic acid, DOPA),0.06mol%磷脂化抗体的靶敏感脂质体可稳定长达30d,而免疫脂质体的特异性仍然保留,也就是只有HSV-1病毒子或病毒感染的细胞能诱导脂质体溶解。DOPA带负电荷,静电排斥而阻止双层之间的接触,因此有很强的稳定作用。
这种改进的靶敏感脂质体的去稳定机制研究表明,免疫脂质体与靶部位的多价结合是至关重要的,而不一定需要contact capping效应,因为脂质体中包含有足够量的强效的双层结构稳定剂DOPA。因此脂质体溶解很可能是结合于同一靶的相邻脂质体紧密接触的结果,并且有实验结果证实了这一假设。首先, HSV-1病毒子或含有它的抗原决定簇的囊泡所引起免疫脂质体的溶解常常伴随着广泛的的脂质体的聚集;游离抗体或游离抗原决定簇抑制脂质体聚集后强烈抑制脂质体的溶解。其次,免疫脂质体溶解的表观活化能很大(5.46×104J/mol),这与纯PE的水化排斥力4.2×104~4.2×105J/mol[10]相一致,说明脂质体去稳定的限制步骤是结合于同一靶的相邻脂质体克服水化排斥力,而不是由双层结构转变为六角相结构。
, 百拇医药
5 应用
5.1 药物传输[11] 用包裹阿糖胞苷(ara-C)或阿昔洛韦(acyclovir,ACV)的靶敏感脂质体处理HSV感染的L929细胞,发现游离ACV的ED50为1.1μg/ml,当用靶敏感脂质体包裹后,ED50降为125ng/ml,并且非特异性细胞毒性降低了2个数量级;ara-C包入靶敏感脂质体后ED50约为1.8ng/ml,比游离药物低1000倍,而细胞毒性降低4个数量级。但是用PC代替PE后,ara-C的抗病毒活性降低了1.5个数量级,说明了脂质体中PE成分的重要性。
5.2 免疫测定[7,12] 靶敏感脂质体包裹钙黄绿素(calcein)或碱性磷酸酶后与HSV孵育,引起脂质体去稳定、溶解,calcein荧光增强,碱性磷酸酶酶活性增加。用calcein荧光或酶活性可分别检测到7ml中5×104pfu和10ml中71pfu的HSV,而其它病毒不能引起溶解。预先用游离anti-HSV-gD处理HSV后,不再引起脂质体溶解,可以看出该方法的抗原特异性及高度灵敏性。与传统的ELISA相比,该方法简便省时,不需要多次的冲洗和孵育等步骤。
, 百拇医药
与普通脂质体一样,靶敏感脂质体也存在血浆稳定的问题;脂质体与靶结合后,内容物释放于靶细胞外,因此传输的药物限于能被快速转入细胞内的小分子及能通过表面受体结合进入细胞内的大分子。
众所周知,普通脂质体经聚乙二醇(PEG)修饰后,血中循环时间显著延长;但是,对于靶敏感脂质体,掺入PEG延长血循环时间的同时,是否影响其靶诱导的去稳定特性,还有待于进一步的研究[13]。
【作者简介】 王黎(1973-),女,博士。主要从事新型药物载体的研究。联系电话:62091508,E-mail:wanglibj@sohu.com
【参考文献】
[1] Ho RJY, Huang L. Interactions of antigen-sensitized liposomes with immobilized antibody: a homogeneous solid-phase immuno-liposomes assay[J].J Immunol,1985, 134(6)∶4035-4040
, http://www.100md.com
[2] Seddon JM, Cevc G, March D. Calorimetric studies of the gel-fluid(Lβ-Lα) and lamellar-inverted hexagonal (Lα-HⅡ) phase transition in dialkyl- and diacyl- phosphatidylethanolamines[J].Biochemistry, 1983, 22(5)∶1280-1289
[3] Tilcock CPS, Cullis PR. The polymorphic phase behavior and miscibility properties of synthetic phosphatidylethanolamines[J].Biochim Biophys Acta, 1982, 684(1)∶212-218
, 百拇医药
[4] Hope MJ, Walker DC, Cullis PR. Ca2+ and pH induced fusion of small unilamellar vesicles consisting of phophatidyl-ethanolamines and negatively charged phospholipids: a freeze fracture study[J].Biochem Biophys Res Commun. 1983,110(1)∶15-22
[5] Tari A, Huang L. Structure and function relationship of phosphatidylglycerol in the stabilization of the phosphatidyl- ethanolamines bilayer[J].Biochemistry,1989, 28(19)∶7708-7712
, 百拇医药
[6] Taraschi TE, Van De Steen TM, De Kruijff B,et al. Lectin-receptor interactions in liposomes: evidence that binding of wheat germ agglutinin to glyciprotein- phoshpatidylethanolamine vesicles induces nonbilayer structures[J]. Biochemistry,1982,21(23)∶5756-5764
[7] Ho RJY, Rouse BT, Huang L. Target- sensitive immunoliposomes: preparation and characterization[J].Biochemistry, 1986, 25(19)∶5500-5506
[8] Ho RJY, Ting-Beall HP, Rouse BT,et al. Kinetic and ultrastructural studies of interactions of target-sensitive immuno- liposomes with Herpes Simplex Virus[J].Biochemistry,1988,27(1)∶500-506
, 百拇医药
[9] Pinnaduwage P, Huang L. Stable target-sensitive immunoliposomes[J].Biochemistry,1992,31(11)∶2850-2855
[10] Rand RP, Parsegian VA. Hydration forces between phospholipid bilayers[J].Biochim Biophys Acta,1989,988(3)∶351-376
[11] Ho RJY, Rouse BT, Huang L. Target-sensitive immunoliposomes as an efficient drug carrier for antiviral activity[J].J Biol Chem, 1987, 262(29)∶13973-13978
[12] Ho RJY, Rouse BT, Huang L. Destabilization of target-sensitive immuno- liposomes by antigen-binding——a rapid assay for virus[J].Biochem Biophys Res Commun, 1986, 138(2)∶931-937
[13] Ng KY, Zhao L, Liu Y, et al. The effects of polyethyleneglycol (PEG)-derived lipid on the activity of target-sensitive immunoliposome[J].Int J Pharm, 2000, 193(2)∶157-166
收稿:2000-03-06
修回:2000-05-19, http://www.100md.com
单位:北京医科大学药学院物理药学研究室,北京 100083
关键词:靶敏感脂质体;药物传输;体外免疫测定
中国新药杂志000802 【摘要】 靶敏感脂质体是自80年代中期发展起来的一种新型脂质体,它不但具有靶向性,而且在与靶部位结合能自动释放内容物,因此有着显著优点。本文着重讨论了实现其靶敏感性的方法及影响因素,并对靶敏感脂质体的发展以及在药物传输、体外免疫测定等方面的应用进行了综述。
【中图分类号】R944.15 【文献标识码】A 【文章编号】1003-3734(2000)08-0516-03
Target-sensitive liposomes
WANG Li HOU Xin-pu
, 百拇医药
(Department of Physical Pharmacy, School of Pharmaceutical Sciences,Beijing Medical University, Beijing 100083)
【Abstract】 Target-sensitive liposome siare a new kind of liposomes developed in the middle of the eighties.They not only own orienting property but also spontaneously release their contents once come into contact with target membrane/surface.The approaches to realize the target-sensitive goal and the factors affecting them were discussed,and their development and applications in areas of site-specific drug delivery system and in vitro immunoassay were also reviewed.
, 百拇医药
【Key words】 target-sensitive liposomes;drug delivery;in vitro immunoassay
靶敏感脂质体(target-sensitive liposomes, TS-liposomes)是脂质体在与靶部位结合后能自动去稳定,将内容物释放出来。对于内吞能力比较弱或没有内吞能力的靶细胞来说,普通的免疫脂质体通常不能有效地释放药物。这时,靶敏感脂质体可能更有效,释放的药物通过跨膜转运进入靶细胞内。
1 实现靶敏感的方法
见图1。

图1 靶敏感脂质体去稳定的两种不同机制
靶敏感脂质体在靶部位去稳定的两种可能的机制[1]为:①脂质体与一个多价靶结合后,配体侧向运动,在脂质体与靶的接触区聚集,造成脂质体表面上的配体由平均分布变为不平均分配,故而在脂质体膜上形成了非双层结构,引起内容物泄露,即“contact capping”效应(图1A);②结合于同一靶的脂质体[图1B(a)],或与多个两价抗体结合的脂质体[图1B(b)],相邻脂质体之间紧密接触,在接触区形成非双层结构,引起内容物泄露。
, 百拇医药
2 磷脂分子的多形性
两亲性磷脂分子分散于水中时,由于疏水效应而自动聚集,形成各种各样的相,不同动态分子形态(dynamic molecular shape)的脂质有不同的优势相(phase preference)。
磷脂酰乙醇胺(phosphatidylethanol-amines, PE)头部小,而碳氢链所占面积比较大,呈正相的圆锥形,因而容易形成六角相(HⅡ相);并且PE的氨基与相邻PE分子的磷脂键形成分子间氢键,降低了PE分子的水化能力,进一步有利于HⅡ相的形成。
PE的DSC图谱见图2。由图2看出,PE从双层结构向六角相转变(Lα→HⅡ)时只发生很小的焓变,而结构发生了巨大的重组,说明HⅡ中的酰基链与双层中的酰基链的混乱程度并无十分显着的差异。双层相与六角相之间相互转换的能垒很低,这就暗示了PE作为靶敏感脂质体主要脂质的可行性。

, 百拇医药
图2 PE的DSC图谱
加热和冷却速率为5℃/min,双箭头表示Lα→HⅡ的转变温度
3 影响因素
3.1 有效的头部面积 头部面积增加有利于形成双层结构。例如,二油酰磷脂酰胆碱(dioleoyl-phosphatidylcholine, DOPC)易于形成双层结构,而二油酰磷脂酰乙醇胺(dioleoyl-phosphatidylethanolamine, DOPE)易于形成六角相。
3.2 静电斥力、氢键 由盐、二价阳离子、pH降低所引起的头部离子化,均有利于双层结构的形成。而分子间氢键则有利于六角相的形成。
3.3 水化程度 去水化有利于HⅡ相。
, 百拇医药
3.4 碳氢链长度及饱和度 降低碳氢链长度及饱和度有利于形成HⅡ相。如二硬脂酰磷脂酰乙醇胺(DSPE) 由双层结构转变为六角相的相转变温度(TH)为101℃[2];DOPE有一顺式不饱和双键,TH为10℃[3]。
3.5 温度 升高温度,碳氢链混乱程度增加,HⅡ相形成的可能性增加。
3.6 双层结构稳定剂 带电荷的或高度可水化的两亲性分子均可作为双层结构的稳定剂。磷脂酰胆碱(phosphatidylcholine, PC)、磷脂酰丝胺酸(phosphatidylserine, PS)、磷脂酰肌醇(phosphatidylinositol, PI)、磷脂酰甘油(phosphatidylglycerol, PG)在含量高于20mol%时,均可稳定PE双层。这主要是由于它们降低了PE分子间的氢键,同时增加了界面水化度[4,5]。寡糖通过增加DOPE双层界面水化度、负电排斥及空间位阻防止双层之间的接触而稳定双层结构[6]。
, 百拇医药
4 靶敏感脂质体的发展
4.1 衍生化的抗体既作为双层结构的稳定剂,又作为寻靶的配体 早期研究[7]将抗简单疱疹病毒HSV糖蛋白gD的单抗用棕榈酸酯化(pIgG)后,稳定脂质体所需的最小浓度为pIgG: PE = 2.5×10-4 (mol/mol)。研究发现,抗体衍生化主要发生在Fc段(可结晶段,fragment crystallizable),而Fab段(抗原结合段,fragment of antigen binding)暴露在外,不但能被gD抗原识别结合,而且易于水化,从而稳定PE双层。pIgG在双层中能自由扩散,当抗原-抗体发生反应时,pIgG集中于抗原-脂质体的接触区,从而引起脂质体中的PE富集区去稳定,释放内容物,即所谓的“contact capping”效应。
另外,有人用共振能量转换技术研究发现[8],脂质体去稳定的程度和表观速率强烈地依赖于脂质体的浓度。当脂质体浓度低时(0.1μmol/L),一个病毒子只去稳定1~2个脂质体;而高浓度时(1~10μmol/L),一个病毒子可结合34~104个脂质体,此时,一个病毒子上结合的脂质体双层之间相互接触,从而诱导HⅡ相的形成。
, 百拇医药
这种早期的靶敏感脂质体稳定性较差,并且不是所有的单抗都有双层结构的稳定作用。
4.2 酰基化的抗体只作为寻靶配体,带电荷的或可水化的双亲性分子作为双层结构稳定剂 研究发现[9],组成为80%DOPE,20%二油酰磷脂酸(dioleoyl phosphatidic acid, DOPA),0.06mol%磷脂化抗体的靶敏感脂质体可稳定长达30d,而免疫脂质体的特异性仍然保留,也就是只有HSV-1病毒子或病毒感染的细胞能诱导脂质体溶解。DOPA带负电荷,静电排斥而阻止双层之间的接触,因此有很强的稳定作用。
这种改进的靶敏感脂质体的去稳定机制研究表明,免疫脂质体与靶部位的多价结合是至关重要的,而不一定需要contact capping效应,因为脂质体中包含有足够量的强效的双层结构稳定剂DOPA。因此脂质体溶解很可能是结合于同一靶的相邻脂质体紧密接触的结果,并且有实验结果证实了这一假设。首先, HSV-1病毒子或含有它的抗原决定簇的囊泡所引起免疫脂质体的溶解常常伴随着广泛的的脂质体的聚集;游离抗体或游离抗原决定簇抑制脂质体聚集后强烈抑制脂质体的溶解。其次,免疫脂质体溶解的表观活化能很大(5.46×104J/mol),这与纯PE的水化排斥力4.2×104~4.2×105J/mol[10]相一致,说明脂质体去稳定的限制步骤是结合于同一靶的相邻脂质体克服水化排斥力,而不是由双层结构转变为六角相结构。
, 百拇医药
5 应用
5.1 药物传输[11] 用包裹阿糖胞苷(ara-C)或阿昔洛韦(acyclovir,ACV)的靶敏感脂质体处理HSV感染的L929细胞,发现游离ACV的ED50为1.1μg/ml,当用靶敏感脂质体包裹后,ED50降为125ng/ml,并且非特异性细胞毒性降低了2个数量级;ara-C包入靶敏感脂质体后ED50约为1.8ng/ml,比游离药物低1000倍,而细胞毒性降低4个数量级。但是用PC代替PE后,ara-C的抗病毒活性降低了1.5个数量级,说明了脂质体中PE成分的重要性。
5.2 免疫测定[7,12] 靶敏感脂质体包裹钙黄绿素(calcein)或碱性磷酸酶后与HSV孵育,引起脂质体去稳定、溶解,calcein荧光增强,碱性磷酸酶酶活性增加。用calcein荧光或酶活性可分别检测到7ml中5×104pfu和10ml中71pfu的HSV,而其它病毒不能引起溶解。预先用游离anti-HSV-gD处理HSV后,不再引起脂质体溶解,可以看出该方法的抗原特异性及高度灵敏性。与传统的ELISA相比,该方法简便省时,不需要多次的冲洗和孵育等步骤。
, 百拇医药
与普通脂质体一样,靶敏感脂质体也存在血浆稳定的问题;脂质体与靶结合后,内容物释放于靶细胞外,因此传输的药物限于能被快速转入细胞内的小分子及能通过表面受体结合进入细胞内的大分子。
众所周知,普通脂质体经聚乙二醇(PEG)修饰后,血中循环时间显著延长;但是,对于靶敏感脂质体,掺入PEG延长血循环时间的同时,是否影响其靶诱导的去稳定特性,还有待于进一步的研究[13]。
【作者简介】 王黎(1973-),女,博士。主要从事新型药物载体的研究。联系电话:62091508,E-mail:wanglibj@sohu.com
【参考文献】
[1] Ho RJY, Huang L. Interactions of antigen-sensitized liposomes with immobilized antibody: a homogeneous solid-phase immuno-liposomes assay[J].J Immunol,1985, 134(6)∶4035-4040
, http://www.100md.com
[2] Seddon JM, Cevc G, March D. Calorimetric studies of the gel-fluid(Lβ-Lα) and lamellar-inverted hexagonal (Lα-HⅡ) phase transition in dialkyl- and diacyl- phosphatidylethanolamines[J].Biochemistry, 1983, 22(5)∶1280-1289
[3] Tilcock CPS, Cullis PR. The polymorphic phase behavior and miscibility properties of synthetic phosphatidylethanolamines[J].Biochim Biophys Acta, 1982, 684(1)∶212-218
, 百拇医药
[4] Hope MJ, Walker DC, Cullis PR. Ca2+ and pH induced fusion of small unilamellar vesicles consisting of phophatidyl-ethanolamines and negatively charged phospholipids: a freeze fracture study[J].Biochem Biophys Res Commun. 1983,110(1)∶15-22
[5] Tari A, Huang L. Structure and function relationship of phosphatidylglycerol in the stabilization of the phosphatidyl- ethanolamines bilayer[J].Biochemistry,1989, 28(19)∶7708-7712
, 百拇医药
[6] Taraschi TE, Van De Steen TM, De Kruijff B,et al. Lectin-receptor interactions in liposomes: evidence that binding of wheat germ agglutinin to glyciprotein- phoshpatidylethanolamine vesicles induces nonbilayer structures[J]. Biochemistry,1982,21(23)∶5756-5764
[7] Ho RJY, Rouse BT, Huang L. Target- sensitive immunoliposomes: preparation and characterization[J].Biochemistry, 1986, 25(19)∶5500-5506
[8] Ho RJY, Ting-Beall HP, Rouse BT,et al. Kinetic and ultrastructural studies of interactions of target-sensitive immuno- liposomes with Herpes Simplex Virus[J].Biochemistry,1988,27(1)∶500-506
, 百拇医药
[9] Pinnaduwage P, Huang L. Stable target-sensitive immunoliposomes[J].Biochemistry,1992,31(11)∶2850-2855
[10] Rand RP, Parsegian VA. Hydration forces between phospholipid bilayers[J].Biochim Biophys Acta,1989,988(3)∶351-376
[11] Ho RJY, Rouse BT, Huang L. Target-sensitive immunoliposomes as an efficient drug carrier for antiviral activity[J].J Biol Chem, 1987, 262(29)∶13973-13978
[12] Ho RJY, Rouse BT, Huang L. Destabilization of target-sensitive immuno- liposomes by antigen-binding——a rapid assay for virus[J].Biochem Biophys Res Commun, 1986, 138(2)∶931-937
[13] Ng KY, Zhao L, Liu Y, et al. The effects of polyethyleneglycol (PEG)-derived lipid on the activity of target-sensitive immunoliposome[J].Int J Pharm, 2000, 193(2)∶157-166
收稿:2000-03-06
修回:2000-05-19, http://www.100md.com