抗槲皮素抗体的研制
作者:姜玲 章文才 柯云 马湘涛., http://www.100md.com
单位:姜玲(华中农业大学园艺系作物遗传改良国家重点实验室,湖北 武汉 430070);章文才(华中农业大学园艺系作物遗传改良国家重点实验室,湖北 武汉 430070);柯云(微生物农药国家工程研究中心,湖北 武汉 430070);马湘涛(华中农业大学园艺系作物遗传改良国家重点实验室,湖北 武汉 430070)., http://www.100md.com
关键词:槲皮素;抗体;双向琼脂扩散试验;酶联免疫吸附测定(ELISA)., http://www.100md.com
免疫学杂志000520., http://www.100md.com
[摘 要] 目的 通过人工抗原的构建,制备针对槲皮素的特异性抗体。方法 采用混合酸酐法合成的槲皮素卵清蛋白结合物作为包被抗原,将槲皮素与载体蛋白牛血清白蛋白(BSA)结合,制成人工抗原。用人工抗原免疫家兔,制备了针对槲皮素的特异性抗体,并用双向琼脂扩散试验和ELISA方法对抗体进行了鉴定。IR、UV、TLC和熔点分析表明,中间体结合物为新的化合物。结果 理想的包被抗原浓度为400 ng/ml,相应抗血清工作浓度为1∶1 600。结论 运用混合酸酐法可以合成槲皮素人工抗原,进一步免疫可制备抗槲皮素的特异性抗体。., http://www.100md.com
[中图分类号] Q946.8;R392-33 [文献标识码] A., http://www.100md.com
[文章编号]1000-8861(2000)05-0383-04., http://www.100md.com
Development of anti-quercetin antibodies., http://www.100md.com
JIANG Ling ZHANG Wen-cai MA Xiang-tao., http://www.100md.com
(National Key Laboratory of Crop Genetic Improvement,Department of Horticulture,Huazhong Agricultural University,Wuhan 430070,China)., http://www.100md.com
KE Yun., http://www.100md.com
(National Engineering Research Center of Microbe Pesticides,Wuhan 430070,China)
[Abstract] Objective To build the artificial immunogen and product-specific antibody.Methods The hapten Quercetin was coupled to BSA and OVA with mixed-anhydride method and the Quercetin carrier protein conjugations were synthesized. Quercetin-HS-OVA was used as coating antigen. The antibody was obtained successfully by immunizing big ear rabbits with Quercetin-HS-BSA,the polyclonal anti-quercetin antibodies were developed,which were determined with double agar diffusion test and ELISA. IR,UV,TLC and m.p.for qualitative analysis were also performed. It can be confirmed that the middle conjugations were produced. Results It was shown that the ideal coating antigen concentration was 400 ng/ml,the available antibody dilution was 1:1 600.Conclusion The artificial immunogen could be synthesized by mixed-anhydride method and the specificity of the polyclonal anti-quercetin antibodies could be produced.dp44/y5, 百拇医药
[Key words] quercetin;antibodies;double agar diffusion test;enzyme-linked immunosorbent assaydp44/y5, 百拇医药
槲皮素是存在于银杏等植物中的一种重要的黄酮苷元,具有对抗自由基,抑制癌细胞生长,改善心脑血管循环等重要药理作用。近三十年来,植物细胞、组织以及发状根培养生产次生代谢物已成为珍贵药用植物资源开发利用的一条新途径。前人曾采用ELISA方法对不同植物培养物所含药用成份如:quassin[1]、lindoline[2]、anthoyanin[3]成功地进行了高产细胞系的筛选,从而为次生代谢物的工业化生产奠定了基础。JOURDAN[4]利用免疫学方法测定了柑桔中苦味成分微量黄酮类化合物含量。在前人研究的基础上,本试验试图将槲皮素与载体蛋白结合,构建人工抗原,制备针对槲皮素的多克隆抗体,从而为银杏组织、细胞培养和天然植物资源的筛选,建立一种快速、精确、廉价、处理样品量大的ELISA检测方法提供依据。
1 材料与方法%, http://www.100md.com
1.1 材料及试剂%, http://www.100md.com
1.1.1 试剂:槲皮素[quercetin(QU),Sigma]经聚酰胺柱层析,冷冻干燥后使用;牛血清白蛋白(BSA,上海伯奥生物技术公司);卵清蛋白(OVA,Sigma);羊抗兔-辣根过氧化物酶(lgG-HRP工作浓度1∶1 000,中科院上海生物化学研究所);福氏完全佐剂(FCA,Sigma);福氏不完全佐剂(FIA,Sigma);Sephadex-G200(Sigma);DEAE-纤维素(DE-52,whatman);琥珀酸酐(succinice anhydride,天津化学试剂一厂);其它试剂为AR级或CP级,酶联免疫吸附测定所用溶液,根据参考文献[5]配制。%, http://www.100md.com
银杏内酯A(ginkgolide A,Sigma);银杏内酯B、C、D (ginkgolide B、C、D)及白果内酯(bilobalide)标样由荷兰VAN BEEK TA博士惠赠;茄呢醇(solaneaol,Sigma);阿魏酸(ferulic acid,sigma);山奈素(kaempferol)和异鼠李素(isorhamnetin)由瑞士HASLER博士惠赠。%, http://www.100md.com
1.1.2 实验动物:6月龄以上雄性长耳白兔,体重2 500 g左右,购自华中农业大学畜牧兽医学院。%, http://www.100md.com
1.1.3 主要仪器设备:透析袋(截止分子量1 000 U,Sigma);聚苯乙烯酶联反应板(96孔,浙江);微量移液器(25~100 μl,德国);DG-3200型酶联免疫检测仪;120-UV分光光度计(日本);Spectra-physics 高效液相色谱仪(SP8800泵,紫外检测器,美国);MODEL260-10/260-30红外光谱仪(日本)。%, http://www.100md.com
1.2 试验方法%, http://www.100md.com
1.2.1 槲皮素-蛋白结合物构建的方法:根据参考文献[6],制备槲皮素与琥珀酸酐反应获得浅棕色中间体结晶(QU-HS)。槲皮素蛋白结合物(QU-HS-BSA)的合成,参考混合酸酐法[6],并稍加改进。称取160 mg BSA于烧杯中,加入8.7 ml重蒸水,用精密pH计调pH值至9.5。另取5 ml的1.4-二氧六环加入含QU-HS的烧杯中,再加入150 μl预冷的三正丁胺,在冰浴中保持10 min,加入100 μl预冷的氯甲酸乙酯,将溶液在冰浴中保持20 min,然后将BSA溶液与QU-HS溶液混合,迅速调整pH至7.15,混合物呈乳白色。将蛋白结合物放在冰筒内放置在摇床上(80 r/min)振摇4 h,然后将混合物装入透析袋中,用重蒸水透析48 h,透析后的蛋白结合物在冷冻离心机上(8 000 r/min)离心20 min,去上清液,下层物质经浓度测定后,分装在样品瓶中,经冰冻干燥,在-20 °C冰柜中保存。QU-HS-OVA合成方法同上所述。
1.2.2 中间体及蛋白结合物的定性鉴定j52'hd, 百拇医药
1.2.2.1 红外光谱分析:将上述中间体和蛋白结合物压成薄而透明的KBr样片,立即进行红外光谱分析。j52'hd, 百拇医药
1.2.2.2 紫外光谱分析:根据参考文献[7] 利用紫外吸收光谱对半抗原与载体蛋白的连接进行鉴定,并计算结合比(每分子载体蛋白连接的半抗原数目)。j52'hd, 百拇医药
1.2.2.3 薄层色谱及熔点测定:用1%的羧甲基纤维素钠将硅胶GF254调呈糊状,均匀地铺在玻璃板上,铺板厚度约0.25 mm,在烘箱中110 °C下活化30 min,展开剂为甲苯∶氯仿∶丙酮(40∶25∶35),点样量为2 μl[8]。用显微熔点仪测定中间体的熔点。j52'hd, 百拇医药
1.2.3 抗血清的制备:选取雄性长耳白兔,随机分成2组。第一次基础免疫时,将抗原(QU-HS-BSA)加入0.5 ml生理盐水和0.5 ml FCA,在无菌条件下,用两支注射器来回抽拉制成乳剂,在兔的背部皮下多点注射(约15点)。以后每隔10 d加强免疫1次,取0.25 mg抗原,溶于0.25 ml生理盐水和0.25 ml FIA,制成乳剂,在兔的腿部肌肉注射[9]。如此反复加强免疫6次,其后再隔20 d免疫1次,共免疫2次,最后1次加强免疫后的第10 d,从动脉取血,采集血清,于-20 °C冰箱保存[9]。j52'hd, 百拇医药
1.2.4 抗体的鉴定和纯化j52'hd, 百拇医药
1.2.4.1 ELISA基本条件的建立:用盒子滴定的方法优化包被抗原和抗血清稀释度(工作浓度);以QU-HS-OVA作为包被抗原。ELISA程序参见文献[9]。j52'hd, 百拇医药
1.2.4.2 抗体的亲合性和特异性:根据参考文献[9]对槲皮素的类似物及银杏叶中常见成分进行交叉反应测定。j52'hd, 百拇医药
1.2.4.3 抗体的纯化:首先将抗血清用饱和硫酸铵沉淀法粗提和浓缩,再进一步用DEAE-纤维素柱层析纯化,测定浓度后,在—20 °C下分装、冻存。j52'hd, 百拇医药
2 结果j52'hd, 百拇医药
2.1 半抗原及载体复合物的定性鉴定
2.1.1 红外光谱定性分析:红外光谱分析显示,中间体 QU-HS所具有的特征峰与Quercetin标准吸收峰有所不同,在1 720 cm-1、1 700 cm-1、1 640 cm-1(C=0)有伸缩振动,820 cm-1(苯环C-H),3 450 cm-1羧酸类游离羟基(-OH),1 610 cm-1、1 560 cm-1(苯核)存在。说明含有羧酸基团的中间化合物产生,而且基本结构没有破坏,而在QU-HS-BSA的红外图谱中,1 720 cm-1,1 640cm-1消失,1 650 cm-1(-CO-N)产生吸收峰,证明-COOH与蛋白质中-NH2的结合,1 750 cm-1说明链状饱和酯链存在,1 580 cm-1、1 505 cm-1、770 cm-1说明苯核结构的存在。QU-HS-OVA红外光谱分析表明:1 740 cm-1有链状饱和酯存在,1 640 cm-1、1 650 cm-1表明(-CO-N)存在。%z|;, http://www.100md.com
2.1.2 熔点分析:显微熔点仪测定表明,中间体 QU-HS的熔点mp为134~136 °C,在此温度范围内,中间体全部熔为棕色液体,据文献报道,quercetin的熔点为312~316 °C,当quercetin全乙酰化时,熔点为193.5 °C,全甲基化时,熔点为151~152 °C,琥珀酸酐熔点为119.6 °C,由此可以初步判断,槲皮素与琥珀酸酐反应的产物是一种新化合物。%z|;, http://www.100md.com
2.1.3 薄层层析及紫外光谱分析:TLC分析表明,在λ=250 nm紫外灯下观察,quercetin的迁移率Rf=0.35,而QU-HS的迁移率Rf=0.32。紫外光谱分析测得QU∶BSA的偶联率为20.96∶1(在λ=280 nm)。%z|;, http://www.100md.com
2.2 抗体的制备与鉴定%z|;, http://www.100md.com
2.2.1 抗体的制备:从1998年9月24日开始基础免疫到11月22日,用双向琼脂扩散试验(DADT)法检查发现,用QU-HS-BSA免疫的3只大耳白兔中,2只已产生抗血清,而且观察到抗血清与BSA产生的沉淀线和抗血清与QU-HS-BSA产生的沉淀线形成分叉(见图1)。在免疫双扩散中,置于相邻两孔中的两种抗原与第3孔扩散的抗体反应,形成一条连续的沉淀线并交叉,表明两种抗原相关,但不相同。DADT结果表明;抗血清中含有抗载体蛋白BSA的抗体和抗半抗原分子槲皮素特异的抗体,当进一步加强免疫至1999年2月1日时,抗血清效价达1∶32。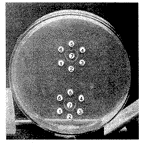
图1双向琼脂扩散试验+[;q(, http://www.100md.com
Fig 1Double agar diffusion test+[;q(, http://www.100md.com
①②③:BSA;④⑤⑥:QU-HS-BSA;⑦:Ab+[;q(, http://www.100md.com
2.2.2 理想的包被抗原浓度及抗体浓度的筛选与鉴定:试验表明,当包被抗原QU-HS-OVA浓度为400 ng/ml,相应抗血清工作浓度为1∶1 600时,零对照OD值与5 ng/ml最小抑制的OD值差异最大,且曲线的倾斜度最大,线性关系较好(r=-0.983 7),因此,理想的包被抗原浓度为400 ng/ml(见表1)。不同抗体稀释倍数测定的曲线比较,1∶1 600倍稀释的抗体,使零抑制与最小抑制间的OD值差异最大,且曲线的倾斜度最大,因此,宜用1∶1 600的抗血清作槲皮素的ELISA(见表2)。试验表明:槲皮素的检测范围为0.5~50 ng,批内变异系数为5.46%,批间变异系数为9.38%。+[;q(, http://www.100md.com
表1 不同包被抗原浓度的吸光度的比较+[;q(, http://www.100md.com
Tab 1 Comparison of the absorbance (OD) of the different antigen coating concentration antigen coating+[;q(, http://www.100md.com
concentration (ng/ml)+[;q(, http://www.100md.com
Ig[QU](ng/ml)+[;q(, http://www.100md.com
0+[;q(, http://www.100md.com
0.7+[;q(, http://www.100md.com
1.0+[;q(, http://www.100md.com
2.0+[;q(, http://www.100md.com
2.4+[;q(, http://www.100md.com
2.7+[;q(, http://www.100md.com
1 000+[;q(, http://www.100md.com
0.99+[;q(, http://www.100md.com
0.88+[;q(, http://www.100md.com
0.81
0.66(x8kki, 百拇医药
0.64(x8kki, 百拇医药
0.62(x8kki, 百拇医药
500(x8kki, 百拇医药
0.95(x8kki, 百拇医药
0.84(x8kki, 百拇医药
0.70(x8kki, 百拇医药
0.63(x8kki, 百拇医药
0.60(x8kki, 百拇医药
0.54(x8kki, 百拇医药
400(x8kki, 百拇医药
0.93(x8kki, 百拇医药
0.82(x8kki, 百拇医药
0.67(x8kki, 百拇医药
0.49(x8kki, 百拇医药
0.42(x8kki, 百拇医药
0.35(x8kki, 百拇医药
300(x8kki, 百拇医药
0.85(x8kki, 百拇医药
0.78(x8kki, 百拇医药
0.57(x8kki, 百拇医药
0.47(x8kki, 百拇医药
0.37(x8kki, 百拇医药
0.34(x8kki, 百拇医药
200(x8kki, 百拇医药
0.71(x8kki, 百拇医药
0.63(x8kki, 百拇医药
0.48(x8kki, 百拇医药
0.42(x8kki, 百拇医药
0.31(x8kki, 百拇医药
0.30
表2 不同抗血清稀释度的吸光度的比较6&{{fjm, http://www.100md.com
Tab 2 Comparison of the absorbance (OD) of the different dilution of antiserum dilution of Ab6&{{fjm, http://www.100md.com
Ig[QU](ng/ml)6&{{fjm, http://www.100md.com
06&{{fjm, http://www.100md.com
1.06&{{fjm, http://www.100md.com
2.06&{{fjm, http://www.100md.com
2.46&{{fjm, http://www.100md.com
2.76&{{fjm, http://www.100md.com
1∶8006&{{fjm, http://www.100md.com
0.946&{{fjm, http://www.100md.com
0.866&{{fjm, http://www.100md.com
0.676&{{fjm, http://www.100md.com
0.586&{{fjm, http://www.100md.com
0.526&{{fjm, http://www.100md.com
1∶1 6006&{{fjm, http://www.100md.com
0.856&{{fjm, http://www.100md.com
0.716&{{fjm, http://www.100md.com
0.466&{{fjm, http://www.100md.com
0.396&{{fjm, http://www.100md.com
0.346&{{fjm, http://www.100md.com
1∶3 2006&{{fjm, http://www.100md.com
0.636&{{fjm, http://www.100md.com
0.536&{{fjm, http://www.100md.com
0.396&{{fjm, http://www.100md.com
0.316&{{fjm, http://www.100md.com
0.296&{{fjm, http://www.100md.com
对槲皮素的类似物及银杏叶中含有的主要成分进行交叉反应分析,可知抗血清与异鼠李素的交叉反应为14.26%,而与银杏叶中其它成分的交叉反应接近于0,这可能是异鼠李素与槲皮素结构极其相似所至(见表3)。表3 抗QU-HS-BSA抗血清的交叉反应
Tab 3 Cross-reactivity of anti-QU-HS-BSA antiserum compound\wae@ag, 百拇医药
cross-reaction (%)\wae@ag, 百拇医药
quercertin\wae@ag, 百拇医药
100\wae@ag, 百拇医药
isohamnetin\wae@ag, 百拇医药
14.26\wae@ag, 百拇医药
kaempferol\wae@ag, 百拇医药
0.06\wae@ag, 百拇医药
ginkgolide A\wae@ag, 百拇医药
<0.001\wae@ag, 百拇医药
ginkgolide B\wae@ag, 百拇医药
<0.001\wae@ag, 百拇医药
ginkgolide C\wae@ag, 百拇医药
<0.001\wae@ag, 百拇医药
bilobalide\wae@ag, 百拇医药
<0.001\wae@ag, 百拇医药
solaneaol\wae@ag, 百拇医药
<0.001\wae@ag, 百拇医药
ferulic acid\wae@ag, 百拇医药
<0.001\wae@ag, 百拇医药
3 讨 论 1959年ERLANGER[10]首先将混合酸酐法应用于人工抗原的合成。根据quercetin化学结构中存在活泼C3-OH基团的特点,先将quercetin与琥珀酸酐反应,接上羧基臂,制得中间体QU-HS,然后将QU-HS与BSA通过酰胺键相连,生成QU-HS-BSA蛋白结合物。此法的优点是QU-HS中间体合成条件比较温和,产物容易得到。采用混合酸酐法形成酰胺键,反应专属性高,而且可以在低温下进行,避免了蛋白质发生变性反应。反应中加入三正丁胺作为缚酸剂,对羧酸中的-OH起到束缚作用。反应产物中,除QU-HS-BSA是大分子外,其余产物为低分子乙醇和CO2气体,经过离心、透析和柱层析等方式,可以将QU-HS-BSA分离出来,从而达到纯化的目的。
采用混合酸酐法合成抗原,前人多采用氯甲酸异丁酯作反应介质[10],国内外还未见用氯甲酸乙酯进行反应的报道。从理论上分析,该反应是利用氯甲酸乙酯中的(O- CO -Cl)键与羧酸发生酰卤反应,此反应十分剧烈,一般在低温下进行,而(O- CO -Cl)的另一端是异丁基还是乙基对反应本身来讲,并不是关键的因素。本试验结果表明:用廉价、易得的氯甲酸乙酯用于混合酸酐反应是可行的。n, http://www.100md.com
当抗原合成后,单纯用化学方法定性鉴定小分子与载体蛋白质共价结合,并不能表明此抗原免疫动物就一定能产生出合格的抗体。前人研究表明[9]:凡是分子中环状结构较多的,免疫原性必定较强。在水中溶解性较小的抗原,其免疫原性也较大。特异性抗体能否形成,还与动物的种类、年龄、性别、免疫程序有关,抗原的免疫原性还与半抗原与载体蛋白的偶联率的大小和半抗原蛋白结合物的分子结构有关。本试验以QU-HS-BSA作免疫原,制备抗血清。其中QU∶BSA偶联率为20.96∶1,符合一般的比例要求[6]。从分子结构上看,槲皮素包含呋喃色原酮的复杂化学结构,因而为抗体的产生提供了结构基础。n, http://www.100md.com
本课题通过槲皮素人工抗原的构建和免疫学试验,制备了针对槲皮素的多克隆抗体,这对于开发银杏等药用植物资源和开辟药用成分检测的新途径是一次新尝试。n, http://www.100md.com
[基金项目] 湖北省重点资助科技基金项目(98190802)n, http://www.100md.com
[作者简介] 姜 玲(1964-),女,湖北武汉市人,副教授,博士,主要从事生物技术与育种及免疫学方面的研究。n, http://www.100md.com
[参考文献]n, http://www.100md.com
[1] ROBINS RJ,MORGAN MRA,RHODES MJC,et al. Determination of guassin in picogram quantities by and enzyme-linked immunosorbent assay [J]. Phytochemistry,1984,23(5):1 119-1 123.n, http://www.100md.com
[2] LAPINJOKI S,VERAJANKOEVA H,HEISKANEN J,et al. Immunoanalytical methods for screening vindoline from catharanthus roseus cell culture [J]. Planta Medica,1987,53(6):565-567.
[3] YAMAMOTO Y,KINOSHITA Y,WATANABE S. Anthoyanin production in suspension cultures of high-producing cells of Euphoria millii [J]. Agric Biol Chem,1989,53(2):417-423.\|l, 百拇医药
[4] JOURDAN PS,MANSELL RL,OLIVER DG,et al. Competitive solid phase enzyme-linked immunoassay for the quantification of limonin in citrus[J]. Ana Biochem,1984,138(1):19-24.\|l, 百拇医药
[5] 刘室金,孙惠兰,李俊宝,等.兽医免疫学实验指导[M].上海:上海科学技术出版社,1985.74-82.\|l, 百拇医药
[6] ROBINS RJ. The measurement of low-molecular-weight,non-immunogenic compounds by immunoassay [M].In:LINSKENS HF,eds.Immunology in plant sciences. Berlin:Springer-Verlag,1986.86-108.\|l, 百拇医药
[7] 徐如涓,季本仁,段金玉. 玉米素核苷的酶标免疫测定法[J].云南植物研究,1986,8(3):333-342.\|l, 百拇医药
[8] HORHAM L,WAGNEK H,HEIN K.Kieselgel dunnschichtchromatographie von flavonoiden of chromatog[J].J Chroma,1964,13(1):235-237.\|l, 百拇医药
[9] 李宗霆,周 燮.植物激素及其免疫检测技术[M].江苏:江苏科学技术出版社,1996.250-298.\|l, 百拇医药
[10] ERLANGER BE;BOREK F,BEISER SM,et al. Steroid-protein conjugates [J].J Biol Chem,1959,234(5):1 090-1 094.\|l, 百拇医药
[收稿日期] 2000-01-27; [修回日期] 2000-05-04(姜玲 章文才 柯云 马湘涛)
单位:姜玲(华中农业大学园艺系作物遗传改良国家重点实验室,湖北 武汉 430070);章文才(华中农业大学园艺系作物遗传改良国家重点实验室,湖北 武汉 430070);柯云(微生物农药国家工程研究中心,湖北 武汉 430070);马湘涛(华中农业大学园艺系作物遗传改良国家重点实验室,湖北 武汉 430070)., http://www.100md.com
关键词:槲皮素;抗体;双向琼脂扩散试验;酶联免疫吸附测定(ELISA)., http://www.100md.com
免疫学杂志000520., http://www.100md.com
[摘 要] 目的 通过人工抗原的构建,制备针对槲皮素的特异性抗体。方法 采用混合酸酐法合成的槲皮素卵清蛋白结合物作为包被抗原,将槲皮素与载体蛋白牛血清白蛋白(BSA)结合,制成人工抗原。用人工抗原免疫家兔,制备了针对槲皮素的特异性抗体,并用双向琼脂扩散试验和ELISA方法对抗体进行了鉴定。IR、UV、TLC和熔点分析表明,中间体结合物为新的化合物。结果 理想的包被抗原浓度为400 ng/ml,相应抗血清工作浓度为1∶1 600。结论 运用混合酸酐法可以合成槲皮素人工抗原,进一步免疫可制备抗槲皮素的特异性抗体。., http://www.100md.com
[中图分类号] Q946.8;R392-33 [文献标识码] A., http://www.100md.com
[文章编号]1000-8861(2000)05-0383-04., http://www.100md.com
Development of anti-quercetin antibodies., http://www.100md.com
JIANG Ling ZHANG Wen-cai MA Xiang-tao., http://www.100md.com
(National Key Laboratory of Crop Genetic Improvement,Department of Horticulture,Huazhong Agricultural University,Wuhan 430070,China)., http://www.100md.com
KE Yun., http://www.100md.com
(National Engineering Research Center of Microbe Pesticides,Wuhan 430070,China)
[Abstract] Objective To build the artificial immunogen and product-specific antibody.Methods The hapten Quercetin was coupled to BSA and OVA with mixed-anhydride method and the Quercetin carrier protein conjugations were synthesized. Quercetin-HS-OVA was used as coating antigen. The antibody was obtained successfully by immunizing big ear rabbits with Quercetin-HS-BSA,the polyclonal anti-quercetin antibodies were developed,which were determined with double agar diffusion test and ELISA. IR,UV,TLC and m.p.for qualitative analysis were also performed. It can be confirmed that the middle conjugations were produced. Results It was shown that the ideal coating antigen concentration was 400 ng/ml,the available antibody dilution was 1:1 600.Conclusion The artificial immunogen could be synthesized by mixed-anhydride method and the specificity of the polyclonal anti-quercetin antibodies could be produced.dp44/y5, 百拇医药
[Key words] quercetin;antibodies;double agar diffusion test;enzyme-linked immunosorbent assaydp44/y5, 百拇医药
槲皮素是存在于银杏等植物中的一种重要的黄酮苷元,具有对抗自由基,抑制癌细胞生长,改善心脑血管循环等重要药理作用。近三十年来,植物细胞、组织以及发状根培养生产次生代谢物已成为珍贵药用植物资源开发利用的一条新途径。前人曾采用ELISA方法对不同植物培养物所含药用成份如:quassin[1]、lindoline[2]、anthoyanin[3]成功地进行了高产细胞系的筛选,从而为次生代谢物的工业化生产奠定了基础。JOURDAN[4]利用免疫学方法测定了柑桔中苦味成分微量黄酮类化合物含量。在前人研究的基础上,本试验试图将槲皮素与载体蛋白结合,构建人工抗原,制备针对槲皮素的多克隆抗体,从而为银杏组织、细胞培养和天然植物资源的筛选,建立一种快速、精确、廉价、处理样品量大的ELISA检测方法提供依据。
1 材料与方法%, http://www.100md.com
1.1 材料及试剂%, http://www.100md.com
1.1.1 试剂:槲皮素[quercetin(QU),Sigma]经聚酰胺柱层析,冷冻干燥后使用;牛血清白蛋白(BSA,上海伯奥生物技术公司);卵清蛋白(OVA,Sigma);羊抗兔-辣根过氧化物酶(lgG-HRP工作浓度1∶1 000,中科院上海生物化学研究所);福氏完全佐剂(FCA,Sigma);福氏不完全佐剂(FIA,Sigma);Sephadex-G200(Sigma);DEAE-纤维素(DE-52,whatman);琥珀酸酐(succinice anhydride,天津化学试剂一厂);其它试剂为AR级或CP级,酶联免疫吸附测定所用溶液,根据参考文献[5]配制。%, http://www.100md.com
银杏内酯A(ginkgolide A,Sigma);银杏内酯B、C、D (ginkgolide B、C、D)及白果内酯(bilobalide)标样由荷兰VAN BEEK TA博士惠赠;茄呢醇(solaneaol,Sigma);阿魏酸(ferulic acid,sigma);山奈素(kaempferol)和异鼠李素(isorhamnetin)由瑞士HASLER博士惠赠。%, http://www.100md.com
1.1.2 实验动物:6月龄以上雄性长耳白兔,体重2 500 g左右,购自华中农业大学畜牧兽医学院。%, http://www.100md.com
1.1.3 主要仪器设备:透析袋(截止分子量1 000 U,Sigma);聚苯乙烯酶联反应板(96孔,浙江);微量移液器(25~100 μl,德国);DG-3200型酶联免疫检测仪;120-UV分光光度计(日本);Spectra-physics 高效液相色谱仪(SP8800泵,紫外检测器,美国);MODEL260-10/260-30红外光谱仪(日本)。%, http://www.100md.com
1.2 试验方法%, http://www.100md.com
1.2.1 槲皮素-蛋白结合物构建的方法:根据参考文献[6],制备槲皮素与琥珀酸酐反应获得浅棕色中间体结晶(QU-HS)。槲皮素蛋白结合物(QU-HS-BSA)的合成,参考混合酸酐法[6],并稍加改进。称取160 mg BSA于烧杯中,加入8.7 ml重蒸水,用精密pH计调pH值至9.5。另取5 ml的1.4-二氧六环加入含QU-HS的烧杯中,再加入150 μl预冷的三正丁胺,在冰浴中保持10 min,加入100 μl预冷的氯甲酸乙酯,将溶液在冰浴中保持20 min,然后将BSA溶液与QU-HS溶液混合,迅速调整pH至7.15,混合物呈乳白色。将蛋白结合物放在冰筒内放置在摇床上(80 r/min)振摇4 h,然后将混合物装入透析袋中,用重蒸水透析48 h,透析后的蛋白结合物在冷冻离心机上(8 000 r/min)离心20 min,去上清液,下层物质经浓度测定后,分装在样品瓶中,经冰冻干燥,在-20 °C冰柜中保存。QU-HS-OVA合成方法同上所述。
1.2.2 中间体及蛋白结合物的定性鉴定j52'hd, 百拇医药
1.2.2.1 红外光谱分析:将上述中间体和蛋白结合物压成薄而透明的KBr样片,立即进行红外光谱分析。j52'hd, 百拇医药
1.2.2.2 紫外光谱分析:根据参考文献[7] 利用紫外吸收光谱对半抗原与载体蛋白的连接进行鉴定,并计算结合比(每分子载体蛋白连接的半抗原数目)。j52'hd, 百拇医药
1.2.2.3 薄层色谱及熔点测定:用1%的羧甲基纤维素钠将硅胶GF254调呈糊状,均匀地铺在玻璃板上,铺板厚度约0.25 mm,在烘箱中110 °C下活化30 min,展开剂为甲苯∶氯仿∶丙酮(40∶25∶35),点样量为2 μl[8]。用显微熔点仪测定中间体的熔点。j52'hd, 百拇医药
1.2.3 抗血清的制备:选取雄性长耳白兔,随机分成2组。第一次基础免疫时,将抗原(QU-HS-BSA)加入0.5 ml生理盐水和0.5 ml FCA,在无菌条件下,用两支注射器来回抽拉制成乳剂,在兔的背部皮下多点注射(约15点)。以后每隔10 d加强免疫1次,取0.25 mg抗原,溶于0.25 ml生理盐水和0.25 ml FIA,制成乳剂,在兔的腿部肌肉注射[9]。如此反复加强免疫6次,其后再隔20 d免疫1次,共免疫2次,最后1次加强免疫后的第10 d,从动脉取血,采集血清,于-20 °C冰箱保存[9]。j52'hd, 百拇医药
1.2.4 抗体的鉴定和纯化j52'hd, 百拇医药
1.2.4.1 ELISA基本条件的建立:用盒子滴定的方法优化包被抗原和抗血清稀释度(工作浓度);以QU-HS-OVA作为包被抗原。ELISA程序参见文献[9]。j52'hd, 百拇医药
1.2.4.2 抗体的亲合性和特异性:根据参考文献[9]对槲皮素的类似物及银杏叶中常见成分进行交叉反应测定。j52'hd, 百拇医药
1.2.4.3 抗体的纯化:首先将抗血清用饱和硫酸铵沉淀法粗提和浓缩,再进一步用DEAE-纤维素柱层析纯化,测定浓度后,在—20 °C下分装、冻存。j52'hd, 百拇医药
2 结果j52'hd, 百拇医药
2.1 半抗原及载体复合物的定性鉴定
2.1.1 红外光谱定性分析:红外光谱分析显示,中间体 QU-HS所具有的特征峰与Quercetin标准吸收峰有所不同,在1 720 cm-1、1 700 cm-1、1 640 cm-1(C=0)有伸缩振动,820 cm-1(苯环C-H),3 450 cm-1羧酸类游离羟基(-OH),1 610 cm-1、1 560 cm-1(苯核)存在。说明含有羧酸基团的中间化合物产生,而且基本结构没有破坏,而在QU-HS-BSA的红外图谱中,1 720 cm-1,1 640cm-1消失,1 650 cm-1(-CO-N)产生吸收峰,证明-COOH与蛋白质中-NH2的结合,1 750 cm-1说明链状饱和酯链存在,1 580 cm-1、1 505 cm-1、770 cm-1说明苯核结构的存在。QU-HS-OVA红外光谱分析表明:1 740 cm-1有链状饱和酯存在,1 640 cm-1、1 650 cm-1表明(-CO-N)存在。%z|;, http://www.100md.com
2.1.2 熔点分析:显微熔点仪测定表明,中间体 QU-HS的熔点mp为134~136 °C,在此温度范围内,中间体全部熔为棕色液体,据文献报道,quercetin的熔点为312~316 °C,当quercetin全乙酰化时,熔点为193.5 °C,全甲基化时,熔点为151~152 °C,琥珀酸酐熔点为119.6 °C,由此可以初步判断,槲皮素与琥珀酸酐反应的产物是一种新化合物。%z|;, http://www.100md.com
2.1.3 薄层层析及紫外光谱分析:TLC分析表明,在λ=250 nm紫外灯下观察,quercetin的迁移率Rf=0.35,而QU-HS的迁移率Rf=0.32。紫外光谱分析测得QU∶BSA的偶联率为20.96∶1(在λ=280 nm)。%z|;, http://www.100md.com
2.2 抗体的制备与鉴定%z|;, http://www.100md.com
2.2.1 抗体的制备:从1998年9月24日开始基础免疫到11月22日,用双向琼脂扩散试验(DADT)法检查发现,用QU-HS-BSA免疫的3只大耳白兔中,2只已产生抗血清,而且观察到抗血清与BSA产生的沉淀线和抗血清与QU-HS-BSA产生的沉淀线形成分叉(见图1)。在免疫双扩散中,置于相邻两孔中的两种抗原与第3孔扩散的抗体反应,形成一条连续的沉淀线并交叉,表明两种抗原相关,但不相同。DADT结果表明;抗血清中含有抗载体蛋白BSA的抗体和抗半抗原分子槲皮素特异的抗体,当进一步加强免疫至1999年2月1日时,抗血清效价达1∶32。

图1双向琼脂扩散试验+[;q(, http://www.100md.com
Fig 1Double agar diffusion test+[;q(, http://www.100md.com
①②③:BSA;④⑤⑥:QU-HS-BSA;⑦:Ab+[;q(, http://www.100md.com
2.2.2 理想的包被抗原浓度及抗体浓度的筛选与鉴定:试验表明,当包被抗原QU-HS-OVA浓度为400 ng/ml,相应抗血清工作浓度为1∶1 600时,零对照OD值与5 ng/ml最小抑制的OD值差异最大,且曲线的倾斜度最大,线性关系较好(r=-0.983 7),因此,理想的包被抗原浓度为400 ng/ml(见表1)。不同抗体稀释倍数测定的曲线比较,1∶1 600倍稀释的抗体,使零抑制与最小抑制间的OD值差异最大,且曲线的倾斜度最大,因此,宜用1∶1 600的抗血清作槲皮素的ELISA(见表2)。试验表明:槲皮素的检测范围为0.5~50 ng,批内变异系数为5.46%,批间变异系数为9.38%。+[;q(, http://www.100md.com
表1 不同包被抗原浓度的吸光度的比较+[;q(, http://www.100md.com
Tab 1 Comparison of the absorbance (OD) of the different antigen coating concentration antigen coating+[;q(, http://www.100md.com
concentration (ng/ml)+[;q(, http://www.100md.com
Ig[QU](ng/ml)+[;q(, http://www.100md.com
0+[;q(, http://www.100md.com
0.7+[;q(, http://www.100md.com
1.0+[;q(, http://www.100md.com
2.0+[;q(, http://www.100md.com
2.4+[;q(, http://www.100md.com
2.7+[;q(, http://www.100md.com
1 000+[;q(, http://www.100md.com
0.99+[;q(, http://www.100md.com
0.88+[;q(, http://www.100md.com
0.81
0.66(x8kki, 百拇医药
0.64(x8kki, 百拇医药
0.62(x8kki, 百拇医药
500(x8kki, 百拇医药
0.95(x8kki, 百拇医药
0.84(x8kki, 百拇医药
0.70(x8kki, 百拇医药
0.63(x8kki, 百拇医药
0.60(x8kki, 百拇医药
0.54(x8kki, 百拇医药
400(x8kki, 百拇医药
0.93(x8kki, 百拇医药
0.82(x8kki, 百拇医药
0.67(x8kki, 百拇医药
0.49(x8kki, 百拇医药
0.42(x8kki, 百拇医药
0.35(x8kki, 百拇医药
300(x8kki, 百拇医药
0.85(x8kki, 百拇医药
0.78(x8kki, 百拇医药
0.57(x8kki, 百拇医药
0.47(x8kki, 百拇医药
0.37(x8kki, 百拇医药
0.34(x8kki, 百拇医药
200(x8kki, 百拇医药
0.71(x8kki, 百拇医药
0.63(x8kki, 百拇医药
0.48(x8kki, 百拇医药
0.42(x8kki, 百拇医药
0.31(x8kki, 百拇医药
0.30
表2 不同抗血清稀释度的吸光度的比较6&{{fjm, http://www.100md.com
Tab 2 Comparison of the absorbance (OD) of the different dilution of antiserum dilution of Ab6&{{fjm, http://www.100md.com
Ig[QU](ng/ml)6&{{fjm, http://www.100md.com
06&{{fjm, http://www.100md.com
1.06&{{fjm, http://www.100md.com
2.06&{{fjm, http://www.100md.com
2.46&{{fjm, http://www.100md.com
2.76&{{fjm, http://www.100md.com
1∶8006&{{fjm, http://www.100md.com
0.946&{{fjm, http://www.100md.com
0.866&{{fjm, http://www.100md.com
0.676&{{fjm, http://www.100md.com
0.586&{{fjm, http://www.100md.com
0.526&{{fjm, http://www.100md.com
1∶1 6006&{{fjm, http://www.100md.com
0.856&{{fjm, http://www.100md.com
0.716&{{fjm, http://www.100md.com
0.466&{{fjm, http://www.100md.com
0.396&{{fjm, http://www.100md.com
0.346&{{fjm, http://www.100md.com
1∶3 2006&{{fjm, http://www.100md.com
0.636&{{fjm, http://www.100md.com
0.536&{{fjm, http://www.100md.com
0.396&{{fjm, http://www.100md.com
0.316&{{fjm, http://www.100md.com
0.296&{{fjm, http://www.100md.com
对槲皮素的类似物及银杏叶中含有的主要成分进行交叉反应分析,可知抗血清与异鼠李素的交叉反应为14.26%,而与银杏叶中其它成分的交叉反应接近于0,这可能是异鼠李素与槲皮素结构极其相似所至(见表3)。表3 抗QU-HS-BSA抗血清的交叉反应
Tab 3 Cross-reactivity of anti-QU-HS-BSA antiserum compound\wae@ag, 百拇医药
cross-reaction (%)\wae@ag, 百拇医药
quercertin\wae@ag, 百拇医药
100\wae@ag, 百拇医药
isohamnetin\wae@ag, 百拇医药
14.26\wae@ag, 百拇医药
kaempferol\wae@ag, 百拇医药
0.06\wae@ag, 百拇医药
ginkgolide A\wae@ag, 百拇医药
<0.001\wae@ag, 百拇医药
ginkgolide B\wae@ag, 百拇医药
<0.001\wae@ag, 百拇医药
ginkgolide C\wae@ag, 百拇医药
<0.001\wae@ag, 百拇医药
bilobalide\wae@ag, 百拇医药
<0.001\wae@ag, 百拇医药
solaneaol\wae@ag, 百拇医药
<0.001\wae@ag, 百拇医药
ferulic acid\wae@ag, 百拇医药
<0.001\wae@ag, 百拇医药
3 讨 论 1959年ERLANGER[10]首先将混合酸酐法应用于人工抗原的合成。根据quercetin化学结构中存在活泼C3-OH基团的特点,先将quercetin与琥珀酸酐反应,接上羧基臂,制得中间体QU-HS,然后将QU-HS与BSA通过酰胺键相连,生成QU-HS-BSA蛋白结合物。此法的优点是QU-HS中间体合成条件比较温和,产物容易得到。采用混合酸酐法形成酰胺键,反应专属性高,而且可以在低温下进行,避免了蛋白质发生变性反应。反应中加入三正丁胺作为缚酸剂,对羧酸中的-OH起到束缚作用。反应产物中,除QU-HS-BSA是大分子外,其余产物为低分子乙醇和CO2气体,经过离心、透析和柱层析等方式,可以将QU-HS-BSA分离出来,从而达到纯化的目的。
采用混合酸酐法合成抗原,前人多采用氯甲酸异丁酯作反应介质[10],国内外还未见用氯甲酸乙酯进行反应的报道。从理论上分析,该反应是利用氯甲酸乙酯中的(O- CO -Cl)键与羧酸发生酰卤反应,此反应十分剧烈,一般在低温下进行,而(O- CO -Cl)的另一端是异丁基还是乙基对反应本身来讲,并不是关键的因素。本试验结果表明:用廉价、易得的氯甲酸乙酯用于混合酸酐反应是可行的。n, http://www.100md.com
当抗原合成后,单纯用化学方法定性鉴定小分子与载体蛋白质共价结合,并不能表明此抗原免疫动物就一定能产生出合格的抗体。前人研究表明[9]:凡是分子中环状结构较多的,免疫原性必定较强。在水中溶解性较小的抗原,其免疫原性也较大。特异性抗体能否形成,还与动物的种类、年龄、性别、免疫程序有关,抗原的免疫原性还与半抗原与载体蛋白的偶联率的大小和半抗原蛋白结合物的分子结构有关。本试验以QU-HS-BSA作免疫原,制备抗血清。其中QU∶BSA偶联率为20.96∶1,符合一般的比例要求[6]。从分子结构上看,槲皮素包含呋喃色原酮的复杂化学结构,因而为抗体的产生提供了结构基础。n, http://www.100md.com
本课题通过槲皮素人工抗原的构建和免疫学试验,制备了针对槲皮素的多克隆抗体,这对于开发银杏等药用植物资源和开辟药用成分检测的新途径是一次新尝试。n, http://www.100md.com
[基金项目] 湖北省重点资助科技基金项目(98190802)n, http://www.100md.com
[作者简介] 姜 玲(1964-),女,湖北武汉市人,副教授,博士,主要从事生物技术与育种及免疫学方面的研究。n, http://www.100md.com
[参考文献]n, http://www.100md.com
[1] ROBINS RJ,MORGAN MRA,RHODES MJC,et al. Determination of guassin in picogram quantities by and enzyme-linked immunosorbent assay [J]. Phytochemistry,1984,23(5):1 119-1 123.n, http://www.100md.com
[2] LAPINJOKI S,VERAJANKOEVA H,HEISKANEN J,et al. Immunoanalytical methods for screening vindoline from catharanthus roseus cell culture [J]. Planta Medica,1987,53(6):565-567.
[3] YAMAMOTO Y,KINOSHITA Y,WATANABE S. Anthoyanin production in suspension cultures of high-producing cells of Euphoria millii [J]. Agric Biol Chem,1989,53(2):417-423.\|l, 百拇医药
[4] JOURDAN PS,MANSELL RL,OLIVER DG,et al. Competitive solid phase enzyme-linked immunoassay for the quantification of limonin in citrus[J]. Ana Biochem,1984,138(1):19-24.\|l, 百拇医药
[5] 刘室金,孙惠兰,李俊宝,等.兽医免疫学实验指导[M].上海:上海科学技术出版社,1985.74-82.\|l, 百拇医药
[6] ROBINS RJ. The measurement of low-molecular-weight,non-immunogenic compounds by immunoassay [M].In:LINSKENS HF,eds.Immunology in plant sciences. Berlin:Springer-Verlag,1986.86-108.\|l, 百拇医药
[7] 徐如涓,季本仁,段金玉. 玉米素核苷的酶标免疫测定法[J].云南植物研究,1986,8(3):333-342.\|l, 百拇医药
[8] HORHAM L,WAGNEK H,HEIN K.Kieselgel dunnschichtchromatographie von flavonoiden of chromatog[J].J Chroma,1964,13(1):235-237.\|l, 百拇医药
[9] 李宗霆,周 燮.植物激素及其免疫检测技术[M].江苏:江苏科学技术出版社,1996.250-298.\|l, 百拇医药
[10] ERLANGER BE;BOREK F,BEISER SM,et al. Steroid-protein conjugates [J].J Biol Chem,1959,234(5):1 090-1 094.\|l, 百拇医药
[收稿日期] 2000-01-27; [修回日期] 2000-05-04(姜玲 章文才 柯云 马湘涛)