薄基底膜肾病的分子遗传学
作者:张承英
单位:北京医科大学第一医院肾内科 北京,100034
关键词:薄基底膜肾病;胶原;基底膜
肾脏病与透析肾移植杂志 CHINESE JOURNAL OF NEPHROLOGY DIALYSIS张承英 综述 朱世乐 审校
薄基底膜肾病(thin basement membrane nephropathy,TBMN)是以持续性镜下血尿为主要表现的一种遗传性肾病,因其呈家族遗传,预后良好,又称之为良性家族性血尿(benign familiar hematuria,BFH)或良性再发性血尿(benign recurrent hematuria,BRH)。国外于六十年代中期由MeConville[1]首先报道此病,国内1990年由章友康[2]首先报道。最近的研究表明TBMN是由编码Ⅳ型胶原α4链的COL4A4基因突变所致[3],已分离到了编码Ⅳ型胶原α4链的cDNA克隆,并将COL4A4基因定位于2q35~37[4,5],但COL4A4基因的确切外显子数目前尚不清楚,免疫组化研究发现TBMN肾小球基底膜(GBM)Ⅳ型胶原α链分布正常,可能携带的突变不能影响Ⅳ型胶原三螺旋结构的形成[6]。
, http://www.100md.com
1 薄基底膜肾病的临床特征
TBMN是以持续性镜下血尿为主要表现的一种遗传性肾病,其预后良好,不伴眼,耳疾患。肾活检电镜检查肾小球基底膜(GBM)弥漫性变薄为该病唯一重要的病理特征[7]。TBMN主要以常染色体显性方式遗传。关于其发病率,报道不一,荷兰Tiebosch统计TBMN的发病率为19/106,英国Dische[8]通过对76例移植肾的肾活检检查估计该病 在全部人口的发病率约为5.2%~9.2%(5~7/76)。澳大利亚Kincaid-Smith[9]认为以尿红细胞计数为判断标准,镜下血尿约占澳大利亚墨尔本人群中的6%,而薄基底膜肾病又占镜下血尿患者的50%,故推测薄基底膜肾病约占正常人群的3%,国内尚无人群发病率的确切统计,但国内的研究显示TBMN占肾活检患者的3.7%,占单纯性血尿肾活检患者的11%[10]。目前关于诊断TBMN患者GBM的确切厚度尚无统一标准,Van Breda Vriesman[11]测定荷兰TBMN患者GBM的平均厚度为191±28 nm,国内章友康等[10]测定的TBMN患者GBM的平均厚度为207±36 nm,建议采用小于或等于正常肾小球或非TBMN的原发性肾小球肾炎患者GBM厚度的均值减去三倍标准差( -3s)为TBMN的诊断标准,并认为符合下例标准者TBMN诊断成立:①临床,实验室检查(包括可疑患者的电测听和眼科检查)和病理学改变排除继发性肾小球疾病,泌尿外科疾病和Alport综合征(AS)以及原发性肾小球疾病者;②GBM变薄范围≥80%;③GBM的平均厚度≤280 nm(对照组GBM厚度的均值减去3倍标准差为限)。
-3s)为TBMN的诊断标准,并认为符合下例标准者TBMN诊断成立:①临床,实验室检查(包括可疑患者的电测听和眼科检查)和病理学改变排除继发性肾小球疾病,泌尿外科疾病和Alport综合征(AS)以及原发性肾小球疾病者;②GBM变薄范围≥80%;③GBM的平均厚度≤280 nm(对照组GBM厚度的均值减去3倍标准差为限)。
, 百拇医药
2 Ⅳ型胶原
TBMN主要表现为GBM弥漫性变薄,Ⅳ型胶原是哺乳动物基底膜的主要结构成份,Ⅳ型胶原是由3条α链形成的一种厚约400 nm的三螺旋网状结构[12]。目前已知构成Ⅳ型胶原的α链有6种(α1~6),这6种α链可形成不同的三聚体,其α1(Ⅳ)2α2是最常见的分子形式[13]。6种α链的序列已完全清楚,它们是高度同源的,根据它们的同源性可以把它们分成α1和α2两类,α1类包括α1,α3和α5;α2类包括α2,α4和α6,α链分子大小约170 000~185 000,由三个完全不同的结构域组成,即C末端非胶原区(NC1),7S区和N末端胶原区,C末端NC1区由230个氨基酸(aa)组成,形成一个大的球状结构,并含有12个完全保守的半胱氨酸残基,这些半胱氨酸参与了链内和链间二硫键的形成,从果蝇到人,所有的Ⅳ型胶原α链中60%的NC1区是保守的,这种高度的保守性说明任何α链的NC1区都具有某种功能。胶原区由1400个aa残基构成,内含G1y-X-Y重复序列,并且被非胶原序列打断了21~23次,这些非胶原序列的打断赋予Ⅳ型胶原分子高度的柔韧性,由于甘氨酸是分子量最小的一种aa,是唯一一个能够进入Ⅳ型胶原三螺旋结构中心的aa,α链胶原区每三个aa就有一个甘氨酸重复序列的出现对维持Ⅳ型胶原三螺旋结构的稳定性是很重要的,N末端7S区由15个aa残基组成[12~15]。
, http://www.100md.com
Ⅳ型胶原三螺旋单体通过头对头(end to end),边对边(side to side)的方式自我缔合形成网状的超微结构。N末端7S区以平行或反平行方式相距30 nm通过侧方之间的相互作用形成四聚体,C末端球状的NC1区通过头与头之间的相互作用形成二聚体。这两种作用方式都可通过链间二硫键的共价作用而得到加强。通过Ⅳ型胶原三螺旋结构的相互缠结以及NC1区与胶原三螺旋结构之间的连接而形成了Ⅳ型胶原的超螺旋结构(图1)。NC1区控制了Ⅳ型胶原单体的自我缔合,NC1区在不同种族之间是高度保守的,含有两个同源的亚区,每个亚区在同一位置含有6个半胱氨酸残基,这12个半胱氨酸形成了6个二硫键而使NCl区形成2个对称的三叶草状结构(图2)[16]。
图1 Ⅳ型胶原分子相互缔合的模式图
, 百拇医药
构成Ⅳ型胶原的6种不同α链的分布也是不同的。α1和α2存在于所有的基底膜,在肾内,α3和α4分布相同,均位于GBM,TBM,而系膜基质区没有α3和α4的分布。α5,α6分布于GBM,肾小球囊。在肾内,α1和α2主要位于GBM,系膜基质,血管和肾小管基底膜,α3和α4还存在于突触肌纤维,而在突触外肌纤维如中枢和周围神经中不存在,α1和α2在这些部位均存在,但在突触基底膜含量少,α1,α2,α3和α4在晶体囊基底膜和主动脉基底膜分布均很少,在肾外,α5和α6还分布于皮肤,骨骼肌,平滑肌,心肌和肝脏[17~21]。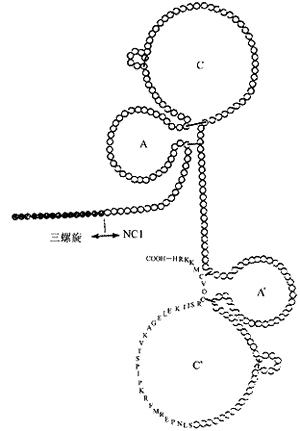
图2 C末端非胶原区(NC1)结构示意图
6种二硫键使非胶原区形成一种对称的三叶草状结构
, http://www.100md.com
3 Ⅳ型胶原α链基因
编码Ⅳ型胶原α链的基因以一种独特的头对头的方式成对地位于3条不同的染色体上,其中α1和α2位于13号染色体[22],α3和α4位于2号染色体[5],而α5和α6位于X染色体[23,24]。每一个基因3′末端的5个外显子编码C末端非胶原区,而剩余的大部分外显子编码胶原区。
每一对基因的5′端彼此相互邻近,被不同长度的具有转录活性的序列所分开。基因以反方向转录,控制COL4A1/COL4A2转录的操纵子已被广泛鉴定,由两个反方向起作用的启动子组成。这个区域含有3种功能蛋白结合位点,包括一个被命名为CTC盒的新的序列[25,26],同CTC盒相似的的序列也出现在其它编码EMC蛋白的基因的5′侧翼区,包括层粘连蛋白B1(β1),B2(γ1)和纤维连接蛋白,提示EMC基因活性的调节可能是在常见的转录因子或者转录因子家族的控制下[27]。每一个基因的第一个内/外显子边缘区域的激活部位对转录COL4A1和COL4A2都是必需的[28]。对COL4A1和COL4A2转录有抑制作用的一个位于COL4A2基因第3个内含子的序列最近已有研究[29]。COL4A1和COL4A2在产生Ⅳ型胶原细胞转录的效率可以反映启动子和沉默子活性的相应水平(图3)[13]。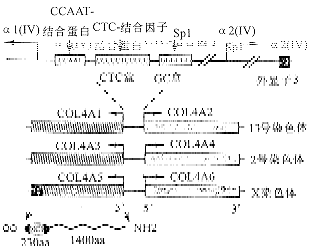
, http://www.100md.com
图3 分别位于13号,2号和X染色体上的6种Ⅳ型胶原α基因以及COL4A1和COL4A2基因活性的调节序列和与这些部位结合的转录因子
目前对于COL4A3/COL4A4和COL4A5/COL4A6基因的调节因素有了一些了解,对鼠基因的研究表明COL4A3和COL4A4基因的启动元件从两个方向启动,然而人同鼠的COL4A1和COL4A2启动序列只有很少的同源性[30]。同COL4A1/COL4A2一样,介于COL4A5和COL4A6之间的基因内区域也含有一个CTC盒。COL4A6基因以一种组织特异性方式从2个相应的启动子转录,产生2个不同的转录产物[31]。COL4A6是唯一以此种方式转录的Ⅳ型胶原基因类型。
α3链例外,相应的剪接似乎在决定不同部位Ⅳ型胶原结构时并不起重要的作用。α3(Ⅳ)前mRNA的相应剪接至少产生6种C末端不同的转录产物,形成5种不同的蛋白[32]。α3前mRNA相应剪接的功能重要性目前尚不清楚。
, http://www.100md.com
4 薄基底膜肾病的免疫病理
多数TBMN患者肾活检标本免疫荧光检查阴性,少数患者在系膜区有微量免疫球蛋白和补体C3沉积,提示免疫因素在该病的发生中不起主要作用。早年的研究表明抗GBM抗体可与TBMN患者的GBM相结合,而不能与AS患者的GBM结合,利用抗GBM抗体可以鉴别TBMN和AS[33]。1997年Smeets[6]又用α链特异的单克隆抗体对TBMN患者的GBM进行了间接免疫荧光研究,结果表明TBMN患者GBM上Ⅳ胶原α链分布正常,与正常人群没有明显差异。
5 由COL4A4基因突变所引起的薄基底膜肾病
TBMN和AS均是以持续性镜下血尿为主要表现的两种遗传性肾病,AS的超微结构特征为GBM不规则变薄增厚,撕裂,分层等。AS在发病早期也可以表现为GBM弥漫性变薄,从临床上很难与TBMN鉴别[34]。目前已经发现X连锁的AS是由COL4A5基因突变引起,常染色体显性和隐性遗传的AS是由COL4A3和COL4A4基因突变引起[35,36]。Reeders和Kashgarian认为TBMN和AS均是由Ⅳ型胶原的突变所引起,一些突变引起了TBMN,另外一些突变引起了AS。突变的性质以及其它一些因素共同作用决定了疾病的进展程度。如果在某个特定的时间进行肾活检,在同一个肾脏上可以同时看到弥漫性变薄和撕裂,分层两种病理改变。TBMN和AS可能是同一种疾病的两种不同病理类型[37]。1996年Lemmink用基因连锁分析的方法对一荷兰家系进行了研究,结果表明TBMN与位于2q35-37的COL4A3和COL4A4基因连锁,同时在COL4A4基因上发现了一由G→A(甘aa→谷aa)的点突变,首次证明常染色体显性遗传的TBMN是由COL4A4基因突变引起,常染色体显性遗传的TBMN可能是常染色体隐性遗传的AS的杂合突变型。甘氨酸是分子量最小的足以进入Ⅳ型胶原三螺旋结构中心的一种aa,在Ⅳ型胶原α链胶原区的基本序列中,每三个aa就存在一个甘氨酸,如果甘氨酸被体积更大的aa如谷氨酸代替,将破坏Ⅳ型胶原三螺旋结构的稳定性,最终使GBM发生改变[3]。
, 百拇医药
参考文献
1 McConcille JM,West CD,McAdams AJ et al. Familiar and nonfamiliar benign hematuria. J Pediatr, 1966;69:209
2 章友康.血尿,肾功能良好和阳性家族史-国内首例薄基底膜肾病报告.中华肾脏病杂志,1990;6:375
3 Lemmink HH, Nillesen WN, Mochiznki T et al. Benign familiar hematuraia duo to mutation of the type Ⅳ collagen α4 gene. J Clin Invest, 1996;98:1114
4 Sugimoto M, Oohashi T, Yoshioka H et al. cDNA isolation and partial gene structure of the human α4(Ⅳ) collagen chain. FEBS, 1993;330:122
, http://www.100md.com
5 Mariyama M, Zheng K, Yang-Feng TL et al. Colocalization of the genes for the α3(Ⅳ) and α4(Ⅳ)chains of type Ⅳ collagen to chromosome 2 bands q35-37. Genomics, 1992;13:809
6 Smeets HJM, Vanderloop FTL, Timmer EDJ et al. Immunohistochemical analysis of basement membrane in patients with Alport syndrome and benign familiar hematuria(abstract). Am J Hum Genetics, 1997;61:347
7 章友康,王海燕,邹万忠等.薄基底膜肾病-附8例分析.中华内科杂志,1992;31:167
, 百拇医药
8 Dische FE, Andesen VER, Keane SJ et al. Incidence of thin membrane nephropathy: morphomeric investigation of a pupulation sample. J Clin Pathol,1990;43:457
9 Kincaid Smith P. Thin basement mebrane disease. In: Massry SG, Glassock RJ. Eds. Textbook of nephrology. Vol:1,3rd ed. Balimore: Williams & Wilkins, 1995:760~764
10 章友康,周 蓉,王素霞等.薄基底膜肾病27例研究.中华内科杂志,1997;36:736
11 Van Breda Vriesman PJC. Thin basement membrane nephropathy in adults. Nephron, 1998;79:1
, 百拇医药
12 Hudson BG, Reeder ST, Tryggvason K et al.Type Ⅳ collagen: structure, gene organization and role in Human disease. J Biol Chem, 1993;268:26033
13 Timpl R. Structure and biological activity of basement proteins. Eur J Biochem, 1989;180:487
14 Kashtan CE, Michael AF. Alport syndrome. Kidney Int, 1996;50:1445
15 Tryggvason K, Zhou J, Hostikka SL et al. Molecular genetics of Alport syndrome. Kidney Int, 1993;43:38
, 百拇医药
16 Weber M, Marx M, Merkel F. Goodpasture syndrome. In:Schlondorff D eds.Molecular nephrology kidney function in health and disease.New York:Marcel Dekker,1995:809-820
17 Mounier F, Gros F, Wieslander J et al. Glomerular distribution of M1 and M2 subunits of the globular domain of the basement membrane collagen: An immunohistochemical study, In:Progress in Basement membrane Research, Renal and Rlated Aspects in Heaslth and Disease. edited by Gubler MC, Sternberg M.London,Paris:John Libbey Eurotext 1988:53-59
, 百拇医药
18 Desjardins M, Gros F, Wieslander J et al. Heterogeneous distribution of monometric elements from the globular domain(NCI) of type Ⅳ collagen in renal basement as revealed by high resolution puantitive immunohistochemistry. Lab Invest, 1990;63:637
19 Butkowski RJ, Wieslander J, Kleppel MM et al. Basement membrane collagen on the kidney: Regional cocalization of novel chains related to collagen Ⅳ. Kidney Int,1989,35:1195
20 Keppel MM, Santi PA, Cameron JD et al. Human tissue distribution of novel basement membrane collagen. Am J Pathol, 1989;134:813
, http://www.100md.com
21 Ninomiya Y, Kagawa M, Iyama K et al. Differential expression of two basement membrane collagen genes COL4A6 and COL4A5, demonstrated by immunofluorescence staining using peptide-specific monoclonal antibodies. J Cell Biol, 1995;130:1219
22 Boyd CD, Toth-Fejel S, Gadi IK et al. The genes coding for human pro alpha1(Ⅳ) and pro alpha 2(Ⅳ) collagen are both located at the end of the long arm of chromosome 13. Am J Hum Genet, 1988;42:309
, 百拇医药
23 Myers JC. Jones TA, Pohjolainen ER et al. Molecular cloning of α5(Ⅳ) collagen and assignment of the gene to the region of the X chromosome containing the Alport syndrome locus. Am J Hum Genet, 1990;46:1029
24 Hostikka SL, Eddy RL, Byers MG et al. Identification of a distinct type Ⅳ collagen α chain with restricted kidney distribution and assignment of its gene to locus of X chromosome-linked Alport syndrome. Proc Natl Acad Sci USA, 1990;87:1606
, http://www.100md.com
25 Fischer G, Schmidt C, Opitz J et al. Identification of a novel sequence element in the common promoter region of human collagen typeⅣ genes, involved in the regulation of divergent transcription. Biochem J, 1993;229:687
26 Schmidt C, Pollner R, Poschl E et al. Expression of human collagen type Ⅳ genes is regulated by transcriptional and posttranscriptinal mechanism. FEBS Lett, 1992;312:174
27 Bruggeman LA, Burbelo PD, Yamada Y et al. A novel sequence in the type Ⅳ collagen promoter binds nuclear proteins from Engelbreth-Holm-Swarm tumer. Oncogene, 1992;7:1497
, http://www.100md.com
28 Posch1 E, Pollner R, Kuhn K et al. The genes for the α1(Ⅳ) and α2(Ⅳ) chains of human basement membrane collagen type Ⅳ are arranged head-to-head and separated by a bidirectional promoter of unique structure. EMBO J, 1988;7:2678
29 Haniel A, Welge-Luben U, Kuhn K et al. Identification and characterization of a novel transcriptional silencer in the human collagen type Ⅳ gene COL4A2. J Biol Chem, 1995;270:11209
30 Hlaing T, Funabiki K, Togawa M et al. Molecular cloning of the murine α3(Ⅳ) and α4(Ⅳ) collagen promoter(abstract). J Am Soc Nephrol, 1994;5:625
, 百拇医药
31 Sugimeto M, Oohashi T, Ninomiya Y et al. The genes COL4A5 and COL4A6, coding for basement membrane collagen chains α5(Ⅳ) and α6(Ⅳ), are locuted head-to-head in close proximity on human chromosome Xq22 and COL4A6 is transcribed from two alternatived promoters. Proc Natrl Acad Sci USA,1994;91:11679
32 Penades JR, Bernal D, Revert F et al. Characterization and expression of multiple alternatively spliced transcripts of the Goodpasture antigen gene region. Eur J Biochem, 1995;229:754
, 百拇医药
33 Jenis E, Valeski J, Caleagno P. Vaviability of anti-GBM binding in hereditary nephritis. Clin Nephrol, 1981;15:111
34 谌贻璞,邹万忠,徐世全等.遗传性进行性肾炎-11个家系及2例肾活检报告.中华内科杂志,1982;21:587
35 Barker DF, Hostikka SL, Zhou J et al. Identification of mutations in the COL4A5 gene in Alport syndrome. Science, 1990;248:1224
36 Mochizuki T, Lemmink HH, Mariyama M et al. Identification of mutation in the α3(Ⅳ) and α4(Ⅳ) collagen genes in autosomal recessive Alport syndrome. Nature Genet, 1994;8:77
37 Reeders ST. Molecular genetics of hereditary nephritis. Kidney Int, 1992;42:783
收稿日期:1998-12-08, 百拇医药
单位:北京医科大学第一医院肾内科 北京,100034
关键词:薄基底膜肾病;胶原;基底膜
肾脏病与透析肾移植杂志 CHINESE JOURNAL OF NEPHROLOGY DIALYSIS张承英 综述 朱世乐 审校
薄基底膜肾病(thin basement membrane nephropathy,TBMN)是以持续性镜下血尿为主要表现的一种遗传性肾病,因其呈家族遗传,预后良好,又称之为良性家族性血尿(benign familiar hematuria,BFH)或良性再发性血尿(benign recurrent hematuria,BRH)。国外于六十年代中期由MeConville[1]首先报道此病,国内1990年由章友康[2]首先报道。最近的研究表明TBMN是由编码Ⅳ型胶原α4链的COL4A4基因突变所致[3],已分离到了编码Ⅳ型胶原α4链的cDNA克隆,并将COL4A4基因定位于2q35~37[4,5],但COL4A4基因的确切外显子数目前尚不清楚,免疫组化研究发现TBMN肾小球基底膜(GBM)Ⅳ型胶原α链分布正常,可能携带的突变不能影响Ⅳ型胶原三螺旋结构的形成[6]。
, http://www.100md.com
1 薄基底膜肾病的临床特征
TBMN是以持续性镜下血尿为主要表现的一种遗传性肾病,其预后良好,不伴眼,耳疾患。肾活检电镜检查肾小球基底膜(GBM)弥漫性变薄为该病唯一重要的病理特征[7]。TBMN主要以常染色体显性方式遗传。关于其发病率,报道不一,荷兰Tiebosch统计TBMN的发病率为19/106,英国Dische[8]通过对76例移植肾的肾活检检查估计该病 在全部人口的发病率约为5.2%~9.2%(5~7/76)。澳大利亚Kincaid-Smith[9]认为以尿红细胞计数为判断标准,镜下血尿约占澳大利亚墨尔本人群中的6%,而薄基底膜肾病又占镜下血尿患者的50%,故推测薄基底膜肾病约占正常人群的3%,国内尚无人群发病率的确切统计,但国内的研究显示TBMN占肾活检患者的3.7%,占单纯性血尿肾活检患者的11%[10]。目前关于诊断TBMN患者GBM的确切厚度尚无统一标准,Van Breda Vriesman[11]测定荷兰TBMN患者GBM的平均厚度为191±28 nm,国内章友康等[10]测定的TBMN患者GBM的平均厚度为207±36 nm,建议采用小于或等于正常肾小球或非TBMN的原发性肾小球肾炎患者GBM厚度的均值减去三倍标准差(
, 百拇医药
2 Ⅳ型胶原
TBMN主要表现为GBM弥漫性变薄,Ⅳ型胶原是哺乳动物基底膜的主要结构成份,Ⅳ型胶原是由3条α链形成的一种厚约400 nm的三螺旋网状结构[12]。目前已知构成Ⅳ型胶原的α链有6种(α1~6),这6种α链可形成不同的三聚体,其α1(Ⅳ)2α2是最常见的分子形式[13]。6种α链的序列已完全清楚,它们是高度同源的,根据它们的同源性可以把它们分成α1和α2两类,α1类包括α1,α3和α5;α2类包括α2,α4和α6,α链分子大小约170 000~185 000,由三个完全不同的结构域组成,即C末端非胶原区(NC1),7S区和N末端胶原区,C末端NC1区由230个氨基酸(aa)组成,形成一个大的球状结构,并含有12个完全保守的半胱氨酸残基,这些半胱氨酸参与了链内和链间二硫键的形成,从果蝇到人,所有的Ⅳ型胶原α链中60%的NC1区是保守的,这种高度的保守性说明任何α链的NC1区都具有某种功能。胶原区由1400个aa残基构成,内含G1y-X-Y重复序列,并且被非胶原序列打断了21~23次,这些非胶原序列的打断赋予Ⅳ型胶原分子高度的柔韧性,由于甘氨酸是分子量最小的一种aa,是唯一一个能够进入Ⅳ型胶原三螺旋结构中心的aa,α链胶原区每三个aa就有一个甘氨酸重复序列的出现对维持Ⅳ型胶原三螺旋结构的稳定性是很重要的,N末端7S区由15个aa残基组成[12~15]。
, http://www.100md.com
Ⅳ型胶原三螺旋单体通过头对头(end to end),边对边(side to side)的方式自我缔合形成网状的超微结构。N末端7S区以平行或反平行方式相距30 nm通过侧方之间的相互作用形成四聚体,C末端球状的NC1区通过头与头之间的相互作用形成二聚体。这两种作用方式都可通过链间二硫键的共价作用而得到加强。通过Ⅳ型胶原三螺旋结构的相互缠结以及NC1区与胶原三螺旋结构之间的连接而形成了Ⅳ型胶原的超螺旋结构(图1)。NC1区控制了Ⅳ型胶原单体的自我缔合,NC1区在不同种族之间是高度保守的,含有两个同源的亚区,每个亚区在同一位置含有6个半胱氨酸残基,这12个半胱氨酸形成了6个二硫键而使NCl区形成2个对称的三叶草状结构(图2)[16]。

图1 Ⅳ型胶原分子相互缔合的模式图
, 百拇医药
构成Ⅳ型胶原的6种不同α链的分布也是不同的。α1和α2存在于所有的基底膜,在肾内,α3和α4分布相同,均位于GBM,TBM,而系膜基质区没有α3和α4的分布。α5,α6分布于GBM,肾小球囊。在肾内,α1和α2主要位于GBM,系膜基质,血管和肾小管基底膜,α3和α4还存在于突触肌纤维,而在突触外肌纤维如中枢和周围神经中不存在,α1和α2在这些部位均存在,但在突触基底膜含量少,α1,α2,α3和α4在晶体囊基底膜和主动脉基底膜分布均很少,在肾外,α5和α6还分布于皮肤,骨骼肌,平滑肌,心肌和肝脏[17~21]。

图2 C末端非胶原区(NC1)结构示意图
6种二硫键使非胶原区形成一种对称的三叶草状结构
, http://www.100md.com
3 Ⅳ型胶原α链基因
编码Ⅳ型胶原α链的基因以一种独特的头对头的方式成对地位于3条不同的染色体上,其中α1和α2位于13号染色体[22],α3和α4位于2号染色体[5],而α5和α6位于X染色体[23,24]。每一个基因3′末端的5个外显子编码C末端非胶原区,而剩余的大部分外显子编码胶原区。
每一对基因的5′端彼此相互邻近,被不同长度的具有转录活性的序列所分开。基因以反方向转录,控制COL4A1/COL4A2转录的操纵子已被广泛鉴定,由两个反方向起作用的启动子组成。这个区域含有3种功能蛋白结合位点,包括一个被命名为CTC盒的新的序列[25,26],同CTC盒相似的的序列也出现在其它编码EMC蛋白的基因的5′侧翼区,包括层粘连蛋白B1(β1),B2(γ1)和纤维连接蛋白,提示EMC基因活性的调节可能是在常见的转录因子或者转录因子家族的控制下[27]。每一个基因的第一个内/外显子边缘区域的激活部位对转录COL4A1和COL4A2都是必需的[28]。对COL4A1和COL4A2转录有抑制作用的一个位于COL4A2基因第3个内含子的序列最近已有研究[29]。COL4A1和COL4A2在产生Ⅳ型胶原细胞转录的效率可以反映启动子和沉默子活性的相应水平(图3)[13]。

, http://www.100md.com
图3 分别位于13号,2号和X染色体上的6种Ⅳ型胶原α基因以及COL4A1和COL4A2基因活性的调节序列和与这些部位结合的转录因子
目前对于COL4A3/COL4A4和COL4A5/COL4A6基因的调节因素有了一些了解,对鼠基因的研究表明COL4A3和COL4A4基因的启动元件从两个方向启动,然而人同鼠的COL4A1和COL4A2启动序列只有很少的同源性[30]。同COL4A1/COL4A2一样,介于COL4A5和COL4A6之间的基因内区域也含有一个CTC盒。COL4A6基因以一种组织特异性方式从2个相应的启动子转录,产生2个不同的转录产物[31]。COL4A6是唯一以此种方式转录的Ⅳ型胶原基因类型。
α3链例外,相应的剪接似乎在决定不同部位Ⅳ型胶原结构时并不起重要的作用。α3(Ⅳ)前mRNA的相应剪接至少产生6种C末端不同的转录产物,形成5种不同的蛋白[32]。α3前mRNA相应剪接的功能重要性目前尚不清楚。
, http://www.100md.com
4 薄基底膜肾病的免疫病理
多数TBMN患者肾活检标本免疫荧光检查阴性,少数患者在系膜区有微量免疫球蛋白和补体C3沉积,提示免疫因素在该病的发生中不起主要作用。早年的研究表明抗GBM抗体可与TBMN患者的GBM相结合,而不能与AS患者的GBM结合,利用抗GBM抗体可以鉴别TBMN和AS[33]。1997年Smeets[6]又用α链特异的单克隆抗体对TBMN患者的GBM进行了间接免疫荧光研究,结果表明TBMN患者GBM上Ⅳ胶原α链分布正常,与正常人群没有明显差异。
5 由COL4A4基因突变所引起的薄基底膜肾病
TBMN和AS均是以持续性镜下血尿为主要表现的两种遗传性肾病,AS的超微结构特征为GBM不规则变薄增厚,撕裂,分层等。AS在发病早期也可以表现为GBM弥漫性变薄,从临床上很难与TBMN鉴别[34]。目前已经发现X连锁的AS是由COL4A5基因突变引起,常染色体显性和隐性遗传的AS是由COL4A3和COL4A4基因突变引起[35,36]。Reeders和Kashgarian认为TBMN和AS均是由Ⅳ型胶原的突变所引起,一些突变引起了TBMN,另外一些突变引起了AS。突变的性质以及其它一些因素共同作用决定了疾病的进展程度。如果在某个特定的时间进行肾活检,在同一个肾脏上可以同时看到弥漫性变薄和撕裂,分层两种病理改变。TBMN和AS可能是同一种疾病的两种不同病理类型[37]。1996年Lemmink用基因连锁分析的方法对一荷兰家系进行了研究,结果表明TBMN与位于2q35-37的COL4A3和COL4A4基因连锁,同时在COL4A4基因上发现了一由G→A(甘aa→谷aa)的点突变,首次证明常染色体显性遗传的TBMN是由COL4A4基因突变引起,常染色体显性遗传的TBMN可能是常染色体隐性遗传的AS的杂合突变型。甘氨酸是分子量最小的足以进入Ⅳ型胶原三螺旋结构中心的一种aa,在Ⅳ型胶原α链胶原区的基本序列中,每三个aa就存在一个甘氨酸,如果甘氨酸被体积更大的aa如谷氨酸代替,将破坏Ⅳ型胶原三螺旋结构的稳定性,最终使GBM发生改变[3]。
, 百拇医药
参考文献
1 McConcille JM,West CD,McAdams AJ et al. Familiar and nonfamiliar benign hematuria. J Pediatr, 1966;69:209
2 章友康.血尿,肾功能良好和阳性家族史-国内首例薄基底膜肾病报告.中华肾脏病杂志,1990;6:375
3 Lemmink HH, Nillesen WN, Mochiznki T et al. Benign familiar hematuraia duo to mutation of the type Ⅳ collagen α4 gene. J Clin Invest, 1996;98:1114
4 Sugimoto M, Oohashi T, Yoshioka H et al. cDNA isolation and partial gene structure of the human α4(Ⅳ) collagen chain. FEBS, 1993;330:122
, http://www.100md.com
5 Mariyama M, Zheng K, Yang-Feng TL et al. Colocalization of the genes for the α3(Ⅳ) and α4(Ⅳ)chains of type Ⅳ collagen to chromosome 2 bands q35-37. Genomics, 1992;13:809
6 Smeets HJM, Vanderloop FTL, Timmer EDJ et al. Immunohistochemical analysis of basement membrane in patients with Alport syndrome and benign familiar hematuria(abstract). Am J Hum Genetics, 1997;61:347
7 章友康,王海燕,邹万忠等.薄基底膜肾病-附8例分析.中华内科杂志,1992;31:167
, 百拇医药
8 Dische FE, Andesen VER, Keane SJ et al. Incidence of thin membrane nephropathy: morphomeric investigation of a pupulation sample. J Clin Pathol,1990;43:457
9 Kincaid Smith P. Thin basement mebrane disease. In: Massry SG, Glassock RJ. Eds. Textbook of nephrology. Vol:1,3rd ed. Balimore: Williams & Wilkins, 1995:760~764
10 章友康,周 蓉,王素霞等.薄基底膜肾病27例研究.中华内科杂志,1997;36:736
11 Van Breda Vriesman PJC. Thin basement membrane nephropathy in adults. Nephron, 1998;79:1
, 百拇医药
12 Hudson BG, Reeder ST, Tryggvason K et al.Type Ⅳ collagen: structure, gene organization and role in Human disease. J Biol Chem, 1993;268:26033
13 Timpl R. Structure and biological activity of basement proteins. Eur J Biochem, 1989;180:487
14 Kashtan CE, Michael AF. Alport syndrome. Kidney Int, 1996;50:1445
15 Tryggvason K, Zhou J, Hostikka SL et al. Molecular genetics of Alport syndrome. Kidney Int, 1993;43:38
, 百拇医药
16 Weber M, Marx M, Merkel F. Goodpasture syndrome. In:Schlondorff D eds.Molecular nephrology kidney function in health and disease.New York:Marcel Dekker,1995:809-820
17 Mounier F, Gros F, Wieslander J et al. Glomerular distribution of M1 and M2 subunits of the globular domain of the basement membrane collagen: An immunohistochemical study, In:Progress in Basement membrane Research, Renal and Rlated Aspects in Heaslth and Disease. edited by Gubler MC, Sternberg M.London,Paris:John Libbey Eurotext 1988:53-59
, 百拇医药
18 Desjardins M, Gros F, Wieslander J et al. Heterogeneous distribution of monometric elements from the globular domain(NCI) of type Ⅳ collagen in renal basement as revealed by high resolution puantitive immunohistochemistry. Lab Invest, 1990;63:637
19 Butkowski RJ, Wieslander J, Kleppel MM et al. Basement membrane collagen on the kidney: Regional cocalization of novel chains related to collagen Ⅳ. Kidney Int,1989,35:1195
20 Keppel MM, Santi PA, Cameron JD et al. Human tissue distribution of novel basement membrane collagen. Am J Pathol, 1989;134:813
, http://www.100md.com
21 Ninomiya Y, Kagawa M, Iyama K et al. Differential expression of two basement membrane collagen genes COL4A6 and COL4A5, demonstrated by immunofluorescence staining using peptide-specific monoclonal antibodies. J Cell Biol, 1995;130:1219
22 Boyd CD, Toth-Fejel S, Gadi IK et al. The genes coding for human pro alpha1(Ⅳ) and pro alpha 2(Ⅳ) collagen are both located at the end of the long arm of chromosome 13. Am J Hum Genet, 1988;42:309
, 百拇医药
23 Myers JC. Jones TA, Pohjolainen ER et al. Molecular cloning of α5(Ⅳ) collagen and assignment of the gene to the region of the X chromosome containing the Alport syndrome locus. Am J Hum Genet, 1990;46:1029
24 Hostikka SL, Eddy RL, Byers MG et al. Identification of a distinct type Ⅳ collagen α chain with restricted kidney distribution and assignment of its gene to locus of X chromosome-linked Alport syndrome. Proc Natl Acad Sci USA, 1990;87:1606
, http://www.100md.com
25 Fischer G, Schmidt C, Opitz J et al. Identification of a novel sequence element in the common promoter region of human collagen typeⅣ genes, involved in the regulation of divergent transcription. Biochem J, 1993;229:687
26 Schmidt C, Pollner R, Poschl E et al. Expression of human collagen type Ⅳ genes is regulated by transcriptional and posttranscriptinal mechanism. FEBS Lett, 1992;312:174
27 Bruggeman LA, Burbelo PD, Yamada Y et al. A novel sequence in the type Ⅳ collagen promoter binds nuclear proteins from Engelbreth-Holm-Swarm tumer. Oncogene, 1992;7:1497
, http://www.100md.com
28 Posch1 E, Pollner R, Kuhn K et al. The genes for the α1(Ⅳ) and α2(Ⅳ) chains of human basement membrane collagen type Ⅳ are arranged head-to-head and separated by a bidirectional promoter of unique structure. EMBO J, 1988;7:2678
29 Haniel A, Welge-Luben U, Kuhn K et al. Identification and characterization of a novel transcriptional silencer in the human collagen type Ⅳ gene COL4A2. J Biol Chem, 1995;270:11209
30 Hlaing T, Funabiki K, Togawa M et al. Molecular cloning of the murine α3(Ⅳ) and α4(Ⅳ) collagen promoter(abstract). J Am Soc Nephrol, 1994;5:625
, 百拇医药
31 Sugimeto M, Oohashi T, Ninomiya Y et al. The genes COL4A5 and COL4A6, coding for basement membrane collagen chains α5(Ⅳ) and α6(Ⅳ), are locuted head-to-head in close proximity on human chromosome Xq22 and COL4A6 is transcribed from two alternatived promoters. Proc Natrl Acad Sci USA,1994;91:11679
32 Penades JR, Bernal D, Revert F et al. Characterization and expression of multiple alternatively spliced transcripts of the Goodpasture antigen gene region. Eur J Biochem, 1995;229:754
, 百拇医药
33 Jenis E, Valeski J, Caleagno P. Vaviability of anti-GBM binding in hereditary nephritis. Clin Nephrol, 1981;15:111
34 谌贻璞,邹万忠,徐世全等.遗传性进行性肾炎-11个家系及2例肾活检报告.中华内科杂志,1982;21:587
35 Barker DF, Hostikka SL, Zhou J et al. Identification of mutations in the COL4A5 gene in Alport syndrome. Science, 1990;248:1224
36 Mochizuki T, Lemmink HH, Mariyama M et al. Identification of mutation in the α3(Ⅳ) and α4(Ⅳ) collagen genes in autosomal recessive Alport syndrome. Nature Genet, 1994;8:77
37 Reeders ST. Molecular genetics of hereditary nephritis. Kidney Int, 1992;42:783
收稿日期:1998-12-08, 百拇医药