氨基胍对非酶糖基化人脐静脉内皮细胞信号转导物DAG影响
作者:严金川 刘乃丰
单位:严金川:镇江市第四人民医院心内科,212001;刘乃丰:南京铁道医学院附属医院;严金川:现在上海第二军医大学附属长征医院心内科 200003
关键词:氨基胍;非酶糖化;信号转导;内皮细胞;二酰基甘油
高血压杂志990433
摘要 目的:为探讨氨基胍(AG)对非酶糖化(NGEs)引起的人脐静脉内皮细胞信号(DAG)转导的影响及其机制。
方法:采用薄层层析、放射自显影及放射酶标法分离、检测细胞中DAG含量,应用荧光法检测NGEs的含量。
结果:氨基胍组荧光值从27.8±5.9(AFU)降为8.5±2.8(AFU) ,DAG含量从541.5±46.23 pmol.L-1降为253.5±18.20 pmol.L-1。
, 百拇医药
结论:氨基胍明显阻断糖基化终末产物(NGEs)的形成,并且由NGEs刺激内皮细胞产生的DAG含量显著降低。这对糖尿病的慢性并发症防止提供了重要的理论依据。
要点:非酶糖化终末产物(NGEs)能促进平滑肌细胞的增殖和提高细胞内钙浓度。二乙酰甘油(DAG)是细胞信号转导物随组织的NGEs的增高呈量效性地增高。本文研究氨基胍(AG)这种经典阻断NGEs形成的药物于不同浓度时使DAG浓度呈量效性地降低,氨基胍对糖尿病血管并发症及动脉粥样硬化中有药用价值。
中图分类号:Q46;R589.1;R54 文献标识码:A
文章编号:1006-2866(1999)04-0377-02
Effect of Aminoguanidine on Nonenzymatic Glycosylation-Induced Signal Transduction in Cultured Human Umbilical Vein Endothelial Cells
, 百拇医药
YAN Jinchuan1,LIU Naifeng2
(1.Department of Cardiology,the fourth peoples hospital, Zhenjiang 212002; 2.Affiliated Hospital of Nanjing Railway Medical College)
ABSTRACT Aim:To study the mechanism and effect of aminoguanidine(AG) on nonenzymatic glycosylation-induced signal transduction in cultured human umbilical vein endothelial cells(HUVEC).
Methods:Separation and quantitative measurement of diacylglycerol(DAG) were studied with thin-layer chromatography,autoradiography and radioenzymatic assay. The formation of nonenzymatic glycosation end product(NGEs) was measured by fluorescence method.
, 百拇医药
Results:In adding AG groups the AFU was decreased from 27.8±5.9 to 8.5±2.8. The levels of DAG was also decreased from 541.5±46.23 pmol.L-1 to 253.5±18.20 in HUVEC.
Conclusion:The results suggest that AG significantly inhibit the formation of NGEs. AG also markedly attenuated the accumulation of DAG .It is an important theoretical basis to prevent chronic complications in diabetic mellitus.
, http://www.100md.com Key words:aminoguanidine; nonenzymatic glycosylation; signal transduction; endothelial cells; diacylglycerol
糖尿病是临床常见病和多发病,其血管病变则是该病主要的致残及致死原因。糖尿病病人易患动脉粥样硬化, 随着机体衰老非酶糖基化随之增加,糖基化终产物可在组织中不断积聚,这一过程在糖尿病病人体内明显加快。近年来的研究表明,阻断糖基化终末产物(NGEs)的形成,对防止糖尿病并发症有着重要意义。氨基胍作为经典的能抑制NGEs形成药物,在国外已被大多数学者证实。我们采用检测NGEs的荧光值以及应用薄层层析、放射自显影和放射酶标记方法检测氨基胍对NGEs引起的信号转导物DAG的影响,以进一步探讨氨基胍阻断NGEs形成的程度。
MATERIALS AND METHODS
1 材料:脐带由本院产房提供,胎牛血清为杭州四季青生物工程公司产品,RPMI1640培养基、氨基胍系美国sigma公司产品,DAG药盒为英国Amersham公司产品,[γ-P32]ATP北京原子能公司产品,液闪计数仪为Beckman LS 5000TD美国产品,F-3000型荧光分光光度计为Hitachi日本产品。
, 百拇医药
2 方法
2.1 人脐静脉内皮细胞培养: 参照Lorenzi[1]等无菌条件下取健康新生儿脐带25 cm~30 cm, PBS冲洗干净后,灌入0.1%Ⅱ型胶原酶12 ml~15 ml,37℃孵育15分钟,分离、调节细胞数在3×105/ml,用RPMI1640培养液(含20%胎牛血清)接种于6孔进口培养板,2~3天后细胞铺满板底,换液后即可用于实验,内皮细胞鉴定采用Ⅷ因子相关抗原免疫组化染色[2]。
2.2 NGEs的制备:将葡萄糖用pH7.4 PBS液配制成0.5 mol.L-1溶液,无菌过滤4℃保存,取牛血清白蛋白(BSA) 5.0 g.L-1加入一定量葡萄糖使终浓度为50 mmol.L-1。在37℃无菌孵育,其中三组分别加入10 mmol、20 mmol、30 mmol氨基胍共同孵育。实验前用pH 7.4 PBS透析去除未结合的葡萄糖。对照组BSA中不含葡萄糖,余条件一致。
, 百拇医药
2.3 NGEs自由荧光度(AFU)的测定[3]取不同浓度NGEs和不同浓度氨基胍孵育的NGEs各1.0 ml于F-3000型荧光分光光度计上测其荧光值(激发波长390 nm,发射波长450 nm),以1.0 ml BSA按同样操作作为对照。
2.4 细胞内DAG的提取和测定[4]:将细胞用3 ml 氯仿∶甲醇(1∶2, v/v)抽取细胞总脂,采用DAG激酶法使DAG降解为磷脂酸(PA),然后用[γ-P32]ATP标记,通过薄层层析、放射自显影法分离出由DAG降解的PA,取下显影点,测其液闪值,根据DAG标准曲线求出对应的DAG含量。
2.5 DAG标准曲线的制备:将不同浓度的标准DAG(31.25,62.5,125,250,500,1000 pmol/L) 采用DAG激酶法使DAG降解为磷脂酸(PA),然后用γ-32P-ATP标记,测其液闪值,制定标准曲线。
, 百拇医药
2.6 数据处理:均以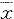 ±s表示,采用小样本t检验进行统计处理。
±s表示,采用小样本t检验进行统计处理。
RESULTS
1 DAG测定的标准曲线:随DAG浓度增加其转化为PA的放射性活性增强,呈线型关系(Fig 1)。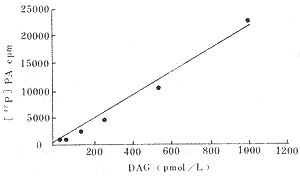
Fig 1 DAG standard curve(二酰基甘油标准曲线)
2 氨基胍(AG)对NGEs刺激内皮细胞产生DAG的影响:如Tab 1所示,在不同浓度NGE组中内皮细胞中DAG含量随NGEs浓度增加而增加。在加入AG组中内皮细胞产生DAG量明显减少,均具有显著差异性(n=5,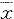 ±s)
±s)
, 百拇医药
Tab 1 The effect of aminoguanidine on DAG in HUVEC
表1 氨基胍(AG)对NGEs刺激内皮细胞产生DAG的影响 Group
DAG(pmol.L-1)
NGEs 50 mg/L
348.5±25.27
NGEs 100 mg/L
656.5±32.55
NGEs 200 mg/L
873.3±47.5
, 百拇医药
NGEs 200 mg/L+AG 10 mmol
541.5±46.23**
NGEs 200 mg/L+AG 20 mmol
432.6±27.52**
NGEs 200 mg/L+AG 30 mmol
253.5±18.20**
BSA 50 mg/L
222.5±13.25
BSA 100 mg/L
, 百拇医药 218.75±23.25
BSA 200 mg/L
229.6±17.52
**:P<0.01 vs NGEs 200 mg/L
3 氨基胍对NGEs形成的影响:如表2所示,荧光值随NGEs的浓度增加而增加,AG组其荧光值明显受到抑制;但仍然较对照组为高。
Tab 2 AFU of NGEs
表2 氨基胍对非酶糖化终末产物自由荧光度形成的影响(n=5,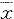 ±s) Group
±s) Group
荧光值(AFU)
, http://www.100md.com
NGEs 50 mg/L
11.4±2.6
NGEs 100 mg/L
24.6±4.7
NGEs 200 mg/L
38.8±4.9
NGEs 200 mg/L+AG 10 mmol
27.8±5.9*
NGEs 200 mg/L+AG 20 mmol
16.7±4.6*
, http://www.100md.com
NGEs 200 mg/L+AG 30 mmol
8.5±2.8*
BSA 200 mg/L
4.3±1.5
*:P<0.01 vs NGEs 200 mg/L组
DISCUSSION
NGEs与这类特异性受体作用后,能改变细胞功能,如影响细胞通透性、抗血凝特性及分泌细胞因子[5]。其病理意义极为广泛,不仅与衰老、透析相关病和Alzheimer's病密切相关,而且胞浆及核蛋白如:肿瘤、抑制因子、原癌基因的糖基化,能促发类似于蛋白磷酸化的重要调控方式的发生[6]。糖尿病病人易患动脉粥样硬化,随着机体衰老糖基化终产物(NGEs)可在组织中不断积聚,这一过程在糖尿病病人体内明显加快。
, 百拇医药
近年来,有关细胞信号传导与细胞功能的研究越来越引起人们的关注,特别是二酰基甘油-蛋白激酶C(DAG-PKC)信使传导途径受到普遍重视。DAG是细胞内重要信使物质,它可将外界的刺激信号,通过激活细胞内蛋白激酶C(PKC),并磷酸化各种底物蛋白,产生相应的生物学效应[7]。
氨基胍作为一个经典的阻断NGEs形成的药物,在大规模的动物试验和临床验证中已被证实[8],其机制是由于氨基胍阻断了Amadori产物进一步交联,形成不可逆的NGEs[9]。我们已证实平滑肌细胞上存在高亲和特异性NGEs受体,并促进平滑肌细胞增殖和胞内Ca2+升高[10,11],最近,我们又发现NGEs通过受体介导能刺激平滑肌细胞和内皮细胞信号转导物DAG产生双时相性变化;并且具有浓度依赖效应。本研究中应用加入氨基胍共同孵育的NGEs刺激内皮细胞发现DAG含量明显减少,提示:氨基胍可能通过阻断NGEs形成而起作用,通过对NGEs的荧光值检测进一步证实NGEs形成减少。但氨基胍的这种阻断NGEs形成作用并不完全;而只是部分抑制其产生,亦即在氨基胍共同孵育条件下,NGEs仍能缓慢形成。
, 百拇医药
氨基胍对NGEs刺激内皮细胞产生信号转导物DAG的影响是通过阻断NGEs形成而实现的,这种抑制作用并不完全。氨基胍尚难完全免除NGEs对糖尿病病人机体的影响。但氨基胍作用的研究为糖尿病血管并发症及其在动脉粥样硬化的预防措施中开拓新的治疗途径提供了必要的理论依据。
REFERENCES
1 Lorenzi M, Cadliero E, Markey B, et al. Interaction of human endothelial cells with elevated glucose concentrations and native and glycosylated low -density lipoprotein[J] Diabetologia 1984;26:218
2 Ryan US. Isolation and culture of pulmonary endothelia cell[J] Environ Health Perspect 1984;56:103
, 百拇医药
3 Makita Z, Rodoff S, Rayfield EJ, et al . Advanced glycosylation end products in patients with diabetic nephropathy[J] N EngL J Med 1991;325:836-842
4 Bligh EG, Dyer WJ. A rapid method of total lipid extraction and purification [J] Can J Biochem Physiol 1959;37:911
5 Schmidt AM, Hori O,Chem JX,et al. Advanced glycation end products interacting with their endothelial receptor induce expression of vascular cell adhesive molecule-1(VCAM-1) in cultured human endothelial cells in mice[J] J Clin Invest 1995;96:1395
, 百拇医药
6 Haltiwanger RS, Busby S, Grove K,et al . O-glycosylation of nuclear and cytoplasmic proteins :regulation analogous to phosphorylation[J] Biochm Biophys Res Commun 1997;237-242
7 Nishizuka Y. Intracellular signaling by hydrolysis of phospholipids and activation of protein kinase C[J] Science 1992;258:607
8 Brownlce M. Glycation and diabetic complications[J] Diabetes 1994;43(6):836
9 Chen HJ, Cerami A. Mechanism of inhibition of advanced glycosylation by aminoguanidine in vitro[J] J Carbohydr Chem 1993;12:732
, 百拇医药
10 Zhou QG, Liu NF, Xie PL. Expression of receptor for advanced glycosylation end products and inhibition of AGEs induced cytosolic calcium elevation by diltiazam in cultured rat smooth muscle cells[J] Acta Pharmacol Sinica 1997;18(5):425
11 Jin H, Liu N F, Tang R. Effects of advanced glycosylation end products on proliferation and cytosolic ica Sinica 1997;18(5):422
收稿日期:1999-05-18, http://www.100md.com
单位:严金川:镇江市第四人民医院心内科,212001;刘乃丰:南京铁道医学院附属医院;严金川:现在上海第二军医大学附属长征医院心内科 200003
关键词:氨基胍;非酶糖化;信号转导;内皮细胞;二酰基甘油
高血压杂志990433
摘要 目的:为探讨氨基胍(AG)对非酶糖化(NGEs)引起的人脐静脉内皮细胞信号(DAG)转导的影响及其机制。
方法:采用薄层层析、放射自显影及放射酶标法分离、检测细胞中DAG含量,应用荧光法检测NGEs的含量。
结果:氨基胍组荧光值从27.8±5.9(AFU)降为8.5±2.8(AFU) ,DAG含量从541.5±46.23 pmol.L-1降为253.5±18.20 pmol.L-1。
, 百拇医药
结论:氨基胍明显阻断糖基化终末产物(NGEs)的形成,并且由NGEs刺激内皮细胞产生的DAG含量显著降低。这对糖尿病的慢性并发症防止提供了重要的理论依据。
要点:非酶糖化终末产物(NGEs)能促进平滑肌细胞的增殖和提高细胞内钙浓度。二乙酰甘油(DAG)是细胞信号转导物随组织的NGEs的增高呈量效性地增高。本文研究氨基胍(AG)这种经典阻断NGEs形成的药物于不同浓度时使DAG浓度呈量效性地降低,氨基胍对糖尿病血管并发症及动脉粥样硬化中有药用价值。
中图分类号:Q46;R589.1;R54 文献标识码:A
文章编号:1006-2866(1999)04-0377-02
Effect of Aminoguanidine on Nonenzymatic Glycosylation-Induced Signal Transduction in Cultured Human Umbilical Vein Endothelial Cells
, 百拇医药
YAN Jinchuan1,LIU Naifeng2
(1.Department of Cardiology,the fourth peoples hospital, Zhenjiang 212002; 2.Affiliated Hospital of Nanjing Railway Medical College)
ABSTRACT Aim:To study the mechanism and effect of aminoguanidine(AG) on nonenzymatic glycosylation-induced signal transduction in cultured human umbilical vein endothelial cells(HUVEC).
Methods:Separation and quantitative measurement of diacylglycerol(DAG) were studied with thin-layer chromatography,autoradiography and radioenzymatic assay. The formation of nonenzymatic glycosation end product(NGEs) was measured by fluorescence method.
, 百拇医药
Results:In adding AG groups the AFU was decreased from 27.8±5.9 to 8.5±2.8. The levels of DAG was also decreased from 541.5±46.23 pmol.L-1 to 253.5±18.20 in HUVEC.
Conclusion:The results suggest that AG significantly inhibit the formation of NGEs. AG also markedly attenuated the accumulation of DAG .It is an important theoretical basis to prevent chronic complications in diabetic mellitus.
, http://www.100md.com Key words:aminoguanidine; nonenzymatic glycosylation; signal transduction; endothelial cells; diacylglycerol
糖尿病是临床常见病和多发病,其血管病变则是该病主要的致残及致死原因。糖尿病病人易患动脉粥样硬化, 随着机体衰老非酶糖基化随之增加,糖基化终产物可在组织中不断积聚,这一过程在糖尿病病人体内明显加快。近年来的研究表明,阻断糖基化终末产物(NGEs)的形成,对防止糖尿病并发症有着重要意义。氨基胍作为经典的能抑制NGEs形成药物,在国外已被大多数学者证实。我们采用检测NGEs的荧光值以及应用薄层层析、放射自显影和放射酶标记方法检测氨基胍对NGEs引起的信号转导物DAG的影响,以进一步探讨氨基胍阻断NGEs形成的程度。
MATERIALS AND METHODS
1 材料:脐带由本院产房提供,胎牛血清为杭州四季青生物工程公司产品,RPMI1640培养基、氨基胍系美国sigma公司产品,DAG药盒为英国Amersham公司产品,[γ-P32]ATP北京原子能公司产品,液闪计数仪为Beckman LS 5000TD美国产品,F-3000型荧光分光光度计为Hitachi日本产品。
, 百拇医药
2 方法
2.1 人脐静脉内皮细胞培养: 参照Lorenzi[1]等无菌条件下取健康新生儿脐带25 cm~30 cm, PBS冲洗干净后,灌入0.1%Ⅱ型胶原酶12 ml~15 ml,37℃孵育15分钟,分离、调节细胞数在3×105/ml,用RPMI1640培养液(含20%胎牛血清)接种于6孔进口培养板,2~3天后细胞铺满板底,换液后即可用于实验,内皮细胞鉴定采用Ⅷ因子相关抗原免疫组化染色[2]。
2.2 NGEs的制备:将葡萄糖用pH7.4 PBS液配制成0.5 mol.L-1溶液,无菌过滤4℃保存,取牛血清白蛋白(BSA) 5.0 g.L-1加入一定量葡萄糖使终浓度为50 mmol.L-1。在37℃无菌孵育,其中三组分别加入10 mmol、20 mmol、30 mmol氨基胍共同孵育。实验前用pH 7.4 PBS透析去除未结合的葡萄糖。对照组BSA中不含葡萄糖,余条件一致。
, 百拇医药
2.3 NGEs自由荧光度(AFU)的测定[3]取不同浓度NGEs和不同浓度氨基胍孵育的NGEs各1.0 ml于F-3000型荧光分光光度计上测其荧光值(激发波长390 nm,发射波长450 nm),以1.0 ml BSA按同样操作作为对照。
2.4 细胞内DAG的提取和测定[4]:将细胞用3 ml 氯仿∶甲醇(1∶2, v/v)抽取细胞总脂,采用DAG激酶法使DAG降解为磷脂酸(PA),然后用[γ-P32]ATP标记,通过薄层层析、放射自显影法分离出由DAG降解的PA,取下显影点,测其液闪值,根据DAG标准曲线求出对应的DAG含量。
2.5 DAG标准曲线的制备:将不同浓度的标准DAG(31.25,62.5,125,250,500,1000 pmol/L) 采用DAG激酶法使DAG降解为磷脂酸(PA),然后用γ-32P-ATP标记,测其液闪值,制定标准曲线。
, 百拇医药
2.6 数据处理:均以
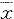 ±s表示,采用小样本t检验进行统计处理。
±s表示,采用小样本t检验进行统计处理。RESULTS
1 DAG测定的标准曲线:随DAG浓度增加其转化为PA的放射性活性增强,呈线型关系(Fig 1)。

Fig 1 DAG standard curve(二酰基甘油标准曲线)
2 氨基胍(AG)对NGEs刺激内皮细胞产生DAG的影响:如Tab 1所示,在不同浓度NGE组中内皮细胞中DAG含量随NGEs浓度增加而增加。在加入AG组中内皮细胞产生DAG量明显减少,均具有显著差异性(n=5,
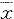 ±s)
±s), 百拇医药
Tab 1 The effect of aminoguanidine on DAG in HUVEC
表1 氨基胍(AG)对NGEs刺激内皮细胞产生DAG的影响 Group
DAG(pmol.L-1)
NGEs 50 mg/L
348.5±25.27
NGEs 100 mg/L
656.5±32.55
NGEs 200 mg/L
873.3±47.5
, 百拇医药
NGEs 200 mg/L+AG 10 mmol
541.5±46.23**
NGEs 200 mg/L+AG 20 mmol
432.6±27.52**
NGEs 200 mg/L+AG 30 mmol
253.5±18.20**
BSA 50 mg/L
222.5±13.25
BSA 100 mg/L
, 百拇医药 218.75±23.25
BSA 200 mg/L
229.6±17.52
**:P<0.01 vs NGEs 200 mg/L
3 氨基胍对NGEs形成的影响:如表2所示,荧光值随NGEs的浓度增加而增加,AG组其荧光值明显受到抑制;但仍然较对照组为高。
Tab 2 AFU of NGEs
表2 氨基胍对非酶糖化终末产物自由荧光度形成的影响(n=5,
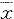 ±s) Group
±s) Group荧光值(AFU)
, http://www.100md.com
NGEs 50 mg/L
11.4±2.6
NGEs 100 mg/L
24.6±4.7
NGEs 200 mg/L
38.8±4.9
NGEs 200 mg/L+AG 10 mmol
27.8±5.9*
NGEs 200 mg/L+AG 20 mmol
16.7±4.6*
, http://www.100md.com
NGEs 200 mg/L+AG 30 mmol
8.5±2.8*
BSA 200 mg/L
4.3±1.5
*:P<0.01 vs NGEs 200 mg/L组
DISCUSSION
NGEs与这类特异性受体作用后,能改变细胞功能,如影响细胞通透性、抗血凝特性及分泌细胞因子[5]。其病理意义极为广泛,不仅与衰老、透析相关病和Alzheimer's病密切相关,而且胞浆及核蛋白如:肿瘤、抑制因子、原癌基因的糖基化,能促发类似于蛋白磷酸化的重要调控方式的发生[6]。糖尿病病人易患动脉粥样硬化,随着机体衰老糖基化终产物(NGEs)可在组织中不断积聚,这一过程在糖尿病病人体内明显加快。
, 百拇医药
近年来,有关细胞信号传导与细胞功能的研究越来越引起人们的关注,特别是二酰基甘油-蛋白激酶C(DAG-PKC)信使传导途径受到普遍重视。DAG是细胞内重要信使物质,它可将外界的刺激信号,通过激活细胞内蛋白激酶C(PKC),并磷酸化各种底物蛋白,产生相应的生物学效应[7]。
氨基胍作为一个经典的阻断NGEs形成的药物,在大规模的动物试验和临床验证中已被证实[8],其机制是由于氨基胍阻断了Amadori产物进一步交联,形成不可逆的NGEs[9]。我们已证实平滑肌细胞上存在高亲和特异性NGEs受体,并促进平滑肌细胞增殖和胞内Ca2+升高[10,11],最近,我们又发现NGEs通过受体介导能刺激平滑肌细胞和内皮细胞信号转导物DAG产生双时相性变化;并且具有浓度依赖效应。本研究中应用加入氨基胍共同孵育的NGEs刺激内皮细胞发现DAG含量明显减少,提示:氨基胍可能通过阻断NGEs形成而起作用,通过对NGEs的荧光值检测进一步证实NGEs形成减少。但氨基胍的这种阻断NGEs形成作用并不完全;而只是部分抑制其产生,亦即在氨基胍共同孵育条件下,NGEs仍能缓慢形成。
, 百拇医药
氨基胍对NGEs刺激内皮细胞产生信号转导物DAG的影响是通过阻断NGEs形成而实现的,这种抑制作用并不完全。氨基胍尚难完全免除NGEs对糖尿病病人机体的影响。但氨基胍作用的研究为糖尿病血管并发症及其在动脉粥样硬化的预防措施中开拓新的治疗途径提供了必要的理论依据。
REFERENCES
1 Lorenzi M, Cadliero E, Markey B, et al. Interaction of human endothelial cells with elevated glucose concentrations and native and glycosylated low -density lipoprotein[J] Diabetologia 1984;26:218
2 Ryan US. Isolation and culture of pulmonary endothelia cell[J] Environ Health Perspect 1984;56:103
, 百拇医药
3 Makita Z, Rodoff S, Rayfield EJ, et al . Advanced glycosylation end products in patients with diabetic nephropathy[J] N EngL J Med 1991;325:836-842
4 Bligh EG, Dyer WJ. A rapid method of total lipid extraction and purification [J] Can J Biochem Physiol 1959;37:911
5 Schmidt AM, Hori O,Chem JX,et al. Advanced glycation end products interacting with their endothelial receptor induce expression of vascular cell adhesive molecule-1(VCAM-1) in cultured human endothelial cells in mice[J] J Clin Invest 1995;96:1395
, 百拇医药
6 Haltiwanger RS, Busby S, Grove K,et al . O-glycosylation of nuclear and cytoplasmic proteins :regulation analogous to phosphorylation[J] Biochm Biophys Res Commun 1997;237-242
7 Nishizuka Y. Intracellular signaling by hydrolysis of phospholipids and activation of protein kinase C[J] Science 1992;258:607
8 Brownlce M. Glycation and diabetic complications[J] Diabetes 1994;43(6):836
9 Chen HJ, Cerami A. Mechanism of inhibition of advanced glycosylation by aminoguanidine in vitro[J] J Carbohydr Chem 1993;12:732
, 百拇医药
10 Zhou QG, Liu NF, Xie PL. Expression of receptor for advanced glycosylation end products and inhibition of AGEs induced cytosolic calcium elevation by diltiazam in cultured rat smooth muscle cells[J] Acta Pharmacol Sinica 1997;18(5):425
11 Jin H, Liu N F, Tang R. Effects of advanced glycosylation end products on proliferation and cytosolic ica Sinica 1997;18(5):422
收稿日期:1999-05-18, http://www.100md.com