肠必清肠溶颗粒剂的质量控制*
作者:田莉 陈象青 刘圣 黄守正
单位:黄守正(安徽中医学院99级毕业生,合肥市 230001);田莉 陈象青 刘圣(安徽省立医院,合肥市 230001)
关键词:肠必清肠溶颗粒剂;番泻苷;橙皮苷;质量控制
中国药房000106
摘 要:目的:建立肠必清肠溶颗粒剂的质量控制方法。方法:参照《中国药典》类似制剂的质量要求,对本品的质量进行了全面检测,并用薄层色谱法对本品的番泻苷A和橙皮苷进行定性鉴别,用比色法对总番泻苷进行含量测定。结果:本品的粒度、水分、释放度等均符合规定。薄层定性方法斑点清晰,分离完全,易于区别。含量测定方法精密度<1.6%,平均回收率为97.40%(RSD=1.06%,n=5)。结论:本文所建立的定性及定量方法准确、可靠,重现性好,可作为该制剂的质量控制方法。
, http://www.100md.com
中图分类号:R9442+7 文献标识码:B
文章编号:1001-0408(2000)01-0011-02
Quality Control of Chang Bi Qing Enteric-coated Granules
TIAN Li,CHEN Xiangqing,LIU Sheng,CHEN Liming
(Anhui Provincial Hospital,Hefei 230001)
HUANG Shouzheng
ABSTRACT:OBJECTIVE:To establish the quality control method for Chang Bi Qing enteric-coated granules.METHODS:The preparation was monitored according to the quality requirements of similar preparations in the Chinese pharmacopoeia.Its ingredients,sennoside A and hesperidin,were identified by TLC.The total sennosides in the preparation was quantitatively detected by colorimetry.RESULTS:The granularity,water content and release rate met the requirements.The spots were clear and separated completely in the TLC methods.The average recovery of the determining method was 97.40% with a RSD of 1.06% and its repeatability was good(standard derivations<1.6%).CONCLUSION:The quality standard of the preparation was provided.The methods of identification and determination were accurate and reproducible.It can be used for quality control of the preparation.
, 百拇医药
KEY WORDS:Chang Bi Qing enteric-coated granule;sennoside;hesperidin;quality control.▲
肠必清肠溶颗粒剂(CBQ)是以番泻叶为主药,以青皮、木香等为辅佐药的新型中药制剂。其主要制备工艺为中药材经适宜的溶媒提取后,再浓缩、喷雾干燥,可得粒径为80目~120目、含水量小于5%的黄褐色粉末,其总番泻苷提取率可达93.2%,干粉得率为21.05%[1]。粉末再以微晶纤维素作赋形剂,乙醇为润滑剂,PVP为粘合剂制成丸芯[2],最后将丸芯用聚丙烯酸树脂Ⅱ号和Ⅲ号包衣,即得。本品具有通便和清肠之功效。为保证药品的内在质量,本文初步探讨了该制剂的质量控制方法。
1 仪器与试剂
HP8453紫外-可见分光光度计(美国惠普公司,Pentium CPU);RC-3B药物溶出仪(天津大学无线电厂);TG328A型分析天平(上海天平仪器厂);XK96-A型快速混合器(江苏姜堰市新康仪器厂)。
, http://www.100md.com
潘泻叶、青皮、木香等药材经过安徽省药品检验所全项检验,均符合《中国药典》(一部)1995年版各药材项目下规定;三氯甲烷、碳酸氢钠、乙醚等试剂均为分析纯;番泻苷A对照品(日本和光纯药);肠必清肠溶颗粒剂为本室自制。
2 性状
本品为灰褐色圆形颗粒;除去薄膜衣后为黄褐色圆形颗粒。味微苦。
3 鉴别
3.1 番泻叶:取CBQ约4g,研磨成粉,加70%四氢呋喃水溶液40ml,浸润20分钟,超声提取30分钟,振荡20分钟,离心;取上清液,加13gNaCl,超声30分钟,振荡20分钟,离心,静置2小时;水层用1mol/L盐酸调pH至1.5,加四氢呋喃15ml,超声15分钟,振荡10分钟,静置2小时,分取四氢呋喃10ml,作为供试品溶液。另取番泻苷A对照品用磷酸盐缓冲液(pH6.8)配制成1.19mg/ml,作为对照品溶液。按《中国药典》(一部)1995年版附录VIB薄层色谱法(下同),吸取上述供试品溶液8μl,对照品溶液5μl,阴性对照溶液8μl,分别点于同一硅胶G薄层板上,以醋酸乙酯∶正丙醇∶水∶冰醋酸(40∶40∶30∶1)为展开剂,展开,取出晾干。置紫外灯(365nm)下检视,供试品色谱中,在与对照品色谱相应的位置上,显相同的暗红色荧光斑点。喷以20%硝酸溶液,在120℃加热10分钟,冷却,再喷以5%氢氧化钾的50%乙醇溶液。在日光下检视,供试品色谱中,在与对照品色谱相应的位置上,显暗红色斑点[3](番泻苷A的Rf=0.67),见图1。
, 百拇医药
1-阴性对照;2-番泻苷A;3-CBQ
图1 番泻叶的薄层色谱图
3.2 青皮:取CBQ约2g,研磨成粉,加甲醇20ml,加热回流20分钟,过滤,取滤液10ml,浓缩至2ml,作供试品溶液。取橙皮苷对照品,用甲醇制成饱和溶液,作为对照品溶液。照薄层色谱法,吸取上述供试品溶液2μl,对照品溶液2μl,阴性对照溶液8μl,分别点于用0.5%氢氧化钠制备的同一硅胶G薄层板上,以醋酸乙酯∶甲醇∶水(100∶17∶13)为展开剂,喷以三氯化铝试液。置紫外灯(254nm)下检视,供试品色谱中,在与对照品色谱相应的位置上,显亮黄色荧光斑点(橙皮苷的Rf=0.48),见图2。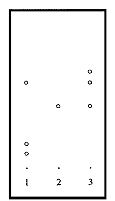
1-阴性对照;2-橙皮苷;3-CBQ
图2 青皮的薄层色谱图
, 百拇医药
4 检查
4.1 粒径:取本品5袋,称定重量,置药筛内过筛,结果全部颗粒通过20目筛,而不过40目筛,其粒径在0.5mm~1.0mm之内。共测定5个批号(990429、990504、990507、990518、990530)的样品,均符合《中国药典》(一部)1995年版中浓缩微丸的有关规定。
4.2 水分:取本品2g,按《中国药典》(一部)1995年版附录IXH第1法(烘干法)测定水分。共测定5个批号(990429、990504、990507、990518、990530)的样品,含水量均小于5%(4.06%~4.81%),均符合《中国药典》(一部)1995年版中浓缩微丸的有关规定。
4.3 释放度:参照西药肠溶片的规定,采用《中国药典》(二部)1995年版释放度测定第2法(浆法,75rpm),进行该制剂的释放度测定,共测定5个批号(990429、990504、990507、990518、990530)样品。结果表明,按标示量为18mg/g计算,本品的释放度符合《中国药典》(二 部)1995年版有关释放度的要求。(本品在0.1mol/L 盐酸中2小时释放百分率为1.74%~9.43%,在pH6.8磷酸盐缓冲液中45分钟的释放百分率为90.53%~103.6%)。
, http://www.100md.com
5 含量测定
本制剂的主药番泻叶的主要有效成分为总番泻苷,其含 量测定方法主要按照《中国药典》(一部)1995年版番泻叶项下含量测定方法,并在提取方面加以改进。
5.1 样品的测定:取样品3g,研细,精密称取适量(约相当于总番泻苷3mg),加水30.0ml,旋涡混合2分钟,离心;取上清液20.0ml,加2mol/L盐酸0.1ml,摇匀,用三氯甲烷提取3次,每次15ml,水层加入0.1g碳酸氢钠,振摇3分钟,离心;取上清液10.0ml,加入10.5%三氯化铁20ml,沸水浴回流20分钟,加盐酸1.0ml,继续加热20分钟,冷却,用乙醚提取3次,每次25ml,醚液用水清洗2次,每次15ml,醚液过滤并定容至100.0ml,摇匀;取醚液10ml,水浴挥发至干,加0.5%醋酸镁甲醇溶液10.0ml,混匀,以甲醇为空白,在515nm处测定吸收度,按番泻苷B的吸收系数为(E1%1cm)240计算,即得总番泻苷含量。
, http://www.100md.com
5.2 精密度实验:取3个批号的样品,按5.1项下的方法测定,每批样品测定5次,结果见表1。
表1 精密度实验结果
批号
测得值
平均值
RSD%
981231
19.73
19.31
18.94
19.40±0.32
1.65
, http://www.100md.com
19.36
19.66
990329
18.25
18.68
18.78
18.39±0.32
1.74
18.13
18.09
990429
20.41
20.77
, http://www.100md.com
19.86
20.32±0.33
1.62
20.26
20.33
5.3 回收率试验:取已知含量的样品细粉0.1g,精密称定,加入3.1项下番泻苷A对照品溶液1.0ml,加水29.0ml,旋涡混合2分钟,余下操作同5.1,结果见表2。
表2 加样回收率实验结果
样品含量(mg)
加入量(mg)
测得量(mg)
, 百拇医药
回收率(%)
平均回收率(%)
1.83
1.19
2.91
96.35
1.76
1.19
2.81
95.25
1.45
1.19
2.53
, 百拇医药
95.83
97.40
1.78
1.19
3.01
101.34
RSD=2.54%
1.64
1.19
2.78
98.23
5.4 阴性对照试验:按肠必清处方比例,取青皮、木香适量投料,以同样的工艺制备空白肠溶颗粒,研细,取约0.15g, 精密称定,加水30.0ml,余下操作同4.1项。结果表明,处方的其它成分对总番泻苷的含量测定没有干扰。
, 百拇医药
5.5 含量限度的确定:依法测定14个批号的样品,结果见表3。测定结果,本制剂的含量限度以不低于18mg/g为宜。
表3 14批样品含量测定结果
批号
总番泻苷含量(mg/g)
批号
总番泻苷含量(mg/g)
981012
18.39
940420
23.16
981019
, 百拇医药
17.91
990425
22.71
981103
18.74
990429
20.32
981116
18.84
990504
21.28
981231
19.40
, 百拇医药
990507
21.08
990407
22.66
990518
20.65
990413
23.62
990530
23.04
6 讨论
6.1 本品番泻叶薄层定性方法,曾采用《中国药典》(一部)1995年版番泻叶项下的方法,但分离效果较差,斑点不清晰。经摸索,本文方法效果较好,可以作为质量控制方法。
, 百拇医药
6.2 含量测定方法的提取条件中,旋涡混合2分钟与水浴回流15分钟效果相同,可能是由于该制剂为番泻叶提取物,番泻苷更易提取,从而可以简化操作步骤。
6.3 本文含量测定方法操作比较繁锁,但因所需试剂及设备易得,在目前国内尚无番泻苷标准品的情况下,仍可作为一种质量控制的方法。
6.4 本品做总番泻苷含量回收率实验也可用已知含量的番泻叶细粉,只是番泻叶细粉应先用水浴回流15分钟,再加入已知含量的制剂粉末,否则回收率会偏低。
6.5 比色法测定总番泻苷含量的灵敏度较差,在进行释放度试验时所需样品量较大(20ml),对研究本品的溶出曲线有一定的困难。目前正在摸索高效液相色谱测定本品中番泻苷A含量的方法,一旦方法成熟,即可用于本品的释放度研究。
6.6 《中国药典》尚未收载此种剂型,其质量标准只能参照类似剂型制定,粒度、水分、检查项目参照《中国药典》(一部)1995年版丸剂项下浓缩微丸的规定;释放度则参照《中国药典》(二部)1995年版有关规定。该剂型质量标准的具体条例还需进一步摸索。■
参考文献:
[1]陈象清,陈礼明,田 莉,等.肠必清制剂提取及喷雾干燥工艺[J].中国药房,1998,9(6):248
[2]刘 圣,陈象清,田 莉,等.快速搅拌制备肠必清微丸的工艺研究[J].中国药房,1999,10(5):205
[3]日本药局方[S].1991:965
收稿日期:1999-09-27
修回日期:1999-11-07, 百拇医药
单位:黄守正(安徽中医学院99级毕业生,合肥市 230001);田莉 陈象青 刘圣(安徽省立医院,合肥市 230001)
关键词:肠必清肠溶颗粒剂;番泻苷;橙皮苷;质量控制
中国药房000106
摘 要:目的:建立肠必清肠溶颗粒剂的质量控制方法。方法:参照《中国药典》类似制剂的质量要求,对本品的质量进行了全面检测,并用薄层色谱法对本品的番泻苷A和橙皮苷进行定性鉴别,用比色法对总番泻苷进行含量测定。结果:本品的粒度、水分、释放度等均符合规定。薄层定性方法斑点清晰,分离完全,易于区别。含量测定方法精密度<1.6%,平均回收率为97.40%(RSD=1.06%,n=5)。结论:本文所建立的定性及定量方法准确、可靠,重现性好,可作为该制剂的质量控制方法。
, http://www.100md.com
中图分类号:R9442+7 文献标识码:B
文章编号:1001-0408(2000)01-0011-02
Quality Control of Chang Bi Qing Enteric-coated Granules
TIAN Li,CHEN Xiangqing,LIU Sheng,CHEN Liming
(Anhui Provincial Hospital,Hefei 230001)
HUANG Shouzheng
ABSTRACT:OBJECTIVE:To establish the quality control method for Chang Bi Qing enteric-coated granules.METHODS:The preparation was monitored according to the quality requirements of similar preparations in the Chinese pharmacopoeia.Its ingredients,sennoside A and hesperidin,were identified by TLC.The total sennosides in the preparation was quantitatively detected by colorimetry.RESULTS:The granularity,water content and release rate met the requirements.The spots were clear and separated completely in the TLC methods.The average recovery of the determining method was 97.40% with a RSD of 1.06% and its repeatability was good(standard derivations<1.6%).CONCLUSION:The quality standard of the preparation was provided.The methods of identification and determination were accurate and reproducible.It can be used for quality control of the preparation.
, 百拇医药
KEY WORDS:Chang Bi Qing enteric-coated granule;sennoside;hesperidin;quality control.▲
肠必清肠溶颗粒剂(CBQ)是以番泻叶为主药,以青皮、木香等为辅佐药的新型中药制剂。其主要制备工艺为中药材经适宜的溶媒提取后,再浓缩、喷雾干燥,可得粒径为80目~120目、含水量小于5%的黄褐色粉末,其总番泻苷提取率可达93.2%,干粉得率为21.05%[1]。粉末再以微晶纤维素作赋形剂,乙醇为润滑剂,PVP为粘合剂制成丸芯[2],最后将丸芯用聚丙烯酸树脂Ⅱ号和Ⅲ号包衣,即得。本品具有通便和清肠之功效。为保证药品的内在质量,本文初步探讨了该制剂的质量控制方法。
1 仪器与试剂
HP8453紫外-可见分光光度计(美国惠普公司,Pentium CPU);RC-3B药物溶出仪(天津大学无线电厂);TG328A型分析天平(上海天平仪器厂);XK96-A型快速混合器(江苏姜堰市新康仪器厂)。
, http://www.100md.com
潘泻叶、青皮、木香等药材经过安徽省药品检验所全项检验,均符合《中国药典》(一部)1995年版各药材项目下规定;三氯甲烷、碳酸氢钠、乙醚等试剂均为分析纯;番泻苷A对照品(日本和光纯药);肠必清肠溶颗粒剂为本室自制。
2 性状
本品为灰褐色圆形颗粒;除去薄膜衣后为黄褐色圆形颗粒。味微苦。
3 鉴别
3.1 番泻叶:取CBQ约4g,研磨成粉,加70%四氢呋喃水溶液40ml,浸润20分钟,超声提取30分钟,振荡20分钟,离心;取上清液,加13gNaCl,超声30分钟,振荡20分钟,离心,静置2小时;水层用1mol/L盐酸调pH至1.5,加四氢呋喃15ml,超声15分钟,振荡10分钟,静置2小时,分取四氢呋喃10ml,作为供试品溶液。另取番泻苷A对照品用磷酸盐缓冲液(pH6.8)配制成1.19mg/ml,作为对照品溶液。按《中国药典》(一部)1995年版附录VIB薄层色谱法(下同),吸取上述供试品溶液8μl,对照品溶液5μl,阴性对照溶液8μl,分别点于同一硅胶G薄层板上,以醋酸乙酯∶正丙醇∶水∶冰醋酸(40∶40∶30∶1)为展开剂,展开,取出晾干。置紫外灯(365nm)下检视,供试品色谱中,在与对照品色谱相应的位置上,显相同的暗红色荧光斑点。喷以20%硝酸溶液,在120℃加热10分钟,冷却,再喷以5%氢氧化钾的50%乙醇溶液。在日光下检视,供试品色谱中,在与对照品色谱相应的位置上,显暗红色斑点[3](番泻苷A的Rf=0.67),见图1。

, 百拇医药
1-阴性对照;2-番泻苷A;3-CBQ
图1 番泻叶的薄层色谱图
3.2 青皮:取CBQ约2g,研磨成粉,加甲醇20ml,加热回流20分钟,过滤,取滤液10ml,浓缩至2ml,作供试品溶液。取橙皮苷对照品,用甲醇制成饱和溶液,作为对照品溶液。照薄层色谱法,吸取上述供试品溶液2μl,对照品溶液2μl,阴性对照溶液8μl,分别点于用0.5%氢氧化钠制备的同一硅胶G薄层板上,以醋酸乙酯∶甲醇∶水(100∶17∶13)为展开剂,喷以三氯化铝试液。置紫外灯(254nm)下检视,供试品色谱中,在与对照品色谱相应的位置上,显亮黄色荧光斑点(橙皮苷的Rf=0.48),见图2。

1-阴性对照;2-橙皮苷;3-CBQ
图2 青皮的薄层色谱图
, 百拇医药
4 检查
4.1 粒径:取本品5袋,称定重量,置药筛内过筛,结果全部颗粒通过20目筛,而不过40目筛,其粒径在0.5mm~1.0mm之内。共测定5个批号(990429、990504、990507、990518、990530)的样品,均符合《中国药典》(一部)1995年版中浓缩微丸的有关规定。
4.2 水分:取本品2g,按《中国药典》(一部)1995年版附录IXH第1法(烘干法)测定水分。共测定5个批号(990429、990504、990507、990518、990530)的样品,含水量均小于5%(4.06%~4.81%),均符合《中国药典》(一部)1995年版中浓缩微丸的有关规定。
4.3 释放度:参照西药肠溶片的规定,采用《中国药典》(二部)1995年版释放度测定第2法(浆法,75rpm),进行该制剂的释放度测定,共测定5个批号(990429、990504、990507、990518、990530)样品。结果表明,按标示量为18mg/g计算,本品的释放度符合《中国药典》(二 部)1995年版有关释放度的要求。(本品在0.1mol/L 盐酸中2小时释放百分率为1.74%~9.43%,在pH6.8磷酸盐缓冲液中45分钟的释放百分率为90.53%~103.6%)。
, http://www.100md.com
5 含量测定
本制剂的主药番泻叶的主要有效成分为总番泻苷,其含 量测定方法主要按照《中国药典》(一部)1995年版番泻叶项下含量测定方法,并在提取方面加以改进。
5.1 样品的测定:取样品3g,研细,精密称取适量(约相当于总番泻苷3mg),加水30.0ml,旋涡混合2分钟,离心;取上清液20.0ml,加2mol/L盐酸0.1ml,摇匀,用三氯甲烷提取3次,每次15ml,水层加入0.1g碳酸氢钠,振摇3分钟,离心;取上清液10.0ml,加入10.5%三氯化铁20ml,沸水浴回流20分钟,加盐酸1.0ml,继续加热20分钟,冷却,用乙醚提取3次,每次25ml,醚液用水清洗2次,每次15ml,醚液过滤并定容至100.0ml,摇匀;取醚液10ml,水浴挥发至干,加0.5%醋酸镁甲醇溶液10.0ml,混匀,以甲醇为空白,在515nm处测定吸收度,按番泻苷B的吸收系数为(E1%1cm)240计算,即得总番泻苷含量。
, http://www.100md.com
5.2 精密度实验:取3个批号的样品,按5.1项下的方法测定,每批样品测定5次,结果见表1。
表1 精密度实验结果
批号
测得值
平均值
RSD%
981231
19.73
19.31
18.94
19.40±0.32
1.65
, http://www.100md.com
19.36
19.66
990329
18.25
18.68
18.78
18.39±0.32
1.74
18.13
18.09
990429
20.41
20.77
, http://www.100md.com
19.86
20.32±0.33
1.62
20.26
20.33
5.3 回收率试验:取已知含量的样品细粉0.1g,精密称定,加入3.1项下番泻苷A对照品溶液1.0ml,加水29.0ml,旋涡混合2分钟,余下操作同5.1,结果见表2。
表2 加样回收率实验结果
样品含量(mg)
加入量(mg)
测得量(mg)
, 百拇医药
回收率(%)
平均回收率(%)
1.83
1.19
2.91
96.35
1.76
1.19
2.81
95.25
1.45
1.19
2.53
, 百拇医药
95.83
97.40
1.78
1.19
3.01
101.34
RSD=2.54%
1.64
1.19
2.78
98.23
5.4 阴性对照试验:按肠必清处方比例,取青皮、木香适量投料,以同样的工艺制备空白肠溶颗粒,研细,取约0.15g, 精密称定,加水30.0ml,余下操作同4.1项。结果表明,处方的其它成分对总番泻苷的含量测定没有干扰。
, 百拇医药
5.5 含量限度的确定:依法测定14个批号的样品,结果见表3。测定结果,本制剂的含量限度以不低于18mg/g为宜。
表3 14批样品含量测定结果
批号
总番泻苷含量(mg/g)
批号
总番泻苷含量(mg/g)
981012
18.39
940420
23.16
981019
, 百拇医药
17.91
990425
22.71
981103
18.74
990429
20.32
981116
18.84
990504
21.28
981231
19.40
, 百拇医药
990507
21.08
990407
22.66
990518
20.65
990413
23.62
990530
23.04
6 讨论
6.1 本品番泻叶薄层定性方法,曾采用《中国药典》(一部)1995年版番泻叶项下的方法,但分离效果较差,斑点不清晰。经摸索,本文方法效果较好,可以作为质量控制方法。
, 百拇医药
6.2 含量测定方法的提取条件中,旋涡混合2分钟与水浴回流15分钟效果相同,可能是由于该制剂为番泻叶提取物,番泻苷更易提取,从而可以简化操作步骤。
6.3 本文含量测定方法操作比较繁锁,但因所需试剂及设备易得,在目前国内尚无番泻苷标准品的情况下,仍可作为一种质量控制的方法。
6.4 本品做总番泻苷含量回收率实验也可用已知含量的番泻叶细粉,只是番泻叶细粉应先用水浴回流15分钟,再加入已知含量的制剂粉末,否则回收率会偏低。
6.5 比色法测定总番泻苷含量的灵敏度较差,在进行释放度试验时所需样品量较大(20ml),对研究本品的溶出曲线有一定的困难。目前正在摸索高效液相色谱测定本品中番泻苷A含量的方法,一旦方法成熟,即可用于本品的释放度研究。
6.6 《中国药典》尚未收载此种剂型,其质量标准只能参照类似剂型制定,粒度、水分、检查项目参照《中国药典》(一部)1995年版丸剂项下浓缩微丸的规定;释放度则参照《中国药典》(二部)1995年版有关规定。该剂型质量标准的具体条例还需进一步摸索。■
参考文献:
[1]陈象清,陈礼明,田 莉,等.肠必清制剂提取及喷雾干燥工艺[J].中国药房,1998,9(6):248
[2]刘 圣,陈象清,田 莉,等.快速搅拌制备肠必清微丸的工艺研究[J].中国药房,1999,10(5):205
[3]日本药局方[S].1991:965
收稿日期:1999-09-27
修回日期:1999-11-07, 百拇医药