常见致病性曲霉的随机扩增多态性DNA技术分型
http://www.100md.com
中华皮肤科杂志 2000年第5期第33卷
作者:骆志成 王端礼 李若瑜 李世荫
单位:骆志成 王端礼 李若瑜(100034北京大学第一医院皮肤科);李世荫(北京大学第三医院皮肤科)
关键词:曲霉菌属;随机扩增多态性DNA技术
中华皮肤科杂志000502
【摘要】目的对5种常见致病性曲霉进行基因分型研究。方法采用随机扩增多态性DNA分析(RAPD)方法。结果多引物聚类分析表明4个引物可将30株不同来源的烟曲霉分作28个型,3个引物可将10株不同来源的黄曲霉分作9个型。烟曲霉、黄曲霉、黑曲霉、土曲霉和构巢曲霉等5种常见致病性曲霉的多引物聚类分析表明,黄曲霉、黑曲霉、土曲霉与构巢曲霉之间的亲缘关系相对较近,而烟曲霉与上述4种曲霉之间的亲缘关系均相对较远。结论RAPD带型显示曲霉种间差异大于种内差异;RAPD分析结果与曲霉形态学分类特征之间具有良好的一致性。
, 百拇医药
RAPD Typing of the Common Pathogenic Aspergillus Species
LUO Zhicheng,WANG Duanli,LI Ruoyu,et al.
(Department of Dermatology,First Hospital,Peking University,Beijing 100034)
【 Abstract】 Objective To genotype 5 species of common pathogenic Aspergillus. Method The genomic DNAs of Aspergillus spp. were amplified with random amplification of polymorphic DNA (RAPD) technique. Results Multi- primer clustering showed that 30 isolates of A.fumigatus from different geographical areas were classified into 28 patterns with 4 primers,meanwhile 10 isolates of A.flavus from different geographical areas were classified into 9 patterns with 3 primers. The relationship between A.flavus,A.niger,A.terrus and A.nidulans is relatively closer whereas the relationship between A.fumigatus and one of the above 4 species is relatively distant. Conlusion The differences in DNA patterns of Aspergillus between different species are more significant than those between different strains within one species and the RAPD patterns are of good consistency with the morphological characteristics.
, 百拇医药
【 Key words】 Aspergillus Random amplified polymorphic DNA technique
曲霉的准确分类和分型是曲霉属(Aspergillus)系统发生学研究的基础,同时对曲霉感染的流行病学调查和实验室诊断具有重要意义。曲霉分类和分型在传统上以形态学为主,辅之以生理生化实验、酶学分析、次级代谢产物分析及免疫学分析等手段。尽管这些基于表型的分类分型方法仍具有不可替代的基础地位,但它们不可避免地存在某些缺点和不足。基因型分型(即DNA分型)能从遗传分子水平反映生物间的差异,具有重复性好、特异性强及分辨力高等优势[1,2]。随机扩增多态性DNA分析(random amplification of polymorphic DNA,RAPD)可在未知靶序列的情况下进行,是真菌基因型分型中颇有应用前景的一种技术。
材料和方法
, 百拇医药 一、菌株及试剂
1.菌株:临床和环境分离的曲霉共5种55株,包括烟曲霉30株,黄曲霉10株,黑曲霉、土曲霉及构巢曲霉各5株。烟曲霉(A.fum1~A.fum30)A.fum1~A.fum26分离自环境,A.fum27~A.fum30分离自临床;黄曲霉(A.fla1~A.fla10)A.fla1~A.fla5分离自环境,A.fla6~A.fla10分离自临床;黑曲霉(A.nig1~A.nig5)A.nig1~A.nig3分离自环境,A.nig4~A.nig5分离自临床;土曲霉(A.ter1~A.ter5)A.ter1~A.ter3分离自环境,A.ter4~A.ter5分离自临床;构巢曲霉(A.nid1~A.nid5)A.nid1~A.nid4分离自环境,A.nid5分离自临床。将所有菌株转种于查氏琼脂(Czapekagar)平皿,25℃培养7~14d,经菌落和镜下形态学特征重新统一进行鉴定。
2.试剂:氯化苄为北京化学试剂厂生产的分析纯原液;随机引物购自美国Operan公司,选用引物为OPD-01(ACCGCGAAGG)、OPD-03(GTCGCCGTCA)、OPD-05(TGAGCGGACA)和OPD-13(GGGGTGACG
, 百拇医药
A);PCR标记为华美生物工程公司生产,为pBR322被6种内切酶酶切获得,各条带分子量大小依次为1543、994、695、515、377和237bp;其他PCR扩增所用试剂均购自于上海生工生物工程有限公司。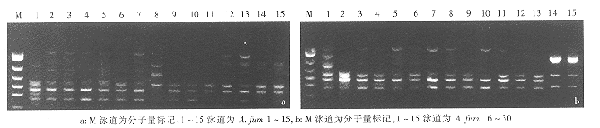
图1引物OPD-05扩增的烟曲霉RAPD带型
二、方法及步骤
1.DNA提取:将菌株转种于马铃薯葡萄糖琼脂(PDA)斜面,28℃~30℃培养7~14d,至菌丝体铺满斜面,小心刮取菌丝体约0.05~0.1g置1.5mLEppendorf管中。然后,采用氯化苄法提取DNA[3]。
2.RAPD分析:PCR反应体系为25μL,成分包括10×缓冲液2.5μL,MgCl2(15mmol/L2.5μL),dNTPs(各2.5mmol/L1.25μL),Primer(7.5ng/μL)2.0μL,TaqDNA聚合酶(5U/μL)0.4μL,模板DNA(约10ng/μL)1.0μL,以四蒸水补足至25μL,混匀,加石蜡油20μL覆盖反应液。扩增反应条件为94℃预变性40s;接着94℃变性20s,35℃退火1min,72℃延伸1min,共45个循环;最后72℃延伸10min。扩增反应在日本Sanyo公司生产的DNA扩增仪中进行。取反应产物10μL与溴酚蓝加样缓冲液2μL混匀,在含溴化乙啶的质量分数2%琼脂糖凝胶上在1×TBE缓冲液中电泳,80V2.5h。电泳后取出凝胶于紫外分析仪观察。所剩反应产物存-20℃,待统一电泳照相。
, http://www.100md.com
3.统计学处理:应用MINTS数值分类软件包进行处理分析。首先用PCR标记作为分子量标记,确定各反应条带在凝胶成像上的相对位置。在同一分子量水平上,有反应条带记作“1”,无反应条带则记作“0”。将所有菌株的反应条带都转换为“1”“0”组成的数据组。单匹配系数SM的计算公式为SM=a×2/(a+b+c),其中a为两菌共有的“1”条带总数,b为其中一菌独有的“1”条带数,c为另一菌独有的“1”。输入每个菌株的“1”、“0”数据后,用MINTS软件可得到单匹配系数矩阵图。然后用该软件中的UPGMA聚类分析法进行表示菌株间亲缘关系的树状图自动生成。
结果
本实验从引物Kit-D盒20个引物中筛选出4个
引物能形成清晰、稳定的反应带型。其中引物OPD-03对烟曲霉的扩增效果较好,而对黄曲霉、黑曲霉、土曲霉和构巢曲霉的扩增条带较弱,数目少或不够稳定。各引物OPD-05对上述5种常见致病性曲霉的RAPD带型分别见图1~3。
, http://www.100md.com
一、烟曲霉种内RAPD分型
30株不同来源的烟曲霉的RAPD带型:根据主带,引物OPD-01产生5个DNA型,其中A.fum8菌为烟曲霉椭孢变种,带型与其他烟曲霉均不相同而自成一型;引物OPD-03产生4个DNA型,其中A.fum8菌带型独特自成一型;引物OPD-05产生3个DNA型,其中A.fum8菌自成一型(图1a);引物OPD-13产生5个DNA型,其中A.fum8菌也自成一型。临床分离株与环境分离株之间未发现特征性差异。多引物UPGMA聚类分析(图4):4个引物产生的RAPD带型可将30株不同来源的烟曲霉分作28个型。在树状图中SM=0.79(79%)相似性水平上30株烟曲霉可分作11个群,其中A.fum8菌自成1群。
二、黄曲霉种内RAPD分型
10株不同来源的黄曲霉的RAPD带型,根据主带,引物OPD-01产生3个DNA型,OPD-05产生6个DNA型(图2),OPD-13产生4个DNA型。5株临床分离株带型比较接近。多引物UPGMA聚类分析结果表明,3个引物可将10株黄曲霉分作9个型。在树状图中SM=0.89(89%)相似性水平上,10株黄曲霉可分作3个群(图5)。
, 百拇医药
三、5种常见致病性曲霉种间RAPD分型
从图1~3可以看出,烟曲霉、黄曲霉、黑曲霉、土曲霉和构巢曲霉同一引物的RAPD带型,种间差异十分显著而且明显大于种内差异。多引物UPGMA聚类分析(图6),3个引物的UPGMA聚类分析树状图上,同种菌株在不同层次基本上各聚为一群。在不同的种间,土曲霉与构巢曲霉之间相距最近,而烟曲霉与其他4种曲霉之间的距离均较远。
讨论
我们对烟曲霉所做的RAPD带型经多引物UPGMA聚类分析,4个10bp引物所产生的RAPD带型将30株不同来源的烟曲霉分作28个型。在树状图中SM=0.79相似水平上,30株烟曲霉可分作11个群,但这些分群与地理分布之间似无明显关系。vanBelkum等[4]用1个22bp引物的RAPD分析将7株烟曲霉分作6个型。Loudon等[5]用2个8bp引物的RAPD分析将19株烟曲霉分作12个型。可见RAPD分析具有很强的分型能力,而且使用的引物越多,其分型能力会越强。Lin等应用IEA、RAPD和RFLP3种方法对35株烟曲霉进行了分型,并对3种方法的分型效果进行了对比评估,结果表明联合使用上述方法可提高分型能力,对烟曲霉来说,RAPD和RFLP联合应用具有最佳的分辨力和可靠性[1]。Rinyu等[2]也用上述方法对61株烟曲霉进行了分型,结果提示RAPD对烟曲霉的分型效果最好,强于IEA,而RFLP分型未能揭示出菌株间的差异。
, http://www.100md.com
图2引物OPD-05扩增的黄曲霉RAPD带型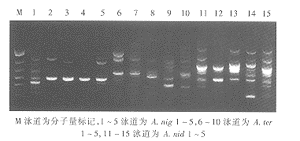
图3引物OPD-05扩增的黑曲霉、土曲霉和构巢曲霉RAPD带型
图4烟曲霉用4种引物(OPD-01、OPD-03、OPD-05和OPD-13)
的RAPD带型菌株间平均相似性聚类分析树状图
图5黄曲霉用3种引物OPD-01、OPD-05和OPD-13的RAPD
带型菌株间相似性聚类分析树状图
, 百拇医药
图6烟曲霉、黄曲霉、黑曲霉、土曲霉和构巢曲霉用3种引物
OPD-01、OPD-05和OPD-13的RAPD带型相似性聚类分析树状图
关于黄曲霉的RAPD分型,我们用3个引物将10株不同来源的黄曲霉分作9个型,而且5株临床分离株(其中4株分离自北京)的带型比较接近,在多引物UPGMA聚类分析树状图SM=0.89相似水平上可分作1群。但究竟是黄曲霉的RAPD带型与地理位置分布之间有关,还是临床分离株与环境分离株之间存在一定的差异,尚有待于进一步研究。
烟曲霉、黄曲霉、黑曲霉、土曲霉和构巢曲霉的RAPD带型的多引物UPGMA聚类分析结果表明,同一种内的不同菌株在不同层次上聚为1群,说明曲霉种内差异小于种间差异。多引物UPGMA聚类分析可反映不同种间的亲缘关系。在我们所做的3个引物UPGMA的聚类分析树状图上,土曲霉与构巢曲霉距离最近,说明二者之间的亲缘关系相对其他菌种更为亲近。这与曲霉属的现代分类学中将土曲霉与构巢曲霉安排在同一亚属(巢状亚属)的观点相一致[6,7]。在该树状图上,烟曲霉与其他4种曲霉的距离均较远,而这4种曲霉之间的距离相对较近,提示烟曲霉与这4种曲霉之间的亲缘关系相对均较远,而这4种曲霉之间的亲缘关系相对较近。在形态学上,烟曲霉为单层瓶梗,而黑曲霉、土曲霉和构巢曲霉均为双层瓶梗,黄曲霉虽可呈单层瓶梗,但多数仍为双层瓶梗。这提示RAPD结果与形态学特征之间有良好的一致性。
, http://www.100md.com
志谢中国科学院微生物研究所齐祖同和孔华中研究员及日本千叶博物馆崛江义一博士惠赠菌株;本院王晓红和万哲技师协助实验
卫生部部属院校临床学科重点项目资助课题
参考文献
[1]Lin D,Lehman PF,Hamory BH,et al. Comparison of three typing methods for clinical and environmental isolates of Aspergillus fumigatus. J Clin Microbiol,1995,33: 1596- 1601.
[2]Rinyu E,Varga J,Ferenczy L. Phenotypic and genotypic of variability in Aspergillus fumgatus. J Clin Microbiol,1995,33: 2567- 2575.
, http://www.100md.com
[3]Zhu H,Jun F,Zhu LH. Isolation of genomic DNA from plant,fungi and bacteria using benzyl chloride. Nucl Acids Res,1993,21: 5279.
[4]van Belkum A,Quint WG,de Pauw BE,et al. Typing of Aspergillus species and Aspergillus fumigatus isolates by interrepeat polymerase chain reaction. J Clin Microbiol,1993,31: 2502- 2505.
[5]Loudon KW,Burnie JP,Coke AP,et al. Application of polymerase chain reaction to fingerprinting Aspergillus fumigatus by random amplification of polymorphic DNA. J Clin Microbiol,1993,31: 1117- 1121.
, 百拇医药
[6]Samson RA,Gams W. Typification of the species of Aspergillus and associated teleomorphs. In: Samson RA,Pitt JI(eds). Advances in Penicillium and Aspergillus Systematics. New York: Plenum Press, 1985.31- 35.
[7]Gams W,Christensen M,Onions AM,et al. Infrageneric taxa of Aspergillus. In: Samson RA,Pitt JI eds. Advances in Penicillium and Aspergillus Systematics. New York: Plenum Press,1985,55- 61.
(收稿日期:2000-01-10), http://www.100md.com
单位:骆志成 王端礼 李若瑜(100034北京大学第一医院皮肤科);李世荫(北京大学第三医院皮肤科)
关键词:曲霉菌属;随机扩增多态性DNA技术
中华皮肤科杂志000502
【摘要】目的对5种常见致病性曲霉进行基因分型研究。方法采用随机扩增多态性DNA分析(RAPD)方法。结果多引物聚类分析表明4个引物可将30株不同来源的烟曲霉分作28个型,3个引物可将10株不同来源的黄曲霉分作9个型。烟曲霉、黄曲霉、黑曲霉、土曲霉和构巢曲霉等5种常见致病性曲霉的多引物聚类分析表明,黄曲霉、黑曲霉、土曲霉与构巢曲霉之间的亲缘关系相对较近,而烟曲霉与上述4种曲霉之间的亲缘关系均相对较远。结论RAPD带型显示曲霉种间差异大于种内差异;RAPD分析结果与曲霉形态学分类特征之间具有良好的一致性。
, 百拇医药
RAPD Typing of the Common Pathogenic Aspergillus Species
LUO Zhicheng,WANG Duanli,LI Ruoyu,et al.
(Department of Dermatology,First Hospital,Peking University,Beijing 100034)
【 Abstract】 Objective To genotype 5 species of common pathogenic Aspergillus. Method The genomic DNAs of Aspergillus spp. were amplified with random amplification of polymorphic DNA (RAPD) technique. Results Multi- primer clustering showed that 30 isolates of A.fumigatus from different geographical areas were classified into 28 patterns with 4 primers,meanwhile 10 isolates of A.flavus from different geographical areas were classified into 9 patterns with 3 primers. The relationship between A.flavus,A.niger,A.terrus and A.nidulans is relatively closer whereas the relationship between A.fumigatus and one of the above 4 species is relatively distant. Conlusion The differences in DNA patterns of Aspergillus between different species are more significant than those between different strains within one species and the RAPD patterns are of good consistency with the morphological characteristics.
, 百拇医药
【 Key words】 Aspergillus Random amplified polymorphic DNA technique
曲霉的准确分类和分型是曲霉属(Aspergillus)系统发生学研究的基础,同时对曲霉感染的流行病学调查和实验室诊断具有重要意义。曲霉分类和分型在传统上以形态学为主,辅之以生理生化实验、酶学分析、次级代谢产物分析及免疫学分析等手段。尽管这些基于表型的分类分型方法仍具有不可替代的基础地位,但它们不可避免地存在某些缺点和不足。基因型分型(即DNA分型)能从遗传分子水平反映生物间的差异,具有重复性好、特异性强及分辨力高等优势[1,2]。随机扩增多态性DNA分析(random amplification of polymorphic DNA,RAPD)可在未知靶序列的情况下进行,是真菌基因型分型中颇有应用前景的一种技术。
材料和方法
, 百拇医药 一、菌株及试剂
1.菌株:临床和环境分离的曲霉共5种55株,包括烟曲霉30株,黄曲霉10株,黑曲霉、土曲霉及构巢曲霉各5株。烟曲霉(A.fum1~A.fum30)A.fum1~A.fum26分离自环境,A.fum27~A.fum30分离自临床;黄曲霉(A.fla1~A.fla10)A.fla1~A.fla5分离自环境,A.fla6~A.fla10分离自临床;黑曲霉(A.nig1~A.nig5)A.nig1~A.nig3分离自环境,A.nig4~A.nig5分离自临床;土曲霉(A.ter1~A.ter5)A.ter1~A.ter3分离自环境,A.ter4~A.ter5分离自临床;构巢曲霉(A.nid1~A.nid5)A.nid1~A.nid4分离自环境,A.nid5分离自临床。将所有菌株转种于查氏琼脂(Czapekagar)平皿,25℃培养7~14d,经菌落和镜下形态学特征重新统一进行鉴定。
2.试剂:氯化苄为北京化学试剂厂生产的分析纯原液;随机引物购自美国Operan公司,选用引物为OPD-01(ACCGCGAAGG)、OPD-03(GTCGCCGTCA)、OPD-05(TGAGCGGACA)和OPD-13(GGGGTGACG
, 百拇医药
A);PCR标记为华美生物工程公司生产,为pBR322被6种内切酶酶切获得,各条带分子量大小依次为1543、994、695、515、377和237bp;其他PCR扩增所用试剂均购自于上海生工生物工程有限公司。

图1引物OPD-05扩增的烟曲霉RAPD带型
二、方法及步骤
1.DNA提取:将菌株转种于马铃薯葡萄糖琼脂(PDA)斜面,28℃~30℃培养7~14d,至菌丝体铺满斜面,小心刮取菌丝体约0.05~0.1g置1.5mLEppendorf管中。然后,采用氯化苄法提取DNA[3]。
2.RAPD分析:PCR反应体系为25μL,成分包括10×缓冲液2.5μL,MgCl2(15mmol/L2.5μL),dNTPs(各2.5mmol/L1.25μL),Primer(7.5ng/μL)2.0μL,TaqDNA聚合酶(5U/μL)0.4μL,模板DNA(约10ng/μL)1.0μL,以四蒸水补足至25μL,混匀,加石蜡油20μL覆盖反应液。扩增反应条件为94℃预变性40s;接着94℃变性20s,35℃退火1min,72℃延伸1min,共45个循环;最后72℃延伸10min。扩增反应在日本Sanyo公司生产的DNA扩增仪中进行。取反应产物10μL与溴酚蓝加样缓冲液2μL混匀,在含溴化乙啶的质量分数2%琼脂糖凝胶上在1×TBE缓冲液中电泳,80V2.5h。电泳后取出凝胶于紫外分析仪观察。所剩反应产物存-20℃,待统一电泳照相。
, http://www.100md.com
3.统计学处理:应用MINTS数值分类软件包进行处理分析。首先用PCR标记作为分子量标记,确定各反应条带在凝胶成像上的相对位置。在同一分子量水平上,有反应条带记作“1”,无反应条带则记作“0”。将所有菌株的反应条带都转换为“1”“0”组成的数据组。单匹配系数SM的计算公式为SM=a×2/(a+b+c),其中a为两菌共有的“1”条带总数,b为其中一菌独有的“1”条带数,c为另一菌独有的“1”。输入每个菌株的“1”、“0”数据后,用MINTS软件可得到单匹配系数矩阵图。然后用该软件中的UPGMA聚类分析法进行表示菌株间亲缘关系的树状图自动生成。
结果
本实验从引物Kit-D盒20个引物中筛选出4个
引物能形成清晰、稳定的反应带型。其中引物OPD-03对烟曲霉的扩增效果较好,而对黄曲霉、黑曲霉、土曲霉和构巢曲霉的扩增条带较弱,数目少或不够稳定。各引物OPD-05对上述5种常见致病性曲霉的RAPD带型分别见图1~3。
, http://www.100md.com
一、烟曲霉种内RAPD分型
30株不同来源的烟曲霉的RAPD带型:根据主带,引物OPD-01产生5个DNA型,其中A.fum8菌为烟曲霉椭孢变种,带型与其他烟曲霉均不相同而自成一型;引物OPD-03产生4个DNA型,其中A.fum8菌带型独特自成一型;引物OPD-05产生3个DNA型,其中A.fum8菌自成一型(图1a);引物OPD-13产生5个DNA型,其中A.fum8菌也自成一型。临床分离株与环境分离株之间未发现特征性差异。多引物UPGMA聚类分析(图4):4个引物产生的RAPD带型可将30株不同来源的烟曲霉分作28个型。在树状图中SM=0.79(79%)相似性水平上30株烟曲霉可分作11个群,其中A.fum8菌自成1群。
二、黄曲霉种内RAPD分型
10株不同来源的黄曲霉的RAPD带型,根据主带,引物OPD-01产生3个DNA型,OPD-05产生6个DNA型(图2),OPD-13产生4个DNA型。5株临床分离株带型比较接近。多引物UPGMA聚类分析结果表明,3个引物可将10株黄曲霉分作9个型。在树状图中SM=0.89(89%)相似性水平上,10株黄曲霉可分作3个群(图5)。
, 百拇医药
三、5种常见致病性曲霉种间RAPD分型
从图1~3可以看出,烟曲霉、黄曲霉、黑曲霉、土曲霉和构巢曲霉同一引物的RAPD带型,种间差异十分显著而且明显大于种内差异。多引物UPGMA聚类分析(图6),3个引物的UPGMA聚类分析树状图上,同种菌株在不同层次基本上各聚为一群。在不同的种间,土曲霉与构巢曲霉之间相距最近,而烟曲霉与其他4种曲霉之间的距离均较远。
讨论
我们对烟曲霉所做的RAPD带型经多引物UPGMA聚类分析,4个10bp引物所产生的RAPD带型将30株不同来源的烟曲霉分作28个型。在树状图中SM=0.79相似水平上,30株烟曲霉可分作11个群,但这些分群与地理分布之间似无明显关系。vanBelkum等[4]用1个22bp引物的RAPD分析将7株烟曲霉分作6个型。Loudon等[5]用2个8bp引物的RAPD分析将19株烟曲霉分作12个型。可见RAPD分析具有很强的分型能力,而且使用的引物越多,其分型能力会越强。Lin等应用IEA、RAPD和RFLP3种方法对35株烟曲霉进行了分型,并对3种方法的分型效果进行了对比评估,结果表明联合使用上述方法可提高分型能力,对烟曲霉来说,RAPD和RFLP联合应用具有最佳的分辨力和可靠性[1]。Rinyu等[2]也用上述方法对61株烟曲霉进行了分型,结果提示RAPD对烟曲霉的分型效果最好,强于IEA,而RFLP分型未能揭示出菌株间的差异。

, http://www.100md.com
图2引物OPD-05扩增的黄曲霉RAPD带型

图3引物OPD-05扩增的黑曲霉、土曲霉和构巢曲霉RAPD带型

图4烟曲霉用4种引物(OPD-01、OPD-03、OPD-05和OPD-13)
的RAPD带型菌株间平均相似性聚类分析树状图

图5黄曲霉用3种引物OPD-01、OPD-05和OPD-13的RAPD
带型菌株间相似性聚类分析树状图

, 百拇医药
图6烟曲霉、黄曲霉、黑曲霉、土曲霉和构巢曲霉用3种引物
OPD-01、OPD-05和OPD-13的RAPD带型相似性聚类分析树状图
关于黄曲霉的RAPD分型,我们用3个引物将10株不同来源的黄曲霉分作9个型,而且5株临床分离株(其中4株分离自北京)的带型比较接近,在多引物UPGMA聚类分析树状图SM=0.89相似水平上可分作1群。但究竟是黄曲霉的RAPD带型与地理位置分布之间有关,还是临床分离株与环境分离株之间存在一定的差异,尚有待于进一步研究。
烟曲霉、黄曲霉、黑曲霉、土曲霉和构巢曲霉的RAPD带型的多引物UPGMA聚类分析结果表明,同一种内的不同菌株在不同层次上聚为1群,说明曲霉种内差异小于种间差异。多引物UPGMA聚类分析可反映不同种间的亲缘关系。在我们所做的3个引物UPGMA的聚类分析树状图上,土曲霉与构巢曲霉距离最近,说明二者之间的亲缘关系相对其他菌种更为亲近。这与曲霉属的现代分类学中将土曲霉与构巢曲霉安排在同一亚属(巢状亚属)的观点相一致[6,7]。在该树状图上,烟曲霉与其他4种曲霉的距离均较远,而这4种曲霉之间的距离相对较近,提示烟曲霉与这4种曲霉之间的亲缘关系相对均较远,而这4种曲霉之间的亲缘关系相对较近。在形态学上,烟曲霉为单层瓶梗,而黑曲霉、土曲霉和构巢曲霉均为双层瓶梗,黄曲霉虽可呈单层瓶梗,但多数仍为双层瓶梗。这提示RAPD结果与形态学特征之间有良好的一致性。
, http://www.100md.com
志谢中国科学院微生物研究所齐祖同和孔华中研究员及日本千叶博物馆崛江义一博士惠赠菌株;本院王晓红和万哲技师协助实验
卫生部部属院校临床学科重点项目资助课题
参考文献
[1]Lin D,Lehman PF,Hamory BH,et al. Comparison of three typing methods for clinical and environmental isolates of Aspergillus fumigatus. J Clin Microbiol,1995,33: 1596- 1601.
[2]Rinyu E,Varga J,Ferenczy L. Phenotypic and genotypic of variability in Aspergillus fumgatus. J Clin Microbiol,1995,33: 2567- 2575.
, http://www.100md.com
[3]Zhu H,Jun F,Zhu LH. Isolation of genomic DNA from plant,fungi and bacteria using benzyl chloride. Nucl Acids Res,1993,21: 5279.
[4]van Belkum A,Quint WG,de Pauw BE,et al. Typing of Aspergillus species and Aspergillus fumigatus isolates by interrepeat polymerase chain reaction. J Clin Microbiol,1993,31: 2502- 2505.
[5]Loudon KW,Burnie JP,Coke AP,et al. Application of polymerase chain reaction to fingerprinting Aspergillus fumigatus by random amplification of polymorphic DNA. J Clin Microbiol,1993,31: 1117- 1121.
, 百拇医药
[6]Samson RA,Gams W. Typification of the species of Aspergillus and associated teleomorphs. In: Samson RA,Pitt JI(eds). Advances in Penicillium and Aspergillus Systematics. New York: Plenum Press, 1985.31- 35.
[7]Gams W,Christensen M,Onions AM,et al. Infrageneric taxa of Aspergillus. In: Samson RA,Pitt JI eds. Advances in Penicillium and Aspergillus Systematics. New York: Plenum Press,1985,55- 61.
(收稿日期:2000-01-10), http://www.100md.com