S/D处理的纤维蛋白胶的张力和稳定性分析
作者:李 征 熊祥政 王 焰
单位:成都生物制品研究所 成都 610063
关键词:S/D处理;纤维蛋白胶;张力和稳定性
华西药学杂志990519 提要 从混合人血浆中制备经S/D处理灭活病毒的纤维蛋白胶,其中有高含量的可凝结纤维蛋白原、von Willebrand因子、因子XⅢ、纤维结合蛋白和低含量的纤维蛋白溶酶原,平均张力达到(135.6±23.6) g/cm2,经免疫电泳分析,S/D处理没有产生新抗原;纤维蛋白胶的稳定性好,S/D残余量不足以引起副反应,S/D处理的纤维蛋白胶能有效替代自体纤维蛋白原或冷沉淀制剂应用于外科手术中。
ANALYSIS OF TENSILE STRENGTH AND STABILITY OF A
, http://www.100md.com SOVENT-DETERGENT TREATED FIBRIN GLUE
Li Zheng Xiong Xiangzheng Wang Yan
(Chengdu Institute of Biological Products Chengdu 610063)
ABSTRACT A fibrin glue preparation has obtained from pooled human plasma using a procedure which includes a solvent-detergent (S/D) treatment to inactivate viruses. The product was found to contain high quantities of fibrinogen, von willebrand factor, factor XⅢ, and low level of plasminogen. The mean tensile strength reached (135.6±23.6) g/cm2. According to immune electrophoresis analysis, S/D treatment did not produce new antigens. The fibrin glue had good stability. The residual S/D was not enough to induce by-effect. S/D treatment fibrin glue should efficiently replace autologous fibrinogen or cryoprecipitate preparations for surgical application.
, 百拇医药
Key Words S/D treatment Fibrin glue Tensile strength and stability
纤维蛋白胶是一种二元粘结剂,成份之一是含有因子XⅢ、纤维结合蛋白等因子的纤维蛋白原;成份之二是凝血酶。使用时将纤维蛋白原溶于抑肽酶溶液中,凝血酶溶于氯化钙溶液中,两者混合敷于伤口即可起到粘结和密封作用。纤维蛋白胶已广泛用于皮肤移植,神经和脉管的吻合,肝、肺和脾组织的外科手术中,部份或全部代替了缝合[1~8]。与合成胶相比,它显示出极好的生物相容性和对生物组织的无毒副作用。实验在查阅大量文献的基础上,经过改进工艺,大大改善了纤维蛋白胶的理化性质,尤其是大幅度提高了它的张力。S/D对纤维蛋白原的处理主要是灭活其中的有害病毒,而对纤维蛋白胶的理化性质无影响。
1 实验部分
1.1 主要材料
, 百拇医药
Cohn组份Ⅰ沉淀糊(自制);磷酸三正丁酯(TNBP,成都化学试剂厂,AR)。吐温80(Tween80,上海大众制药厂)符合中国药典1990年版。兔抗人全血浆抗血清(自制);兔抗人纤维蛋白原抗血清(自制,纤维蛋白原经S/D处理)。
1.2 方法与结果
1.2.1 纤维蛋白原制做工艺 工艺见图1。蛋白组成见表1。
图1 纤维蛋白原制备工艺流程图
Fig 1 Scheme of preparation of fibrinogen
表1 纤维蛋白原制剂蛋白成份的组成
Table 1 Protein composition of fibrinogen preparation Items
, 百拇医药
Content
Total protein(g/L)
51.5±1.25
Clottable fibrinogen(g/L)
47.5±2.34
Fibronectin
5 times pooled human plasma
vWF:Ag
23.9 times pooled human plasma
Fibrinolysin(mg/L)
, http://www.100md.com
48.41±1.45
Factor XⅢ
2.37 times pooled human plasma
1.2.2 张力的测量(gottlob鼠皮试验法)[9] 试验前先将3只小鼠杀死,剥去其背部的皮,将其剪成1 cm2的方块,浸于生理盐水中10 min,在鼠的裸背上涂含有氯化钙的凝血酶(约500 IU/ml),每块鼠皮涂以50μl纤原溶液,然后立即贴回到鼠背上,40 min后测量把鼠皮扯下所需的力的大小,即为张力。张力达到(135.6±23.6) g/cm2(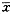 ±s)。由图2的张力时间曲线可以看出,在一定范围内张力随着凝血酶与纤维蛋白原制剂的作用时间增加而增加,最高达到165 g/cm2。平均张力比以前我们报道的有显著提高,已经接近M.Burnouf-Radosevich等报道[13]的张力水平(139±10) g/cm2。
±s)。由图2的张力时间曲线可以看出,在一定范围内张力随着凝血酶与纤维蛋白原制剂的作用时间增加而增加,最高达到165 g/cm2。平均张力比以前我们报道的有显著提高,已经接近M.Burnouf-Radosevich等报道[13]的张力水平(139±10) g/cm2。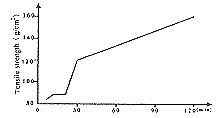
, http://www.100md.com
图2 张力的时间曲线
Fig 2 The variation of tensile strength with time
1.2.3 稳定性试验 观察纤维蛋白原制品室温下放24 h内的变化,并在第0、4、8、24 h测量可凝结纤原的含量及张力变化。室温和37℃放置24 h未发现肉眼可见的颗粒、沉淀等出现(图3、4)。由图可见可凝结纤原和张力只是略有变化。在(2~6)℃放置时由于纤维蛋白原分子量大而析出。
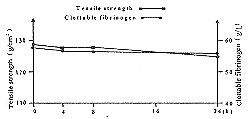
图3 张力和可凝纤原在室温下24 h内的变化
Fig 3 The variation of tensile strength and clottable fibrinogen in 24 hours at ambient temperature
, 百拇医药
图4 定性免疫电泳图谱
Fig 4 Immune electrophoresis spectrum
a Whole human palsma b S/D-treated clarified Cohn frac-tion Ⅰ solution c Clarified Cohn fraction Ⅱ solution d Rab-bit anti-whole human plasma serum e Rabbit anti-S/D-treated fibrinogen serum
1.2.4 蛋白成份的测量 总蛋白浓度用凯氏定氮法测量[10],纤维结合蛋白、von Wille-brand因子(vWF:Ag)和纤维蛋白溶酶原用火箭免疫电泳法测量[11],因子XⅢ的测量参照文献[12];可凝结纤维蛋白原的测量参照文献[10]。
, http://www.100md.com
1.2.5 醋酸纤维薄膜电泳 用pH8.6,0.06 mol的巴比妥钠-巴比妥缓冲液,在110 V下恒压电泳60 min,染色,漂洗,观察结果。纤维蛋白原制品中主要是纤维蛋白原以及少量的α、β-球蛋白。用醋酸纤维薄膜电泳测得纤维蛋白原的含量为78.13%。
1.2.6 S/D处理是否产生新抗原的测定 用定性免疫电泳检测[11]。根据B.Horowitz等人的报道[14],S/D对血浆的处理未产生新的抗原。实验对S/D处理的纤维蛋白原作了免疫学分析。首先,用正常人全血浆和经S/D处理的纤维蛋白原制品免疫家兔,得到两种抗血清。然后进行定性免疫电泳检测看是否有新抗原产生。从免疫电泳图谱上观察(图2),经S/D处理和未经S/D处理的Cohn氏组份Ⅰ溶解液对两种抗血清所形成的电泳图谱完全相同。证明S/D对纤维蛋白原的处理未产生新的抗原。
1.2.7 S/D残余量 以上制品中TNBP和Tween 80残余量的标准分别限定为小于10 ppm和小于100 ppm。据文献报道[15]TNBP和Tween 80对于小鼠的LD50分别为602 mg/kg和5 800 mg/kg。假设一个60 kg的人一次接受100 ml纤维蛋白胶的治疗,其所接受的TNBP和Tween 80最多分别为0.017 mg/kg体重和0.17 mg/kg体重,这些值分别为TNBP和Tween 80对小鼠LD50值的1/35411和1/34117。因此,此残余量不足以引起任何毒副反应。目前全世界已有成千上万的人接受S/D处理的血液制品,还未见由S/D引起的毒副反应的报道。
, http://www.100md.com
2 结论
以Cohn氏组份Ⅰ为起始材料,经S/D病毒灭活,去除S/D,超滤脱醇,除菌分装、冻干而制得的冻干人纤维蛋白胶含有多种微量因子、张力强度大、稳定性好、不产生新抗原并且S/D残余量极微。综上所述,该制品是一种安全、高效、稳定的冻干人纤维蛋白胶制品。
参考文献
1 Kram HB, Shoemaker WC, Hino ST, et al. Splenic salvage using biologic glue. Arch Surg,1984, 119∶1309
2 Barton B, Moore EE, Pearace WH. Fibrin glue a biologic vascular patch-a comparative study. J Surgical Research, 1986, 40∶510
, 百拇医药
3 McCarthy PM, Trastek VF, Bell DG, et al. The effetiveness of fibrin glue sealant for reducing experimental pulmonary air leak. Ann Thorac Surg,1988, 45∶203
4 Bergsland J, Kalmbach T, Balu D, et al. Fibrin seal-an alternative to suture repair in experimental pulmonary surgery. J Surgical Research, 1986, 40∶340
5 Cronkite EP, Lozner EL, Deaver JM, et al. Use of thrombin and fibrinogen in skin grafting. JAMA, 1944, 124∶976
, 百拇医药
6 Ventura R, Torri G, Campari A, et al.Experimental suture of the peripheral nerves with `fibrin glue'. Ital J Orthop Traumatol, 1981, 6∶407
7 Jakob H, Campbell CD, Stemberger A, et al. Combined application of heterologous collagen and fibrin sealant for liver injuries. J Surg Res, 1984, 36∶571
8 Tidrick RT, Warner ED. Fibrin fixation of skin transplants. Surgery, 1944,15∶90
9 Gestring GF, Lerner R.Autologous fibrinogen for tissue-adhesion hemostasis and embolization.Vasc Surg, 1983,17∶293
, 百拇医药
10 中华人民共和国卫生部.中国生物制品规程(一部).北京:中国人口出版社,1995.31,251
11 张龙翔,张庭芳,李令媛等.生化实验方法和技术.北京:高等教育出版社,1981.316,313
12 邓家栋,杨崇礼,杨天楹.血液病实验诊断.天津:天津科学技术出版社,1985.251
13 Burnouf-Radosevich M, Burnouf T, Huart JJ, et al. Biochemical and physical properties of a solvent-detergent-treated fibrin glue. Vox Sang, 1990, 58∶77
14 Horowitz B, Nonomo R, Prince AM, et al. Soluvent-detergent-treated plasma: a virusinactivated substitute for fresh frozen plasma. Blood, 1992,179(3)∶826
15 Piet MPJ, Chin S, Prince AM, et al. The use of tri(n-butyl)phosphate detergent mixtures to inactivate hepatitis viruses and human immunodeficiency virus in plasma and plasma's subsequent fractionation. Transfusion, 1990, 30∶591598, http://www.100md.com
单位:成都生物制品研究所 成都 610063
关键词:S/D处理;纤维蛋白胶;张力和稳定性
华西药学杂志990519 提要 从混合人血浆中制备经S/D处理灭活病毒的纤维蛋白胶,其中有高含量的可凝结纤维蛋白原、von Willebrand因子、因子XⅢ、纤维结合蛋白和低含量的纤维蛋白溶酶原,平均张力达到(135.6±23.6) g/cm2,经免疫电泳分析,S/D处理没有产生新抗原;纤维蛋白胶的稳定性好,S/D残余量不足以引起副反应,S/D处理的纤维蛋白胶能有效替代自体纤维蛋白原或冷沉淀制剂应用于外科手术中。
ANALYSIS OF TENSILE STRENGTH AND STABILITY OF A
, http://www.100md.com SOVENT-DETERGENT TREATED FIBRIN GLUE
Li Zheng Xiong Xiangzheng Wang Yan
(Chengdu Institute of Biological Products Chengdu 610063)
ABSTRACT A fibrin glue preparation has obtained from pooled human plasma using a procedure which includes a solvent-detergent (S/D) treatment to inactivate viruses. The product was found to contain high quantities of fibrinogen, von willebrand factor, factor XⅢ, and low level of plasminogen. The mean tensile strength reached (135.6±23.6) g/cm2. According to immune electrophoresis analysis, S/D treatment did not produce new antigens. The fibrin glue had good stability. The residual S/D was not enough to induce by-effect. S/D treatment fibrin glue should efficiently replace autologous fibrinogen or cryoprecipitate preparations for surgical application.
, 百拇医药
Key Words S/D treatment Fibrin glue Tensile strength and stability
纤维蛋白胶是一种二元粘结剂,成份之一是含有因子XⅢ、纤维结合蛋白等因子的纤维蛋白原;成份之二是凝血酶。使用时将纤维蛋白原溶于抑肽酶溶液中,凝血酶溶于氯化钙溶液中,两者混合敷于伤口即可起到粘结和密封作用。纤维蛋白胶已广泛用于皮肤移植,神经和脉管的吻合,肝、肺和脾组织的外科手术中,部份或全部代替了缝合[1~8]。与合成胶相比,它显示出极好的生物相容性和对生物组织的无毒副作用。实验在查阅大量文献的基础上,经过改进工艺,大大改善了纤维蛋白胶的理化性质,尤其是大幅度提高了它的张力。S/D对纤维蛋白原的处理主要是灭活其中的有害病毒,而对纤维蛋白胶的理化性质无影响。
1 实验部分
1.1 主要材料
, 百拇医药
Cohn组份Ⅰ沉淀糊(自制);磷酸三正丁酯(TNBP,成都化学试剂厂,AR)。吐温80(Tween80,上海大众制药厂)符合中国药典1990年版。兔抗人全血浆抗血清(自制);兔抗人纤维蛋白原抗血清(自制,纤维蛋白原经S/D处理)。
1.2 方法与结果
1.2.1 纤维蛋白原制做工艺 工艺见图1。蛋白组成见表1。

图1 纤维蛋白原制备工艺流程图
Fig 1 Scheme of preparation of fibrinogen
表1 纤维蛋白原制剂蛋白成份的组成
Table 1 Protein composition of fibrinogen preparation Items
, 百拇医药
Content
Total protein(g/L)
51.5±1.25
Clottable fibrinogen(g/L)
47.5±2.34
Fibronectin
5 times pooled human plasma
vWF:Ag
23.9 times pooled human plasma
Fibrinolysin(mg/L)
, http://www.100md.com
48.41±1.45
Factor XⅢ
2.37 times pooled human plasma
1.2.2 张力的测量(gottlob鼠皮试验法)[9] 试验前先将3只小鼠杀死,剥去其背部的皮,将其剪成1 cm2的方块,浸于生理盐水中10 min,在鼠的裸背上涂含有氯化钙的凝血酶(约500 IU/ml),每块鼠皮涂以50μl纤原溶液,然后立即贴回到鼠背上,40 min后测量把鼠皮扯下所需的力的大小,即为张力。张力达到(135.6±23.6) g/cm2(
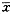 ±s)。由图2的张力时间曲线可以看出,在一定范围内张力随着凝血酶与纤维蛋白原制剂的作用时间增加而增加,最高达到165 g/cm2。平均张力比以前我们报道的有显著提高,已经接近M.Burnouf-Radosevich等报道[13]的张力水平(139±10) g/cm2。
±s)。由图2的张力时间曲线可以看出,在一定范围内张力随着凝血酶与纤维蛋白原制剂的作用时间增加而增加,最高达到165 g/cm2。平均张力比以前我们报道的有显著提高,已经接近M.Burnouf-Radosevich等报道[13]的张力水平(139±10) g/cm2。
, http://www.100md.com
图2 张力的时间曲线
Fig 2 The variation of tensile strength with time
1.2.3 稳定性试验 观察纤维蛋白原制品室温下放24 h内的变化,并在第0、4、8、24 h测量可凝结纤原的含量及张力变化。室温和37℃放置24 h未发现肉眼可见的颗粒、沉淀等出现(图3、4)。由图可见可凝结纤原和张力只是略有变化。在(2~6)℃放置时由于纤维蛋白原分子量大而析出。


图3 张力和可凝纤原在室温下24 h内的变化
Fig 3 The variation of tensile strength and clottable fibrinogen in 24 hours at ambient temperature

, 百拇医药
图4 定性免疫电泳图谱
Fig 4 Immune electrophoresis spectrum
a Whole human palsma b S/D-treated clarified Cohn frac-tion Ⅰ solution c Clarified Cohn fraction Ⅱ solution d Rab-bit anti-whole human plasma serum e Rabbit anti-S/D-treated fibrinogen serum
1.2.4 蛋白成份的测量 总蛋白浓度用凯氏定氮法测量[10],纤维结合蛋白、von Wille-brand因子(vWF:Ag)和纤维蛋白溶酶原用火箭免疫电泳法测量[11],因子XⅢ的测量参照文献[12];可凝结纤维蛋白原的测量参照文献[10]。
, http://www.100md.com
1.2.5 醋酸纤维薄膜电泳 用pH8.6,0.06 mol的巴比妥钠-巴比妥缓冲液,在110 V下恒压电泳60 min,染色,漂洗,观察结果。纤维蛋白原制品中主要是纤维蛋白原以及少量的α、β-球蛋白。用醋酸纤维薄膜电泳测得纤维蛋白原的含量为78.13%。
1.2.6 S/D处理是否产生新抗原的测定 用定性免疫电泳检测[11]。根据B.Horowitz等人的报道[14],S/D对血浆的处理未产生新的抗原。实验对S/D处理的纤维蛋白原作了免疫学分析。首先,用正常人全血浆和经S/D处理的纤维蛋白原制品免疫家兔,得到两种抗血清。然后进行定性免疫电泳检测看是否有新抗原产生。从免疫电泳图谱上观察(图2),经S/D处理和未经S/D处理的Cohn氏组份Ⅰ溶解液对两种抗血清所形成的电泳图谱完全相同。证明S/D对纤维蛋白原的处理未产生新的抗原。
1.2.7 S/D残余量 以上制品中TNBP和Tween 80残余量的标准分别限定为小于10 ppm和小于100 ppm。据文献报道[15]TNBP和Tween 80对于小鼠的LD50分别为602 mg/kg和5 800 mg/kg。假设一个60 kg的人一次接受100 ml纤维蛋白胶的治疗,其所接受的TNBP和Tween 80最多分别为0.017 mg/kg体重和0.17 mg/kg体重,这些值分别为TNBP和Tween 80对小鼠LD50值的1/35411和1/34117。因此,此残余量不足以引起任何毒副反应。目前全世界已有成千上万的人接受S/D处理的血液制品,还未见由S/D引起的毒副反应的报道。
, http://www.100md.com
2 结论
以Cohn氏组份Ⅰ为起始材料,经S/D病毒灭活,去除S/D,超滤脱醇,除菌分装、冻干而制得的冻干人纤维蛋白胶含有多种微量因子、张力强度大、稳定性好、不产生新抗原并且S/D残余量极微。综上所述,该制品是一种安全、高效、稳定的冻干人纤维蛋白胶制品。
参考文献
1 Kram HB, Shoemaker WC, Hino ST, et al. Splenic salvage using biologic glue. Arch Surg,1984, 119∶1309
2 Barton B, Moore EE, Pearace WH. Fibrin glue a biologic vascular patch-a comparative study. J Surgical Research, 1986, 40∶510
, 百拇医药
3 McCarthy PM, Trastek VF, Bell DG, et al. The effetiveness of fibrin glue sealant for reducing experimental pulmonary air leak. Ann Thorac Surg,1988, 45∶203
4 Bergsland J, Kalmbach T, Balu D, et al. Fibrin seal-an alternative to suture repair in experimental pulmonary surgery. J Surgical Research, 1986, 40∶340
5 Cronkite EP, Lozner EL, Deaver JM, et al. Use of thrombin and fibrinogen in skin grafting. JAMA, 1944, 124∶976
, 百拇医药
6 Ventura R, Torri G, Campari A, et al.Experimental suture of the peripheral nerves with `fibrin glue'. Ital J Orthop Traumatol, 1981, 6∶407
7 Jakob H, Campbell CD, Stemberger A, et al. Combined application of heterologous collagen and fibrin sealant for liver injuries. J Surg Res, 1984, 36∶571
8 Tidrick RT, Warner ED. Fibrin fixation of skin transplants. Surgery, 1944,15∶90
9 Gestring GF, Lerner R.Autologous fibrinogen for tissue-adhesion hemostasis and embolization.Vasc Surg, 1983,17∶293
, 百拇医药
10 中华人民共和国卫生部.中国生物制品规程(一部).北京:中国人口出版社,1995.31,251
11 张龙翔,张庭芳,李令媛等.生化实验方法和技术.北京:高等教育出版社,1981.316,313
12 邓家栋,杨崇礼,杨天楹.血液病实验诊断.天津:天津科学技术出版社,1985.251
13 Burnouf-Radosevich M, Burnouf T, Huart JJ, et al. Biochemical and physical properties of a solvent-detergent-treated fibrin glue. Vox Sang, 1990, 58∶77
14 Horowitz B, Nonomo R, Prince AM, et al. Soluvent-detergent-treated plasma: a virusinactivated substitute for fresh frozen plasma. Blood, 1992,179(3)∶826
15 Piet MPJ, Chin S, Prince AM, et al. The use of tri(n-butyl)phosphate detergent mixtures to inactivate hepatitis viruses and human immunodeficiency virus in plasma and plasma's subsequent fractionation. Transfusion, 1990, 30∶591598, http://www.100md.com