微小按蚊种团酯酶同工酶比较研究
作者:王学忠 李菊升 王丕玉
单位:王学忠(云南省疟疾防治研究所,思茅 665000);李菊升(云南省疟疾防治研究所,思茅 665000);王丕玉(云南省疟疾防治研究所,思茅 665000)
关键词:微小按蚊;乌头按蚊;溪流按蚊;酯酶同工酶;电泳
实用寄生虫病杂志000103 摘要 应用聚丙烯酰胺凝胶电泳(PAGE)技术比较分析了3种(微小按蚊、乌头按蚊、溪流按蚊)雌按蚊酯酶(EST)酶谱,EST出现两组区带,微小按蚊(含2个不同地株)存在遗传上的多态现象,乌头按蚊EST酯酶相对简单。各自均有稳定的酶带,并可根据Rm值结合各自特殊酶带区分成3个不同的种。
中图分类号:R384.1 文献标识码:A
文章编号:1005-2534(2000)01-0009-03
, 百拇医药
COMPARISON OF ESTERASE ISOENZYME OF
ANOPHELES MINIMUS GROUP IN YUNNAN
Wang Xuezhong
(Yunnan Institute of Malaria Control, Simao 665000)
Li Jusheng
(Yunnan Institute of Malaria Control, Simao 665000)
Wang Peiyu
(Yunnan Institute of Malaria Control, Simao 665000)
, 百拇医药
ABSTRACT Esterase enzymograms of femal An.minimus, An.aconitus and An. fluviatilis have been compared and analysed by polyacrylamide gel electrophoresis. The results showed that esterase enzymogram of each species revealed stable and respective two band groups. There were genetic polymorphism in both two geographic strains of An. minimus while it was relatively simple in An.aconitus. In addition, the three species could be differentiated by respective band and Rm value.
, http://www.100md.com
Key words:An. minimus; An.aconitus; An.fluviatilis; esterase isoenzyme; electrophoresis
微小按蚊(Anopheles[cellia]minimus Theabald 1901)广泛分布于我国南方山区,是云南省北纬25°以南地区的主要传疟媒介[1]。最近研究认为,微小按蚊是一个复合体,含A、B、C三型,A、C型分布于泰国,B型分布于中国南部[2]。作者以往的研究证明不同地株染色体存在差异,特别是性染色体上出现了不同的着丝粒,对间日疟原虫敏感性也存在一定的差异[1]。乌头按蚊被认为是东南亚的传疟媒介,溪流按蚊幼虫与微小按蚊差别无异,仅靠成蚊作为区别,而且也被认为是我国南方的传疟媒介。对3者比较,确定其EST同工酶酶谱以资鉴别。本研究旨在扩大地区范围对各群体间等位基因遗传情况和分化程度作进一步探讨。
1 材料和方法
, 百拇医药
1.1 蚊虫来源
微小按蚊采自临沧,乌头按蚊和溪流按蚊采自思茅,自然群体带回实验室进行驯化。广西株微小按蚊由广西医学院寄生虫学教研室惠赠。实验室室温26℃±1℃,相对湿度75%~80%,光照(40W日光灯)12h/d。
1.2 蚊虫匀浆的制备
将化蛹6~8h和羽化24~36h雌蚊,取单管培养的单只虫体,群体管取2~5只蚊虫加50μl缓冲液(0.2mol/L Tris 25ml,0.1N HCl 45ml,Triton X-100 0.5ml,双蒸水29.5ml),50μl 50%蔗糖,在微型匀浆器内冰浴磨碎,3 500r/min离心。电泳时把每次离心出的全部上清液加入凝胶槽内。
1.3 电泳
采用垂直平板聚丙烯酰胺凝胶电泳,根据文献[2]方法进行。制备7.5%分离胶 pH8.9和2.5%浓缩胶 pH6.7,Tris-甘氨酸系统。电压:浓缩胶为240V,分离胶为360V,在4℃冰箱内进行,以溴酚蓝为指示剂,当指示剂到达边缘时停止电泳。电泳时间约2h,在BIO-RAD3000型恒压稳流电泳仪中进行。
, 百拇医药
1.4 染色
取40mg醋酸-α-萘酯,用4ml丙酮溶解,染色前加入pH6.4磷酸缓冲液40ml,40mg坚牢兰RR(Fast blue RR),把凝胶放入盛有染色液的培养皿中,于37℃水浴15min,用7%醋酸漂洗脱色,制成干胶片或浸于该液中保存。
2 结果
两地株微小按蚊与乌头按蚊比较,EST同工酶酶谱,微小按蚊不论单母系子代和群体均显示出Ⅰ、Ⅱ两组区带,乌头按蚊Ⅰ区带不明显,Ⅱ区带显示明显,溪流按蚊和乌头按蚊一样Ⅰ区带不清、Ⅱ区带较明显。近负极Ⅰ区带全部为淡染,证明酯酶活性较弱,靠近正极Ⅱ区带而以深染带为主,酯酶活性较强,两地株微小按蚊Rm值(Relative mobility)均存在着明显的差异,乌头按蚊与微小按蚊Rm值存在着明显的差异,足以区别两种按蚊分别为各自独立的种。
临沧株与广西株的Rm值存在着差异,但二者均未大于1.00。临沧株成蚊分别为:0.18、0.26、0.49、0.58、0.64、0.71、0.90、1.00;蛹分别为:0.21、0.26、0.62、0.67、0.71、0.75、0.78、0.88、0.92、0.98。广西株成蚊Ⅰ区带显带不清,蛹的Ⅰ区带出现一条和其他地株不同单一的条区带,其成蚊分别为:0.62、0.63、0.65、0.71、0.90、1.00;蛹为:0.26、0.62、0.66、0.82、0.90、1.00。乌头按蚊Ⅰ区带不出现,而Ⅱ区带仅有1条0.80的带。溪流按蚊Ⅰ区带显带不清,Ⅱ区带分别为0.63、0.68、0.75、0.80条带(图1)。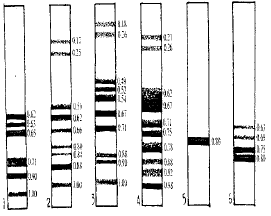
, http://www.100md.com
图1.微小按蚊种团酯酶同工酶比较
1,2.广西微小按蚊成蚊,蛹,3,4.临沧微小按蚊成蚊,蛹,5.乌头按蚊,6.溪流按蚊。
3 讨论
微小按蚊种型特征的研究,仍应用经典的形态分类结合电镜扫描和用染色体、同工酶酶谱和DNA遗传分类两大类型。最近的研究证明微小按蚊是一个复合体,A型分布于整个泰国,B型分布于中国南部,C型仅分布于泰国西部。Sucharit.S用成虫和卵形态特征结合电镜证明,C型成蚊翅前缘脉具分脉前白斑(PSP)和肩白斑(HP),卵船表面不完整和缘饰不规则。作者根据以往的研究表明,云南西部微小按蚊卵也有船面不完整,但数量极少(6/350)占1.71%,认为是变异引起。对云南微小按蚊随机扩增多态DNA及遗传分化关系的研究表明,从遗传距离指数构建分子聚类树可见,受试的29只微小按蚊可归并5个显著不同的组,对应于5个样品源的5个地株。云南微小按蚊的地理群体间基因流程度不高,存在着遗传分化[3]。本文报道的两个地株微小按蚊Est Ⅱ虽不尽相同,但也有相似的酶谱带型。临沧株成蚊Ⅰ区带显带不清,而蛹Ⅰ区带显带较清晰。各自的Rm值都相对稳定,其中以Est[-71],Est[-80]Est[-88]占优势,而且出现频率较高。由此可见两地株Est同工酶存在多态性,遗传一致性(Ⅰ)并不一致,临沧株Ⅰ=0.85、广西Ⅰ=0.95。同时再一次证明了微小按蚊各群体间已出现了分化现象,但其分化程度未超出种和亚种的分子水平,而且各群体间有鲜明的地域性,形成了独立的地理品质。各群体间对间日疟原虫敏感性上存在一定的差异(最高的83.3%镇定,最低为44.8%元阳,(P<0.01)[1]。以往自然感染调查,各群体间的感染率也不尽相同(思茅0.21%、景洪0.78%、潞西1.2%、广西0.11%),由于不同地理群体间遗传上的相对独立性导致不同地域的疟疾流行强度,作者认为,目前要有效控制微小按蚊,首先应因地制宜,根据各地的实际情况制定出一整套行之有效的技术方案,才能取得事半功倍的成果。
, http://www.100md.com
微小按蚊种团成员间的形态分类,由于形态上的差异较小,给分类带来了许多困难。微小按蚊与溪流按蚊近似,二者杂交可以产生健壮的子代,各虫期的发育和生长正常,子代形态也无固定的母体特征,这表明两者在形态及其遗传性上无明显区别特征。许锦江等认为翅前缘脉上分脉前白斑的有无和分脉白斑与分脉暗斑比例的大小,是鉴别二者的重要依据[7]。乌头按蚊与上述的微小按蚊和溪流按蚊形态比较近似,加上多个体变异,鉴别时也出现困难。本研究用酯酶同工酶可以根据酶谱带型和各自相对稳定的Rm值区分三个不同的种,但仍需应用分子生物学手段加以证实。
参考文献
1,王学忠,王丕玉,李菊升.云南微小按蚊(Anopheles minimus)种型和间日疟原虫感染性初步研究〔J〕.寄生虫与医学昆虫学报,1995;2(4)∶223
2,王学忠,李菊升,王丕玉.云南不同地株微小按蚊酯酶同工酶比较研究〔J〕.中国媒介生物学及控制杂志,1996;7(5)∶321
, http://www.100md.com
3,陈永久,王学忠,王丕玉,等.云南微小按蚊随机扩增多态DNA及遗传分化关系〔J〕.动物学研究,1998;19(3)∶184
4,叶奕英,许政拱,黄若密,等.广西和云南两地微小按蚊的杂交试验〔J〕.中国寄生虫学与寄生虫病杂志,1992;10(4)∶287
5,Sucharit S,Kowalamisar N,Leemingsawat S et al.Population genetic studies on the Anopheles minimus complex in Thailand〔J〕.Southeast Asian J Trop Med Pub Hlth,1988;19(4)∶717
6,Sucharit S,et al.New evidence for the differed character of Anopheles minimus species complex〔J〕.Mosquito-Borne Dis Bull,1995;12(1)∶1
7,许锦江,罗幸福,汤林华.微小按蚊和溪流按蚊翅斑形态的比较〔J〕.中国寄生虫学与寄生虫病杂志,1998;16(2)∶89
8,周祖杰.中国疟疾的防治研究〔M〕,北京:人民卫生出版社,1991:122
9,董学书.云南蚊类志〔M〕.上卷(按蚊亚科).昆明:云南科技出版社,1993:170, http://www.100md.com
单位:王学忠(云南省疟疾防治研究所,思茅 665000);李菊升(云南省疟疾防治研究所,思茅 665000);王丕玉(云南省疟疾防治研究所,思茅 665000)
关键词:微小按蚊;乌头按蚊;溪流按蚊;酯酶同工酶;电泳
实用寄生虫病杂志000103 摘要 应用聚丙烯酰胺凝胶电泳(PAGE)技术比较分析了3种(微小按蚊、乌头按蚊、溪流按蚊)雌按蚊酯酶(EST)酶谱,EST出现两组区带,微小按蚊(含2个不同地株)存在遗传上的多态现象,乌头按蚊EST酯酶相对简单。各自均有稳定的酶带,并可根据Rm值结合各自特殊酶带区分成3个不同的种。
中图分类号:R384.1 文献标识码:A
文章编号:1005-2534(2000)01-0009-03
, 百拇医药
COMPARISON OF ESTERASE ISOENZYME OF
ANOPHELES MINIMUS GROUP IN YUNNAN
Wang Xuezhong
(Yunnan Institute of Malaria Control, Simao 665000)
Li Jusheng
(Yunnan Institute of Malaria Control, Simao 665000)
Wang Peiyu
(Yunnan Institute of Malaria Control, Simao 665000)
, 百拇医药
ABSTRACT Esterase enzymograms of femal An.minimus, An.aconitus and An. fluviatilis have been compared and analysed by polyacrylamide gel electrophoresis. The results showed that esterase enzymogram of each species revealed stable and respective two band groups. There were genetic polymorphism in both two geographic strains of An. minimus while it was relatively simple in An.aconitus. In addition, the three species could be differentiated by respective band and Rm value.
, http://www.100md.com
Key words:An. minimus; An.aconitus; An.fluviatilis; esterase isoenzyme; electrophoresis
微小按蚊(Anopheles[cellia]minimus Theabald 1901)广泛分布于我国南方山区,是云南省北纬25°以南地区的主要传疟媒介[1]。最近研究认为,微小按蚊是一个复合体,含A、B、C三型,A、C型分布于泰国,B型分布于中国南部[2]。作者以往的研究证明不同地株染色体存在差异,特别是性染色体上出现了不同的着丝粒,对间日疟原虫敏感性也存在一定的差异[1]。乌头按蚊被认为是东南亚的传疟媒介,溪流按蚊幼虫与微小按蚊差别无异,仅靠成蚊作为区别,而且也被认为是我国南方的传疟媒介。对3者比较,确定其EST同工酶酶谱以资鉴别。本研究旨在扩大地区范围对各群体间等位基因遗传情况和分化程度作进一步探讨。
1 材料和方法
, 百拇医药
1.1 蚊虫来源
微小按蚊采自临沧,乌头按蚊和溪流按蚊采自思茅,自然群体带回实验室进行驯化。广西株微小按蚊由广西医学院寄生虫学教研室惠赠。实验室室温26℃±1℃,相对湿度75%~80%,光照(40W日光灯)12h/d。
1.2 蚊虫匀浆的制备
将化蛹6~8h和羽化24~36h雌蚊,取单管培养的单只虫体,群体管取2~5只蚊虫加50μl缓冲液(0.2mol/L Tris 25ml,0.1N HCl 45ml,Triton X-100 0.5ml,双蒸水29.5ml),50μl 50%蔗糖,在微型匀浆器内冰浴磨碎,3 500r/min离心。电泳时把每次离心出的全部上清液加入凝胶槽内。
1.3 电泳
采用垂直平板聚丙烯酰胺凝胶电泳,根据文献[2]方法进行。制备7.5%分离胶 pH8.9和2.5%浓缩胶 pH6.7,Tris-甘氨酸系统。电压:浓缩胶为240V,分离胶为360V,在4℃冰箱内进行,以溴酚蓝为指示剂,当指示剂到达边缘时停止电泳。电泳时间约2h,在BIO-RAD3000型恒压稳流电泳仪中进行。
, 百拇医药
1.4 染色
取40mg醋酸-α-萘酯,用4ml丙酮溶解,染色前加入pH6.4磷酸缓冲液40ml,40mg坚牢兰RR(Fast blue RR),把凝胶放入盛有染色液的培养皿中,于37℃水浴15min,用7%醋酸漂洗脱色,制成干胶片或浸于该液中保存。
2 结果
两地株微小按蚊与乌头按蚊比较,EST同工酶酶谱,微小按蚊不论单母系子代和群体均显示出Ⅰ、Ⅱ两组区带,乌头按蚊Ⅰ区带不明显,Ⅱ区带显示明显,溪流按蚊和乌头按蚊一样Ⅰ区带不清、Ⅱ区带较明显。近负极Ⅰ区带全部为淡染,证明酯酶活性较弱,靠近正极Ⅱ区带而以深染带为主,酯酶活性较强,两地株微小按蚊Rm值(Relative mobility)均存在着明显的差异,乌头按蚊与微小按蚊Rm值存在着明显的差异,足以区别两种按蚊分别为各自独立的种。
临沧株与广西株的Rm值存在着差异,但二者均未大于1.00。临沧株成蚊分别为:0.18、0.26、0.49、0.58、0.64、0.71、0.90、1.00;蛹分别为:0.21、0.26、0.62、0.67、0.71、0.75、0.78、0.88、0.92、0.98。广西株成蚊Ⅰ区带显带不清,蛹的Ⅰ区带出现一条和其他地株不同单一的条区带,其成蚊分别为:0.62、0.63、0.65、0.71、0.90、1.00;蛹为:0.26、0.62、0.66、0.82、0.90、1.00。乌头按蚊Ⅰ区带不出现,而Ⅱ区带仅有1条0.80的带。溪流按蚊Ⅰ区带显带不清,Ⅱ区带分别为0.63、0.68、0.75、0.80条带(图1)。

, http://www.100md.com
图1.微小按蚊种团酯酶同工酶比较
1,2.广西微小按蚊成蚊,蛹,3,4.临沧微小按蚊成蚊,蛹,5.乌头按蚊,6.溪流按蚊。
3 讨论
微小按蚊种型特征的研究,仍应用经典的形态分类结合电镜扫描和用染色体、同工酶酶谱和DNA遗传分类两大类型。最近的研究证明微小按蚊是一个复合体,A型分布于整个泰国,B型分布于中国南部,C型仅分布于泰国西部。Sucharit.S用成虫和卵形态特征结合电镜证明,C型成蚊翅前缘脉具分脉前白斑(PSP)和肩白斑(HP),卵船表面不完整和缘饰不规则。作者根据以往的研究表明,云南西部微小按蚊卵也有船面不完整,但数量极少(6/350)占1.71%,认为是变异引起。对云南微小按蚊随机扩增多态DNA及遗传分化关系的研究表明,从遗传距离指数构建分子聚类树可见,受试的29只微小按蚊可归并5个显著不同的组,对应于5个样品源的5个地株。云南微小按蚊的地理群体间基因流程度不高,存在着遗传分化[3]。本文报道的两个地株微小按蚊Est Ⅱ虽不尽相同,但也有相似的酶谱带型。临沧株成蚊Ⅰ区带显带不清,而蛹Ⅰ区带显带较清晰。各自的Rm值都相对稳定,其中以Est[-71],Est[-80]Est[-88]占优势,而且出现频率较高。由此可见两地株Est同工酶存在多态性,遗传一致性(Ⅰ)并不一致,临沧株Ⅰ=0.85、广西Ⅰ=0.95。同时再一次证明了微小按蚊各群体间已出现了分化现象,但其分化程度未超出种和亚种的分子水平,而且各群体间有鲜明的地域性,形成了独立的地理品质。各群体间对间日疟原虫敏感性上存在一定的差异(最高的83.3%镇定,最低为44.8%元阳,(P<0.01)[1]。以往自然感染调查,各群体间的感染率也不尽相同(思茅0.21%、景洪0.78%、潞西1.2%、广西0.11%),由于不同地理群体间遗传上的相对独立性导致不同地域的疟疾流行强度,作者认为,目前要有效控制微小按蚊,首先应因地制宜,根据各地的实际情况制定出一整套行之有效的技术方案,才能取得事半功倍的成果。
, http://www.100md.com
微小按蚊种团成员间的形态分类,由于形态上的差异较小,给分类带来了许多困难。微小按蚊与溪流按蚊近似,二者杂交可以产生健壮的子代,各虫期的发育和生长正常,子代形态也无固定的母体特征,这表明两者在形态及其遗传性上无明显区别特征。许锦江等认为翅前缘脉上分脉前白斑的有无和分脉白斑与分脉暗斑比例的大小,是鉴别二者的重要依据[7]。乌头按蚊与上述的微小按蚊和溪流按蚊形态比较近似,加上多个体变异,鉴别时也出现困难。本研究用酯酶同工酶可以根据酶谱带型和各自相对稳定的Rm值区分三个不同的种,但仍需应用分子生物学手段加以证实。
参考文献
1,王学忠,王丕玉,李菊升.云南微小按蚊(Anopheles minimus)种型和间日疟原虫感染性初步研究〔J〕.寄生虫与医学昆虫学报,1995;2(4)∶223
2,王学忠,李菊升,王丕玉.云南不同地株微小按蚊酯酶同工酶比较研究〔J〕.中国媒介生物学及控制杂志,1996;7(5)∶321
, http://www.100md.com
3,陈永久,王学忠,王丕玉,等.云南微小按蚊随机扩增多态DNA及遗传分化关系〔J〕.动物学研究,1998;19(3)∶184
4,叶奕英,许政拱,黄若密,等.广西和云南两地微小按蚊的杂交试验〔J〕.中国寄生虫学与寄生虫病杂志,1992;10(4)∶287
5,Sucharit S,Kowalamisar N,Leemingsawat S et al.Population genetic studies on the Anopheles minimus complex in Thailand〔J〕.Southeast Asian J Trop Med Pub Hlth,1988;19(4)∶717
6,Sucharit S,et al.New evidence for the differed character of Anopheles minimus species complex〔J〕.Mosquito-Borne Dis Bull,1995;12(1)∶1
7,许锦江,罗幸福,汤林华.微小按蚊和溪流按蚊翅斑形态的比较〔J〕.中国寄生虫学与寄生虫病杂志,1998;16(2)∶89
8,周祖杰.中国疟疾的防治研究〔M〕,北京:人民卫生出版社,1991:122
9,董学书.云南蚊类志〔M〕.上卷(按蚊亚科).昆明:云南科技出版社,1993:170, http://www.100md.com