茶多酚在体外诱导HL-60细胞的凋亡
作者:赵燕 曹进 刘箭卫 祝和成 马洪
单位:赵燕 曹进 刘箭卫 湖南医科大学茶与健康研究室(长沙410078);祝和成 马洪 湖南医科大学肿瘤研究所
关键词:茶;酚类;白血病
中国病理生理杂志990321 摘 要 目的:寻找新的肿瘤细胞凋亡诱导剂。方法:选用茶的主要活性成分茶多酚,采用噻唑蓝(MTT)还原法,DNA凝胶电泳以及透射电镜技术,在体外观察了茶多酚对人急性早幼粒白血病细胞(HL-60)凋亡的影响。结果:被250 mg/L茶多酚作用5 h后HL-60细胞进行凝胶电泳呈现出典型的DNA条带,透射电镜下看到凋亡小体,茶多酚对HL-60细胞凋亡的诱导活性平行于它的细胞杀伤作用。结论:在体外培养条件下,茶多酚可诱导HL-60细胞凋亡。
Induction of apoptosis by tea polyphenols in HL-60 cells
, 百拇医药
ZHAO Yan, CAO Jin, ZHU He-Cheng, MA Hong, LIU Jian-Wei
Tea and Health Lab. Hunan Medical University, Changsha (410078)
Abstract AIM To study anticarcinogenic mechanism of polyphenolic compounds in tea.METHODS: The apoptosis inducing effects of tea polyphenols (TP), the main active component purified from tea, were observed on the human promyelocytic leukemic cell (HL-60) by thiazolyl blue tetrazolium bromide reduction test, DNA agarose gel electrophoresis and transmission electronic microscopy technique.RESULTS:After treating HL-60 cells with TP in 250mg.L-1 for 5h, DNA extracted from HL-60 cells showed a typical internucleosomal DNA degradation, i.e., DNA ladder and apoptosis vehicles were observed. The effect of TP was showed to parallel with its cytotoxic activity in HL-60 cells.CONCLUSION:The mechanism of antitumor action of TP is related to its apoptosis inducing activity.
, 百拇医药
MeSH Tea; Phenols; Leukemia
茶多酚(tea polyphenols)是以茶中酚类及其衍生物为主的酚性化合物。一些研究表明[1,2],茶多酚对癌症具有良好的化学预防作用,其机理是茶多酚类化合物具有明显的拮抗促癌物12-氧-十四烷佛波醇-13-乙酸酯(12-0-tetra-decanoylphorbol-13-acetate,TPA)的多种生物学作用,以及抑制与致癌物代谢活化相关的细胞色素P450酶系。为进一步探讨茶多酚抑制癌变的机制,本实验观察了茶多酚对体外培养的HL-60细胞凋亡的影响。
材料与方法
一、材料:
(一)细胞系及培养条件:人急性早幼粒白血病细胞株(human acute promyelocytic leukemia cell line: HL-60),由本校血液生理研究室提供。接种于含15%小牛血清(华美生物工程公司,经56℃,30 min灭活),100 U.mL-1青霉素及100μg.mL-1链霉素的RPMI-1640培养液,在37℃含体积分数为5%CO2的培养箱内培养传代;4℃ 1000r/min离心5~10 min收集。
, 百拇医药
(二)药品与试剂:茶多酚由本校茶与健康研究室提供(含量86.0%),生理盐水溶解,0.45 μm微孔滤膜灭菌备用。喜树碱(camptothecin, CAM)(广西东兰制药厂)用二甲基亚砜(DMSO)溶解,RNase A(华美生物技术公司)和Proteinase K(美国,BTL):均按分子克隆操作指南[3]配成10 mg.mL-1,分装后置-20℃存放。Nonidet P-40(NP-40):Fluka产品。溴化噻唑蓝四唑(thiazolyl blue tetrazolium bromide: MTT):Fluka产品。琼脂糖(agarose):美国BRL产品,bp Marker DNA:华美生物技术公司,其余均为国产分析纯试剂。
二、方法:
(一)MTT还原反应测定肿瘤细胞存活率:参照文献[4]将对数生长期细胞稀释成1×105 cells.mL-1接种于96孔培养板,每孔0.2 mL,接种同时加不同浓度茶多酚处理,每个浓度平行4孔,对照组加等体积培养液,置37℃体积分数为5%CO2培养箱培养,48 h后取出96孔培养板,每孔加入新配制的1 mg.mL-1 MTT 50μL,混匀,置37℃,体积分数为5%CO2培养箱内继续培养4 h,再离心,弃上清液后每孔加200 μL DMSO,振荡10 min,溶解MTT甲月 赞沉淀,用EL309型酶标仪,以570 nm为实验波长,450 nm为参考波长测定其吸收度,按下式计算肿瘤细胞存活率及杀伤率并计算IC50: 肿瘤细胞杀伤率=1-肿瘤细胞存活率
肿瘤细胞杀伤率=1-肿瘤细胞存活率
, 百拇医药
(二)细胞DNA的提取及琼脂糖凝胶电泳:参照文献[5]收集3×106细胞,用含2 mmol.L-1EDTA的PBS洗2次,加0.3 mL TBE缓冲液(Triscl.HCL 45 mmol.L-1,pH8.0,含1 mmol.L-1EDTA),0.25%NP-40及RNase A(终浓度为1%),混匀后,37℃保温30 min,再加入Proteinasek(终浓度为1 g.L-1),37℃继续保温30 min,取上清液45 μL加5 μL上样缓冲液。在1.5%琼脂糖凝胶上电泳(3 V.cm-1),紫外灯下观察并摄影。
, http://www.100md.com
(三)细胞形态学观察:收集适量茶多酚处理后的HL-60细胞,离心沉淀,2.5%戊二醛前固定,0.1 mol/L蔗糖磷酸盐缓冲液清洗,1%锇酸PBS(pH 7.4)后固定(4℃),丙酮乙醇梯度脱水,Epon812包埋,LKB 8800型超薄切片机切片,醋酸铀、硝酸铅双层染色,日立H 600透射电镜,摄影。
结果
(一)茶多酚对HL-60细胞毒作用:茶多酚处理HL-60细胞48 h后,仅有近11%细胞成活,茶多酚对HL-60细胞的IC50值为732.2 μg.mL-1。
表1 茶多酚作用于HL-60细胞培养液的pH变化
Tab 1 Changes of pH in HL-60 cells treated with tea polyphenols ( ±s,n=4) TP concentration
±s,n=4) TP concentration
, http://www.100md.com
(mg/L)
pH
Untreated with
Treated with
Treated with TP for
TP
TP
48 h
0
6.92±0.01*
62.5
6.95±0.01
, 百拇医药
6.93±0.08
125
6.89±0.04
6.91±0.04
250
6.91±0.11
6.92±0.05
500
6.94±0.02
6.95±0.08
1000
6.90±0.09
, http://www.100md.com
6.89±0.07
2000
6.93±0.13
6.90±0.06
4000
6.89±0.01
6.88±0.10
*P>0.05,vs treated with TP, TP=tea polyphenols
(二)茶多酚诱导HL-60细胞凋亡-以核小体间DNA降解为标志:Dive等[6]报道,0.15 μmol.L-1喜树碱作用3 h即诱导HL-60细胞凋亡,细胞DNA在琼脂糖凝胶电泳上显示DNA梯状带型ladder。本文以喜树碱作阳性对照药,发现250 mg.L-1茶多酚作用5 h即诱导HL-60细胞产生类似喜树碱作用后的DNA条带,大小相当于180 bp或180 bp的整倍数,提示茶多酚能诱导HL-60细胞产生凋亡。电泳图1A显示,当茶多酚浓度为250 mg.L-1时,隐约可见DNA带谱,当茶多酚浓度至500 mg.L-1,DNA条带明显,当茶多酚浓度至1000 mg.L-1,DNA条带亮度增加。此后,浓度升到2000 mg.L-1时,未出现DNA条带。
, 百拇医药
表2 茶多酚作用后HL-60细胞存活率
Tab 2 Survival rate of HL-60 cells treated with tea polyphenols (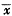 ±s,n=4) Concentration
±s,n=4) Concentration
62.5
125
250
500
1000
2000
4000
, http://www.100md.com (mg.L-1)
Survivalrate
94.8±
89.4±
84.7±
61.4±
38.2±
25.8±
11.4±
(%)
0.39
1.02
, http://www.100md.com
0.78
0.47
0.61
0.39
0.54
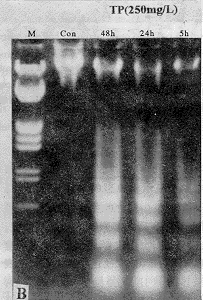
Fig 1A:Degradation of DNA from HL-60 cells treated with TP. Lane Con: Control. Lane CAM: 0.17 μmol.L-1 of camptothecin. Lane M:λ DNA Hind Ⅲ digested. B: Time course of degration of DNA from HL-60 cells incubated with 250 mg/L TP. Lane Con: Control. Lane M: λ DNA/EcoR Ⅰ+Hind Ⅲ digested
, 百拇医药
图1 HL-60细胞电泳剂量-时间效应关系
250 μg.mL-1茶多酚作用于HL-60细胞不同时间后细胞DNA的降解程度见图1B。最初48 h内,茶多酚引起的DNA降解随作用时间延长而增强,因此低浓度茶多酚作用较长时间也能引起明显的DNA降解,但96 h作用组由于细胞大部分死亡而无法检测。
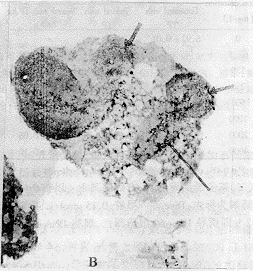
(三)茶多酚诱导HL-60细胞凋亡的细胞形态变化:图2A为未经药物作用的HL-60细胞透射电镜观察结果。图2B则为经250μg*mL-1茶多酚作用5 h后HL-60细胞透射电镜观察的结果,HL-60细胞染色体凝集裂解成碎片后整个细胞碎裂成由膜包绕的不连续的凋亡小体。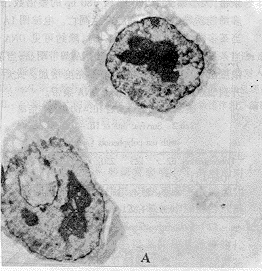
, http://www.100md.com
Fig 2 Changes in the morphology of HL-60 cells untreated and treated with TP.A:×3500,HL-60 cells untreated with TP. B:×5000, 250 mg/L TP treatment on HL-60 cells for 24 h displayed as apoptotic vehicles.
图2 对照组和茶多酚组HL-60细胞超微形态变化
讨论
细胞凋亡具有独特的生化和形态学特征,凋亡细胞在琼脂凝胶电泳上显示出典型的DNA条带[7],目前认为,这是判断细胞发生凋亡的主要标志[5]。在形态学上,细胞凋亡首先表现为细胞核的一系列改变,如染色体断裂、聚集,进而固缩,核膜崩解,细胞浆空泡变、固缩,最后胞膜凸出,形成凋亡小体。本实验表明,250μg*mL-1茶多酚与HL-60细胞作用24 h后,DNA电泳显示出典型的DNA条带(图2),透射电镜观察到凋亡小体。从DNA电泳剂量-效应关系中可看到,茶多酚诱导HL-60细胞凋亡的最适浓度在500~1000μg*mL-1之间。DNA电泳时间-效应关系结果提示,最适时间在24~48 h之内。由此可见,茶多酚诱导HL-60细胞凋亡具有较强的浓度和时间依赖性。并且,茶多酚对HL-60细胞凋亡的诱导活性平行于它的细胞杀伤作用。本实验以喜树碱作为阳性对照药,进一步验证茶多酚诱导HL-60细胞凋亡的作用,其结果提示,在体外培养条件下可诱导HL-60细胞凋亡。
, 百拇医药
谢冰芬等报道[8],绿茶提取物对DNA拓朴异构酶Ⅱ有显著的抑制作用。而Bertrand等[9]用拓朴异构酶抑制剂处理HL-60细胞。Ling[10]用拓朴异构酶抑制剂doxorubicin和annamycin处理鼠白血病P 388细胞时,均出现了DNA的降解,即癌细胞的凋亡。DNA拓朴异构酶是一种存在细胞核内的酶,通常细胞凋亡的最主要生化变化是内源性Ca2+、Mg2+依赖性核酸内切酶被激活而使染色体DNA双链变短,但拓朴异构酶抑制剂可直接渗入细胞DNA中,损伤DNA使之裂解成较大的核酸片断,继而触发核酸内切酶对其进一步作用,这种裂解成较大的核酸片断不象核酸内切酶活性那样依赖于Ca2+,但可被bcl-2的表达所抑制,表明这仍是细胞凋亡的过程[9]。综上所述,茶多酚在体外诱导HL-60细胞凋亡的途径可能是通过对拓朴异构酶的抑制而体现的。
参考文献
, 百拇医药
1 童 彤,程书钧,李秀琴,等.没食子酰表没食子儿茶素对促癌物TPA抑制作用的研究.癌变.畸变.突变,1992,4(1):1.
2 冯 磊,余应年,刘志强,等.茶多酚对人羊膜上皮细胞FL形成B(a)P-DNA加成物的影响.癌变.畸变.突变,1995,2:65.
3 Subivade I,Fernandez Y,Periquet A.Catechin protection of 3T3 swiss fibroblasts in culture under oxidative stress.Biol Trace Elem Reo,1995,47:313.
4 Mosmann T. Rapid colormetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. J Immunol Methods, 1983, 65:55.
, 百拇医药
5 Traganos F, Kapuscinski J, Ardelt B. Caffeine prevents apoptosis and cell cycle effects induced by camptothecin or topotecan in HL-60 cells. Cancer Res, 1993, 53:4613.
6 Dive C, Hickman JA. Drug-target interactions: only the first step in the commitment to a programmed cell death. Br J Cancer, 1991, 64:192.
7 Gerschenson LE, Rotello RJ. Apoptosis: a different type of cell death. FASEB J, 1992, 6:2450.
, http://www.100md.com
8 谢冰芬,刘宗潮,王理开,等.毛叶茶和龙井茶提取物的抗癌作用以及对DNA拓朴异构酶Ⅱ的抑制作用.癌症,1992, 6:424.
9 Betrtand R, Solary E, Jenkins J, et al. Apoptosis and its modulation in human promyelocytic HL-60 cells treated with DNA topoisomerase Ⅰ and Ⅱ inhibitors. Exp Cell Res, 1993, 207:388.
10 Ling YH, Priebe W, Perez-Soler R. Apoptosis induced by anthracycline antibiotics in P388 parent and multidrug-resistant cells. Cancer Res, 1993, 8:1845.
1997年6月9日收稿,1998年4月23日修回, 百拇医药
单位:赵燕 曹进 刘箭卫 湖南医科大学茶与健康研究室(长沙410078);祝和成 马洪 湖南医科大学肿瘤研究所
关键词:茶;酚类;白血病
中国病理生理杂志990321 摘 要 目的:寻找新的肿瘤细胞凋亡诱导剂。方法:选用茶的主要活性成分茶多酚,采用噻唑蓝(MTT)还原法,DNA凝胶电泳以及透射电镜技术,在体外观察了茶多酚对人急性早幼粒白血病细胞(HL-60)凋亡的影响。结果:被250 mg/L茶多酚作用5 h后HL-60细胞进行凝胶电泳呈现出典型的DNA条带,透射电镜下看到凋亡小体,茶多酚对HL-60细胞凋亡的诱导活性平行于它的细胞杀伤作用。结论:在体外培养条件下,茶多酚可诱导HL-60细胞凋亡。
Induction of apoptosis by tea polyphenols in HL-60 cells
, 百拇医药
ZHAO Yan, CAO Jin, ZHU He-Cheng, MA Hong, LIU Jian-Wei
Tea and Health Lab. Hunan Medical University, Changsha (410078)
Abstract AIM To study anticarcinogenic mechanism of polyphenolic compounds in tea.METHODS: The apoptosis inducing effects of tea polyphenols (TP), the main active component purified from tea, were observed on the human promyelocytic leukemic cell (HL-60) by thiazolyl blue tetrazolium bromide reduction test, DNA agarose gel electrophoresis and transmission electronic microscopy technique.RESULTS:After treating HL-60 cells with TP in 250mg.L-1 for 5h, DNA extracted from HL-60 cells showed a typical internucleosomal DNA degradation, i.e., DNA ladder and apoptosis vehicles were observed. The effect of TP was showed to parallel with its cytotoxic activity in HL-60 cells.CONCLUSION:The mechanism of antitumor action of TP is related to its apoptosis inducing activity.
, 百拇医药
MeSH Tea; Phenols; Leukemia
茶多酚(tea polyphenols)是以茶中酚类及其衍生物为主的酚性化合物。一些研究表明[1,2],茶多酚对癌症具有良好的化学预防作用,其机理是茶多酚类化合物具有明显的拮抗促癌物12-氧-十四烷佛波醇-13-乙酸酯(12-0-tetra-decanoylphorbol-13-acetate,TPA)的多种生物学作用,以及抑制与致癌物代谢活化相关的细胞色素P450酶系。为进一步探讨茶多酚抑制癌变的机制,本实验观察了茶多酚对体外培养的HL-60细胞凋亡的影响。
材料与方法
一、材料:
(一)细胞系及培养条件:人急性早幼粒白血病细胞株(human acute promyelocytic leukemia cell line: HL-60),由本校血液生理研究室提供。接种于含15%小牛血清(华美生物工程公司,经56℃,30 min灭活),100 U.mL-1青霉素及100μg.mL-1链霉素的RPMI-1640培养液,在37℃含体积分数为5%CO2的培养箱内培养传代;4℃ 1000r/min离心5~10 min收集。
, 百拇医药
(二)药品与试剂:茶多酚由本校茶与健康研究室提供(含量86.0%),生理盐水溶解,0.45 μm微孔滤膜灭菌备用。喜树碱(camptothecin, CAM)(广西东兰制药厂)用二甲基亚砜(DMSO)溶解,RNase A(华美生物技术公司)和Proteinase K(美国,BTL):均按分子克隆操作指南[3]配成10 mg.mL-1,分装后置-20℃存放。Nonidet P-40(NP-40):Fluka产品。溴化噻唑蓝四唑(thiazolyl blue tetrazolium bromide: MTT):Fluka产品。琼脂糖(agarose):美国BRL产品,bp Marker DNA:华美生物技术公司,其余均为国产分析纯试剂。
二、方法:
(一)MTT还原反应测定肿瘤细胞存活率:参照文献[4]将对数生长期细胞稀释成1×105 cells.mL-1接种于96孔培养板,每孔0.2 mL,接种同时加不同浓度茶多酚处理,每个浓度平行4孔,对照组加等体积培养液,置37℃体积分数为5%CO2培养箱培养,48 h后取出96孔培养板,每孔加入新配制的1 mg.mL-1 MTT 50μL,混匀,置37℃,体积分数为5%CO2培养箱内继续培养4 h,再离心,弃上清液后每孔加200 μL DMSO,振荡10 min,溶解MTT甲月 赞沉淀,用EL309型酶标仪,以570 nm为实验波长,450 nm为参考波长测定其吸收度,按下式计算肿瘤细胞存活率及杀伤率并计算IC50:
 肿瘤细胞杀伤率=1-肿瘤细胞存活率
肿瘤细胞杀伤率=1-肿瘤细胞存活率, 百拇医药
(二)细胞DNA的提取及琼脂糖凝胶电泳:参照文献[5]收集3×106细胞,用含2 mmol.L-1EDTA的PBS洗2次,加0.3 mL TBE缓冲液(Triscl.HCL 45 mmol.L-1,pH8.0,含1 mmol.L-1EDTA),0.25%NP-40及RNase A(终浓度为1%),混匀后,37℃保温30 min,再加入Proteinasek(终浓度为1 g.L-1),37℃继续保温30 min,取上清液45 μL加5 μL上样缓冲液。在1.5%琼脂糖凝胶上电泳(3 V.cm-1),紫外灯下观察并摄影。
, http://www.100md.com
(三)细胞形态学观察:收集适量茶多酚处理后的HL-60细胞,离心沉淀,2.5%戊二醛前固定,0.1 mol/L蔗糖磷酸盐缓冲液清洗,1%锇酸PBS(pH 7.4)后固定(4℃),丙酮乙醇梯度脱水,Epon812包埋,LKB 8800型超薄切片机切片,醋酸铀、硝酸铅双层染色,日立H 600透射电镜,摄影。
结果
(一)茶多酚对HL-60细胞毒作用:茶多酚处理HL-60细胞48 h后,仅有近11%细胞成活,茶多酚对HL-60细胞的IC50值为732.2 μg.mL-1。
表1 茶多酚作用于HL-60细胞培养液的pH变化
Tab 1 Changes of pH in HL-60 cells treated with tea polyphenols (
 ±s,n=4) TP concentration
±s,n=4) TP concentration, http://www.100md.com
(mg/L)
pH
Untreated with
Treated with
Treated with TP for
TP
TP
48 h
0
6.92±0.01*
62.5
6.95±0.01
, 百拇医药
6.93±0.08
125
6.89±0.04
6.91±0.04
250
6.91±0.11
6.92±0.05
500
6.94±0.02
6.95±0.08
1000
6.90±0.09
, http://www.100md.com
6.89±0.07
2000
6.93±0.13
6.90±0.06
4000
6.89±0.01
6.88±0.10
*P>0.05,vs treated with TP, TP=tea polyphenols
(二)茶多酚诱导HL-60细胞凋亡-以核小体间DNA降解为标志:Dive等[6]报道,0.15 μmol.L-1喜树碱作用3 h即诱导HL-60细胞凋亡,细胞DNA在琼脂糖凝胶电泳上显示DNA梯状带型ladder。本文以喜树碱作阳性对照药,发现250 mg.L-1茶多酚作用5 h即诱导HL-60细胞产生类似喜树碱作用后的DNA条带,大小相当于180 bp或180 bp的整倍数,提示茶多酚能诱导HL-60细胞产生凋亡。电泳图1A显示,当茶多酚浓度为250 mg.L-1时,隐约可见DNA带谱,当茶多酚浓度至500 mg.L-1,DNA条带明显,当茶多酚浓度至1000 mg.L-1,DNA条带亮度增加。此后,浓度升到2000 mg.L-1时,未出现DNA条带。
, 百拇医药
表2 茶多酚作用后HL-60细胞存活率
Tab 2 Survival rate of HL-60 cells treated with tea polyphenols (
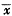 ±s,n=4) Concentration
±s,n=4) Concentration62.5
125
250
500
1000
2000
4000
, http://www.100md.com (mg.L-1)
Survivalrate
94.8±
89.4±
84.7±
61.4±
38.2±
25.8±
11.4±
(%)
0.39
1.02
, http://www.100md.com
0.78
0.47
0.61
0.39
0.54


Fig 1A:Degradation of DNA from HL-60 cells treated with TP. Lane Con: Control. Lane CAM: 0.17 μmol.L-1 of camptothecin. Lane M:λ DNA Hind Ⅲ digested. B: Time course of degration of DNA from HL-60 cells incubated with 250 mg/L TP. Lane Con: Control. Lane M: λ DNA/EcoR Ⅰ+Hind Ⅲ digested
, 百拇医药
图1 HL-60细胞电泳剂量-时间效应关系
250 μg.mL-1茶多酚作用于HL-60细胞不同时间后细胞DNA的降解程度见图1B。最初48 h内,茶多酚引起的DNA降解随作用时间延长而增强,因此低浓度茶多酚作用较长时间也能引起明显的DNA降解,但96 h作用组由于细胞大部分死亡而无法检测。
(三)茶多酚诱导HL-60细胞凋亡的细胞形态变化:图2A为未经药物作用的HL-60细胞透射电镜观察结果。图2B则为经250μg*mL-1茶多酚作用5 h后HL-60细胞透射电镜观察的结果,HL-60细胞染色体凝集裂解成碎片后整个细胞碎裂成由膜包绕的不连续的凋亡小体。


, http://www.100md.com
Fig 2 Changes in the morphology of HL-60 cells untreated and treated with TP.A:×3500,HL-60 cells untreated with TP. B:×5000, 250 mg/L TP treatment on HL-60 cells for 24 h displayed as apoptotic vehicles.
图2 对照组和茶多酚组HL-60细胞超微形态变化
讨论
细胞凋亡具有独特的生化和形态学特征,凋亡细胞在琼脂凝胶电泳上显示出典型的DNA条带[7],目前认为,这是判断细胞发生凋亡的主要标志[5]。在形态学上,细胞凋亡首先表现为细胞核的一系列改变,如染色体断裂、聚集,进而固缩,核膜崩解,细胞浆空泡变、固缩,最后胞膜凸出,形成凋亡小体。本实验表明,250μg*mL-1茶多酚与HL-60细胞作用24 h后,DNA电泳显示出典型的DNA条带(图2),透射电镜观察到凋亡小体。从DNA电泳剂量-效应关系中可看到,茶多酚诱导HL-60细胞凋亡的最适浓度在500~1000μg*mL-1之间。DNA电泳时间-效应关系结果提示,最适时间在24~48 h之内。由此可见,茶多酚诱导HL-60细胞凋亡具有较强的浓度和时间依赖性。并且,茶多酚对HL-60细胞凋亡的诱导活性平行于它的细胞杀伤作用。本实验以喜树碱作为阳性对照药,进一步验证茶多酚诱导HL-60细胞凋亡的作用,其结果提示,在体外培养条件下可诱导HL-60细胞凋亡。
, 百拇医药
谢冰芬等报道[8],绿茶提取物对DNA拓朴异构酶Ⅱ有显著的抑制作用。而Bertrand等[9]用拓朴异构酶抑制剂处理HL-60细胞。Ling[10]用拓朴异构酶抑制剂doxorubicin和annamycin处理鼠白血病P 388细胞时,均出现了DNA的降解,即癌细胞的凋亡。DNA拓朴异构酶是一种存在细胞核内的酶,通常细胞凋亡的最主要生化变化是内源性Ca2+、Mg2+依赖性核酸内切酶被激活而使染色体DNA双链变短,但拓朴异构酶抑制剂可直接渗入细胞DNA中,损伤DNA使之裂解成较大的核酸片断,继而触发核酸内切酶对其进一步作用,这种裂解成较大的核酸片断不象核酸内切酶活性那样依赖于Ca2+,但可被bcl-2的表达所抑制,表明这仍是细胞凋亡的过程[9]。综上所述,茶多酚在体外诱导HL-60细胞凋亡的途径可能是通过对拓朴异构酶的抑制而体现的。
参考文献
, 百拇医药
1 童 彤,程书钧,李秀琴,等.没食子酰表没食子儿茶素对促癌物TPA抑制作用的研究.癌变.畸变.突变,1992,4(1):1.
2 冯 磊,余应年,刘志强,等.茶多酚对人羊膜上皮细胞FL形成B(a)P-DNA加成物的影响.癌变.畸变.突变,1995,2:65.
3 Subivade I,Fernandez Y,Periquet A.Catechin protection of 3T3 swiss fibroblasts in culture under oxidative stress.Biol Trace Elem Reo,1995,47:313.
4 Mosmann T. Rapid colormetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. J Immunol Methods, 1983, 65:55.
, 百拇医药
5 Traganos F, Kapuscinski J, Ardelt B. Caffeine prevents apoptosis and cell cycle effects induced by camptothecin or topotecan in HL-60 cells. Cancer Res, 1993, 53:4613.
6 Dive C, Hickman JA. Drug-target interactions: only the first step in the commitment to a programmed cell death. Br J Cancer, 1991, 64:192.
7 Gerschenson LE, Rotello RJ. Apoptosis: a different type of cell death. FASEB J, 1992, 6:2450.
, http://www.100md.com
8 谢冰芬,刘宗潮,王理开,等.毛叶茶和龙井茶提取物的抗癌作用以及对DNA拓朴异构酶Ⅱ的抑制作用.癌症,1992, 6:424.
9 Betrtand R, Solary E, Jenkins J, et al. Apoptosis and its modulation in human promyelocytic HL-60 cells treated with DNA topoisomerase Ⅰ and Ⅱ inhibitors. Exp Cell Res, 1993, 207:388.
10 Ling YH, Priebe W, Perez-Soler R. Apoptosis induced by anthracycline antibiotics in P388 parent and multidrug-resistant cells. Cancer Res, 1993, 8:1845.
1997年6月9日收稿,1998年4月23日修回, 百拇医药