吡喃葡萄糖甙对培养大鼠视网膜神经细胞的影响△
作者:钟一声 蒋幼芹
单位:蒋幼芹:410011 湖南长沙市,湖南医科大学第二医院眼科;钟一声:现在上海医科大学附属瑞金医院眼科中心
关键词:视网膜神经细胞;细胞培养;4-吡喃酮-3-β-D-吡喃葡萄糖甙
眼科新进展990102
摘要 目的 观察灯盏细辛主要成份之一4-吡喃酮-3-β-D-吡喃葡萄糖甙(4-pyrone-3-β-D-glucopyraoside, PGP)对培养大鼠视网膜神经细胞的影响,并筛选出其有效浓度。方法 6只生后2~3d Sprague-Dawley大鼠,视网膜采用胰酶消化法制成细胞悬液后接种于经鼠尾胶原处理的96孔培养板(每孔1×105个细胞),同时加入1g.L-1~10-5g.L-1PGP及DMEM,分别培养1、3、5d,用MTT法测量OD值。对部分d5的细胞行Nissel体染色检查。结果 培养在鼠尾胶原上的视网膜神经细胞生长良好,部分细胞伸出突起,且少数突起相互连接。Nissel体染色检查示培养5d的存活细胞大部分为神经细胞。各种浓度的PGP对培养细胞形态无影响,药物浓度≥10-2g.L-1时,各培养时期细胞数目明显减少,OD值明显降低(P<0.001~0.05),在该浓度以下各培养时期细胞数目未见明显减少,OD值仅有轻微下降(P>0.05)。结论 PGP无直接促进培养大鼠视网膜神经细胞生长的作用,药物浓度≤10-3g.L-1时,对培养细胞无毒副作用。
, 百拇医药
Effect of 4-pyrone-3-β-D-glucopyraoside on rat retinal neurons in vitro
ZHONG Yi-Sheng, JIANG You-Qin
From the Department of Ophthalmology, Second Affiliated Hospital, Hunan Medical University, Changsha 410011 Hunan Province,China
Abstract Objectives To observe the effect of 4-pyrone-3-β-D-glucopyraoside(PGP),one of the main integrants of Erigeron Breviscapus(Vant.) Hand-Mazz, on rat retinal neurons in vitro and to find out its nontoxicity concentration for cultured retinal neurons.Methods The retinae of 6 postnatal 2~3 days Sprague-Dawley rats were dissociated into cell suspension with trypsin digestion. The cell suspension was implanted in 96-well culture plates covered with murine-tail collagen in each well(1×105 cells/well). The concentrations of PGP solution were 1g.L-1~10-5g.L-1. The period of culture was 1,3 and 5 days respectively, Then, the OD of living cells in each well was tested by MTT colorimetric microassay. Some of the 5-day culture cells were identified by Nissel technique.Results The retinal neurons cultured in the well coated by murine-tail collagen tissue grew very well. Some cells processed axons and some axons connected network form. Most of the living cells were retinal neurons by Nissel identification. The morphological contour of cultured retinal cells showed no significant changes in each concentrations of PGP. However, the numbers of cells and OD decreased significantly at the concentrations of above or equal to 10-2g.L-1(P<0.01~0.05);The number of cells and OD decreased slightly under this concentration (P>0.05).Conclusion PGP has no direct effect on retinal neuron growth in vitro, and it has no toxicity on cells under the concentration of 10-3g.L-1.
, 百拇医药
Key words retinal neuron;cell culture;4-pyrone-3-β-D-glucopyraoside 青光眼是以视盘呈典型凹陷及视网膜神经节细胞(retinal ganglion cells, RGCs)死亡为特征的眼病,其损伤机理尚未明确。目前青光眼的治疗主要是降低眼压,而对视网膜神经细胞的保护尚无有效药物。灯盏细辛治疗眼压已控制的晚期青光眼具有扩大或保持患者视功能(视力、视野)的作用已经临床观察证实[1,2],在大鼠急性高眼压时具有提高RGCs细胞色素氧化酶的作用已经实验证实[3]。最近,Quigley[4]提出了治疗青光眼的新观点,应从保护RGCs损伤着手,并提出了可能存在的2种途径:应用神经营养因子治疗青光眼和用药物控制RGCs凋亡基因的表达。本文应用灯盏细辛的主要成份之一4-吡喃酮-3-β-D-吡喃葡萄糖甙(4-pyrone-3-β-D-glucopyraoside, PGP),观察其是否具有类似神经营养因子的作用,并筛选出其有效的药物浓度,现报告如下。
, http://www.100md.com
1 材料和方法
1.1 材料 6只生后2~3d的Sprague-Dawley大鼠眼球由湖南医科大学实验动物中心提供。4-吡喃酮-3-β-D-吡喃葡萄糖甙(PGP)粉剂由云南药物研究所提供,用DMEM培养液分配成浓度为4g.L-1、4×10-1g.L-1、4×10-2g.L-1、4×10-3g.L-1、4×10-4g.L-1、4×10-5g.L-1,均在临用前配制。
, http://www.100md.com
1.2 细胞接种培养和PGP加入方法
1.2.1 鼠尾胶原的制备 参照王子淑 [5]介绍的方法制备鼠尾胶原。
1.2.2 培养板处理 用吸管将胶原液均匀涂于96孔培养板(Coster,USA)后,向孔内充入氨气片刻,待胶原与氨气作用30min后胶原凝固,然后用D-Hank液反复冲洗,晾干后即可使用。
1.2.3 细胞悬液制备 将乳鼠颈椎脱位致死,消毒后轻轻摘出眼球,置入含100×103U.L-1青霉素和100mg.L-1链霉素的D-Hank液内漂洗3次。显微镜下沿角膜缘剪除角膜,去除晶状体和玻璃体,然后钝性分离出神经层视网膜组织。用D-Hank液漂洗视网膜3次,置入0.8g.L-1胰蛋白酶(Sigma产品)37℃消化30min后,加入100mL.L-1小牛血清的DMEM液终止消化。将上清液300r.min-1离心3~5min后,弃上清液,加入培养液(800mL.L-1DMEM,200mL.L-1胎牛血清,葡萄糖6g.L-1,青霉素100×103U.L-1,链霉素100mg.L-1,二性霉素2mg.L-1,氯化钾25×10-3mol.L-1,Hepes10×10-3mol.L-1)约8mL,钝头吸管吹打使之成为细胞悬液,行细胞计数,调整培养液量使每mL含1.3~1.4×106个细胞。
, http://www.100md.com
1.2.4 接种培养和PGP加入方法 将细胞悬液接种于已处理的96孔培养板内,随机分为培养1、3、5d组,每孔约75μL细胞悬液(每孔含细胞数约100×103个),每组又分6个亚组,分别加入DMEM(对照组)和各种浓度PGP溶液(Ⅰ~Ⅵ实验组)25μL,分别使每亚组PGP浓度为0、1g.L-1、10-1g.L-1、10-2g.L-1、10-3g.L-1、10-4g.L-1、10-5g.L-1。置于50mL.L-1CO2培养箱内37℃培养。12~24h后,加入5-溴-2’-脱氧尿苷(20mg.L-1,Sigma,USA)以抑制非神经细胞生长,48h后,更换培养液,d5组换液时仍按上法加入PGP继续培养。
, 百拇医药
1.3 观察指标
1.3.1 形态学观察 应用Olympus倒置显微镜每天行活细胞观察。
1.3.2 Nissel染色检查 采用缓冲亚甲蓝法(Pischinger法)[6]对培养5d的细胞行Nissel体染色检查,以确定存活细胞中神经细胞的量。
1.3.3 MTT微量自动比色法[7] 取培养1、3、5d的96孔培养板细胞,分别每孔加入MTT20μL(2.5g.L-1,0.15mol.L-1 PBS pH=7.4),继续培养4h后,小心吸去培养上清液,用0.04mol.L-1盐酸异丙醇每孔120μL终止反应,振荡5min,室温静置30min后,用ELISA仪(EL 312e型,USA)测光密度OD值。实验波长为570nm,每孔测3次,取其平均值。
, 百拇医药
2 结果
2.1 形态学观察 经胰蛋白酶消化获得的视网膜神经细胞静置在覆有鼠尾胶原的培养板内4~6h开始贴壁,24h细胞基本完全贴壁,单层排列,部分细胞聚集成团,细胞呈圆形或椭圆形,核圆且相对透明,少数细胞接种1d后胞膜上伸出短而小的突起;72h后,少数细胞形成典型细胞突起,且少数突起相互连接;5d后有明显突起的细胞增多,细胞部分死亡,细胞数目明显减少。实验组中,Ⅰ~Ⅵ组培养1、3、5d细胞形态与对照组无明显差异,除Ⅰ、Ⅱ组细胞数量明显较同期对照组少之外,其余4组细胞数目与同期对照组未见明显差异。
2.2 Nissel体染色检查 应用缓冲亚甲蓝法行Nissel体染色,神经细胞染成蓝色;培养5d时,胞膜完整的细胞中大部分为Nissel体阳性染色细胞,表明存活细胞大部分为神经细胞。
2.3 视网膜神经细胞存活的定量观察 培养1d时,Ⅰ、Ⅱ组细胞存活的OD值明显低于对照组,差异有显著性(P<0.001和P<0.05);Ⅲ~Ⅵ中,除Ⅲ组OD值高于对照组外,其余均低于对照组,但与对照组相比均无显著性差异(P>0.05)。见表1。
, http://www.100md.com
表1 PGP对培养1d的视网膜细胞生长影响的定量测量
Table 1 The quantitative effect of PGP on the retinal neurons growth at 1-day culture (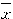 ±s) Groups
±s) Groups
Wells(n)
OD
P
Control group(DMEM)
12
0.1686±0.0365
, 百拇医药 Group Ⅰ(1g.L-1PGP)
14
0.1189±0.0223
<0.001
Group Ⅱ(10-1g.L-1PGP)
14
0.1366±0.0348
<0.05
Group Ⅲ (10-2g.L-1PGP)
, http://www.100md.com
14
0.1878±0.0672
>0.05
Group Ⅳ(10-3g.L-1PGP)
14
0.1538±0.0519
>0.05
Group Ⅴ(10-4g.L-1PGP)
14
, 百拇医药
0.1598±0.0494
>0.05
Group Ⅵ(10-5g.L-1PGP)
14
0.1578±0.0390
>0.05
培养3、5d时,Ⅰ、Ⅱ、Ⅲ组OD值较对照组低,有显著性差异(P<0.001、P<0.002和P<0.05);Ⅳ、Ⅴ、Ⅵ组OD值均低于对照组,但无显著性差异(P>0.05)。见表2、3。表2 PGP对培养3d的视网膜细胞生长影响的定量测量
Table 2 The quantitative effect of PGP on the retinal neurons growth at 3-day culture (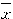 ±s) Groups
±s) Groups
, http://www.100md.com
Wells(n)
OD
P
Control group(DMEM)
12
0.1438±0.0237
Group Ⅰ(1g.L-1PGP)
14
0.0995±0.0210
<0.001
Group Ⅱ(10-1g.L-1PGP)
, 百拇医药
14
0.1145±0.0258
<0.002
Group Ⅲ (10-2g.L-1PGP)
14
0.1230±0.0183
<0.05
Group Ⅳ(10-3g.L-1PGP)
14
, http://www.100md.com
0.1336±0.0362
>0.05
Group Ⅴ(10-4g.L-1PGP)
14
0.1374±0.0332
>0.05
Group Ⅵ(10-5g.L-1PGP)
14
0.1369±0.0294
, http://www.100md.com
>0.05
表3 PGP对培养5d的视网膜细胞生长影响的定量测量
Table 3 The quantitative effect of PGP on the retinal neurons growth at 5-day culture (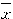 ±s)
±s)
Groups
Wells(n)
OD
P
Control group(DMEM)
12
, http://www.100md.com
0.1056±0.0133
Group Ⅰ(1g.L-1PGP)
14
0.0686±0.0096
<0.002
Group Ⅱ(10-1g.L-1PGP)
14
0.0685±0.0133
<0.002
, http://www.100md.com
Group Ⅲ (10-2g.L-1PGP)
14
0.0758±0.0135
<0.05
Group Ⅳ(10-3g.L-1PGP)
14
0.0982±0.0134
>0.05
Group Ⅴ(10-4g.L-1PGP)
, 百拇医药
14
0.0930±0.0083
>0.05
Group Ⅵ(10-5g.L-1PGP)
14
0.0914±0.0139
>0.05
说明PGP在体外对培养大鼠视网膜神经细胞生长无明显促进作用,在10-3g.L-1浓度以下时,对培养细胞无毒副作用。
, 百拇医药
3 讨论
一般认为,一旦出现青光眼性视盘严重损害,即使眼压控制,恢复视功能亦非常困难,甚至是不可能的。但越来越多的实验和临床证据表明:当眼压充分降低后,神经轴浆流可恢复,青光眼视盘损害、视野缺损可得到改善。Katz等报道青光眼手术后眼压下降>30%的患者中1/3视盘有明显的改善,并认为最有意义的解释是已受到损伤但仍存活的神经细胞代谢的正常化和(或)眼压下降后神经轴浆流的改善;视野恢复则可能是受到高眼压损伤但仍存活的RGCs及其纤维在一定条件下恢复部分功能。最近,Aguayo等[8]研究证实神经细胞损伤后在一些神经营养因子的作用下其轴突可以再生,为研究促进RGCs存活的药物提供了理论基础。
灯盏细辛是一种云南民间中草药,张人伟[9]研究表明其有效成份为灯盏花黄酮类,吡喃酮葡萄糖甙为其主要成份之一。它具有扩张血管、减少外周血管阻力,改善大脑微循环及抗血小板凝聚的作用[10],临床上治疗脑血栓形成获得佳效。
, 百拇医药
贾莉君等[3]以前房灌注加压法制成急性高眼压模型后,腹腔注射灯盏细辛注射液,视网膜铺片观察视网膜细胞细胞色素氧化酶的活性,结果说明灯盏细辛能提高视网膜节细胞细胞色素氧化酶的活性及视网膜活性节细胞的密度,提示灯盏细辛有防止高眼压对视网膜损伤的作用。蒋幼芹等[1]在眼压控制的晚期青光眼患者中,应用灯盏细辛片治疗2~6mo,结果显示视野提高率达22.8%;贾莉君等[2]对25例29眼眼压控制的原发性晚期青光眼患者应用该药6个疗程后,发现视野进步率达93.10%,并且发现治疗前后血液流变学各项指标无显著差异,说明灯盏细辛改善视野不是通过血液流变途径。这些证据表明灯盏细辛具有保护RGCs的作用。本实验结果发现4-吡喃酮-3- β-D-吡喃葡萄糖甙无直接促进培养大鼠视网膜细胞生长的作用,但在10-3g*L-1浓度以下对细胞无毒副作用,我们认为4-吡喃酮-3-β-D-吡喃葡萄糖甙可能不是灯盏细辛保护视网膜细胞的唯一有效单体成份或者需要在某些神经营养因子的共同作用下,具有保护RGCs损伤的作用。临床上应用灯盏细辛能改善眼压已控制晚期青光眼患者视功能,其具体作用机制尚有待进一步研究。
, http://www.100md.com
参考文献
[1]蒋幼芹,吴振中,莫杏君,等. 眼压已控制的晚期青光眼治疗的探讨. 眼科研究 1991;9∶229-232.
[2]贾莉君,蒋幼芹,吴振中. 青光康片对眼压已控制的原发性晚期青光眼临床疗效观察. 实用眼科杂志 1994;12∶269-273.
[3]贾莉君,刘忠浩,罗学港,等.青光康注射液对急性实验性高眼压大鼠视网膜节细胞代谢的作用. 中华眼科杂志 1995;31∶129-132.
[4]Quigley HA. Ganglion cell death in glaucoma:pathology recapitulates ontogeny. Au]st N Z J Ophthalmol 1995;23∶85-91.
[5]王子淑. 动物细胞遗传实验技术. 成都:四川大学出版社1987∶381-382.
, 百拇医药
[6]凌启波. 实用病理特殊染色和组化技术. 广东:广东教育出版社 1989∶148-168.
[7]Manthorpe M, Fagnani R, Skaper SD, et al. An automated colorimetric microassay for neurotrophic factors. Dev Brain Res 1986; 25∶191-198.
[8]Aguayo AJ, Bray GM, Rasminsky M, et al. Synaptic connections made by axons regenerating in the CNS of adult mammals. J Exp Biol 1990;153∶199-224.
[9]张人伟. 灯盏花黄酮类成份的分离鉴定. 中草药 1988;19∶7.
, 百拇医药
[10]灯盏花素临床验证协作组. 灯盏花素注射液治疗中风后瘫痪469例报告. 中草药 1983;14∶33.
△ 国家自然科学基金资助课题(39570752)
作者简介 钟一声,男,1968年1月生,湖北崇阳县人,汉族。1986年~1991年就读于湖北医学院五官系,获医学学士学位;1991~1994年在兰州医学院攻读眼科硕士学位,导师李浒源教授和金婉容教授,获医学硕士学位;1994年~1997年在湖南医科大学攻读临床技能型眼科博士研究生,师从著名眼科专家蒋幼芹教授,获临床医学博士学位。1997年考入上海第二医科大学临床医学博士后流动站学习,师从眼科专家王康孙教授。现为上海瑞金医院眼科主治医师。先后从事眼科白内障和青光眼专业的基础和临床研究。在《中国实用眼科杂志》、《眼科研究》、《眼科新进展》、《国外医学眼科学分册》、《美国医学会眼科杂志中文版》等期刊上发表论文、综述及译文近10篇。联系电话:021-64370045-5433
收稿 1998-03-31 修回 1998-04-17
Accepted for publication Mar 31,1998, http://www.100md.com
单位:蒋幼芹:410011 湖南长沙市,湖南医科大学第二医院眼科;钟一声:现在上海医科大学附属瑞金医院眼科中心
关键词:视网膜神经细胞;细胞培养;4-吡喃酮-3-β-D-吡喃葡萄糖甙
眼科新进展990102
摘要 目的 观察灯盏细辛主要成份之一4-吡喃酮-3-β-D-吡喃葡萄糖甙(4-pyrone-3-β-D-glucopyraoside, PGP)对培养大鼠视网膜神经细胞的影响,并筛选出其有效浓度。方法 6只生后2~3d Sprague-Dawley大鼠,视网膜采用胰酶消化法制成细胞悬液后接种于经鼠尾胶原处理的96孔培养板(每孔1×105个细胞),同时加入1g.L-1~10-5g.L-1PGP及DMEM,分别培养1、3、5d,用MTT法测量OD值。对部分d5的细胞行Nissel体染色检查。结果 培养在鼠尾胶原上的视网膜神经细胞生长良好,部分细胞伸出突起,且少数突起相互连接。Nissel体染色检查示培养5d的存活细胞大部分为神经细胞。各种浓度的PGP对培养细胞形态无影响,药物浓度≥10-2g.L-1时,各培养时期细胞数目明显减少,OD值明显降低(P<0.001~0.05),在该浓度以下各培养时期细胞数目未见明显减少,OD值仅有轻微下降(P>0.05)。结论 PGP无直接促进培养大鼠视网膜神经细胞生长的作用,药物浓度≤10-3g.L-1时,对培养细胞无毒副作用。
, 百拇医药
Effect of 4-pyrone-3-β-D-glucopyraoside on rat retinal neurons in vitro
ZHONG Yi-Sheng, JIANG You-Qin
From the Department of Ophthalmology, Second Affiliated Hospital, Hunan Medical University, Changsha 410011 Hunan Province,China
Abstract Objectives To observe the effect of 4-pyrone-3-β-D-glucopyraoside(PGP),one of the main integrants of Erigeron Breviscapus(Vant.) Hand-Mazz, on rat retinal neurons in vitro and to find out its nontoxicity concentration for cultured retinal neurons.Methods The retinae of 6 postnatal 2~3 days Sprague-Dawley rats were dissociated into cell suspension with trypsin digestion. The cell suspension was implanted in 96-well culture plates covered with murine-tail collagen in each well(1×105 cells/well). The concentrations of PGP solution were 1g.L-1~10-5g.L-1. The period of culture was 1,3 and 5 days respectively, Then, the OD of living cells in each well was tested by MTT colorimetric microassay. Some of the 5-day culture cells were identified by Nissel technique.Results The retinal neurons cultured in the well coated by murine-tail collagen tissue grew very well. Some cells processed axons and some axons connected network form. Most of the living cells were retinal neurons by Nissel identification. The morphological contour of cultured retinal cells showed no significant changes in each concentrations of PGP. However, the numbers of cells and OD decreased significantly at the concentrations of above or equal to 10-2g.L-1(P<0.01~0.05);The number of cells and OD decreased slightly under this concentration (P>0.05).Conclusion PGP has no direct effect on retinal neuron growth in vitro, and it has no toxicity on cells under the concentration of 10-3g.L-1.
, 百拇医药
Key words retinal neuron;cell culture;4-pyrone-3-β-D-glucopyraoside 青光眼是以视盘呈典型凹陷及视网膜神经节细胞(retinal ganglion cells, RGCs)死亡为特征的眼病,其损伤机理尚未明确。目前青光眼的治疗主要是降低眼压,而对视网膜神经细胞的保护尚无有效药物。灯盏细辛治疗眼压已控制的晚期青光眼具有扩大或保持患者视功能(视力、视野)的作用已经临床观察证实[1,2],在大鼠急性高眼压时具有提高RGCs细胞色素氧化酶的作用已经实验证实[3]。最近,Quigley[4]提出了治疗青光眼的新观点,应从保护RGCs损伤着手,并提出了可能存在的2种途径:应用神经营养因子治疗青光眼和用药物控制RGCs凋亡基因的表达。本文应用灯盏细辛的主要成份之一4-吡喃酮-3-β-D-吡喃葡萄糖甙(4-pyrone-3-β-D-glucopyraoside, PGP),观察其是否具有类似神经营养因子的作用,并筛选出其有效的药物浓度,现报告如下。
, http://www.100md.com
1 材料和方法
1.1 材料 6只生后2~3d的Sprague-Dawley大鼠眼球由湖南医科大学实验动物中心提供。4-吡喃酮-3-β-D-吡喃葡萄糖甙(PGP)粉剂由云南药物研究所提供,用DMEM培养液分配成浓度为4g.L-1、4×10-1g.L-1、4×10-2g.L-1、4×10-3g.L-1、4×10-4g.L-1、4×10-5g.L-1,均在临用前配制。
, http://www.100md.com
1.2 细胞接种培养和PGP加入方法
1.2.1 鼠尾胶原的制备 参照王子淑 [5]介绍的方法制备鼠尾胶原。
1.2.2 培养板处理 用吸管将胶原液均匀涂于96孔培养板(Coster,USA)后,向孔内充入氨气片刻,待胶原与氨气作用30min后胶原凝固,然后用D-Hank液反复冲洗,晾干后即可使用。
1.2.3 细胞悬液制备 将乳鼠颈椎脱位致死,消毒后轻轻摘出眼球,置入含100×103U.L-1青霉素和100mg.L-1链霉素的D-Hank液内漂洗3次。显微镜下沿角膜缘剪除角膜,去除晶状体和玻璃体,然后钝性分离出神经层视网膜组织。用D-Hank液漂洗视网膜3次,置入0.8g.L-1胰蛋白酶(Sigma产品)37℃消化30min后,加入100mL.L-1小牛血清的DMEM液终止消化。将上清液300r.min-1离心3~5min后,弃上清液,加入培养液(800mL.L-1DMEM,200mL.L-1胎牛血清,葡萄糖6g.L-1,青霉素100×103U.L-1,链霉素100mg.L-1,二性霉素2mg.L-1,氯化钾25×10-3mol.L-1,Hepes10×10-3mol.L-1)约8mL,钝头吸管吹打使之成为细胞悬液,行细胞计数,调整培养液量使每mL含1.3~1.4×106个细胞。
, http://www.100md.com
1.2.4 接种培养和PGP加入方法 将细胞悬液接种于已处理的96孔培养板内,随机分为培养1、3、5d组,每孔约75μL细胞悬液(每孔含细胞数约100×103个),每组又分6个亚组,分别加入DMEM(对照组)和各种浓度PGP溶液(Ⅰ~Ⅵ实验组)25μL,分别使每亚组PGP浓度为0、1g.L-1、10-1g.L-1、10-2g.L-1、10-3g.L-1、10-4g.L-1、10-5g.L-1。置于50mL.L-1CO2培养箱内37℃培养。12~24h后,加入5-溴-2’-脱氧尿苷(20mg.L-1,Sigma,USA)以抑制非神经细胞生长,48h后,更换培养液,d5组换液时仍按上法加入PGP继续培养。
, 百拇医药
1.3 观察指标
1.3.1 形态学观察 应用Olympus倒置显微镜每天行活细胞观察。
1.3.2 Nissel染色检查 采用缓冲亚甲蓝法(Pischinger法)[6]对培养5d的细胞行Nissel体染色检查,以确定存活细胞中神经细胞的量。
1.3.3 MTT微量自动比色法[7] 取培养1、3、5d的96孔培养板细胞,分别每孔加入MTT20μL(2.5g.L-1,0.15mol.L-1 PBS pH=7.4),继续培养4h后,小心吸去培养上清液,用0.04mol.L-1盐酸异丙醇每孔120μL终止反应,振荡5min,室温静置30min后,用ELISA仪(EL 312e型,USA)测光密度OD值。实验波长为570nm,每孔测3次,取其平均值。
, 百拇医药
2 结果
2.1 形态学观察 经胰蛋白酶消化获得的视网膜神经细胞静置在覆有鼠尾胶原的培养板内4~6h开始贴壁,24h细胞基本完全贴壁,单层排列,部分细胞聚集成团,细胞呈圆形或椭圆形,核圆且相对透明,少数细胞接种1d后胞膜上伸出短而小的突起;72h后,少数细胞形成典型细胞突起,且少数突起相互连接;5d后有明显突起的细胞增多,细胞部分死亡,细胞数目明显减少。实验组中,Ⅰ~Ⅵ组培养1、3、5d细胞形态与对照组无明显差异,除Ⅰ、Ⅱ组细胞数量明显较同期对照组少之外,其余4组细胞数目与同期对照组未见明显差异。
2.2 Nissel体染色检查 应用缓冲亚甲蓝法行Nissel体染色,神经细胞染成蓝色;培养5d时,胞膜完整的细胞中大部分为Nissel体阳性染色细胞,表明存活细胞大部分为神经细胞。
2.3 视网膜神经细胞存活的定量观察 培养1d时,Ⅰ、Ⅱ组细胞存活的OD值明显低于对照组,差异有显著性(P<0.001和P<0.05);Ⅲ~Ⅵ中,除Ⅲ组OD值高于对照组外,其余均低于对照组,但与对照组相比均无显著性差异(P>0.05)。见表1。
, http://www.100md.com
表1 PGP对培养1d的视网膜细胞生长影响的定量测量
Table 1 The quantitative effect of PGP on the retinal neurons growth at 1-day culture (
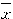 ±s) Groups
±s) GroupsWells(n)
OD
P
Control group(DMEM)
12
0.1686±0.0365
, 百拇医药 Group Ⅰ(1g.L-1PGP)
14
0.1189±0.0223
<0.001
Group Ⅱ(10-1g.L-1PGP)
14
0.1366±0.0348
<0.05
Group Ⅲ (10-2g.L-1PGP)
, http://www.100md.com
14
0.1878±0.0672
>0.05
Group Ⅳ(10-3g.L-1PGP)
14
0.1538±0.0519
>0.05
Group Ⅴ(10-4g.L-1PGP)
14
, 百拇医药
0.1598±0.0494
>0.05
Group Ⅵ(10-5g.L-1PGP)
14
0.1578±0.0390
>0.05
培养3、5d时,Ⅰ、Ⅱ、Ⅲ组OD值较对照组低,有显著性差异(P<0.001、P<0.002和P<0.05);Ⅳ、Ⅴ、Ⅵ组OD值均低于对照组,但无显著性差异(P>0.05)。见表2、3。表2 PGP对培养3d的视网膜细胞生长影响的定量测量
Table 2 The quantitative effect of PGP on the retinal neurons growth at 3-day culture (
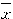 ±s) Groups
±s) Groups, http://www.100md.com
Wells(n)
OD
P
Control group(DMEM)
12
0.1438±0.0237
Group Ⅰ(1g.L-1PGP)
14
0.0995±0.0210
<0.001
Group Ⅱ(10-1g.L-1PGP)
, 百拇医药
14
0.1145±0.0258
<0.002
Group Ⅲ (10-2g.L-1PGP)
14
0.1230±0.0183
<0.05
Group Ⅳ(10-3g.L-1PGP)
14
, http://www.100md.com
0.1336±0.0362
>0.05
Group Ⅴ(10-4g.L-1PGP)
14
0.1374±0.0332
>0.05
Group Ⅵ(10-5g.L-1PGP)
14
0.1369±0.0294
, http://www.100md.com
>0.05
表3 PGP对培养5d的视网膜细胞生长影响的定量测量
Table 3 The quantitative effect of PGP on the retinal neurons growth at 5-day culture (
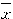 ±s)
±s)Groups
Wells(n)
OD
P
Control group(DMEM)
12
, http://www.100md.com
0.1056±0.0133
Group Ⅰ(1g.L-1PGP)
14
0.0686±0.0096
<0.002
Group Ⅱ(10-1g.L-1PGP)
14
0.0685±0.0133
<0.002
, http://www.100md.com
Group Ⅲ (10-2g.L-1PGP)
14
0.0758±0.0135
<0.05
Group Ⅳ(10-3g.L-1PGP)
14
0.0982±0.0134
>0.05
Group Ⅴ(10-4g.L-1PGP)
, 百拇医药
14
0.0930±0.0083
>0.05
Group Ⅵ(10-5g.L-1PGP)
14
0.0914±0.0139
>0.05
说明PGP在体外对培养大鼠视网膜神经细胞生长无明显促进作用,在10-3g.L-1浓度以下时,对培养细胞无毒副作用。
, 百拇医药
3 讨论
一般认为,一旦出现青光眼性视盘严重损害,即使眼压控制,恢复视功能亦非常困难,甚至是不可能的。但越来越多的实验和临床证据表明:当眼压充分降低后,神经轴浆流可恢复,青光眼视盘损害、视野缺损可得到改善。Katz等报道青光眼手术后眼压下降>30%的患者中1/3视盘有明显的改善,并认为最有意义的解释是已受到损伤但仍存活的神经细胞代谢的正常化和(或)眼压下降后神经轴浆流的改善;视野恢复则可能是受到高眼压损伤但仍存活的RGCs及其纤维在一定条件下恢复部分功能。最近,Aguayo等[8]研究证实神经细胞损伤后在一些神经营养因子的作用下其轴突可以再生,为研究促进RGCs存活的药物提供了理论基础。
灯盏细辛是一种云南民间中草药,张人伟[9]研究表明其有效成份为灯盏花黄酮类,吡喃酮葡萄糖甙为其主要成份之一。它具有扩张血管、减少外周血管阻力,改善大脑微循环及抗血小板凝聚的作用[10],临床上治疗脑血栓形成获得佳效。
, 百拇医药
贾莉君等[3]以前房灌注加压法制成急性高眼压模型后,腹腔注射灯盏细辛注射液,视网膜铺片观察视网膜细胞细胞色素氧化酶的活性,结果说明灯盏细辛能提高视网膜节细胞细胞色素氧化酶的活性及视网膜活性节细胞的密度,提示灯盏细辛有防止高眼压对视网膜损伤的作用。蒋幼芹等[1]在眼压控制的晚期青光眼患者中,应用灯盏细辛片治疗2~6mo,结果显示视野提高率达22.8%;贾莉君等[2]对25例29眼眼压控制的原发性晚期青光眼患者应用该药6个疗程后,发现视野进步率达93.10%,并且发现治疗前后血液流变学各项指标无显著差异,说明灯盏细辛改善视野不是通过血液流变途径。这些证据表明灯盏细辛具有保护RGCs的作用。本实验结果发现4-吡喃酮-3- β-D-吡喃葡萄糖甙无直接促进培养大鼠视网膜细胞生长的作用,但在10-3g*L-1浓度以下对细胞无毒副作用,我们认为4-吡喃酮-3-β-D-吡喃葡萄糖甙可能不是灯盏细辛保护视网膜细胞的唯一有效单体成份或者需要在某些神经营养因子的共同作用下,具有保护RGCs损伤的作用。临床上应用灯盏细辛能改善眼压已控制晚期青光眼患者视功能,其具体作用机制尚有待进一步研究。
, http://www.100md.com
参考文献
[1]蒋幼芹,吴振中,莫杏君,等. 眼压已控制的晚期青光眼治疗的探讨. 眼科研究 1991;9∶229-232.
[2]贾莉君,蒋幼芹,吴振中. 青光康片对眼压已控制的原发性晚期青光眼临床疗效观察. 实用眼科杂志 1994;12∶269-273.
[3]贾莉君,刘忠浩,罗学港,等.青光康注射液对急性实验性高眼压大鼠视网膜节细胞代谢的作用. 中华眼科杂志 1995;31∶129-132.
[4]Quigley HA. Ganglion cell death in glaucoma:pathology recapitulates ontogeny. Au]st N Z J Ophthalmol 1995;23∶85-91.
[5]王子淑. 动物细胞遗传实验技术. 成都:四川大学出版社1987∶381-382.
, 百拇医药
[6]凌启波. 实用病理特殊染色和组化技术. 广东:广东教育出版社 1989∶148-168.
[7]Manthorpe M, Fagnani R, Skaper SD, et al. An automated colorimetric microassay for neurotrophic factors. Dev Brain Res 1986; 25∶191-198.
[8]Aguayo AJ, Bray GM, Rasminsky M, et al. Synaptic connections made by axons regenerating in the CNS of adult mammals. J Exp Biol 1990;153∶199-224.
[9]张人伟. 灯盏花黄酮类成份的分离鉴定. 中草药 1988;19∶7.
, 百拇医药
[10]灯盏花素临床验证协作组. 灯盏花素注射液治疗中风后瘫痪469例报告. 中草药 1983;14∶33.
△ 国家自然科学基金资助课题(39570752)
作者简介 钟一声,男,1968年1月生,湖北崇阳县人,汉族。1986年~1991年就读于湖北医学院五官系,获医学学士学位;1991~1994年在兰州医学院攻读眼科硕士学位,导师李浒源教授和金婉容教授,获医学硕士学位;1994年~1997年在湖南医科大学攻读临床技能型眼科博士研究生,师从著名眼科专家蒋幼芹教授,获临床医学博士学位。1997年考入上海第二医科大学临床医学博士后流动站学习,师从眼科专家王康孙教授。现为上海瑞金医院眼科主治医师。先后从事眼科白内障和青光眼专业的基础和临床研究。在《中国实用眼科杂志》、《眼科研究》、《眼科新进展》、《国外医学眼科学分册》、《美国医学会眼科杂志中文版》等期刊上发表论文、综述及译文近10篇。联系电话:021-64370045-5433
收稿 1998-03-31 修回 1998-04-17
Accepted for publication Mar 31,1998, http://www.100md.com