L-天冬酰胺酶Ⅱ基因工程菌的培养
作者:赖龙生 吴 敬 翟 源 吴梧桐 刘景晶
单位:中国药科大学生化教研室,南京210009
关键词:L-天冬酰胺酶Ⅱ;基因工程菌;发酵
摘 要 为提高L
摘 要 为提高L-天冬酰胺酶Ⅱ基因工程菌Esch erichia coli pKA/CPU210009的产酶量,采用正交试验法确定了较佳培养条件,并优化了发酵工艺。工程菌摇瓶产酶稳定在190U/ml。25L发酵罐产酶亦高达180U/ml,发酵周期大大缩短,仅9~10h。产酶量比原工艺提高1倍以上,具有较好的工业生产前景。
Cultivation of Engineering Bacteria
Producing L-Asparaginase II
, 百拇医药
Lai Longsheng, Wu Jing, Zhai Yuan, Wu Wutong , Liu Jingjing
(Department of Biochemistry, China Pharmaceutical University, Nanjing, 210009)
Abstract In order to improve the enzyme production of engineer ing bacteria Esch erichia coli pKA/CPU 210009, a suitable media has been found by orthogonal desig n and some fermentation conditions were optimized. Enzyme production of enginee ring bacteria maintained 190U/ml in flasks and 180U/ml in a fermentor. Ferme n tation period shortened greatly in a fermentor. Enzyme production from the suit able media increased 2-fold than in original fermentation conditions.
, 百拇医药
Key Words L-asparaginase II, Engineering Bacteria, Fermentation
L-天冬酰胺酶Ⅱ(L-AsparaginaseⅡ,EC3.5.1.1)是重要的抗肿瘤药物。在临床上,广泛用于淋巴瘤和白血病的治疗[1]。美国,德国和日本[2]在70年代均实现了用大肠杆菌野生株生产酶制剂。我国曾于1974年用大肠杆菌发酵法生产[3],因菌株实际产酶率低(2~4U/ml),加上噬菌体污染而停产。我国目前临床使用的天冬酰胺酶主要从美国和日本进口,价格昂贵,限制了该药的使用。1995年,刘景晶等构建了高效表达L-天冬酰胺酶Ⅱ的基因工程菌EscherichiacolipKA/CPU210009,其产酶可达70U/ml,发酵周期约20h[4]。我们在此基础上进行了工程菌培养和发酵工艺的优化研究。
1 材 料
, http://www.100md.com
1.1 菌种
E.coli pKA/CPU 210009(本室提供)。
1.2 培养基
平板、斜面培养基Bacto-Tryptone 1.0%, Bacto-Yeast extract 0.5%, NaCl 1.0%,琼脂2.0%,氨苄青霉素pH7.0。
发酵培养基 玉米浆5.0%,牛肉浸膏3.5%,谷氨酸钠1.0%,氨苄青霉素pH7.0。
2 方 法
2.1 酶活力测定方法
参照刘景晶报告的方法测定[5]。
在规定条件下,每min催化L-天冬酰胺水解释放1μmol氨的酶量定义为1个酶活力单位。
, 百拇医药
2.2 发酵方法
2.2.1 摇瓶发酵 温度37℃,往复式摇床培养12~18h(150次/min,振荡距离1cm)。
2.2.2 25L发酵罐发酵 采用GY-25C型发酵设备(宜兴市建兴化工设备联营厂),温度37℃,装液量70%,罐压0.05Mpa。
2.3 正交试验设计
选用3个因素(玉米浆,牛肉浸膏,谷氨酸钠)和3个水平,采用有交互作用的正交表L27(313)。
3 结 果
3.1 较佳培养基组成的确定
3.1.1 培养基组成的正交试验 以玉米浆(A),牛肉浸膏(B),谷氨酸钠(C)为培养基组分,进行正交试验研究E.colipKA/CPU210009的较佳培养基组成。
, 百拇医药
实验经分析可得各因素和交互作用对菌株产酶影响的大小先后顺为:C>A>B×C>A×B>B>A×C。正交试验结果经方差分析,结果见表1。
Tab 1 Analysis of variance table
Source of
variance
Sum of
deviation
square
Degrees of
freedom
Evaluated
, http://www.100md.com
variance
F value
Fα
Significance
A
2431
2
1215.5
6.27
F0.05(2,14)=3.74
Significant
C
, http://www.100md.com
6563
2
3281.5
15.83
F0.01(2,14)=6.51
Highly significant
A×B
2161
4
540.3
2.78
F0.05(4,14)=3.11
, http://www.100md.com
B×C
2628
4
657
3.39
F0.01(4,14)=5.04
Significant
Error*
2716
14
194
Sum
, http://www.100md.com 26481
26
* In order to enhance the reliability of F-test, S2, S6 and S7 were added to error term.
从表1中可以看出C是影响产酶的高度显著因子,A和B×C为显著因子。B和C交互作用的效应分析见表2。
Tab 2 Effect analysis of the interaction between B and C
B1
B2
B3
, 百拇医药
C1
8.8
12.6
32.9
C2
63.1
49.8
39.1
C3
61.8
53.0
30.2
, 百拇医药
综合方差分析和交互作用效应分析结果,本实验的较佳培养基组成为:A3B2C2,即玉米浆3.5%,牛肉浸膏1.5%,谷氨酸钠1.0%。
3.1.2 较佳培养基组分的验证 按上述选出的培养基组分配制5瓶发酵培养基,进行摇瓶发酵。结果见表3。从表中可见,培养基经优化后,酶活力大幅度提高,基本稳定在170U/ml左右,而以原配方发酵所得酶活力仅为83.5U/ml。Tab 3 Verification of optimal media composition
Test No.
1
2
3
4
, 百拇医药
5
Original
medium
Enzyme activity
(U/ml)
171.0
172.2
164.7
169.6
175.5
83.5
3.2 发酵条件的优化
, 百拇医药
发酵培养条件对产酶的影响因素有:培养基pH值,种龄,接种量,通风量(装液量),培养时间等。
3.2.1 培养基pH对产酶的影响 采用优化培养基,用HCl或NaOH调节发酵培养基的初始pH,于37℃振荡培养16h测定发酵液的酶活力。结果表明,最适初始pH为7.0(表4)。Tab 4 Effect of pH on enzyme production
Test No.
Initial pH
Final pH
Enzyme activity
(U/ml)
1
, 百拇医药
6.0
8.6
158.0
2
6.5
8.6
163.5
3
7.0
8.7
171.0
4
7.5
, http://www.100md.com
8.7
167.3
5
8.0
8.8
163.1
3.2.2 种龄,接种量和通风量对产酶的影响
种龄,接种量和通风量三者对酶的影响情况基本相似,即随着种龄,接种量的增加,发酵液的酶活增加,但到一最高值后,产酶又有所下降。实验表明,合适的种龄为10h,酶活192.3U/ml,接种量为5%,酶活为195.2U/ml。500ml三角瓶装液量为120ml,酶活为199.9U/ml。
3.2.3 培养时间对酶形成的影响 用优化培养基,pH7.0,种龄10h,接种量5%,装液量120ml,37℃振荡培养。测定不同时间酶活力和细胞生长(A570nm)和终止发酵时发酵液的pH值。结果表明细胞生长和酶的活力基本平行,对数生长期酶活力也呈直线上升,14h产酶量达到最高峰,为192.5U/ml(见图1)。培养基的初始pH为7.0至发酵结束时,升高至8.7。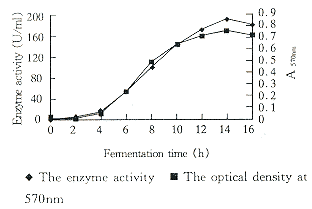
, 百拇医药
Fig 1 Time course of fermentation in flasks.
3.3 发酵罐放大试验
在摇瓶试验的基础上,采用优化后的培养基在25l发酵罐中进行发酵,结果见图2。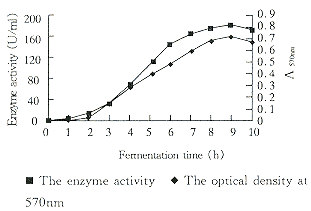
Fig 2 Time course of fermentation in a fermenter.
从图2可见,在第8h菌体生长和产酶均达最高峰,最高酶活力达182.2U/ml。
4 讨 论
1)L-天冬酰胺酶产生菌培养基的优化工作最早由JosephRoberts[6]进行过深入研究。证明谷氨酸,甲硫氨酸,乳酸均可促进L-天冬酰胺酶Ⅱ的产生,玉米浆—肉汤培养基中酶产量较高,钠盐适量亦可促进酶的分泌,葡萄糖抑制酶的产量。我们以玉米浆,牛肉浸膏,谷氨酸钠为培养基组分得出的优化配方经验证,产酶活力是优化前的原配方的2倍。
, 百拇医药
2)在发酵过程中,发酵液的pH是逐渐升高的,并且最终pH在8.7左右,原因可能菌体内的L-天冬酰胺酶不断作用于底物产生的氨所致。
3)产酶的发酵条件优化后,酶的活力进一步得到提高。在摇瓶发酵中,14h产酶达最高峰192.5U/ml,而在25L发酵罐中8h产酶达最高峰182.2U/ml。发酵罐中由于溶氧的提高,菌体很快进入对数生长期,故发酵周期大大缩短,具有较好的工业生产前景。
参考文献
1 Clavell L A,Gelber R D,Cohen H J. Four-agent induction and intensive asparagi nase therapy for treatment of childhood acute lymphoblastic leukemia. N Engl J Med, 1986, 315∶657
, 百拇医药
2 张树政主编. 酶制剂工业. 北京: 科学出版社, 1989,709
3 天津生化制药厂等. 抗癌药物-L-门冬酰胺酶. 医药工业,1974, 4∶8
4 刘景晶,李晶,吴梧桐,等.大肠杆菌L-天门冬酰胺酶II基因的高效表达.中国药 科大学学报.1996, 27(11)∶696
5 刘景晶,金建勤,戴海滨. 大肠杆菌L-天门冬酰胺酶的提取和纯化. 药物生物 技术. 1995, 2(1)∶16
6 Roberts J, Burson G, Hill J M. New procedures for purification of L-asparag inase with high yield from Escherichia coli. J Bacteriol, 1968,9 5(6)∶2117
收稿日期:1999-01-15, 百拇医药
单位:中国药科大学生化教研室,南京210009
关键词:L-天冬酰胺酶Ⅱ;基因工程菌;发酵
摘 要 为提高L
摘 要 为提高L-天冬酰胺酶Ⅱ基因工程菌Esch erichia coli pKA/CPU210009的产酶量,采用正交试验法确定了较佳培养条件,并优化了发酵工艺。工程菌摇瓶产酶稳定在190U/ml。25L发酵罐产酶亦高达180U/ml,发酵周期大大缩短,仅9~10h。产酶量比原工艺提高1倍以上,具有较好的工业生产前景。
Cultivation of Engineering Bacteria
Producing L-Asparaginase II
, 百拇医药
Lai Longsheng, Wu Jing, Zhai Yuan, Wu Wutong , Liu Jingjing
(Department of Biochemistry, China Pharmaceutical University, Nanjing, 210009)
Abstract In order to improve the enzyme production of engineer ing bacteria Esch erichia coli pKA/CPU 210009, a suitable media has been found by orthogonal desig n and some fermentation conditions were optimized. Enzyme production of enginee ring bacteria maintained 190U/ml in flasks and 180U/ml in a fermentor. Ferme n tation period shortened greatly in a fermentor. Enzyme production from the suit able media increased 2-fold than in original fermentation conditions.
, 百拇医药
Key Words L-asparaginase II, Engineering Bacteria, Fermentation
L-天冬酰胺酶Ⅱ(L-AsparaginaseⅡ,EC3.5.1.1)是重要的抗肿瘤药物。在临床上,广泛用于淋巴瘤和白血病的治疗[1]。美国,德国和日本[2]在70年代均实现了用大肠杆菌野生株生产酶制剂。我国曾于1974年用大肠杆菌发酵法生产[3],因菌株实际产酶率低(2~4U/ml),加上噬菌体污染而停产。我国目前临床使用的天冬酰胺酶主要从美国和日本进口,价格昂贵,限制了该药的使用。1995年,刘景晶等构建了高效表达L-天冬酰胺酶Ⅱ的基因工程菌EscherichiacolipKA/CPU210009,其产酶可达70U/ml,发酵周期约20h[4]。我们在此基础上进行了工程菌培养和发酵工艺的优化研究。
1 材 料
, http://www.100md.com
1.1 菌种
E.coli pKA/CPU 210009(本室提供)。
1.2 培养基
平板、斜面培养基Bacto-Tryptone 1.0%, Bacto-Yeast extract 0.5%, NaCl 1.0%,琼脂2.0%,氨苄青霉素pH7.0。
发酵培养基 玉米浆5.0%,牛肉浸膏3.5%,谷氨酸钠1.0%,氨苄青霉素pH7.0。
2 方 法
2.1 酶活力测定方法
参照刘景晶报告的方法测定[5]。
在规定条件下,每min催化L-天冬酰胺水解释放1μmol氨的酶量定义为1个酶活力单位。
, 百拇医药
2.2 发酵方法
2.2.1 摇瓶发酵 温度37℃,往复式摇床培养12~18h(150次/min,振荡距离1cm)。
2.2.2 25L发酵罐发酵 采用GY-25C型发酵设备(宜兴市建兴化工设备联营厂),温度37℃,装液量70%,罐压0.05Mpa。
2.3 正交试验设计
选用3个因素(玉米浆,牛肉浸膏,谷氨酸钠)和3个水平,采用有交互作用的正交表L27(313)。
3 结 果
3.1 较佳培养基组成的确定
3.1.1 培养基组成的正交试验 以玉米浆(A),牛肉浸膏(B),谷氨酸钠(C)为培养基组分,进行正交试验研究E.colipKA/CPU210009的较佳培养基组成。
, 百拇医药
实验经分析可得各因素和交互作用对菌株产酶影响的大小先后顺为:C>A>B×C>A×B>B>A×C。正交试验结果经方差分析,结果见表1。
Tab 1 Analysis of variance table
Source of
variance
Sum of
deviation
square
Degrees of
freedom
Evaluated
, http://www.100md.com
variance
F value
Fα
Significance
A
2431
2
1215.5
6.27
F0.05(2,14)=3.74
Significant
C
, http://www.100md.com
6563
2
3281.5
15.83
F0.01(2,14)=6.51
Highly significant
A×B
2161
4
540.3
2.78
F0.05(4,14)=3.11
, http://www.100md.com
B×C
2628
4
657
3.39
F0.01(4,14)=5.04
Significant
Error*
2716
14
194
Sum
, http://www.100md.com 26481
26
* In order to enhance the reliability of F-test, S2, S6 and S7 were added to error term.
从表1中可以看出C是影响产酶的高度显著因子,A和B×C为显著因子。B和C交互作用的效应分析见表2。
Tab 2 Effect analysis of the interaction between B and C
B1
B2
B3
, 百拇医药
C1
8.8
12.6
32.9
C2
63.1
49.8
39.1
C3
61.8
53.0
30.2
, 百拇医药
综合方差分析和交互作用效应分析结果,本实验的较佳培养基组成为:A3B2C2,即玉米浆3.5%,牛肉浸膏1.5%,谷氨酸钠1.0%。
3.1.2 较佳培养基组分的验证 按上述选出的培养基组分配制5瓶发酵培养基,进行摇瓶发酵。结果见表3。从表中可见,培养基经优化后,酶活力大幅度提高,基本稳定在170U/ml左右,而以原配方发酵所得酶活力仅为83.5U/ml。Tab 3 Verification of optimal media composition
Test No.
1
2
3
4
, 百拇医药
5
Original
medium
Enzyme activity
(U/ml)
171.0
172.2
164.7
169.6
175.5
83.5
3.2 发酵条件的优化
, 百拇医药
发酵培养条件对产酶的影响因素有:培养基pH值,种龄,接种量,通风量(装液量),培养时间等。
3.2.1 培养基pH对产酶的影响 采用优化培养基,用HCl或NaOH调节发酵培养基的初始pH,于37℃振荡培养16h测定发酵液的酶活力。结果表明,最适初始pH为7.0(表4)。Tab 4 Effect of pH on enzyme production
Test No.
Initial pH
Final pH
Enzyme activity
(U/ml)
1
, 百拇医药
6.0
8.6
158.0
2
6.5
8.6
163.5
3
7.0
8.7
171.0
4
7.5
, http://www.100md.com
8.7
167.3
5
8.0
8.8
163.1
3.2.2 种龄,接种量和通风量对产酶的影响
种龄,接种量和通风量三者对酶的影响情况基本相似,即随着种龄,接种量的增加,发酵液的酶活增加,但到一最高值后,产酶又有所下降。实验表明,合适的种龄为10h,酶活192.3U/ml,接种量为5%,酶活为195.2U/ml。500ml三角瓶装液量为120ml,酶活为199.9U/ml。
3.2.3 培养时间对酶形成的影响 用优化培养基,pH7.0,种龄10h,接种量5%,装液量120ml,37℃振荡培养。测定不同时间酶活力和细胞生长(A570nm)和终止发酵时发酵液的pH值。结果表明细胞生长和酶的活力基本平行,对数生长期酶活力也呈直线上升,14h产酶量达到最高峰,为192.5U/ml(见图1)。培养基的初始pH为7.0至发酵结束时,升高至8.7。

, 百拇医药
Fig 1 Time course of fermentation in flasks.
3.3 发酵罐放大试验
在摇瓶试验的基础上,采用优化后的培养基在25l发酵罐中进行发酵,结果见图2。

Fig 2 Time course of fermentation in a fermenter.
从图2可见,在第8h菌体生长和产酶均达最高峰,最高酶活力达182.2U/ml。
4 讨 论
1)L-天冬酰胺酶产生菌培养基的优化工作最早由JosephRoberts[6]进行过深入研究。证明谷氨酸,甲硫氨酸,乳酸均可促进L-天冬酰胺酶Ⅱ的产生,玉米浆—肉汤培养基中酶产量较高,钠盐适量亦可促进酶的分泌,葡萄糖抑制酶的产量。我们以玉米浆,牛肉浸膏,谷氨酸钠为培养基组分得出的优化配方经验证,产酶活力是优化前的原配方的2倍。
, 百拇医药
2)在发酵过程中,发酵液的pH是逐渐升高的,并且最终pH在8.7左右,原因可能菌体内的L-天冬酰胺酶不断作用于底物产生的氨所致。
3)产酶的发酵条件优化后,酶的活力进一步得到提高。在摇瓶发酵中,14h产酶达最高峰192.5U/ml,而在25L发酵罐中8h产酶达最高峰182.2U/ml。发酵罐中由于溶氧的提高,菌体很快进入对数生长期,故发酵周期大大缩短,具有较好的工业生产前景。
参考文献
1 Clavell L A,Gelber R D,Cohen H J. Four-agent induction and intensive asparagi nase therapy for treatment of childhood acute lymphoblastic leukemia. N Engl J Med, 1986, 315∶657
, 百拇医药
2 张树政主编. 酶制剂工业. 北京: 科学出版社, 1989,709
3 天津生化制药厂等. 抗癌药物-L-门冬酰胺酶. 医药工业,1974, 4∶8
4 刘景晶,李晶,吴梧桐,等.大肠杆菌L-天门冬酰胺酶II基因的高效表达.中国药 科大学学报.1996, 27(11)∶696
5 刘景晶,金建勤,戴海滨. 大肠杆菌L-天门冬酰胺酶的提取和纯化. 药物生物 技术. 1995, 2(1)∶16
6 Roberts J, Burson G, Hill J M. New procedures for purification of L-asparag inase with high yield from Escherichia coli. J Bacteriol, 1968,9 5(6)∶2117
收稿日期:1999-01-15, 百拇医药