表达HBV的SMMC-7721人肝癌细胞系模型的建立
作者:谭龙益 王 皓 孔宪涛
单位:
关键词:乙型肝炎病毒基因组;肝癌细胞;基因转染
摘要 目的摘要 目的:建立表达HBV的体外培养的细胞克隆,为研究HBV的生物学性状提供良好的细胞模型。方法:将3.2 kb HBV DNA插入携带新霉素抗药基因的真核细胞表达载体pCNCX,应用磷酸钙沉淀技术将其导入体外培养的SMMC-7721人肝癌细胞系。结果:成功地获得表达HBsAg和HBeAg的细胞克隆。结论:应用磷酸钙沉淀技术将HBV DNA导入体外培养的细胞克隆,获得能表达HBV的细胞克隆,为研究HBV提供细胞模型。
中国图书资料分类法分类号 R 512.62
Establishment of human hepatoma model expressing HBV genome
, 百拇医药
Tan Longyi, Wang Hao, Kong Xiantao (Centre of Clinical Immunology, Changzheng Hospital, Second Military Medical University, Shanghai, 200003)
Abstract Objective: To establish the human hepatoma model expressing HBV genome. Methods: A 3.2 kb HBV DNA fragment was inserted into EcoRⅠ site of HBV-pCNCX plasmid carrying gene of neomycin resistance. Human hepatoma 7721 cell were cultured in DMEM medium. Transfection of HBV-pCNCX plasmid (30 μg) was mediated by exposure of the cells to calcium phosphate. The transfected cells were incubated in DMEM supplemented with 10% fetal bovine serum and G418(400 mg/L)for 30 d. Clones of cells that grew in the presence of G418 were isolated 30 d after transfection. HBsAg and HBeAg were identified with enzyme-linked immunosorbent assay (ELISA). The mRNA for HBV genome was measured by dot blot and in situ hybridization. The integrated and extrachromosomal HBV DNA were identified by Southern blot hybridization. Results: Two transfected cell clones expressing HBsAg and HBeAg were obtained. Intracellular, integrated and extrachromosome HBV DNA sequences and RNA of HBV were detected. Conclusion: The cultured hepatoma cells can express HBV genome.
, 百拇医药
Key words HBV genome; hepatoma cells; gene transfection
乙型肝炎病毒(HBV)是引起人类病毒性肝炎、肝硬化和肝癌的主要致病因素之一。由于HBV具有严格的宿主特异性,不能在体外人工培养[1],限制了对HBV生物学特性和致病机制的研究。因此,建立表达HBV的体外培养细胞模型成为HBV研究领域的重要课题。本研究应用磷酸钙沉淀技术,将3.2 kb HBV DNA全序列导入体外培养的SMMC-7721人肝癌细胞系,成功地建立了表达HBV基因产物的细胞克隆。
1 材料和方法
1.1 材料 SMMC-7721人肝癌细胞系,本校病理解剖学教研室建立,本中心保存;携带双拷贝全序列HBV DNA的pBluescript质粒,由雷章恒博士提供;pCNCX质粒(携带NeoR-基因的真核细胞表达载体)由张鲁榕博士提供;E. coli RR1 菌株由中国科学院上海生物化学研究所提供。地高辛标记的HBV DNA探针,本中心制备;磷酸钙转染试剂盒由Promage公司生产;地高辛标记及检测试剂盒由Boeheringer Mannherin公司生产;HBsAg和HBeAg检测试剂盒由华美生物试剂公司生产;牛小肠碱性磷酸酶(CIP),T4噬菌体DNA连接酶、EcoRⅠ, G418均由Clontech公司生产。
, 百拇医药
1.2 方法
1.2.1 真核细胞HBV-pCNCX表达质粒的构建 携带双拷贝3.2 kb HBV基因组的质粒pBluescript经限制性内切酶EcoRⅠ消化后,回收3.2 kb HBV DNA。载体pCNCX经EcoRⅠ酶切后,在CIP作用下去除 5′端磷酸。在T4噬菌体DNA连接酶的作用下,将HBV DNA插入到载体pCNCX EcoRⅠ位点,获得携带3.2 kb HBV基因组的真核细胞表达质粒HBV-pCNCX。
1.2.2 HBV DNA导入 将经胰蛋白酶消化、生长状态良好的SMMC-7721肝癌细胞2×105个接种于直径100 mm细胞培养皿,20 h更换新鲜含10%小牛血清的DMEM培养基。3 h后,将HBV-pCNCX 30 μl和2 mol/L CaCl2 62 μl混匀,加去离子无菌蒸馏水至0.3 ml,逐滴移至含0.3 ml 2倍HEPES缓冲液(HBS)管中,移入过程中不断转动试管。静置30 min,等待形成沉淀小颗粒。逐滴移至细胞培养皿中(边移入边振荡培养皿),使磷酸钙沉淀 基本均匀分布于表面。置37℃ 5%CO2培养箱培养16 h。Hanks液冲洗细胞3次,15%甘油休克液维持2 min,吸干休克液。HBS洗3次,加入新鲜DMEM培养基。48 h收集上清液,加入含G418 400 mg/L DMEM培养基。每3 d换液1次。培养第30天,可见少数细胞克隆形成,挑选较大克隆各10个,分别接种于无G418、含10%小牛血清的DMEM培养基中继续培养。分别收集上清液和细胞备用。
, 百拇医药
1.2.3 HBsAg和HBeAg的测定 克隆化细胞培养上清液,应用ELISA法测定HBsAg和HBeAg(按说明书进行)。显色后在450 nm处经酶联检测仪阅读D值,当样品D值/阴性对照平均D值≥2.1时为阳性。
1.2.4 原位杂交测定克隆化细胞内HBV mRNA 克隆化细胞悬液滴加于盖玻片上,继续培养24 h。去培养基,4%多聚甲醛室温固定30 min,蛋白酶K 1 μg/ml, 37℃ 20 min, 50 μl杂交液(含特异性HBV cDNA探针),湿盒42℃孵育16 h,抗地高辛抗体75 μl/ml, 37℃ 30 min,显色液避光湿盒放置10 h。显微镜观察,照像。
1.2.5 细胞染色体内HBV DNA的测定 用Southern blot杂交:用快速抽提法提取细胞染色体DNA[2],限制性内切酶EcoRⅠ消化后,经毛细管虹吸法将DNA转印至硝酸纤维薄膜,地高辛标记的HBV DNA探针杂交。
, 百拇医药
2 结 果
2.1 抗G418细胞克隆的形成及筛选 转染细胞在含G418 的DMEM培养基中生长30 d后,形成克隆18个,挑取10个细胞克隆分别进行扩增,其中,培养上清液中HBsAg和HBeAg均阳性者2个。5个克隆仅表达HBsAg,其余3个克隆两种抗原均阴性。扩增和保存表达两种抗原的两株细胞;在含G418的培养基中能生长、但两种抗原均阴性的细胞用于后续鉴定和研究。
2.2 细胞内HBV mRNA的表达 HBsAg和HBeAg阳性细胞株应用地高辛标记HBV DNA探针原位杂交,均显示强烈表达HBV mRNA(图1)。Southern blot杂交显示有两株两种抗原阳性的细胞克隆染色质整合有完整的3.2 kb HBV DNA。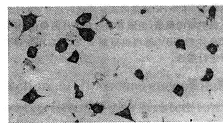
, 百拇医药
图1 HBV-pCNCX转染SMMC-7721细胞
HBV DNA探针原位杂交
Fig 1 Hybridization in situ of SMMC-7721 cells
transfected with HBV-pCNCX by HBV DNA probe
3 讨 论
HBV宿主范围非常狭窄,难以建立实验动物模型。鸭乙型肝炎病毒感染北京田鸭[2],虽然能产生与HBV感染类似的急性肝炎,但其基因序列和致病机制都与HBV之间存在很大差异,不能正确地反映HBV的生物学特征。肝细胞是HBV感染时侵犯和寄生的主要细胞,肝细胞成为建立体外表达HBV细胞模型的首选细胞。将病毒颗粒直接与人类肝细胞和肝脏肿瘤细胞共同孵育[3],仅原代培养的肝细胞能表达HBV基因组产物和完整的HBV病毒体,但原代培养的肝细胞在体外维持时间太短,在应用过程中价值不大。随着分子生物学技术的进步,多种多样的基因转染技术相继建立,为HBV基因在体外细胞克隆中的表达提供了各种工具[4,5]。本研究应用磷酸钙沉淀法,将克隆化的3.2 kb HBV全序列基因组导入体外培养的SMMC-7721肝脏肿瘤细胞,经过长达1个月的含有新霉素培养基的筛选,成功地获得了7721细胞表达HBsAg和HBeAg的克隆,为研究HBV的生物学特性、致病性、基因调控和药物筛选提供了良好的细胞模型。
, 百拇医药
HBV DNA是由一个环状的3.2 kb DNA组成的[6]。两条链长度不等,长链称为负链,含有全部HBV DNA的遗传信息。它由4个开放阅读框(Open reading frames, ORFs)组成,分别是SORF,CORF,PORF和XORF,编码HBsAg, HBeAg/HBcAg,HBxAg和DNA多聚酶。HBeAg和HBcAg是由同一个CORF编码、但起始位点不同、长度上有一定差异的多肽,它们不能互相转换。HBcAg一般不分泌至胞外,在培养基和患者血清中不易检测到。HBxAg含量较少,检测相对困难。本研究选择HBsAg和HBeAg作为筛选指标,能够反映HBV复制状况。体外HBV基因表达克隆的建立,为HBV研究提供新的模型,但随着细胞在体外的传代,整合到染色体的HBV基因也可能丢失,需应用新霉素不断进行筛选。
参 考 文 献
1 Feitelson MA. Biology of hepatitis B virus variants. Lab Invest, 1994, 71(3): 324
, 百拇医药
2 钱耕荪,陈渊卿,瞿永华,等. 鸭肝癌实验模型研究——鸭乙型肝炎病毒对鸭胚的感染. 肿瘤,1986,6(4):163
3 LU X, Block TM, Gerlich WH. Protease-induced infectivity of hepatitis B virus for a human hepatoblastoma cell line. J Virol, 1996, 70(4): 2277
4 Sureau C, Romet-Lemonne JI, Mullins JI, et al. Production of hepatitis B virus by a differentiated human hepatoma cell line after transfection with cloned circular HBV DNA. Cell, 1986, 47(1): 37
, 百拇医药
5 Muller C, Bergmann KF, Gerin JL, et al. Production of hepatitis B virus by a stably transfeced monocytic cell line U-937: a model for extrahepatic hepatitis B virus replication. J Infect Dis, 1992, 165(5): 929
6 Miller RH, Kaneko S, Chung CT, et al. Compact organization of the hepatitis B virus genome. Hepatology, 1989, 9(2): 322
(1997-09-08收稿,1997-12-18修回), http://www.100md.com
单位:
关键词:乙型肝炎病毒基因组;肝癌细胞;基因转染
摘要 目的摘要 目的:建立表达HBV的体外培养的细胞克隆,为研究HBV的生物学性状提供良好的细胞模型。方法:将3.2 kb HBV DNA插入携带新霉素抗药基因的真核细胞表达载体pCNCX,应用磷酸钙沉淀技术将其导入体外培养的SMMC-7721人肝癌细胞系。结果:成功地获得表达HBsAg和HBeAg的细胞克隆。结论:应用磷酸钙沉淀技术将HBV DNA导入体外培养的细胞克隆,获得能表达HBV的细胞克隆,为研究HBV提供细胞模型。
中国图书资料分类法分类号 R 512.62
Establishment of human hepatoma model expressing HBV genome
, 百拇医药
Tan Longyi, Wang Hao, Kong Xiantao (Centre of Clinical Immunology, Changzheng Hospital, Second Military Medical University, Shanghai, 200003)
Abstract Objective: To establish the human hepatoma model expressing HBV genome. Methods: A 3.2 kb HBV DNA fragment was inserted into EcoRⅠ site of HBV-pCNCX plasmid carrying gene of neomycin resistance. Human hepatoma 7721 cell were cultured in DMEM medium. Transfection of HBV-pCNCX plasmid (30 μg) was mediated by exposure of the cells to calcium phosphate. The transfected cells were incubated in DMEM supplemented with 10% fetal bovine serum and G418(400 mg/L)for 30 d. Clones of cells that grew in the presence of G418 were isolated 30 d after transfection. HBsAg and HBeAg were identified with enzyme-linked immunosorbent assay (ELISA). The mRNA for HBV genome was measured by dot blot and in situ hybridization. The integrated and extrachromosomal HBV DNA were identified by Southern blot hybridization. Results: Two transfected cell clones expressing HBsAg and HBeAg were obtained. Intracellular, integrated and extrachromosome HBV DNA sequences and RNA of HBV were detected. Conclusion: The cultured hepatoma cells can express HBV genome.
, 百拇医药
Key words HBV genome; hepatoma cells; gene transfection
乙型肝炎病毒(HBV)是引起人类病毒性肝炎、肝硬化和肝癌的主要致病因素之一。由于HBV具有严格的宿主特异性,不能在体外人工培养[1],限制了对HBV生物学特性和致病机制的研究。因此,建立表达HBV的体外培养细胞模型成为HBV研究领域的重要课题。本研究应用磷酸钙沉淀技术,将3.2 kb HBV DNA全序列导入体外培养的SMMC-7721人肝癌细胞系,成功地建立了表达HBV基因产物的细胞克隆。
1 材料和方法
1.1 材料 SMMC-7721人肝癌细胞系,本校病理解剖学教研室建立,本中心保存;携带双拷贝全序列HBV DNA的pBluescript质粒,由雷章恒博士提供;pCNCX质粒(携带NeoR-基因的真核细胞表达载体)由张鲁榕博士提供;E. coli RR1 菌株由中国科学院上海生物化学研究所提供。地高辛标记的HBV DNA探针,本中心制备;磷酸钙转染试剂盒由Promage公司生产;地高辛标记及检测试剂盒由Boeheringer Mannherin公司生产;HBsAg和HBeAg检测试剂盒由华美生物试剂公司生产;牛小肠碱性磷酸酶(CIP),T4噬菌体DNA连接酶、EcoRⅠ, G418均由Clontech公司生产。
, 百拇医药
1.2 方法
1.2.1 真核细胞HBV-pCNCX表达质粒的构建 携带双拷贝3.2 kb HBV基因组的质粒pBluescript经限制性内切酶EcoRⅠ消化后,回收3.2 kb HBV DNA。载体pCNCX经EcoRⅠ酶切后,在CIP作用下去除 5′端磷酸。在T4噬菌体DNA连接酶的作用下,将HBV DNA插入到载体pCNCX EcoRⅠ位点,获得携带3.2 kb HBV基因组的真核细胞表达质粒HBV-pCNCX。
1.2.2 HBV DNA导入 将经胰蛋白酶消化、生长状态良好的SMMC-7721肝癌细胞2×105个接种于直径100 mm细胞培养皿,20 h更换新鲜含10%小牛血清的DMEM培养基。3 h后,将HBV-pCNCX 30 μl和2 mol/L CaCl2 62 μl混匀,加去离子无菌蒸馏水至0.3 ml,逐滴移至含0.3 ml 2倍HEPES缓冲液(HBS)管中,移入过程中不断转动试管。静置30 min,等待形成沉淀小颗粒。逐滴移至细胞培养皿中(边移入边振荡培养皿),使磷酸钙沉淀 基本均匀分布于表面。置37℃ 5%CO2培养箱培养16 h。Hanks液冲洗细胞3次,15%甘油休克液维持2 min,吸干休克液。HBS洗3次,加入新鲜DMEM培养基。48 h收集上清液,加入含G418 400 mg/L DMEM培养基。每3 d换液1次。培养第30天,可见少数细胞克隆形成,挑选较大克隆各10个,分别接种于无G418、含10%小牛血清的DMEM培养基中继续培养。分别收集上清液和细胞备用。
, 百拇医药
1.2.3 HBsAg和HBeAg的测定 克隆化细胞培养上清液,应用ELISA法测定HBsAg和HBeAg(按说明书进行)。显色后在450 nm处经酶联检测仪阅读D值,当样品D值/阴性对照平均D值≥2.1时为阳性。
1.2.4 原位杂交测定克隆化细胞内HBV mRNA 克隆化细胞悬液滴加于盖玻片上,继续培养24 h。去培养基,4%多聚甲醛室温固定30 min,蛋白酶K 1 μg/ml, 37℃ 20 min, 50 μl杂交液(含特异性HBV cDNA探针),湿盒42℃孵育16 h,抗地高辛抗体75 μl/ml, 37℃ 30 min,显色液避光湿盒放置10 h。显微镜观察,照像。
1.2.5 细胞染色体内HBV DNA的测定 用Southern blot杂交:用快速抽提法提取细胞染色体DNA[2],限制性内切酶EcoRⅠ消化后,经毛细管虹吸法将DNA转印至硝酸纤维薄膜,地高辛标记的HBV DNA探针杂交。
, 百拇医药
2 结 果
2.1 抗G418细胞克隆的形成及筛选 转染细胞在含G418 的DMEM培养基中生长30 d后,形成克隆18个,挑取10个细胞克隆分别进行扩增,其中,培养上清液中HBsAg和HBeAg均阳性者2个。5个克隆仅表达HBsAg,其余3个克隆两种抗原均阴性。扩增和保存表达两种抗原的两株细胞;在含G418的培养基中能生长、但两种抗原均阴性的细胞用于后续鉴定和研究。
2.2 细胞内HBV mRNA的表达 HBsAg和HBeAg阳性细胞株应用地高辛标记HBV DNA探针原位杂交,均显示强烈表达HBV mRNA(图1)。Southern blot杂交显示有两株两种抗原阳性的细胞克隆染色质整合有完整的3.2 kb HBV DNA。

, 百拇医药
图1 HBV-pCNCX转染SMMC-7721细胞
HBV DNA探针原位杂交
Fig 1 Hybridization in situ of SMMC-7721 cells
transfected with HBV-pCNCX by HBV DNA probe
3 讨 论
HBV宿主范围非常狭窄,难以建立实验动物模型。鸭乙型肝炎病毒感染北京田鸭[2],虽然能产生与HBV感染类似的急性肝炎,但其基因序列和致病机制都与HBV之间存在很大差异,不能正确地反映HBV的生物学特征。肝细胞是HBV感染时侵犯和寄生的主要细胞,肝细胞成为建立体外表达HBV细胞模型的首选细胞。将病毒颗粒直接与人类肝细胞和肝脏肿瘤细胞共同孵育[3],仅原代培养的肝细胞能表达HBV基因组产物和完整的HBV病毒体,但原代培养的肝细胞在体外维持时间太短,在应用过程中价值不大。随着分子生物学技术的进步,多种多样的基因转染技术相继建立,为HBV基因在体外细胞克隆中的表达提供了各种工具[4,5]。本研究应用磷酸钙沉淀法,将克隆化的3.2 kb HBV全序列基因组导入体外培养的SMMC-7721肝脏肿瘤细胞,经过长达1个月的含有新霉素培养基的筛选,成功地获得了7721细胞表达HBsAg和HBeAg的克隆,为研究HBV的生物学特性、致病性、基因调控和药物筛选提供了良好的细胞模型。
, 百拇医药
HBV DNA是由一个环状的3.2 kb DNA组成的[6]。两条链长度不等,长链称为负链,含有全部HBV DNA的遗传信息。它由4个开放阅读框(Open reading frames, ORFs)组成,分别是SORF,CORF,PORF和XORF,编码HBsAg, HBeAg/HBcAg,HBxAg和DNA多聚酶。HBeAg和HBcAg是由同一个CORF编码、但起始位点不同、长度上有一定差异的多肽,它们不能互相转换。HBcAg一般不分泌至胞外,在培养基和患者血清中不易检测到。HBxAg含量较少,检测相对困难。本研究选择HBsAg和HBeAg作为筛选指标,能够反映HBV复制状况。体外HBV基因表达克隆的建立,为HBV研究提供新的模型,但随着细胞在体外的传代,整合到染色体的HBV基因也可能丢失,需应用新霉素不断进行筛选。
参 考 文 献
1 Feitelson MA. Biology of hepatitis B virus variants. Lab Invest, 1994, 71(3): 324
, 百拇医药
2 钱耕荪,陈渊卿,瞿永华,等. 鸭肝癌实验模型研究——鸭乙型肝炎病毒对鸭胚的感染. 肿瘤,1986,6(4):163
3 LU X, Block TM, Gerlich WH. Protease-induced infectivity of hepatitis B virus for a human hepatoblastoma cell line. J Virol, 1996, 70(4): 2277
4 Sureau C, Romet-Lemonne JI, Mullins JI, et al. Production of hepatitis B virus by a differentiated human hepatoma cell line after transfection with cloned circular HBV DNA. Cell, 1986, 47(1): 37
, 百拇医药
5 Muller C, Bergmann KF, Gerin JL, et al. Production of hepatitis B virus by a stably transfeced monocytic cell line U-937: a model for extrahepatic hepatitis B virus replication. J Infect Dis, 1992, 165(5): 929
6 Miller RH, Kaneko S, Chung CT, et al. Compact organization of the hepatitis B virus genome. Hepatology, 1989, 9(2): 322
(1997-09-08收稿,1997-12-18修回), http://www.100md.com