细胞外Li+对双基因内向整流钾通道的作用机制
作者:宋祖军 孙脊峰 鲁建国 谢安
单位:宋祖军(第四军医大学西京医院急诊科,陕西 西安 710033,第四军医大学);孙脊峰(第四军医大学西京医院唐都医院肾内科,陕西 西安 710033,第四军医大学) ;鲁建国(第四军医大学西京医院唐都医院普外科,陕西 西安 710033,第四军医大学);谢安(第四军医大学西京医院基础部生理学教研室,陕西 西安 710033)
关键词:Li+;内向整流钾通道;电压钳;爪蟾卵母细胞
第四军医大学学报000419 摘 要:目的 研究Li+对非洲爪蟾卵母细胞表达的双基因内向整流钾通道(IRK1 - T)的作用及其机制. 方法 采用双微电极电压钳(TEV)法. 结果 细胞外K+浓 度为10 mmol.L-1时,细胞外Li+可加速IRK1-T内向电流的失活过程;3个指数拟 合的分析结果表明:由于细胞外Li+对失活过程的时间常数几乎无影响,因此Li+对失活过程的作用是通过Li+与K+在IRK1-T上相互竞争同一结合位点而造成的. 细胞外Li+对IRK1-T的瞬间内向电流(施加电压后1 ms)具有时间依赖性和电压依赖性的易化作用,增加细胞外K+浓度与Li+浓度的比率,这一易化作用增强,表明Li+加速IRK1-T内向电流的失活过程的作用因Li+浓度相对下降而减少. 细胞外Li+对外向电流几乎无作用;Li+对IRK1-T的门控特性几乎无影响;因为在细胞外加入Li+后反转电位几乎不变,所以IRK1-T对Li+不通透. 结论 Li+ 不仅是一快速通道阻断剂,而且细胞外Li+还可以在增大IRK1-T的内向整流作用的同时缩短该电流的时程.
, 百拇医药
中图号:Q424 文献标识码:A
文章编号:1000-2790(2000)04-0452-04
The effects of extracellular Li+ on the inward rectifier potassium tandem chan nel and its mechanism
SONG Zu-Jun
(Department of Emergency Medicine,Xijing Hospital,Fourth Military Medical University, Xi 'an, 710033, China)
SUN Ji-Feng
, http://www.100md.com (Department of Ne phrology,Fourth Military Medical University, Xi 'an, 710033, China)
LU Jian-Guo3
(Department of General Surgery, Tangdu Hospital,Fourth Military Medical University, Xi 'an, 710033, China)
XIE An
(Department of Phys iology, Faculty of Preclinical Medicine, Fourth Military Medical University, Xi 'an, 710033, China)
, http://www.100md.com
Abstract: AIM In order to study the blocking effects of ex tracellular Li+ on the inward rectifier potassium channel (IRK1-T) and its m echanism. METHODS Xenopus oocytes expression system and two-microelectrode voltage clamps (TEV) were used. RESULTS Extracellular Li+ could enhance the inact ivation of IRK1-T inward current when external K+ concentration stayed at 10 mmol.L-1. The analys is of three exponential fitting results showed that Li+ had almost no effect o n the time constants of inactivation phase, indicating that the inactivation was c aused by the competition at the same binding site in IRK1-T between Li+ and K +. Extracellular Li+ could also time-and voltage-dependently facilitate th e IRK1-T instantaneous currents (1 ms after the voltage applied). Increasing the ratio b etween K+ and Li+ concentration increased the facilitatory effect of Li+, indicat ing that the effect of external Li+ on the inactivation phase decreased. Exter na l Li+ almost had no effect on the outward currents of IRK1-T and Li+ had al most no effect on the gating property of IRK1-T. IRK1-T could not permeate Li+ be cau se the reverse potential did not change when external Li+ was added. CON CL USION Extracellular Li+ is not simply a fast channel blocker and it ca n augment and shorten the inward rectifier effect of IRK1-T.
, 百拇医药
Keywords:lithium; inward rectifier potassium channel; tw o-microelectrode voltage clamps; Xenopus oocytes
0 引言
Li+是一价碱金属中最小的金属离子,研究Li+对双基因内向整流钾通道(IRK1-T)的作用不仅对于研究一价阳离子对IRK1-T作用的分子机制有重要作用,而且对于了解IRK1-T的通道结构和功能也有很大帮助. 以往的研究由于技术上的限制,对通道瞬间电流的分析不够精确(施加电压后10 ms)[1],而且采用的数据分析方法也不够精确[2],所以对Li+的作用很难做全面和准确的分析. 我们使用高质量的电流曲线和准确的分析方法对Li+的作用做了详细的评价,准确地发现Li+不仅可以加快IRK1-T内向电流的失活过程,而且 Li+对IRK1-T的瞬间内向电流(施加电压后1 ms)具有电压依赖性的易化作用.
, http://www.100md.com
1 材料和方法
1.1 材料 我们使用的IRK的cDNA是Jan博士(加利福尼亚大学)赠与的. MRN A的线性化由XhoI酶完成,转录过程使用mCAPTM mRNA capping试剂盒(Stratagene Inc),由T3多聚酶转录. mRNA的检测用凝胶电泳;其浓度测量用光谱仪,并于-80℃贮存. 使用第Ⅴ和Ⅵ期的非州爪蟾卵母细胞;在无钙的Barth液中使用胶原酶I(Sigma,10 g.L-1) 处理1.5 h, 温度20℃, 用钠升注射器(Drummond Scientific)将mRNA(质量浓度:1.85 g.L-1,每个细胞内注入100 ng);在正常带有抗菌素的Barth液中孵育24 h后使用.
1.2 方法 全细胞电流记录使用双微电极电压钳(TEV)法,放大 器 为CA-1(Dagan Corp). 用两个有3 mol.L-1 KCl的微电极刺入细胞中,一个(尖端电 阻0.2~0.3 MΩ)做为电流电极,另一个(尖端电阻约0.5 MΩ)做为电压电极,两个电极尖端的形态特别 重要,并且于电极尖端镀上Sylgard. 感受电压的电极置于细胞1 mm左右的距离. 为了测量串联电阻,一个微电极置于细胞上前方约5 μm处,串联电阻一般小于0.2 kΩ,在需要的时候使用串联电阻补偿. 使用一接地的金属板置于微电极之间以减少电 容耦合干扰. 另一个电流电极用于进行电容补偿,旋转3个时间常数和3个相位延迟可以很好地进行电容补偿. 漏电流和电流漂移在分析数据时再除去. 对照浴液中含有(mmol.L-1):10 KCl,80NMDG(或30 KCl加60NMDG),5HEPES,3 mg和0.2 niflumic酸(用于阻断内源性Cl电流),pH 7.4. 研究的Li+作用时,使用氯化盐将NMDG置换使游离的Li+浓度加至80或60 mmol.L-1,pH调为7.4. 换浴液时连续灌流速率约2.5~3 mL.min-1. 电压 波形由586计算机与Digi Data 1200 (Axon Instruments)产生. 电流滤波频率为2 kHz,采样频率为10 kHz,Data的获取由pCLAMP6(Axon)完成. 实验时室内温度为23℃~25℃. 数据分析采用pCLAMP6, Excel 97与Origin完成.
, 百拇医药
对Li+阻断动力学分析是采用3个指数函数的拟合
I=A1e-(t-k)/τ1+A2e-(t-k)/τ2+ A3e-(t-k)/τ3
其中τ为时间常数,最长的τ为阻断的时间常数,A为指数函数的权,K为进行拟合的起始时间.
数据由 ±s表示,每组数据例数为3例.
±s表示,每组数据例数为3例.
2 结果
2.1 Li+对IRK1-T的失活过程的作用及其机制 细胞外K+浓度为10 mmol.L-1时,细胞外Li+可加速IRK1-T内向电流的失活过程(Fig 1),3个指数拟合的分析结果表明:由于细胞外Li+对失活过程的时间常数几乎无影响(Fig 2,B),只是电压依赖性减小了指数拟合的权(Fig 2,A),因此Li+对是通过Li+与K+在IRK1-T上相互竞争同一结合位点而造成内向电流的失活过程.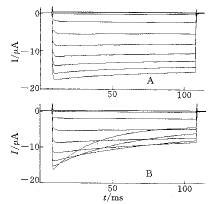
, 百拇医药
图 1 Li+对IRK1-T的失活过程的作用
Fig 1 Effects of extracellular Li+ on inward rectifier potassium chan nel (IRK1-T) inactivation
A: Macroscopic currents without extracellular Li+. B: IRK1-T current s with 80 mmol.L-1 Li+. Voltage duration is:110 ms amplitude is from + 40 mV to -180 mV step -20 mV. Holding potential is -30 mV.
, 百拇医药
图 2 Li+对IRK1-T的失活过程的作用机制
Fig 2 K+ mechanism of effects of extracellular Li+ on IRK1-T inactivat ion
A: The weights of exponential fitting for inactivation. NMDG:N-methyl-D-gluca mine,Li:Lithium. B: The time constants of exponential fitting for inactivation.
2.2 细胞外Li+对IRK1-T的瞬间内向电流具有易化作用 细胞外Li+对IRK1-T的瞬间内向电流(施加电压后1 ms)具有时间依赖 性和电压依赖性的易化作用(Fig 3), 细胞外K+浓度为10 mmol.L-1及Li+浓度 为80 mmol.L-1时,在-140 mV时瞬间内向电流增加(1.1±0.4)%,增加细胞外K+浓度 与Li+浓度的比率,这一易化作用增强,即细胞外K+浓度为30 mmol.L-1及Li+浓 度为60 mmol.L-1时,在-140 mV时瞬间内向电流增加(13.3±0.5)%. 细胞外Li+对外向 电流几乎无作用;因为规一化的电导几乎不受Li+的影响, 所以Li+对IRK1-T的门控特性几乎无影响(Fig 4);因为在细胞外加入Li+后反转电位变化仅为(-0.02±0.05)mV,所以IRK1-T对Li+不通透. 可见Li+不只是一快速的开通道阻断剂.
, http://www.100md.com
图 3 IRK1-T瞬间I-V曲线(电压加上1ms时)
Fig 3 IRK1-T instantaneous I-V curve ( 1 ms after voltage applied )
Data are from Fig 1. Voltage stimulus is the same as Fig 1. [K+]0 10 mmol.L-1+NMDG, [K+]0 10 mmol.L-1+Li, [K+]0 30 mmol.L-1+NMDG,. [K+]0 30 mmol.L-1+Li. NMDG :N-methyl-D-glucamine,Li:lithium.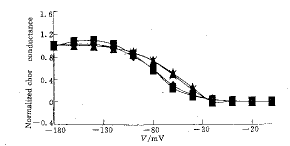
, http://www.100md.com
图 4 IRK1-T规一化的电导
Fig 4 Normalized IRK1-T conductance
Data are from Fig1.Voltage stimulus is the same as
Fig 1. symbols are same mith Fig 3.
3 讨论
内向整流钾通道(IRK1,Kir2.1或IK1)广泛存在于骨骼肌细胞、心肌细胞、神经细胞、胶质细胞、血细胞和内皮细胞等,可维持细胞的静息电位和控制细胞的兴奋性,例如IRK1参与了心肌复极化,还可延长心室肌细胞动作电位时程,对心律失常的产生和防治有很大影响. 对IRK1的各个基因进行功能研究现通常采用基因变异方法,由于基因变异可导致IRK1的通透性改变,所以纯粹用变异基因表达的四聚体通道通常记录不到电流. 解决这个问题的方法通常有两种:一是采用变异基因与野生性基因等比例混合,然后注入细胞[3];二是采用双基因表达的二聚体通道,双基因中一是野生性基因,另一基因可以做成变异基因,然后对变异基因进行功能研究. 后一种方法的关键在于两个野生性基因连接后表达的二聚体通道应与四个野生性基因表达的四聚体通道不仅通道特性完全相同,而且通道阻断剂的作用也要完全相同[4]. 我们就后一点做了详细研究. Li+一直被认为是IRK1-T的快速通道阻断剂,细胞外Li+可以电压和时间依赖性地高效地阻断IRK1-T. 但以往所取得的通道电流在电压加上几个ms后才能避开电容电流的影响,进而进行瞬间电流的分析;而且以往对通道电流进行的拟合也采用的是单指数函数的拟合,对Li+对IRK1-T的作用不能精确地分析研究[1,2]. 通过减小电极尖端阻抗,用Sylgard涂电极尖端等多方改进,我们得到了施加电压下1 ms的高质量电流曲线,并用3个指数函数对电流曲线进行了完美的拟合,这使分析的准确性大大提高.
, 百拇医药
通过分析证实,细胞外K+浓度为10 mmol.L-1时,细胞外Li+可加速IRK1-T内向电流的失活过程. 3个指数拟合的分析结果表明:由于细胞外Li+对失活过程的时间常数几乎无影响,因此Li+对失活过程的作用是通过Li+与K+在IRK1-T上相互竞争同一结合位点而造成的[3]. 细胞外Li+对IRK1-T的瞬间内向电流(施加电压后1 ms)具有时间依赖性和电压依赖性的易化作用,增加细胞外K+浓度与Li+浓度的比率,这一易化作用增加,原因是Li+加速IRK1-T内向电流的失活过程被减弱. 细胞外Li+对外向电流几乎无作用,说明Li+不是IRK1-T外向电流的影响因素[5,6];Li+对IRK1-T的门控特性几乎无影响;因为在细胞外加入Li +后反转电位几乎不变,所以IRK1-T对Li+不通透[7,8]. 结论:Li+不只是一快 速的开通道阻断剂,细胞外Li+还可以使IRK1-T的内向整流增大的同时使作用的时程缩短, 细胞外Li+可增大IRK1-T维持细胞的静息电位的作用效率.
, 百拇医药
细胞外Li+加速IRK1-T内向电流的失活过程是由于Li+是一快速的IRK1-T通道阻断剂. 细胞外Li+对IRK1-T的瞬间内向电流具有时间依赖性和电压依赖性的易化作用的机制尚不清楚,有待进一步的研究. 总之,两个野生性基因连接后表达的二 聚体通道IRK1-T与四个野生性基因表达的四聚体通道IRK1不仅通道特性完全相同,而且通道阻断剂 Li+的作用也要完全相同[4], 提示通过基因重组的方法可以表达IRK1-T,应用变异基因 的IRK1-T可以对该通道的分子结构和功能进行深入研究.
作者简介:宋祖军(1962-),男,(汉族),安徽省五河人. 主任,发 表论文3篇. Tel.(029)3375541 Email. jacksong@fmmu.edu.cn
参考文献:
[1] Kubo Y, Timothy J, Jan YN et al. Primary structure and f unct ional expression of a mouse inward rectifier potassium channel[J]. Nature ,1993;362(11):127-131.
, 百拇医药
[2] Ravshan ZS, Tominaga T, Miwa A et al. A conserved arginine res idue in the preregion of an inward rectifier K channel (IRK1-T) as an external b arrier for cationic blockers[J]. J Gen Physiol,1997;110(6):665-667.
[3] Collins A, Chuang H,Jan YN et al. Scanning mutagenesis of the puta tive transmembrane segment of Kir2.1, an inward rectifier potassium channel[J ]. Proc Natl Acad Sci USA,1997;94(10):5456-5460.
[4] Lee JK,John SA,Weiss JN et al. Novel gating mechanism of polya mine block in the strong inward rectifier K+ channel Kir2.1[J]. J Gen Phys iol,1999;113(4):555-563.
, 百拇医药
[5] Harvey RD, TenEick RE. Voltage-dependent block of cardiac inward -rectifying potassium current by monovalent cations[J]. J Gen Physiol, 1989;94(1): 349-361.
[6] Ohmori H. K ions upon the inactivation of the anomalous rectifier of tunicate egg cell membrane[J]. JMembr Biol,1980;53(2): 143 -156.
[7] Hill B. Ionic channels of excitable membranes[M]. 2nd ed. Sinaue r:Sunderland. MA, 1992:350-361.
[8] Doyle DA,Cabra JM,Richard A et al. The structure of the potass ium channel : Molecular basis of K+ conduction and selectivity[J]. Science,1998;2 8(3):69-74.
收稿日期:1999-12-03; 修回日期:1999-12-30, http://www.100md.com
单位:宋祖军(第四军医大学西京医院急诊科,陕西 西安 710033,第四军医大学);孙脊峰(第四军医大学西京医院唐都医院肾内科,陕西 西安 710033,第四军医大学) ;鲁建国(第四军医大学西京医院唐都医院普外科,陕西 西安 710033,第四军医大学);谢安(第四军医大学西京医院基础部生理学教研室,陕西 西安 710033)
关键词:Li+;内向整流钾通道;电压钳;爪蟾卵母细胞
第四军医大学学报000419 摘 要:目的 研究Li+对非洲爪蟾卵母细胞表达的双基因内向整流钾通道(IRK1 - T)的作用及其机制. 方法 采用双微电极电压钳(TEV)法. 结果 细胞外K+浓 度为10 mmol.L-1时,细胞外Li+可加速IRK1-T内向电流的失活过程;3个指数拟 合的分析结果表明:由于细胞外Li+对失活过程的时间常数几乎无影响,因此Li+对失活过程的作用是通过Li+与K+在IRK1-T上相互竞争同一结合位点而造成的. 细胞外Li+对IRK1-T的瞬间内向电流(施加电压后1 ms)具有时间依赖性和电压依赖性的易化作用,增加细胞外K+浓度与Li+浓度的比率,这一易化作用增强,表明Li+加速IRK1-T内向电流的失活过程的作用因Li+浓度相对下降而减少. 细胞外Li+对外向电流几乎无作用;Li+对IRK1-T的门控特性几乎无影响;因为在细胞外加入Li+后反转电位几乎不变,所以IRK1-T对Li+不通透. 结论 Li+ 不仅是一快速通道阻断剂,而且细胞外Li+还可以在增大IRK1-T的内向整流作用的同时缩短该电流的时程.
, 百拇医药
中图号:Q424 文献标识码:A
文章编号:1000-2790(2000)04-0452-04
The effects of extracellular Li+ on the inward rectifier potassium tandem chan nel and its mechanism
SONG Zu-Jun
(Department of Emergency Medicine,Xijing Hospital,Fourth Military Medical University, Xi 'an, 710033, China)
SUN Ji-Feng
, http://www.100md.com (Department of Ne phrology,Fourth Military Medical University, Xi 'an, 710033, China)
LU Jian-Guo3
(Department of General Surgery, Tangdu Hospital,Fourth Military Medical University, Xi 'an, 710033, China)
XIE An
(Department of Phys iology, Faculty of Preclinical Medicine, Fourth Military Medical University, Xi 'an, 710033, China)
, http://www.100md.com
Abstract: AIM In order to study the blocking effects of ex tracellular Li+ on the inward rectifier potassium channel (IRK1-T) and its m echanism. METHODS Xenopus oocytes expression system and two-microelectrode voltage clamps (TEV) were used. RESULTS Extracellular Li+ could enhance the inact ivation of IRK1-T inward current when external K+ concentration stayed at 10 mmol.L-1. The analys is of three exponential fitting results showed that Li+ had almost no effect o n the time constants of inactivation phase, indicating that the inactivation was c aused by the competition at the same binding site in IRK1-T between Li+ and K +. Extracellular Li+ could also time-and voltage-dependently facilitate th e IRK1-T instantaneous currents (1 ms after the voltage applied). Increasing the ratio b etween K+ and Li+ concentration increased the facilitatory effect of Li+, indicat ing that the effect of external Li+ on the inactivation phase decreased. Exter na l Li+ almost had no effect on the outward currents of IRK1-T and Li+ had al most no effect on the gating property of IRK1-T. IRK1-T could not permeate Li+ be cau se the reverse potential did not change when external Li+ was added. CON CL USION Extracellular Li+ is not simply a fast channel blocker and it ca n augment and shorten the inward rectifier effect of IRK1-T.
, 百拇医药
Keywords:lithium; inward rectifier potassium channel; tw o-microelectrode voltage clamps; Xenopus oocytes
0 引言
Li+是一价碱金属中最小的金属离子,研究Li+对双基因内向整流钾通道(IRK1-T)的作用不仅对于研究一价阳离子对IRK1-T作用的分子机制有重要作用,而且对于了解IRK1-T的通道结构和功能也有很大帮助. 以往的研究由于技术上的限制,对通道瞬间电流的分析不够精确(施加电压后10 ms)[1],而且采用的数据分析方法也不够精确[2],所以对Li+的作用很难做全面和准确的分析. 我们使用高质量的电流曲线和准确的分析方法对Li+的作用做了详细的评价,准确地发现Li+不仅可以加快IRK1-T内向电流的失活过程,而且 Li+对IRK1-T的瞬间内向电流(施加电压后1 ms)具有电压依赖性的易化作用.
, http://www.100md.com
1 材料和方法
1.1 材料 我们使用的IRK的cDNA是Jan博士(加利福尼亚大学)赠与的. MRN A的线性化由XhoI酶完成,转录过程使用mCAPTM mRNA capping试剂盒(Stratagene Inc),由T3多聚酶转录. mRNA的检测用凝胶电泳;其浓度测量用光谱仪,并于-80℃贮存. 使用第Ⅴ和Ⅵ期的非州爪蟾卵母细胞;在无钙的Barth液中使用胶原酶I(Sigma,10 g.L-1) 处理1.5 h, 温度20℃, 用钠升注射器(Drummond Scientific)将mRNA(质量浓度:1.85 g.L-1,每个细胞内注入100 ng);在正常带有抗菌素的Barth液中孵育24 h后使用.
1.2 方法 全细胞电流记录使用双微电极电压钳(TEV)法,放大 器 为CA-1(Dagan Corp). 用两个有3 mol.L-1 KCl的微电极刺入细胞中,一个(尖端电 阻0.2~0.3 MΩ)做为电流电极,另一个(尖端电阻约0.5 MΩ)做为电压电极,两个电极尖端的形态特别 重要,并且于电极尖端镀上Sylgard. 感受电压的电极置于细胞1 mm左右的距离. 为了测量串联电阻,一个微电极置于细胞上前方约5 μm处,串联电阻一般小于0.2 kΩ,在需要的时候使用串联电阻补偿. 使用一接地的金属板置于微电极之间以减少电 容耦合干扰. 另一个电流电极用于进行电容补偿,旋转3个时间常数和3个相位延迟可以很好地进行电容补偿. 漏电流和电流漂移在分析数据时再除去. 对照浴液中含有(mmol.L-1):10 KCl,80NMDG(或30 KCl加60NMDG),5HEPES,3 mg和0.2 niflumic酸(用于阻断内源性Cl电流),pH 7.4. 研究的Li+作用时,使用氯化盐将NMDG置换使游离的Li+浓度加至80或60 mmol.L-1,pH调为7.4. 换浴液时连续灌流速率约2.5~3 mL.min-1. 电压 波形由586计算机与Digi Data 1200 (Axon Instruments)产生. 电流滤波频率为2 kHz,采样频率为10 kHz,Data的获取由pCLAMP6(Axon)完成. 实验时室内温度为23℃~25℃. 数据分析采用pCLAMP6, Excel 97与Origin完成.
, 百拇医药
对Li+阻断动力学分析是采用3个指数函数的拟合
I=A1e-(t-k)/τ1+A2e-(t-k)/τ2+ A3e-(t-k)/τ3
其中τ为时间常数,最长的τ为阻断的时间常数,A为指数函数的权,K为进行拟合的起始时间.
数据由
 ±s表示,每组数据例数为3例.
±s表示,每组数据例数为3例.2 结果
2.1 Li+对IRK1-T的失活过程的作用及其机制 细胞外K+浓度为10 mmol.L-1时,细胞外Li+可加速IRK1-T内向电流的失活过程(Fig 1),3个指数拟合的分析结果表明:由于细胞外Li+对失活过程的时间常数几乎无影响(Fig 2,B),只是电压依赖性减小了指数拟合的权(Fig 2,A),因此Li+对是通过Li+与K+在IRK1-T上相互竞争同一结合位点而造成内向电流的失活过程.

, 百拇医药
图 1 Li+对IRK1-T的失活过程的作用
Fig 1 Effects of extracellular Li+ on inward rectifier potassium chan nel (IRK1-T) inactivation
A: Macroscopic currents without extracellular Li+. B: IRK1-T current s with 80 mmol.L-1 Li+. Voltage duration is:110 ms amplitude is from + 40 mV to -180 mV step -20 mV. Holding potential is -30 mV.

, 百拇医药
图 2 Li+对IRK1-T的失活过程的作用机制
Fig 2 K+ mechanism of effects of extracellular Li+ on IRK1-T inactivat ion
A: The weights of exponential fitting for inactivation. NMDG:N-methyl-D-gluca mine,Li:Lithium. B: The time constants of exponential fitting for inactivation.
2.2 细胞外Li+对IRK1-T的瞬间内向电流具有易化作用 细胞外Li+对IRK1-T的瞬间内向电流(施加电压后1 ms)具有时间依赖 性和电压依赖性的易化作用(Fig 3), 细胞外K+浓度为10 mmol.L-1及Li+浓度 为80 mmol.L-1时,在-140 mV时瞬间内向电流增加(1.1±0.4)%,增加细胞外K+浓度 与Li+浓度的比率,这一易化作用增强,即细胞外K+浓度为30 mmol.L-1及Li+浓 度为60 mmol.L-1时,在-140 mV时瞬间内向电流增加(13.3±0.5)%. 细胞外Li+对外向 电流几乎无作用;因为规一化的电导几乎不受Li+的影响, 所以Li+对IRK1-T的门控特性几乎无影响(Fig 4);因为在细胞外加入Li+后反转电位变化仅为(-0.02±0.05)mV,所以IRK1-T对Li+不通透. 可见Li+不只是一快速的开通道阻断剂.

, http://www.100md.com
图 3 IRK1-T瞬间I-V曲线(电压加上1ms时)
Fig 3 IRK1-T instantaneous I-V curve ( 1 ms after voltage applied )
Data are from Fig 1. Voltage stimulus is the same as Fig 1. [K+]0 10 mmol.L-1+NMDG, [K+]0 10 mmol.L-1+Li, [K+]0 30 mmol.L-1+NMDG,. [K+]0 30 mmol.L-1+Li. NMDG :N-methyl-D-glucamine,Li:lithium.

, http://www.100md.com
图 4 IRK1-T规一化的电导
Fig 4 Normalized IRK1-T conductance
Data are from Fig1.Voltage stimulus is the same as
Fig 1. symbols are same mith Fig 3.
3 讨论
内向整流钾通道(IRK1,Kir2.1或IK1)广泛存在于骨骼肌细胞、心肌细胞、神经细胞、胶质细胞、血细胞和内皮细胞等,可维持细胞的静息电位和控制细胞的兴奋性,例如IRK1参与了心肌复极化,还可延长心室肌细胞动作电位时程,对心律失常的产生和防治有很大影响. 对IRK1的各个基因进行功能研究现通常采用基因变异方法,由于基因变异可导致IRK1的通透性改变,所以纯粹用变异基因表达的四聚体通道通常记录不到电流. 解决这个问题的方法通常有两种:一是采用变异基因与野生性基因等比例混合,然后注入细胞[3];二是采用双基因表达的二聚体通道,双基因中一是野生性基因,另一基因可以做成变异基因,然后对变异基因进行功能研究. 后一种方法的关键在于两个野生性基因连接后表达的二聚体通道应与四个野生性基因表达的四聚体通道不仅通道特性完全相同,而且通道阻断剂的作用也要完全相同[4]. 我们就后一点做了详细研究. Li+一直被认为是IRK1-T的快速通道阻断剂,细胞外Li+可以电压和时间依赖性地高效地阻断IRK1-T. 但以往所取得的通道电流在电压加上几个ms后才能避开电容电流的影响,进而进行瞬间电流的分析;而且以往对通道电流进行的拟合也采用的是单指数函数的拟合,对Li+对IRK1-T的作用不能精确地分析研究[1,2]. 通过减小电极尖端阻抗,用Sylgard涂电极尖端等多方改进,我们得到了施加电压下1 ms的高质量电流曲线,并用3个指数函数对电流曲线进行了完美的拟合,这使分析的准确性大大提高.
, 百拇医药
通过分析证实,细胞外K+浓度为10 mmol.L-1时,细胞外Li+可加速IRK1-T内向电流的失活过程. 3个指数拟合的分析结果表明:由于细胞外Li+对失活过程的时间常数几乎无影响,因此Li+对失活过程的作用是通过Li+与K+在IRK1-T上相互竞争同一结合位点而造成的[3]. 细胞外Li+对IRK1-T的瞬间内向电流(施加电压后1 ms)具有时间依赖性和电压依赖性的易化作用,增加细胞外K+浓度与Li+浓度的比率,这一易化作用增加,原因是Li+加速IRK1-T内向电流的失活过程被减弱. 细胞外Li+对外向电流几乎无作用,说明Li+不是IRK1-T外向电流的影响因素[5,6];Li+对IRK1-T的门控特性几乎无影响;因为在细胞外加入Li +后反转电位几乎不变,所以IRK1-T对Li+不通透[7,8]. 结论:Li+不只是一快 速的开通道阻断剂,细胞外Li+还可以使IRK1-T的内向整流增大的同时使作用的时程缩短, 细胞外Li+可增大IRK1-T维持细胞的静息电位的作用效率.
, 百拇医药
细胞外Li+加速IRK1-T内向电流的失活过程是由于Li+是一快速的IRK1-T通道阻断剂. 细胞外Li+对IRK1-T的瞬间内向电流具有时间依赖性和电压依赖性的易化作用的机制尚不清楚,有待进一步的研究. 总之,两个野生性基因连接后表达的二 聚体通道IRK1-T与四个野生性基因表达的四聚体通道IRK1不仅通道特性完全相同,而且通道阻断剂 Li+的作用也要完全相同[4], 提示通过基因重组的方法可以表达IRK1-T,应用变异基因 的IRK1-T可以对该通道的分子结构和功能进行深入研究.
作者简介:宋祖军(1962-),男,(汉族),安徽省五河人. 主任,发 表论文3篇. Tel.(029)3375541 Email. jacksong@fmmu.edu.cn
参考文献:
[1] Kubo Y, Timothy J, Jan YN et al. Primary structure and f unct ional expression of a mouse inward rectifier potassium channel[J]. Nature ,1993;362(11):127-131.
, 百拇医药
[2] Ravshan ZS, Tominaga T, Miwa A et al. A conserved arginine res idue in the preregion of an inward rectifier K channel (IRK1-T) as an external b arrier for cationic blockers[J]. J Gen Physiol,1997;110(6):665-667.
[3] Collins A, Chuang H,Jan YN et al. Scanning mutagenesis of the puta tive transmembrane segment of Kir2.1, an inward rectifier potassium channel[J ]. Proc Natl Acad Sci USA,1997;94(10):5456-5460.
[4] Lee JK,John SA,Weiss JN et al. Novel gating mechanism of polya mine block in the strong inward rectifier K+ channel Kir2.1[J]. J Gen Phys iol,1999;113(4):555-563.
, 百拇医药
[5] Harvey RD, TenEick RE. Voltage-dependent block of cardiac inward -rectifying potassium current by monovalent cations[J]. J Gen Physiol, 1989;94(1): 349-361.
[6] Ohmori H. K ions upon the inactivation of the anomalous rectifier of tunicate egg cell membrane[J]. JMembr Biol,1980;53(2): 143 -156.
[7] Hill B. Ionic channels of excitable membranes[M]. 2nd ed. Sinaue r:Sunderland. MA, 1992:350-361.
[8] Doyle DA,Cabra JM,Richard A et al. The structure of the potass ium channel : Molecular basis of K+ conduction and selectivity[J]. Science,1998;2 8(3):69-74.
收稿日期:1999-12-03; 修回日期:1999-12-30, http://www.100md.com