重组抗HBx单链噬菌体的表达
作者:周 铬 刘康达 龚 奕 何 进 秦慧莲 何 曦
单位:周 铬 刘康达 龚 奕 何 进 (上海医科大学附属中山医院实验研究中心,上海200032);秦慧莲 何 曦 (上海医科大学免疫学教研室,上海200032)
关键词:噬菌体展示技术;基因工程抗体;乙型肝炎X抗原
中国免疫学杂志990204 中国图书分类号 R371
摘 要 目的:进一步探索重组基因工程抗体在原核系统中有效的活性表达途径。方法:在已构建的抗HBx单链抗体(ScFv)的基础上,利用粘粒载体构建了抗HBx单链噬菌体抗体(phage antibody),并转化大肠杆菌。结果:该噬菌体抗体经辅助噬菌体M13KO7诱导和噬菌体次要衣壳蛋白(PⅢ)融合表达,并组装成噬菌体衣壳蛋白可溶性表达于培养液上清,经ELISA和Western-blot的结果证实可溶性表达产物具有HBx抗原的特异性亲和力。结论:单链噬菌体抗体的构建表达成功,可望成为原核系统中表达筛选特异性抗体可变区及有效制备活性基因工程抗体的简捷途径。
, 百拇医药
Expression of recombinant anti-HBx single chain phageantibody
ZHOU Ge,LIU Kang-Da,GONG Yi et al.
Zhongshan Hospital,Shanghai Medical University,Shanghai 200032
QIN Hui-Lian,HE Xi.
Department of Immunology,Shanghai Medical University,Shanghai 200032
Abstract Objective:To study the expression of recombinant anti-HBx single chain phage antibody.Methods:The anti-HBx single chain phage antibody(pScFv) was constructed for the study on active expression of genetic antibody in E.coli.The anit-HBx ScFv gene was recombined with phagemid vector (pCANTAB) and transferred into host bacteria.Results:The anti-HBx pScFv was induced with helper phage M13KO7.The soluble expression products fused with phage minor coat protein was secreted which was detected specific binding affinity by Western-blot and ELISA assay.Conclusion:The successful construction and expression of anti-HBx pScFv might establish the method for the active selecting and preparing the specific antibodies in the E.coli expression system.
, 百拇医药
Key words Phage display Recombinant antibody HBxAg
作为肝癌相关抗体,抗HBx单克隆抗体多年来一直被应用于肝癌实验性治疗和亚临床治疗的研究,并取得了一定的疗效[1]。为了进一步解决单克隆抗体在临床治疗中的Human Anti-mouse Antibody(HAMA)反应,前期我们构建了原核表达的嵌合抗体和单链抗体[2,3]。虽然采用了金属离子配体螯合纯化技术解决了重组抗体的大量纯化问题,重组抗体的复性问题限制了重组抗体进入实验性研究的进程。本研究试图通过构建噬菌体抗体融合表达载体来解决基因工程抗体可变区的活性原核表达,为基因工程抗体进入实验性导向研究提供基础。
1 材料与方法
1.1 材料 HBx单克隆抗体轻,重链可变区基因由本组克隆制备[3],单链抗体构建载体pOPE-51及重组HBx抗原为德国癌症中心提供(DKFZ,Heiderberg,Germany),噬菌体抗体构建载体PCANTAB,由中国科学院,上海生物化学研究所提供,限制性内切酶为Gibco公司产品,PCR扩增及DNA测序试剂为PE公司产品,酶标抗His-tag抗体,酶标抗噬菌体抗体为Pharmica公司产品。
, 百拇医药
1.2 PCR扩增单链抗体基因引物委托中国科学院,上海植物生理研究所合成序列如下:X+:5′-ACACAAGGCCCAGCTGGCCGAGTCAGGAGGAGG-3′;X-:5′-TCAATAGCGGCCGCATGATGGTGATGTATGC -3′。
1.3 构建抗HBx单链抗体组氨酸融合表达载体及其表达,鉴定,参见文献[3]。
1.4 PCR扩增及电泳纯化HBx ScFv/His融合基因片段 以HBxpOPE为模板(10 ng),PCR扩增引物各50 pmol,dNTPs 200 μmol/L,1×PCR Buffer(KCl 50 mmol/L,Tris-Cl 10 mmol/L pH 8.3,0.1%明胶),在100 μl的反应体积中加入3 U的Taq DNA聚合酶,于94℃ 45 s,52℃ 15 s,72℃ 45 s(PE 9600),共30循环,取5 μl PCR产物于琼脂糖电泳鉴定。其余产物经制备型凝胶回收特异性片段(Gel purification Kit,QIAGEN,Germany)于-20℃保存备用。
, http://www.100md.com
1.5 抗HBx噬菌体抗体的克隆构建见图1。
1.6 将构建的pCANT-X转化大肠杆菌TG1,于含2%葡萄糖,100 μg/ml氨卞青霉素(Amp)的LB培养液于30℃振荡培养过夜,提取双链质粒DNA,经酶切鉴定筛选阳性克隆,并测序鉴定[4]。
1.7 单链噬菌体抗体的融合表达及纯化 阳性克隆1%转种含2%葡萄糖,100 μg/ml氨卞青霉素(Amp)的LB培养液于30℃振荡培养约3 h(OD600=0.6),加入总滴度为109的辅助噬菌体M13KO7,并于37℃静置感染15 min。离心收集菌体并重悬于3 ml含50 μg/ml卡那霉素(Kan),100 μg/ml Amp的LB中37℃培养液过夜。于10 000 r/min,4℃离心收集过夜培养上清,按每ml上清中加入150 μl SA溶液(16% PEG6000,3.3 mol/L NaCl),4℃2 h静置,于10 000 r/min,4℃沉淀噬菌体,沉淀重悬于100 μl的LB培养液中。
, 百拇医药
1.8 抗HBx单链噬菌体抗体的ELISA鉴定 取10 μl纯化的噬菌体单链抗体,按10倍稀释至10-6,以M13KO7为对照,和已包被的HBxAg的酶标板(由德国癌症中心提供)室温亲和30 min,以鼠抗噬菌体抗体(mAb,Pharmacia,USA)为一抗,HRP-羊抗鼠IgG(华美生物工程公司)为二抗,检测抗HBx单链噬菌体抗体的亲和活性。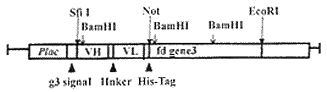
图1 噬菌体单链抗体表达载体的构建
Fig.1 Construction of anti-HBx single chain phage antibody
图2 PCR扩增HBx单链抗体基因的琼脂糖电泳
, http://www.100md.com
Fig.2 Electrophoretic analysis of HBx single chain antibody PCR products
Note:1.PCR products of single chain antibody 2.Negative control 3.100bp molecular
2 结果
2.1 PCR扩增HBx单链抗体基因经琼脂糖电泳检maker测约700 bp的阳性扩增产物如图2。
2.2 HBx单链抗体基因克隆于pCANTAB噬菌体表达载体,经BamHI限制性酶切鉴定结果如阳性克隆含有约620 bp的pⅢ基因5′端片段和750 bp的插入片段。
2.3 阳性表达克隆经DNA序列分析结果表明其含有正确整码插入的单链抗体编码基因见图3。
, http://www.100md.com
2.4 pCANTAB-HBx表达载体经IPTG诱导,Ni2+亲和纯化产物经Western-blot鉴定结果表明该产物约为29 kD的含有His-Tag的蛋白和单链抗体理论分子量相符,见图4。
2.5 表达的噬菌体融合抗体和HBx抗原亲和的ELISA结果表明经辅助噬菌体诱导产生的重组噬菌体具有和HBx抗原的特异性亲和,见图5。

图3 抗HBx噬菌体抗体的DNA序列分析结果
Fig.3 Sequence of anti-HBx single chain phage-antibody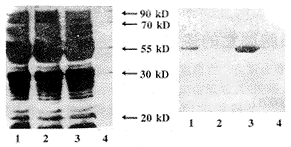
, http://www.100md.com
图4 经IPTG引导的pCANTAB-HBx单链抗体Western-blot
Fig.4 The SDS-PACE and Western-blot results of pCANTAB-HBx Scfv expression
Note:A.SDS-PAGE B.Western-blot 1,3.Positive expression of anti-HBx single chain antibody 2.Host strain TG1 4.Low molecular weight protein marker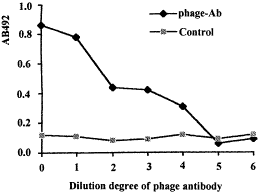
图5 ELISA分析单链抗HBx噬菌体抗体的亲和活性
Fig.5 ELISA result of anti-HBx single chain phage-antibody
, 百拇医药
3 讨论
1988年Smith GP建立噬菌体展示筛选技术以来[5],该技术已被广泛应用于特异性抗体可变区的筛选,在噬菌体载体中构建单链或单区抗体,这种有活性表达的噬菌体抗体也已成为筛选特异性人源抗体的重要手段[6]。特异性抗体可变区在原核系统中的活性表达,在很大程度上推动了抗体工程的发展[7],但是以强表达操纵子调控的高效原核表达导致了抗体蛋白大量以包涵体形式存在面临复性的难题。本研究尝试采用构建噬菌体单链抗体的方式探索以噬菌体为载体在原核系统中活性表达,制备单链基因工程抗体的可能。
我们的结果表明,设计的PCR引物可直接扩增HBx单链抗体的编码基因,在我们得到的5个不同克隆DNA序列分析结果中仅一例发生单基因突变,其余4例均为正常序列,这表明通过优化的PCR条件,可直接利用PCR获得可靠的目的基因用于表达。构建的噬菌体单链抗体是以抗体重链可变区-十肽小侧链柔 性肽段-抗体轻链可变区以及3′端的六聚组氨酸尾组成插入噬菌体次要衣壳蛋白(基因Ⅲ产物,PⅢ)中融合表达。含有表达载体pCANTAB-HBx的大肠杆菌在辅助噬菌体M13KO7的感染下大量产生含有重组HBx单链抗体的噬菌体衣壳蛋白,并包装可溶性分泌于培养液上清,其含量可高达3×1013pfu/ml。同时利用简单的PEG/NaCl沉淀的方法即可制备量和纯度足以满足用于动物模型实验的活性单链抗体表达产物。此外,pCANTAB-HBx表达载体在适量的IPTG诱导下,激活的LacZ操纵子启动大量表达HBx单链抗体-PⅢ融合蛋白,并经噬菌体PⅢ信号肽引导可溶性分泌于培养液中,可利用融合于单链抗体3′端的六聚组氨酸抗体检测,以及Ni2+离子树脂吸附纯化[3]。由于目前的抗噬菌体单克隆抗体或抗血清针对的亲和靶位多为噬菌体主要衣壳蛋白(PⅧ),因而我们在检测噬菌体抗体和检测单链融合抗体时分别应用了抗噬菌体和抗His-Tag抗体作为第一抗体。抗HBx噬菌体抗体的构建,表达为抗体可变区基因活性表达提供了一种高效,简单的方法。同时噬菌体抗体所特有的基因型和表型的一一对应特征,为抗体可变区全基因文库的筛选提供了有力的手段[8]。
, http://www.100md.com
作者简介:周 铬,30岁,助理研究员,主要从事肿瘤导向研究;
秦慧莲,女,46岁,教授,主要从事肿瘤免疫研究
4 参考文献
1 Li J,Tang Z Y,Liu K D et al. Radioimmunoimaging of human hepatocellular carcinoma xenografts with 131-I-HBx monoclonal antibody.J Exp Clin Cancer Res,1995;14(1):25
2 Zhou G,Liu K D,Tang Z Y et al. Reconstruction and expression of chimeric anti-HBx antibody in E.coli.J Cancer Res Clin Oncol,1997;123(6):325
, http://www.100md.com
3 Zhou G,Liu K D,Sun H C et al. Expression and purification of single-chain anti-HBx antibody in Escherichia coli.J Cancer Res Clin Oncol,1997;123(12):609
4 Sambrook J,Fritsch E F,Maniatis T.Molecular cloning:A laboratory manual.2nd ed.New York:Cold Spring Harbor Laboratory Press,1989:p14.5-14.52
5 Parmley S F,Smith G P.Antibody-Selectable filamentous fd phage vector:affinity purification of target genes.Gene,1988;73(1):305
6 Winter G ,Griffiths A D.Making antibodies by phage display technology.Ann Rev Immunol,1994;12(2):433
7 叶 敏.基因工程抗体研究进展.中华微生物学和免疫学杂志,1996;16(4):231
8 张 英,李爱民.噬菌体表面表达技术及其在抗病毒研究中的应用现状和前景.病毒学报,1997;13(2):185
〔收稿1998-09-15 修回1998-11-05〕, http://www.100md.com
单位:周 铬 刘康达 龚 奕 何 进 (上海医科大学附属中山医院实验研究中心,上海200032);秦慧莲 何 曦 (上海医科大学免疫学教研室,上海200032)
关键词:噬菌体展示技术;基因工程抗体;乙型肝炎X抗原
中国免疫学杂志990204 中国图书分类号 R371
摘 要 目的:进一步探索重组基因工程抗体在原核系统中有效的活性表达途径。方法:在已构建的抗HBx单链抗体(ScFv)的基础上,利用粘粒载体构建了抗HBx单链噬菌体抗体(phage antibody),并转化大肠杆菌。结果:该噬菌体抗体经辅助噬菌体M13KO7诱导和噬菌体次要衣壳蛋白(PⅢ)融合表达,并组装成噬菌体衣壳蛋白可溶性表达于培养液上清,经ELISA和Western-blot的结果证实可溶性表达产物具有HBx抗原的特异性亲和力。结论:单链噬菌体抗体的构建表达成功,可望成为原核系统中表达筛选特异性抗体可变区及有效制备活性基因工程抗体的简捷途径。
, 百拇医药
Expression of recombinant anti-HBx single chain phageantibody
ZHOU Ge,LIU Kang-Da,GONG Yi et al.
Zhongshan Hospital,Shanghai Medical University,Shanghai 200032
QIN Hui-Lian,HE Xi.
Department of Immunology,Shanghai Medical University,Shanghai 200032
Abstract Objective:To study the expression of recombinant anti-HBx single chain phage antibody.Methods:The anti-HBx single chain phage antibody(pScFv) was constructed for the study on active expression of genetic antibody in E.coli.The anit-HBx ScFv gene was recombined with phagemid vector (pCANTAB) and transferred into host bacteria.Results:The anti-HBx pScFv was induced with helper phage M13KO7.The soluble expression products fused with phage minor coat protein was secreted which was detected specific binding affinity by Western-blot and ELISA assay.Conclusion:The successful construction and expression of anti-HBx pScFv might establish the method for the active selecting and preparing the specific antibodies in the E.coli expression system.
, 百拇医药
Key words Phage display Recombinant antibody HBxAg
作为肝癌相关抗体,抗HBx单克隆抗体多年来一直被应用于肝癌实验性治疗和亚临床治疗的研究,并取得了一定的疗效[1]。为了进一步解决单克隆抗体在临床治疗中的Human Anti-mouse Antibody(HAMA)反应,前期我们构建了原核表达的嵌合抗体和单链抗体[2,3]。虽然采用了金属离子配体螯合纯化技术解决了重组抗体的大量纯化问题,重组抗体的复性问题限制了重组抗体进入实验性研究的进程。本研究试图通过构建噬菌体抗体融合表达载体来解决基因工程抗体可变区的活性原核表达,为基因工程抗体进入实验性导向研究提供基础。
1 材料与方法
1.1 材料 HBx单克隆抗体轻,重链可变区基因由本组克隆制备[3],单链抗体构建载体pOPE-51及重组HBx抗原为德国癌症中心提供(DKFZ,Heiderberg,Germany),噬菌体抗体构建载体PCANTAB,由中国科学院,上海生物化学研究所提供,限制性内切酶为Gibco公司产品,PCR扩增及DNA测序试剂为PE公司产品,酶标抗His-tag抗体,酶标抗噬菌体抗体为Pharmica公司产品。
, 百拇医药
1.2 PCR扩增单链抗体基因引物委托中国科学院,上海植物生理研究所合成序列如下:X+:5′-ACACAAGGCCCAGCTGGCCGAGTCAGGAGGAGG-3′;X-:5′-TCAATAGCGGCCGCATGATGGTGATGTATGC -3′。
1.3 构建抗HBx单链抗体组氨酸融合表达载体及其表达,鉴定,参见文献[3]。
1.4 PCR扩增及电泳纯化HBx ScFv/His融合基因片段 以HBxpOPE为模板(10 ng),PCR扩增引物各50 pmol,dNTPs 200 μmol/L,1×PCR Buffer(KCl 50 mmol/L,Tris-Cl 10 mmol/L pH 8.3,0.1%明胶),在100 μl的反应体积中加入3 U的Taq DNA聚合酶,于94℃ 45 s,52℃ 15 s,72℃ 45 s(PE 9600),共30循环,取5 μl PCR产物于琼脂糖电泳鉴定。其余产物经制备型凝胶回收特异性片段(Gel purification Kit,QIAGEN,Germany)于-20℃保存备用。
, http://www.100md.com
1.5 抗HBx噬菌体抗体的克隆构建见图1。
1.6 将构建的pCANT-X转化大肠杆菌TG1,于含2%葡萄糖,100 μg/ml氨卞青霉素(Amp)的LB培养液于30℃振荡培养过夜,提取双链质粒DNA,经酶切鉴定筛选阳性克隆,并测序鉴定[4]。
1.7 单链噬菌体抗体的融合表达及纯化 阳性克隆1%转种含2%葡萄糖,100 μg/ml氨卞青霉素(Amp)的LB培养液于30℃振荡培养约3 h(OD600=0.6),加入总滴度为109的辅助噬菌体M13KO7,并于37℃静置感染15 min。离心收集菌体并重悬于3 ml含50 μg/ml卡那霉素(Kan),100 μg/ml Amp的LB中37℃培养液过夜。于10 000 r/min,4℃离心收集过夜培养上清,按每ml上清中加入150 μl SA溶液(16% PEG6000,3.3 mol/L NaCl),4℃2 h静置,于10 000 r/min,4℃沉淀噬菌体,沉淀重悬于100 μl的LB培养液中。
, 百拇医药
1.8 抗HBx单链噬菌体抗体的ELISA鉴定 取10 μl纯化的噬菌体单链抗体,按10倍稀释至10-6,以M13KO7为对照,和已包被的HBxAg的酶标板(由德国癌症中心提供)室温亲和30 min,以鼠抗噬菌体抗体(mAb,Pharmacia,USA)为一抗,HRP-羊抗鼠IgG(华美生物工程公司)为二抗,检测抗HBx单链噬菌体抗体的亲和活性。

图1 噬菌体单链抗体表达载体的构建
Fig.1 Construction of anti-HBx single chain phage antibody

图2 PCR扩增HBx单链抗体基因的琼脂糖电泳
, http://www.100md.com
Fig.2 Electrophoretic analysis of HBx single chain antibody PCR products
Note:1.PCR products of single chain antibody 2.Negative control 3.100bp molecular
2 结果
2.1 PCR扩增HBx单链抗体基因经琼脂糖电泳检maker测约700 bp的阳性扩增产物如图2。
2.2 HBx单链抗体基因克隆于pCANTAB噬菌体表达载体,经BamHI限制性酶切鉴定结果如阳性克隆含有约620 bp的pⅢ基因5′端片段和750 bp的插入片段。
2.3 阳性表达克隆经DNA序列分析结果表明其含有正确整码插入的单链抗体编码基因见图3。
, http://www.100md.com
2.4 pCANTAB-HBx表达载体经IPTG诱导,Ni2+亲和纯化产物经Western-blot鉴定结果表明该产物约为29 kD的含有His-Tag的蛋白和单链抗体理论分子量相符,见图4。
2.5 表达的噬菌体融合抗体和HBx抗原亲和的ELISA结果表明经辅助噬菌体诱导产生的重组噬菌体具有和HBx抗原的特异性亲和,见图5。


图3 抗HBx噬菌体抗体的DNA序列分析结果
Fig.3 Sequence of anti-HBx single chain phage-antibody

, http://www.100md.com
图4 经IPTG引导的pCANTAB-HBx单链抗体Western-blot
Fig.4 The SDS-PACE and Western-blot results of pCANTAB-HBx Scfv expression
Note:A.SDS-PAGE B.Western-blot 1,3.Positive expression of anti-HBx single chain antibody 2.Host strain TG1 4.Low molecular weight protein marker

图5 ELISA分析单链抗HBx噬菌体抗体的亲和活性
Fig.5 ELISA result of anti-HBx single chain phage-antibody
, 百拇医药
3 讨论
1988年Smith GP建立噬菌体展示筛选技术以来[5],该技术已被广泛应用于特异性抗体可变区的筛选,在噬菌体载体中构建单链或单区抗体,这种有活性表达的噬菌体抗体也已成为筛选特异性人源抗体的重要手段[6]。特异性抗体可变区在原核系统中的活性表达,在很大程度上推动了抗体工程的发展[7],但是以强表达操纵子调控的高效原核表达导致了抗体蛋白大量以包涵体形式存在面临复性的难题。本研究尝试采用构建噬菌体单链抗体的方式探索以噬菌体为载体在原核系统中活性表达,制备单链基因工程抗体的可能。
我们的结果表明,设计的PCR引物可直接扩增HBx单链抗体的编码基因,在我们得到的5个不同克隆DNA序列分析结果中仅一例发生单基因突变,其余4例均为正常序列,这表明通过优化的PCR条件,可直接利用PCR获得可靠的目的基因用于表达。构建的噬菌体单链抗体是以抗体重链可变区-十肽小侧链柔 性肽段-抗体轻链可变区以及3′端的六聚组氨酸尾组成插入噬菌体次要衣壳蛋白(基因Ⅲ产物,PⅢ)中融合表达。含有表达载体pCANTAB-HBx的大肠杆菌在辅助噬菌体M13KO7的感染下大量产生含有重组HBx单链抗体的噬菌体衣壳蛋白,并包装可溶性分泌于培养液上清,其含量可高达3×1013pfu/ml。同时利用简单的PEG/NaCl沉淀的方法即可制备量和纯度足以满足用于动物模型实验的活性单链抗体表达产物。此外,pCANTAB-HBx表达载体在适量的IPTG诱导下,激活的LacZ操纵子启动大量表达HBx单链抗体-PⅢ融合蛋白,并经噬菌体PⅢ信号肽引导可溶性分泌于培养液中,可利用融合于单链抗体3′端的六聚组氨酸抗体检测,以及Ni2+离子树脂吸附纯化[3]。由于目前的抗噬菌体单克隆抗体或抗血清针对的亲和靶位多为噬菌体主要衣壳蛋白(PⅧ),因而我们在检测噬菌体抗体和检测单链融合抗体时分别应用了抗噬菌体和抗His-Tag抗体作为第一抗体。抗HBx噬菌体抗体的构建,表达为抗体可变区基因活性表达提供了一种高效,简单的方法。同时噬菌体抗体所特有的基因型和表型的一一对应特征,为抗体可变区全基因文库的筛选提供了有力的手段[8]。
, http://www.100md.com
作者简介:周 铬,30岁,助理研究员,主要从事肿瘤导向研究;
秦慧莲,女,46岁,教授,主要从事肿瘤免疫研究
4 参考文献
1 Li J,Tang Z Y,Liu K D et al. Radioimmunoimaging of human hepatocellular carcinoma xenografts with 131-I-HBx monoclonal antibody.J Exp Clin Cancer Res,1995;14(1):25
2 Zhou G,Liu K D,Tang Z Y et al. Reconstruction and expression of chimeric anti-HBx antibody in E.coli.J Cancer Res Clin Oncol,1997;123(6):325
, http://www.100md.com
3 Zhou G,Liu K D,Sun H C et al. Expression and purification of single-chain anti-HBx antibody in Escherichia coli.J Cancer Res Clin Oncol,1997;123(12):609
4 Sambrook J,Fritsch E F,Maniatis T.Molecular cloning:A laboratory manual.2nd ed.New York:Cold Spring Harbor Laboratory Press,1989:p14.5-14.52
5 Parmley S F,Smith G P.Antibody-Selectable filamentous fd phage vector:affinity purification of target genes.Gene,1988;73(1):305
6 Winter G ,Griffiths A D.Making antibodies by phage display technology.Ann Rev Immunol,1994;12(2):433
7 叶 敏.基因工程抗体研究进展.中华微生物学和免疫学杂志,1996;16(4):231
8 张 英,李爱民.噬菌体表面表达技术及其在抗病毒研究中的应用现状和前景.病毒学报,1997;13(2):185
〔收稿1998-09-15 修回1998-11-05〕, http://www.100md.com