海南哥纳香醇甲GHM-10对L1210细胞DNA分子结构及拓扑异构酶II活性的影响
作者:何剑华 徐承熊*
单位:(中国医学科学院、中国协和医科大学药物研究所,北京 100050)
关键词:抗肿瘤药; 海南哥纳香醇甲(GHM-10); DNA损伤; DNA拓扑异构酶II
药学学报990102.htm 摘要 目的: 研究海南哥纳香醇甲(GHM-10)抑癌细胞DNA合成的作用机制。 方法: 用单细胞凝胶电泳法检测GHM-10对L1210细胞DNA分子的损伤,碱洗脱法测定GHM-10对L1210细胞DNA单链长度的影响,用GHM-10对超螺旋pUC18 DNA的解旋能力测定它对DNA拓扑异构酶II活性的影响。 结果: L1210细胞用GHM-10 (4~10) μg.ml-1处理4.5 h后,DNA分子受损,表现为电泳后在荧光显微镜下可见彗星状拖尾。GHM-10 (4~25) μg.ml-1处理L1210细胞5 h, 可引起DNA单链断裂。 L1210细胞或从L1210细胞分离的蛋白质在用GHM-10处理后,DNA拓扑异构酶II的活性均被抑制。结论: GHM-10可引起L1210细胞DNA分子损伤; 无论在细胞内还是细胞外,GHM-10可抑制拓扑异构酶II的活性。
, http://www.100md.com
EFFECT OF HOWIINOL(GHM-10) ON THE STRUCTURE
OFDNA MOLECULES AND ACTIVITY OFDNA TOPOISOMERASE II
IN L1210 CELLS
He Jianhua(He JH) and Xu Chengxiong(Xu CX)
(Institute of Materia Medica, Chinese Academy of Medical Sciences and
Peking Union Medical College, Beijing 100050)
ABSTRACT AIM: To study the mechanism of inhibitory action of howiinol A(GHM-10) on synthesis of DNA in cancer cells. METHODS: Single cell gel electrophoresis was used to detect the DNA molecular damage induced by GHM-10 in L1210 cells. Alkaline elution technique was used to investigate the effect of GHM-10 on the length of DNA strands of L1210 cells. Dehelix effect of GHM-10 on superhelix pUC 18 DNA was used to estimate its influence on the activity of DNA topoisomerase II. RESULTS: After L1210 cells were treated with 4 and 10 μg.ml-1 of GHM-10 for 4.5 h, comet like tails could be seen in cells under a fluorescence microscope after electrophoresis, indicating that DNA damage was induced by GHM-10. DNA single strand breaks were demonstrated when L1210 cells were treated with GHM-10 in concentrations of 4 and 25 μg.ml-1 for 5 h. When L1210 cells or protein isolated from L1210 cells were treated with GHM-10, the activity of DNA topoisomerase II was inhibited. CONCLUSION: GHM-10 induces damage to DNA molecules in L1210 cells and inhibits the activity of topoisomerase II both inside and outside the cells.
, 百拇医药
KEY WORDS anticancer drugs; howiinol A(GHM-10); DNA damage; DNA topoisomerase II
海南哥纳香醇甲(GHM-10)是从海南哥纳香(Goniothalamus howii) 中分离得到的一种新化合物。前期研究表明: GHM-10在体内外对癌细胞均有较强的细胞毒作用,这种作用有非时相特异性的特点[1]; L1210细胞在体外用GHM-10处理后,DNA,RNA和蛋白质的生物合成均出现明显抑制,其中以DNA合成的抑制最显著[2]; 虽然L1210细胞在用GHM-10处理1 h后DNA合成的抑制已不可逆,但GHM-10不能与小牛胸腺DNA形成复合物,也不能直接破坏DNA的结构[3]。为了进一步探讨GHM-10使DNA产生不可逆损伤的机制,本文用单细胞电泳法、DNA碱洗脱法和酶测定法等研究了GHM-10对DNA分子结构和拓扑异构酶II活性的影响。
, http://www.100md.com
材料和方法
细胞 小鼠白血病L1210细胞培养于含10%新生牛血清的RPMI 1640培养基(GIBCO出品)中,在含5% CO2的37℃温箱中培养,每3 d传代1次。
药品 GHM-10由本所植化室于德泉教授提
供,分子质量380,不溶于水,以DMSO配制,4℃保存,实验前用培养基稀释至所需浓度。
单细胞凝胶电泳法检测GHM-10对L1210细胞的DNA损伤[4] 取对数生长期L1210细胞配成浓度为1×106个.ml-1的细胞悬液,分装3瓶,于接种同时加入GHM-10 4及10 μg.ml-1,对照组给予等剂量溶剂,于37℃,5% CO2中培养4.5 h,冰浴终止反应,收集细胞,用冷PBS洗涤两遍,细胞沉淀用0.5 ml冰冷的PBS悬起。
, 百拇医药
吸取1%琼脂200 μl均匀涂布于载玻片上,于冰上成胶,再将细胞悬液于37℃条件下与1%低熔点琼脂糖(Sigma产品)按1∶3混匀,迅速涂布于已成胶的底层琼脂上,再于冰上成胶,将固定好的细胞凝胶玻片浸于细胞溶解液(NaOH 0.03 mol.L-1, NaCl 1 mol.L-1)中40 min,取出用蒸馏水慢慢冲洗,淋干,再浸入解旋液(NaOH 0.3 mol.L-1, EDTA 1 μmol.L-1)中8 min,取出用双蒸水冲洗,将玻片水平放入电泳槽(DF-C型恒压恒流电泳仪,北京东方仪器厂产品)中,于45 V电压下电泳13 min,用EB(ethidium bromide)染色10 min。操作尽量避光,在反射式荧光显微镜下观察照相。
碱洗脱法测定GHM-10对DNA单链长度的影响[5] 取对数生长期L1210细胞,配成浓度为3×105个.ml-1的细胞悬液,每皿2 ml,于接种细胞同时加入[3H]TdR,每皿1.85×105 Bq,于37℃,5% CO2温箱中培养24 h后,加不同剂量GHM-10(4和25 μg.ml-1),对照组加入等体积溶剂,作用5 h后,将细胞转移到滤膜(Φ 0.2 μm)上,用冷磷酸缓冲液(PBS)洗3次,加10 ml细胞溶解液,其组成为十二烷基磺酸钠(SDS,华美生物工程公司产品) 0.2%,EDTA 0.02 mol.L-1,作用3 min,待细胞溶解液自然流出后,加入冷磷酸缓冲液(PBS) 20 ml进一步洗涤细胞,再加碱洗脱液(EDTA 0.02 mol.L-1,用NaOH调至pH 12)作用5 min,使DNA在碱性条件下变性,控制流速,分步收集洗脱液,每50 min一次,每份约1.5 ml,洗脱过程避光,洗脱完毕,取下滤膜,分别在装有洗脱液和滤膜的闪烁瓶中加入闪烁液(甲苯240 ml,无水乙醇110 ml, triton-X-100 130 ml, PPO 1 g, POPOP 0.025 g),测定cpm,计算膜上DNA残留率(R%),以膜上残留率对时间作图,即得洗脱曲线。
, http://www.100md.com
膜上DNA残留率(R%)=M/M+E×100%
M: 膜上DNA每分钟脉冲数(cpm); E: 分部收集的洗脱液中每分钟脉冲数(cpm)之和
GHM-10对DNA拓扑异构酶II活性的影响 收集药物作用12 h的L1210细胞及对照组细胞,用冷PBS洗涤2次,按文献方法[8]提取并测定酶的活性,观察GHM-10在L1210细胞内对酶活性的影响,并利用对照组的酶,观察GHM-10在细胞外对酶活性的影响。
结果
1 单细胞凝胶电泳检测GHM-10对L1210细胞DNA的损伤
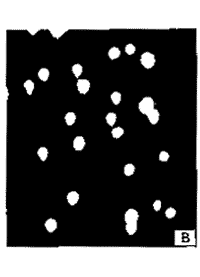
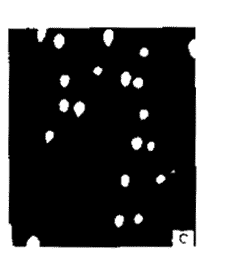
通过单细胞凝胶电泳法检测了GHM-10对L1210细胞DNA的损伤。细胞被低融点琼脂糖固定在微型电泳槽上,在碱性条件下细胞溶解,DNA链解旋,经过短暂的电泳后,用EB染色。无DNA损伤的细胞,在荧光显微镜下可见一明亮的荧光圆点,而有DNA损伤的细胞,经电泳后,细胞朝向阳极有一类似彗星的拖尾,拖尾的亮度决定于药物对细胞DNA损伤的程度。如图1所示,细胞经GHM-10 4和10 μg.ml-1作用4.5 h后,可见明显的彗星状拖尾,随着剂量的加大,彗星拖尾的亮度也增加。而对照组细胞则为一明亮的圆点,说明GHM-10能够损伤L1210细胞的DNA。
, http://www.100md.com
Fig 1 Comet like tails was formed in L1210 cells treated with different concentrations of GHM-10. Photographs of cells under fluorescence microscope after single cell gel electrophoresis. A. Untreated cells; B. GHM-10 (4 μg.ml-1) treated cells; C. GHM-10 (10 μg.ml-1) treated cells.
2 GHM-10对L1210细胞DNA拓扑异构酶II活性的影响
DNA拓扑异构酶是一种重要的核酶,能修饰DNA的拓扑结构,引起DNA单链和双链的断裂或再连接。我们采用对超螺旋pUC18 DNA的解旋能力来测定DNA拓扑异构酶II的活性。结果表明,与对照组相比,经GHM-10 4 μg.ml-1作用12 h的L1210细胞的DNA拓扑异构酶II活性降低(图2)。以对照组L1210细胞的DNA拓扑异构酶II活性为参照,我们测定了GHM-10在细胞外对酶活性的直接影响,结果如图3所示,浓度为(100~500) μg.ml-1的GHM-10可直接抑制DNA拓扑异构酶II的活性。
, 百拇医药
Fig 2 DNA topoisomerase II activity in nuclear extracts from untreated or GHM-10 treated L1210 cells. The enzyme activity was determined by uncoiling pUC18 DNA, which was located in the bottom zones of the photograph. Lane E. pUC18 DNA only; Lane F to I. pUC18 DNA plus protein(0.96, 0.48, 0.24 and 0.12 μg respectively) extracted from untreated L1210 cells. Lane A to D. pUC18 DNA plus protein(0.96, 0.48, 0.24 and 0.12 μg respectively) extracted from L1210 cells treated with GHM-10 4 μg for 12 h.
, 百拇医药
Fig 3 Effect of GHM-10 on the activity of DNA topoisomerase II in a cell free system. Reaction mixtures(20 μl) containing pUC18 DNA 0.42 μg, DNA topoisomerase II 0.12 μg and GHM-10 (100~500) μg.ml-1. Lane A, pUC18 DNA only; Lane B, pUC18 DNA plus GHM-10 500 μg.ml-1; Lane C, pUC18 DNA plus DNA topoisomerase II; Lane D to F, pUC18 DNA plus DNA topoisomerase II and GHM-10 100,200 and 500 μg.ml-1 respectively.
, 百拇医药
3 用碱洗脱法检测GHM-10对DNA单链断裂的影响
碱洗脱法的原理是:双链DNA在pH≥12.0时可被完全解螺旋,在滤膜不吸附DNA的条件下,DNA单链通过滤膜的速度取决于它的长度。因此,检测膜上的DNA存留比即可知道药物是否能导致DNA单链断裂。如图4所示,经GHM-10 4和25 μg.ml-1处理5 h后的L1210细胞,其滤膜上的存留比较对照组明显减少,说明GHM-10能导致L1210细胞DNA单链断裂,而且随着药物浓度的增加,滤膜上的存留比进一步减少,呈明显的量效关系。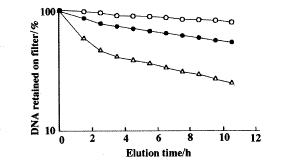
Fig 4 DNA single strand break induced by GHM-10. Alkaline elution technique was used for estimation. DNA single strand break was measured by the percentage of DNA retained on the filter. ○—○ Control; ●—● GHM-10 4 μg.ml-1; △—△ GHM-10 25 μg.ml-1.讨论
, 百拇医药
单细胞凝胶电泳是判断药物能否造成DNA损伤以及测量损伤程度的一种简便、快速和灵敏的方法[7]。本研究的结果表明,GHM-10能够损伤L1210细胞的DNA,使其裂解。用碱洗脱法进一步证明,GHM-10可使L1210细胞的DNA单链断裂。我们曾观察到GHM-10能不可逆地抑制L1210细胞的DNA合成[3],这可能与其能够导致DNA单链断裂有关。
本文还研究了GHM-10对DNA拓扑异构酶II活性的影响。DNA拓扑异构酶II是一种重要的核酶[8],它能修饰DNA的拓扑结构,引起DNA单链及双链的断裂或再连接;它在细胞增殖、DNA复制以及基因表达等方面起着十分重要的作用。近年来大量研究表明[9],DNA拓扑异构酶II是化疗药物作用的重要靶点之一。许多引起DNA单链及双链断裂的药物,包括DNA嵌入剂或非嵌入剂,都是借助于DNA拓扑异构酶II而发挥作用的。抗癌药物作用于拓扑异构酶II一般有两种形式: 促进此酶介导的DNA解旋或断裂反应,如阿霉素、柔红霉素和鬼臼乙叉苷(VP-16)等[10]; 抑制此酶介导的DNA解旋或断裂反应。无论是促进还是抑制此断裂反应,都干扰了DNA的正常功能,从而导致细胞死亡。我们的研究表明,GHM-10无论在细胞内还是细胞外都抑制了L1210细胞的DNA拓扑异构酶II所介导的使DNA解旋的反应,说明GHM-10属于后一类DNA拓扑异构酶II抑制剂。这与文献报道[11~14]的merbarone, aclarubicin, fostriecin和ICRF-154等化合物的作用特点类似。这些化合物也都具有较强的抗肿瘤活性,但它们不能象第1类影响DNA拓扑异构酶II活性的药物(VP-16等)那样,促使酶-DNA可切割复合物的形成,进而导致DNA链断裂。它们可能是通过其它机制而导致细胞死亡的。此外,GHM-10虽可引起DNA单链断裂,但这种断裂不象是通过DNA拓扑异构酶II介导的,其作用机制有待进一步研究。
, http://www.100md.com
*联系人 Tel:(010)63153551转103, Fax:(010)63153557, E-mail:xcx@mdsharris.com
参考文献
1 何剑华,叶玉梅,徐承熊. 从海南哥纳香中分离的一种新化合物海南哥纳香醇甲的抗肿瘤作用. 药学学报, 1998,33∶493
2 何剑华,叶玉梅,徐承熊. 海南哥纳香醇甲(GHM-10)对体外L1210细胞的抗肿瘤活性. 药学学报, 1998,33∶566
3 何剑华,徐承熊. 海南哥纳香醇甲GHM-10对L1210细胞生物大分子合成抑制的研究. 药学学报, 1998,33∶886
4 Singh NP, McCoy MT, Tice PR, et al. A simple technique for quantitation of low levels of DNA damage in individual cells. Exp Cell Res, 1988,175∶184
, 百拇医药
5 Wang LG, Zeng H. DNA-protein, DNA interstrand cross-links induced by camphoramine chloroacetic platinum in vitro. Acta Pharmacol Sin, 1989,10∶261
6 Wang LG, Liu XM, Ji XJ. Determination of DNA topoisomerase II activity from L1210 cells-a target for screening antitumor agents. Acta Pharmacol Sin, 1991,12∶108
7 Gedik CM, Ewen SWB, Collins AR. Single-cell gel electrophoresis applied to the analysis of UV-C damage and its repair in human cells. Int J Radiat Biol, 1992,62∶313
, 百拇医药
8 刘晓梅,王龙贵. DNA拓扑异构酶与抗癌药研究. 国外医学药学分册, 1989,16∶129
9 王龙贵,刘晓梅,籍秀娟. 以DNA拓扑异构酶II为靶点的一种抗癌药筛选的新方法. 癌症, 1991,10∶220
10 Jaxel C, Taudou G, Portemer C, et al. Topoisomerase inhibitors induce irreversible fragmentation of replicated DNA in concanvalin A stimulated splenocytes. Biochemistry, 1988,27∶95
11 Drake FH, Hofmann GA, Mong SM, et al. In vitro and intracellular inhibition of topoisomerase II by the antitumor agent merbarone. Cancer Res, 1989,49∶2578
, 百拇医药
12 Jensen PB, Sorensen BS, Demant EJF, et al. Antagonistic effect of aclarubicin on the cytotoxicity of etoposide and 4′-(9-acridinylamino)methanesulfon-m-anisidide in human small cell lung cancer cell lines and on topoisomerase II-mediated DNA cleavage. Cancer Res, 1990,50∶3311
13 Boritzki TL, Wolfard TS, Besserer JA. et al. Inhibition of type II topoisomerase by fostriecin. Biochem Pharmacol, 1988,37∶4063
14 Tanabe K, Ikegami Y, Ishida R, et al. Inhibition of topoisomerase II by antitumor agents bis(2,6-dioxopiperazine) derivatives. Cancer Res, 1991,51∶4903
收稿日期: 1998-02-26, 百拇医药(何剑华 徐承熊*)
单位:(中国医学科学院、中国协和医科大学药物研究所,北京 100050)
关键词:抗肿瘤药; 海南哥纳香醇甲(GHM-10); DNA损伤; DNA拓扑异构酶II
药学学报990102.htm 摘要 目的: 研究海南哥纳香醇甲(GHM-10)抑癌细胞DNA合成的作用机制。 方法: 用单细胞凝胶电泳法检测GHM-10对L1210细胞DNA分子的损伤,碱洗脱法测定GHM-10对L1210细胞DNA单链长度的影响,用GHM-10对超螺旋pUC18 DNA的解旋能力测定它对DNA拓扑异构酶II活性的影响。 结果: L1210细胞用GHM-10 (4~10) μg.ml-1处理4.5 h后,DNA分子受损,表现为电泳后在荧光显微镜下可见彗星状拖尾。GHM-10 (4~25) μg.ml-1处理L1210细胞5 h, 可引起DNA单链断裂。 L1210细胞或从L1210细胞分离的蛋白质在用GHM-10处理后,DNA拓扑异构酶II的活性均被抑制。结论: GHM-10可引起L1210细胞DNA分子损伤; 无论在细胞内还是细胞外,GHM-10可抑制拓扑异构酶II的活性。
, http://www.100md.com
EFFECT OF HOWIINOL(GHM-10) ON THE STRUCTURE
OFDNA MOLECULES AND ACTIVITY OFDNA TOPOISOMERASE II
IN L1210 CELLS
He Jianhua(He JH) and Xu Chengxiong(Xu CX)
(Institute of Materia Medica, Chinese Academy of Medical Sciences and
Peking Union Medical College, Beijing 100050)
ABSTRACT AIM: To study the mechanism of inhibitory action of howiinol A(GHM-10) on synthesis of DNA in cancer cells. METHODS: Single cell gel electrophoresis was used to detect the DNA molecular damage induced by GHM-10 in L1210 cells. Alkaline elution technique was used to investigate the effect of GHM-10 on the length of DNA strands of L1210 cells. Dehelix effect of GHM-10 on superhelix pUC 18 DNA was used to estimate its influence on the activity of DNA topoisomerase II. RESULTS: After L1210 cells were treated with 4 and 10 μg.ml-1 of GHM-10 for 4.5 h, comet like tails could be seen in cells under a fluorescence microscope after electrophoresis, indicating that DNA damage was induced by GHM-10. DNA single strand breaks were demonstrated when L1210 cells were treated with GHM-10 in concentrations of 4 and 25 μg.ml-1 for 5 h. When L1210 cells or protein isolated from L1210 cells were treated with GHM-10, the activity of DNA topoisomerase II was inhibited. CONCLUSION: GHM-10 induces damage to DNA molecules in L1210 cells and inhibits the activity of topoisomerase II both inside and outside the cells.
, 百拇医药
KEY WORDS anticancer drugs; howiinol A(GHM-10); DNA damage; DNA topoisomerase II
海南哥纳香醇甲(GHM-10)是从海南哥纳香(Goniothalamus howii) 中分离得到的一种新化合物。前期研究表明: GHM-10在体内外对癌细胞均有较强的细胞毒作用,这种作用有非时相特异性的特点[1]; L1210细胞在体外用GHM-10处理后,DNA,RNA和蛋白质的生物合成均出现明显抑制,其中以DNA合成的抑制最显著[2]; 虽然L1210细胞在用GHM-10处理1 h后DNA合成的抑制已不可逆,但GHM-10不能与小牛胸腺DNA形成复合物,也不能直接破坏DNA的结构[3]。为了进一步探讨GHM-10使DNA产生不可逆损伤的机制,本文用单细胞电泳法、DNA碱洗脱法和酶测定法等研究了GHM-10对DNA分子结构和拓扑异构酶II活性的影响。
, http://www.100md.com
材料和方法
细胞 小鼠白血病L1210细胞培养于含10%新生牛血清的RPMI 1640培养基(GIBCO出品)中,在含5% CO2的37℃温箱中培养,每3 d传代1次。
药品 GHM-10由本所植化室于德泉教授提
供,分子质量380,不溶于水,以DMSO配制,4℃保存,实验前用培养基稀释至所需浓度。
单细胞凝胶电泳法检测GHM-10对L1210细胞的DNA损伤[4] 取对数生长期L1210细胞配成浓度为1×106个.ml-1的细胞悬液,分装3瓶,于接种同时加入GHM-10 4及10 μg.ml-1,对照组给予等剂量溶剂,于37℃,5% CO2中培养4.5 h,冰浴终止反应,收集细胞,用冷PBS洗涤两遍,细胞沉淀用0.5 ml冰冷的PBS悬起。
, 百拇医药
吸取1%琼脂200 μl均匀涂布于载玻片上,于冰上成胶,再将细胞悬液于37℃条件下与1%低熔点琼脂糖(Sigma产品)按1∶3混匀,迅速涂布于已成胶的底层琼脂上,再于冰上成胶,将固定好的细胞凝胶玻片浸于细胞溶解液(NaOH 0.03 mol.L-1, NaCl 1 mol.L-1)中40 min,取出用蒸馏水慢慢冲洗,淋干,再浸入解旋液(NaOH 0.3 mol.L-1, EDTA 1 μmol.L-1)中8 min,取出用双蒸水冲洗,将玻片水平放入电泳槽(DF-C型恒压恒流电泳仪,北京东方仪器厂产品)中,于45 V电压下电泳13 min,用EB(ethidium bromide)染色10 min。操作尽量避光,在反射式荧光显微镜下观察照相。
碱洗脱法测定GHM-10对DNA单链长度的影响[5] 取对数生长期L1210细胞,配成浓度为3×105个.ml-1的细胞悬液,每皿2 ml,于接种细胞同时加入[3H]TdR,每皿1.85×105 Bq,于37℃,5% CO2温箱中培养24 h后,加不同剂量GHM-10(4和25 μg.ml-1),对照组加入等体积溶剂,作用5 h后,将细胞转移到滤膜(Φ 0.2 μm)上,用冷磷酸缓冲液(PBS)洗3次,加10 ml细胞溶解液,其组成为十二烷基磺酸钠(SDS,华美生物工程公司产品) 0.2%,EDTA 0.02 mol.L-1,作用3 min,待细胞溶解液自然流出后,加入冷磷酸缓冲液(PBS) 20 ml进一步洗涤细胞,再加碱洗脱液(EDTA 0.02 mol.L-1,用NaOH调至pH 12)作用5 min,使DNA在碱性条件下变性,控制流速,分步收集洗脱液,每50 min一次,每份约1.5 ml,洗脱过程避光,洗脱完毕,取下滤膜,分别在装有洗脱液和滤膜的闪烁瓶中加入闪烁液(甲苯240 ml,无水乙醇110 ml, triton-X-100 130 ml, PPO 1 g, POPOP 0.025 g),测定cpm,计算膜上DNA残留率(R%),以膜上残留率对时间作图,即得洗脱曲线。
, http://www.100md.com
膜上DNA残留率(R%)=M/M+E×100%
M: 膜上DNA每分钟脉冲数(cpm); E: 分部收集的洗脱液中每分钟脉冲数(cpm)之和
GHM-10对DNA拓扑异构酶II活性的影响 收集药物作用12 h的L1210细胞及对照组细胞,用冷PBS洗涤2次,按文献方法[8]提取并测定酶的活性,观察GHM-10在L1210细胞内对酶活性的影响,并利用对照组的酶,观察GHM-10在细胞外对酶活性的影响。
结果
1 单细胞凝胶电泳检测GHM-10对L1210细胞DNA的损伤
通过单细胞凝胶电泳法检测了GHM-10对L1210细胞DNA的损伤。细胞被低融点琼脂糖固定在微型电泳槽上,在碱性条件下细胞溶解,DNA链解旋,经过短暂的电泳后,用EB染色。无DNA损伤的细胞,在荧光显微镜下可见一明亮的荧光圆点,而有DNA损伤的细胞,经电泳后,细胞朝向阳极有一类似彗星的拖尾,拖尾的亮度决定于药物对细胞DNA损伤的程度。如图1所示,细胞经GHM-10 4和10 μg.ml-1作用4.5 h后,可见明显的彗星状拖尾,随着剂量的加大,彗星拖尾的亮度也增加。而对照组细胞则为一明亮的圆点,说明GHM-10能够损伤L1210细胞的DNA。



, http://www.100md.com
Fig 1 Comet like tails was formed in L1210 cells treated with different concentrations of GHM-10. Photographs of cells under fluorescence microscope after single cell gel electrophoresis. A. Untreated cells; B. GHM-10 (4 μg.ml-1) treated cells; C. GHM-10 (10 μg.ml-1) treated cells.
2 GHM-10对L1210细胞DNA拓扑异构酶II活性的影响
DNA拓扑异构酶是一种重要的核酶,能修饰DNA的拓扑结构,引起DNA单链和双链的断裂或再连接。我们采用对超螺旋pUC18 DNA的解旋能力来测定DNA拓扑异构酶II的活性。结果表明,与对照组相比,经GHM-10 4 μg.ml-1作用12 h的L1210细胞的DNA拓扑异构酶II活性降低(图2)。以对照组L1210细胞的DNA拓扑异构酶II活性为参照,我们测定了GHM-10在细胞外对酶活性的直接影响,结果如图3所示,浓度为(100~500) μg.ml-1的GHM-10可直接抑制DNA拓扑异构酶II的活性。

, 百拇医药
Fig 2 DNA topoisomerase II activity in nuclear extracts from untreated or GHM-10 treated L1210 cells. The enzyme activity was determined by uncoiling pUC18 DNA, which was located in the bottom zones of the photograph. Lane E. pUC18 DNA only; Lane F to I. pUC18 DNA plus protein(0.96, 0.48, 0.24 and 0.12 μg respectively) extracted from untreated L1210 cells. Lane A to D. pUC18 DNA plus protein(0.96, 0.48, 0.24 and 0.12 μg respectively) extracted from L1210 cells treated with GHM-10 4 μg for 12 h.
, 百拇医药
Fig 3 Effect of GHM-10 on the activity of DNA topoisomerase II in a cell free system. Reaction mixtures(20 μl) containing pUC18 DNA 0.42 μg, DNA topoisomerase II 0.12 μg and GHM-10 (100~500) μg.ml-1. Lane A, pUC18 DNA only; Lane B, pUC18 DNA plus GHM-10 500 μg.ml-1; Lane C, pUC18 DNA plus DNA topoisomerase II; Lane D to F, pUC18 DNA plus DNA topoisomerase II and GHM-10 100,200 and 500 μg.ml-1 respectively.
, 百拇医药
3 用碱洗脱法检测GHM-10对DNA单链断裂的影响
碱洗脱法的原理是:双链DNA在pH≥12.0时可被完全解螺旋,在滤膜不吸附DNA的条件下,DNA单链通过滤膜的速度取决于它的长度。因此,检测膜上的DNA存留比即可知道药物是否能导致DNA单链断裂。如图4所示,经GHM-10 4和25 μg.ml-1处理5 h后的L1210细胞,其滤膜上的存留比较对照组明显减少,说明GHM-10能导致L1210细胞DNA单链断裂,而且随着药物浓度的增加,滤膜上的存留比进一步减少,呈明显的量效关系。

Fig 4 DNA single strand break induced by GHM-10. Alkaline elution technique was used for estimation. DNA single strand break was measured by the percentage of DNA retained on the filter. ○—○ Control; ●—● GHM-10 4 μg.ml-1; △—△ GHM-10 25 μg.ml-1.讨论
, 百拇医药
单细胞凝胶电泳是判断药物能否造成DNA损伤以及测量损伤程度的一种简便、快速和灵敏的方法[7]。本研究的结果表明,GHM-10能够损伤L1210细胞的DNA,使其裂解。用碱洗脱法进一步证明,GHM-10可使L1210细胞的DNA单链断裂。我们曾观察到GHM-10能不可逆地抑制L1210细胞的DNA合成[3],这可能与其能够导致DNA单链断裂有关。
本文还研究了GHM-10对DNA拓扑异构酶II活性的影响。DNA拓扑异构酶II是一种重要的核酶[8],它能修饰DNA的拓扑结构,引起DNA单链及双链的断裂或再连接;它在细胞增殖、DNA复制以及基因表达等方面起着十分重要的作用。近年来大量研究表明[9],DNA拓扑异构酶II是化疗药物作用的重要靶点之一。许多引起DNA单链及双链断裂的药物,包括DNA嵌入剂或非嵌入剂,都是借助于DNA拓扑异构酶II而发挥作用的。抗癌药物作用于拓扑异构酶II一般有两种形式: 促进此酶介导的DNA解旋或断裂反应,如阿霉素、柔红霉素和鬼臼乙叉苷(VP-16)等[10]; 抑制此酶介导的DNA解旋或断裂反应。无论是促进还是抑制此断裂反应,都干扰了DNA的正常功能,从而导致细胞死亡。我们的研究表明,GHM-10无论在细胞内还是细胞外都抑制了L1210细胞的DNA拓扑异构酶II所介导的使DNA解旋的反应,说明GHM-10属于后一类DNA拓扑异构酶II抑制剂。这与文献报道[11~14]的merbarone, aclarubicin, fostriecin和ICRF-154等化合物的作用特点类似。这些化合物也都具有较强的抗肿瘤活性,但它们不能象第1类影响DNA拓扑异构酶II活性的药物(VP-16等)那样,促使酶-DNA可切割复合物的形成,进而导致DNA链断裂。它们可能是通过其它机制而导致细胞死亡的。此外,GHM-10虽可引起DNA单链断裂,但这种断裂不象是通过DNA拓扑异构酶II介导的,其作用机制有待进一步研究。
, http://www.100md.com
*联系人 Tel:(010)63153551转103, Fax:(010)63153557, E-mail:xcx@mdsharris.com
参考文献
1 何剑华,叶玉梅,徐承熊. 从海南哥纳香中分离的一种新化合物海南哥纳香醇甲的抗肿瘤作用. 药学学报, 1998,33∶493
2 何剑华,叶玉梅,徐承熊. 海南哥纳香醇甲(GHM-10)对体外L1210细胞的抗肿瘤活性. 药学学报, 1998,33∶566
3 何剑华,徐承熊. 海南哥纳香醇甲GHM-10对L1210细胞生物大分子合成抑制的研究. 药学学报, 1998,33∶886
4 Singh NP, McCoy MT, Tice PR, et al. A simple technique for quantitation of low levels of DNA damage in individual cells. Exp Cell Res, 1988,175∶184
, 百拇医药
5 Wang LG, Zeng H. DNA-protein, DNA interstrand cross-links induced by camphoramine chloroacetic platinum in vitro. Acta Pharmacol Sin, 1989,10∶261
6 Wang LG, Liu XM, Ji XJ. Determination of DNA topoisomerase II activity from L1210 cells-a target for screening antitumor agents. Acta Pharmacol Sin, 1991,12∶108
7 Gedik CM, Ewen SWB, Collins AR. Single-cell gel electrophoresis applied to the analysis of UV-C damage and its repair in human cells. Int J Radiat Biol, 1992,62∶313
, 百拇医药
8 刘晓梅,王龙贵. DNA拓扑异构酶与抗癌药研究. 国外医学药学分册, 1989,16∶129
9 王龙贵,刘晓梅,籍秀娟. 以DNA拓扑异构酶II为靶点的一种抗癌药筛选的新方法. 癌症, 1991,10∶220
10 Jaxel C, Taudou G, Portemer C, et al. Topoisomerase inhibitors induce irreversible fragmentation of replicated DNA in concanvalin A stimulated splenocytes. Biochemistry, 1988,27∶95
11 Drake FH, Hofmann GA, Mong SM, et al. In vitro and intracellular inhibition of topoisomerase II by the antitumor agent merbarone. Cancer Res, 1989,49∶2578
, 百拇医药
12 Jensen PB, Sorensen BS, Demant EJF, et al. Antagonistic effect of aclarubicin on the cytotoxicity of etoposide and 4′-(9-acridinylamino)methanesulfon-m-anisidide in human small cell lung cancer cell lines and on topoisomerase II-mediated DNA cleavage. Cancer Res, 1990,50∶3311
13 Boritzki TL, Wolfard TS, Besserer JA. et al. Inhibition of type II topoisomerase by fostriecin. Biochem Pharmacol, 1988,37∶4063
14 Tanabe K, Ikegami Y, Ishida R, et al. Inhibition of topoisomerase II by antitumor agents bis(2,6-dioxopiperazine) derivatives. Cancer Res, 1991,51∶4903
收稿日期: 1998-02-26, 百拇医药(何剑华 徐承熊*)