研究嵌合状态与移植耐受关系的小鼠联体模型的建立①
作者:吕艳 谢蜀生
单位:吕 艳(北京医科大学免疫学系 北京 100083);谢蜀生(北京医科大学免疫学系 北京 100083)
关键词:联体;嵌合体 成年耐受
中国免疫学杂志000213 摘 要:目的:探讨供体源的异基因血细胞嵌合体与受体耐受状态的关系, 在不同品系的成年小鼠之间成功地建立了联体模型。方法:Balb/c (H-2d) 小鼠经尾静脉注入 C57BL/6 (H-2b , B6)脾细胞, 同时C57BL/6(B6)小鼠经尾静脉注入Balb/c 小鼠脾细胞,2 d后,分别给Balb/c及B6小鼠腹腔注射环磷酰胺(CY),可以明显延长Balb/c与B6联体小鼠的存活期 (MST=30.4 d)。对经以上处理的联体小鼠在联体1 w后分开,并分别检测其耐受状态。 结果:联体小鼠在联体1 w后分开,同时进行相互间的植皮,发现Balb/c 小鼠对B6 小鼠的皮肤耐受期明显延长 (MST=25.7 d),而B6 小鼠对Balb/c 小鼠的皮肤耐受期无明显延长(MST=11.9 d)。对上述联体1 w分开后的Balb/c 及B6 小鼠做供体特异性的同种异型反应如MLR 和DTH,表明联体的B6小鼠和Balb/c小鼠的MLR及DTH均显示明显抑制,但Balb/c小鼠抑制程度明显比B6小鼠深。结论:联体分开后的Balb/c小鼠与C57小鼠分别处于不同的耐受状态。
, 百拇医药
分类号:R392.9
Establishment of parabiosis to study relationship between donor derived chimerism and transplantation tolerance
LÜ Yan
(Department of Immunology, Beijing Medical University,Beijing 100083)
XIE Shu-Sheng
(Department of Immunology, Beijing Medical University,Beijing 100083)
Abstract:Objective:To study the relationship between donor blood derived allogeneic chimerism and levels of tolerance induced in the host mice, parabiosis between adult mice with H-2 complete difference was established. Methods:C57BL/6 (H-2b,B6) mice received an injection of allogenetic spleen cells via the tail vein from Balb/c (H-2d) mice, While Balb/c mice received an injection of spleen cells from C57BL/6 (B6) mice. 2 days later, an intraperitoneal injection of cyclophosphamide was given to both of the B6 and Balb/c mice respectively. After the above treatment, the duration of parabiosis was prolonged significantly ( MST=30.4 days ). When the parabiosis continued for 7 days, the parabiosised mice were separated and the level of transplantation tolerance was surveyed. Results:When the parabiosis continued for 7 days, the parabiosised mice were separated and their skins were transplanted from one to the other. Then, a long-lasting survival (MST=25.7 days ) of skin allograft from B6 mice was achieved in Balb/c mice, but B6 mice kept the potency of rejecting the skin graft from Balb/c mice ( MST=11.9 days). Donor specific allogenetic responses, such as MLR and DTH of these Balb/c and B6 mice were all suppressed obviously, but the suppressive degrees of Balb/c mice were much deeper compared with B6 mice. Conclusion: The seperated mice after treatment of parabiosis were in different state of tolerance.
, 百拇医药
Key words:Parabiosis Chimerism Adult tolerance ▲
Starzl 提出了“双向移植排斥理论”(Two-way paradigm), 认为实体器官移植时,供体器官中的过客细胞能迁移到受体全身各组织中,在免疫抑制的条件下,可以长期存活,并形成“微嵌合体”(Microchimerism) , 这是移植器官长期存活的原因[1]。双向移植排斥及微嵌合体理论的提出,对器官移植的理论和实践都产生了很大的影响。但是有关嵌合状态与移植耐受的关系目前仍有争论[2] 。
本文通过H-2完全不相容的成年小鼠之间的联体共生 (Parabiosis),建立了异基因血细胞嵌合体,明显地加深了移植耐受,为进一步分析嵌合状态与移植耐受的关系建立了一个可供分析的实验模型。现将结果报道如下。
1 材料与方法
, http://www.100md.com
1.1 动物 C57BL/6 (H-2b, B6)小鼠,Balb/c (H-2d)小鼠,KM小鼠,均为8~10周龄,雌性,北京医科大学实验动物部提供。
1.2 试剂 环磷酰胺 (CY),上海华联制药有限公司产品。
1.3 耐受诱导
1.3.1 尾静脉注射脾细胞及腹腔注射CY诱导耐受 经尾静脉给Balb/c小鼠注入B6小鼠的脾细胞5×107个,同时B6小鼠亦经尾静脉注入Balb/c小鼠的脾细胞5×107个。2 d后,分别给Balb/c及B6小鼠腹腔注射CY,剂量为150 mg/kg。
1.3.2 联体诱导耐受 腹腔注射CY后1 d,对Balb/c与B6小鼠进行联体手术。联体方法基本按文献报道进行:联体手术区域消毒去毛,分别从两只小鼠的相对侧的耳后至髂骨嵴切开皮肤及肌肉,剥离软组织,沿最后一根肋缘下剪开腹膜并延伸至髂骨嵴,以5-0肠线将两只小鼠的腹膜间断缝合于一起,并闭合两鼠腹腔之间的空隙以阻止腹腔内容物的交换[3]。最后缝合外层肌肉及皮肤。联体动物于洁净动物室内饲养,并观察联体存活时间。
, http://www.100md.com
1.4 皮肤移植 Balb/c与B6小鼠联体1 w后分开,同时相互之间进行植皮。皮肤移植方法参照文献进行[4]。皮肤完全干缩作为排斥标准。
1.5 小鼠脾细胞对供者及无关第三者的单向混合淋巴细胞反应(MLR) 按本室方法进行[5]。
1.6 小鼠对供者及无关第三者的迟发型超敏反应(DTH) 按本室方法进行[5]。
2 结果
2.1 脾细胞+CY预处理的Balb/c与B6小鼠联体后存活情况 不经任何处理的Balb/c与B6小鼠联体,在术后5~7 d出现明显的移植物抗宿主病或排斥反应,联体维持时间仅为10 d左右 (MST=10.1 d)。 经脾细胞+CY预处理的Balb/c与B6小鼠联体,在术后3 w之内无明显GVHD或排斥反应,伤口愈合良好。但此后逐渐发生GVHD症状,并于30 d左右联体逐渐分离 (MST=30.4 d)。以上两种情况的联体维持时间长短比较见图1。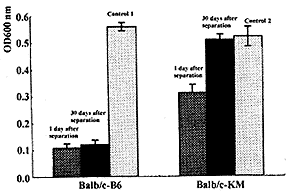
, 百拇医药
图1 Balb/c小鼠对异基因脾细胞的混合淋巴细胞反应(n=5)
Fig.1 MLR to allogenetic spleen cells in Balb/c mice (n=5)
Note: control 1: normal Balb/c-B6; control 2: normal Balb/c-KM
2.2 皮肤移植
2.2.1 正常未经处理小鼠的皮肤移植 B6小鼠的皮肤移植于未经处理的正常Balb/c小鼠, 12 d左右即被排斥。见表1。 Balb/c小鼠的皮肤移植于未经处理的正常B6小鼠,11 d左右即被排斥。见表2。
表1 对Balb/c小鼠异基因皮肤移植耐受的诱导
, http://www.100md.com Tab.1 Induction of tolerance to murine skin allograft in Balb/c mice Group
5×107SC (B6)
iv.
CY 150 mg/kg
ip.
Parabiosis
1 week
Donor of
skin graft
n
, http://www.100md.com
MST±s
days
1
-
-
-
B6
5
12.4±1.1
2
+
+
-
B6
, http://www.100md.com
5
12.6±0.9
3
+
+
+
B6
10
25.7±4.01)
4
-
-
-
, 百拇医药
KM
5
13.0±1.0
5
+
+
+
KM
5
13.2±0.8
Note: 1) P<0.01 compared with other groups
表2 对B6小鼠异基因皮肤移植耐受的诱导
, http://www.100md.com
Tab.2 Induction of tolerance to murine skin allograft in B6 mice Group
5×107SC
(Balb/c)
iv.
CY 150 mg/kg
ip.
Parabiosis
1 week
Donor of
skin graft
, http://www.100md.com
n
MST±s
days
1
-
-
-
Balb/c
5
11.0±1.9
2
+
+
, http://www.100md.com -
Balb/c
5
11.2±2.5
3
+
+
+
Balb/c
10
11.9±2.11)
4
-
, 百拇医药
-
-
KM
5
12.2±1.3
5
+
+
+
KM
5
12.6±1.5
Note:1) P<0.1 compared with other groups
, http://www.100md.com
2.2.2 经移植耐受诱导而未联体的小鼠皮肤移植 5×107个B6小鼠脾细胞+150 mg/kg CY组合不能延长Balb/c对B6小鼠皮肤移植物的耐受期。见表1。另外,5×107个Balb/c小鼠脾细胞+CY150 mg/kg组合亦不能延长B6对Balb/c小鼠皮肤移植物的耐受期。见表2。
2.2.3 经移植耐受诱导并联体后皮肤移植 在移植耐受诱导的基础上进行联体,1?w后分开,同时植皮, 发现此时Balb/c小鼠对B6小鼠皮肤移植物的耐受期明显延长,见表1。耐受显示供体特异性。而B6小鼠对Balb/c小鼠皮肤移植物的耐受期无明显延长,见表2。
2.3 小鼠脾细胞对供体的MLR结果 Balb/c与B6联体1 w后分开第1天及第30天,分别检测Balb/c对B6的MLR结果及B6对Balb/c的MLR结果,均显示为抑制状态。抑制呈供体特异性,见图1及图2。
, http://www.100md.com
图2 B6小鼠对异基因脾细胞的混合淋巴细胞反应(n=5)
Fig.2 MLR to allogenetic spleen cells in B6 mice (n=5)
Note: control 1: normal B6-Balb/c, control 2: normal B6-KM
2.4 小鼠对供体的DTH反应结果 分别于联体分开后第1天及第30天检查Balb/c对B6的DTH反应以及B6对Balb/c的DTH反应。发现在联体分开后第1天检测到的Balb/c对B6的DTH呈明显抑制状态,明显较B6对Balb/c的DTH反应程度轻(P<0.05),见图3,图4。
图3 Balb/c小鼠对异基因小鼠脾细胞的迟发型超敏反应(n=5)
, 百拇医药
Fig.3 DTH to allogenetic spleen cells in Balb/c mice (n=5)
Note: control 1: normal Balb/c-B6; control 2: normal Balb/c-KM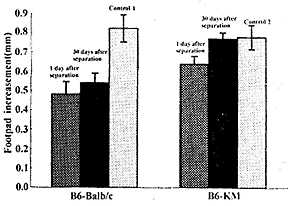
图4 B6小鼠对异基因小鼠脾细胞的迟发型超敏反应DTH(n=5)
Fig.4 DTH to allogenetic spleen cells in B6 mice (n=5)
Note: control 1: normal B6-Balb/c, control 2: normal B6-KM
3 讨论
, http://www.100md.com
1945年,Owen 发现胚胎期发生血流交换的异卵双生小牛,出生后可产生对相互组织器官的移植耐受[6]。受此现象的启发,有学者用联体共生模型研究成年小鼠血流交换诱导耐受的可能性,结果证明在H-2完全不同的小鼠间,联体后即发生严重的GVHD或排斥反应而不能存活[7]。本文的结果也证明,成年Balb/c(H-2d) 小鼠和B6(H-2b)小鼠联体后,由于相互排斥,联体处在10 d左右由于明显的排斥反应而分离 ;小鼠明显消瘦,出现肝脾肿大,腹泻等GVHD症状。Mayumi等人及我们过去研究证明,注射供体小鼠脾细胞后2 d再用环磷酰胺可以在H-2完全不相容的小鼠间诱导一定程度的移植耐受,耐受小鼠可以耐受源于供体的肿瘤,但不能使供体皮肤移植物存活期延长[8,9]。本文根据上述研究的结果,设计了一个首先用这种方法诱导Balb/c与B6小鼠相互之间的浅度耐受,再进行联体,以观察成年小鼠血流持续交换是否可以诱导耐受的研究方案。 本设计方案有以下特点:①可以观察这样预处理后的小鼠是否能延长联体时间;②通过成功地联体一段时间后再将二者分开,相互进行皮肤移植,以观察联体是否可以加深移植耐受的深度;③由于联体小鼠血流相通,形成异基因血细胞嵌合体,这样就可以分析联体小鼠分开后的嵌合状态与移植耐受的关系。
, 百拇医药
本文的实验结果显示:H-2完全不相容的小鼠在联体前诱导浅度耐受可以明显延长联体时间,平均可达30 d左右。另外,联体1 w分开后相互进行皮肤移植表现了不同的结果,Balb/c小鼠在联体分开后MLR及DTH反应均明显抑制 (图1,图3),此时移植B6小鼠的皮肤,则皮肤存活期明显延长,平均为25.7 d(见表1);而B6小鼠在联体分开后虽然MLR和DTH反应受抑制 (见图2,图4),但此时移植 Balb/c小鼠的皮肤并不能延长其存活期 (见表2), 这表明联体的Balb/c 与B6 小鼠血流交换1 w后,虽然B6小鼠的MLR 和DTH 反应受抑制,但尚不足以达到皮肤耐受的程度。Balb/c小鼠和B6小鼠于联体分开后出现耐受程度的明显差异,说明了联体共生诱导移植耐受的程度与动物品系有关,这与早先的报道是一致的[10]。
早期的研究表明:各品系联体小鼠在伤口愈合处于联体术后3 d之内有毛细血管或小动静脉水平的血液交通[10],因而形成了异基因血细胞嵌合体。 Starzl 于1996年指出了这种联体共生小鼠在研究嵌合体与移植耐受关系方面是一个理想的模型[1],但是H-2不相容的小鼠之间,如不经任何处理,则联体不能成功,因此Starzl 的这个设想无法在研究中实施。本文通过联体前相互诱导浅度耐受,再行联体,结果获得了成功的H-2完全不相容的成年小鼠的联体共生,并获得了不同程度耐受加深的结果。从而首次建立了研究嵌合状态与移植耐受关系的联体模型。联体共生诱导耐受的机制及耐受程度与嵌合状态的关系,我们将另文报道。■
, http://www.100md.com
①本项目受国家自然科学基金重点课题资助(编号 39830340)
作者简介:吕 艳,女,26岁,硕士生,主要从事移植免疫学研究;
谢蜀生,男,54岁,博士生导师,主要从事移植免疫和肿瘤免疫学研究
参考文献::
[1]Thomas E S,Anthony J D, Noriko M et al. The lost chord: microchimerism and allograft survival. Immunology Today,1996;17:577
[2]Kathryn W, David H S. Chimerism and transplantation tolerance:cause and effect. Immunology Today,1996;17:584
, 百拇医药
[3]Martinez C, Mariani T, Smith J M et al. Induction of immunological tolerance to male skin isografts in female mice subsequent to neonatal period. Proc Soc Exp Biol And Med, 1959;101:596
[4]Mayumi H, Nomoto K, Good R A et al. A surgical technique for experimental free skin grafting in mice. Jap J Surg,1988;18:548
[5]白爱林,谢蜀生,龙振洲. 成年小鼠皮肤移植耐受诱导的实验研究. 中国免疫学杂志, 1994;10(5):274
[6]Billingham R E, Brent L, Medawar P B. Actively acquired tolerance of foreign cells. Nature,1953;172:603
, 百拇医药
[7]Eichwald E J,Lustgraaf E C, Strainer M. Genetic factors in parabiosis. J Nat Cancer Inst,1959;23:1193
[8]Mayumi H, Kayashina K, Shin T et al. Drug-induced tolerance to allografts in mice. Transplantation,1985;39:335
[9]谢蜀生,叶建平,龙振洲 et al. 成年小鼠移植耐受诱导的研究. 中国免疫学杂志, 1989;5 (Suppl.):5
[10]Nisbet N W. Parabiosis in immunobiology. Transplant Rev,1973;15:123
收稿日期:1999-02-18
修回日期:1999-07-08, http://www.100md.com
单位:吕 艳(北京医科大学免疫学系 北京 100083);谢蜀生(北京医科大学免疫学系 北京 100083)
关键词:联体;嵌合体 成年耐受
中国免疫学杂志000213 摘 要:目的:探讨供体源的异基因血细胞嵌合体与受体耐受状态的关系, 在不同品系的成年小鼠之间成功地建立了联体模型。方法:Balb/c (H-2d) 小鼠经尾静脉注入 C57BL/6 (H-2b , B6)脾细胞, 同时C57BL/6(B6)小鼠经尾静脉注入Balb/c 小鼠脾细胞,2 d后,分别给Balb/c及B6小鼠腹腔注射环磷酰胺(CY),可以明显延长Balb/c与B6联体小鼠的存活期 (MST=30.4 d)。对经以上处理的联体小鼠在联体1 w后分开,并分别检测其耐受状态。 结果:联体小鼠在联体1 w后分开,同时进行相互间的植皮,发现Balb/c 小鼠对B6 小鼠的皮肤耐受期明显延长 (MST=25.7 d),而B6 小鼠对Balb/c 小鼠的皮肤耐受期无明显延长(MST=11.9 d)。对上述联体1 w分开后的Balb/c 及B6 小鼠做供体特异性的同种异型反应如MLR 和DTH,表明联体的B6小鼠和Balb/c小鼠的MLR及DTH均显示明显抑制,但Balb/c小鼠抑制程度明显比B6小鼠深。结论:联体分开后的Balb/c小鼠与C57小鼠分别处于不同的耐受状态。
, 百拇医药
分类号:R392.9
Establishment of parabiosis to study relationship between donor derived chimerism and transplantation tolerance
LÜ Yan
(Department of Immunology, Beijing Medical University,Beijing 100083)
XIE Shu-Sheng
(Department of Immunology, Beijing Medical University,Beijing 100083)
Abstract:Objective:To study the relationship between donor blood derived allogeneic chimerism and levels of tolerance induced in the host mice, parabiosis between adult mice with H-2 complete difference was established. Methods:C57BL/6 (H-2b,B6) mice received an injection of allogenetic spleen cells via the tail vein from Balb/c (H-2d) mice, While Balb/c mice received an injection of spleen cells from C57BL/6 (B6) mice. 2 days later, an intraperitoneal injection of cyclophosphamide was given to both of the B6 and Balb/c mice respectively. After the above treatment, the duration of parabiosis was prolonged significantly ( MST=30.4 days ). When the parabiosis continued for 7 days, the parabiosised mice were separated and the level of transplantation tolerance was surveyed. Results:When the parabiosis continued for 7 days, the parabiosised mice were separated and their skins were transplanted from one to the other. Then, a long-lasting survival (MST=25.7 days ) of skin allograft from B6 mice was achieved in Balb/c mice, but B6 mice kept the potency of rejecting the skin graft from Balb/c mice ( MST=11.9 days). Donor specific allogenetic responses, such as MLR and DTH of these Balb/c and B6 mice were all suppressed obviously, but the suppressive degrees of Balb/c mice were much deeper compared with B6 mice. Conclusion: The seperated mice after treatment of parabiosis were in different state of tolerance.
, 百拇医药
Key words:Parabiosis Chimerism Adult tolerance ▲
Starzl 提出了“双向移植排斥理论”(Two-way paradigm), 认为实体器官移植时,供体器官中的过客细胞能迁移到受体全身各组织中,在免疫抑制的条件下,可以长期存活,并形成“微嵌合体”(Microchimerism) , 这是移植器官长期存活的原因[1]。双向移植排斥及微嵌合体理论的提出,对器官移植的理论和实践都产生了很大的影响。但是有关嵌合状态与移植耐受的关系目前仍有争论[2] 。
本文通过H-2完全不相容的成年小鼠之间的联体共生 (Parabiosis),建立了异基因血细胞嵌合体,明显地加深了移植耐受,为进一步分析嵌合状态与移植耐受的关系建立了一个可供分析的实验模型。现将结果报道如下。
1 材料与方法
, http://www.100md.com
1.1 动物 C57BL/6 (H-2b, B6)小鼠,Balb/c (H-2d)小鼠,KM小鼠,均为8~10周龄,雌性,北京医科大学实验动物部提供。
1.2 试剂 环磷酰胺 (CY),上海华联制药有限公司产品。
1.3 耐受诱导
1.3.1 尾静脉注射脾细胞及腹腔注射CY诱导耐受 经尾静脉给Balb/c小鼠注入B6小鼠的脾细胞5×107个,同时B6小鼠亦经尾静脉注入Balb/c小鼠的脾细胞5×107个。2 d后,分别给Balb/c及B6小鼠腹腔注射CY,剂量为150 mg/kg。
1.3.2 联体诱导耐受 腹腔注射CY后1 d,对Balb/c与B6小鼠进行联体手术。联体方法基本按文献报道进行:联体手术区域消毒去毛,分别从两只小鼠的相对侧的耳后至髂骨嵴切开皮肤及肌肉,剥离软组织,沿最后一根肋缘下剪开腹膜并延伸至髂骨嵴,以5-0肠线将两只小鼠的腹膜间断缝合于一起,并闭合两鼠腹腔之间的空隙以阻止腹腔内容物的交换[3]。最后缝合外层肌肉及皮肤。联体动物于洁净动物室内饲养,并观察联体存活时间。
, http://www.100md.com
1.4 皮肤移植 Balb/c与B6小鼠联体1 w后分开,同时相互之间进行植皮。皮肤移植方法参照文献进行[4]。皮肤完全干缩作为排斥标准。
1.5 小鼠脾细胞对供者及无关第三者的单向混合淋巴细胞反应(MLR) 按本室方法进行[5]。
1.6 小鼠对供者及无关第三者的迟发型超敏反应(DTH) 按本室方法进行[5]。
2 结果
2.1 脾细胞+CY预处理的Balb/c与B6小鼠联体后存活情况 不经任何处理的Balb/c与B6小鼠联体,在术后5~7 d出现明显的移植物抗宿主病或排斥反应,联体维持时间仅为10 d左右 (MST=10.1 d)。 经脾细胞+CY预处理的Balb/c与B6小鼠联体,在术后3 w之内无明显GVHD或排斥反应,伤口愈合良好。但此后逐渐发生GVHD症状,并于30 d左右联体逐渐分离 (MST=30.4 d)。以上两种情况的联体维持时间长短比较见图1。

, 百拇医药
图1 Balb/c小鼠对异基因脾细胞的混合淋巴细胞反应(n=5)
Fig.1 MLR to allogenetic spleen cells in Balb/c mice (n=5)
Note: control 1: normal Balb/c-B6; control 2: normal Balb/c-KM
2.2 皮肤移植
2.2.1 正常未经处理小鼠的皮肤移植 B6小鼠的皮肤移植于未经处理的正常Balb/c小鼠, 12 d左右即被排斥。见表1。 Balb/c小鼠的皮肤移植于未经处理的正常B6小鼠,11 d左右即被排斥。见表2。
表1 对Balb/c小鼠异基因皮肤移植耐受的诱导
, http://www.100md.com Tab.1 Induction of tolerance to murine skin allograft in Balb/c mice Group
5×107SC (B6)
iv.
CY 150 mg/kg
ip.
Parabiosis
1 week
Donor of
skin graft
n
, http://www.100md.com
MST±s
days
1
-
-
-
B6
5
12.4±1.1
2
+
+
-
B6
, http://www.100md.com
5
12.6±0.9
3
+
+
+
B6
10
25.7±4.01)
4
-
-
-
, 百拇医药
KM
5
13.0±1.0
5
+
+
+
KM
5
13.2±0.8
Note: 1) P<0.01 compared with other groups
表2 对B6小鼠异基因皮肤移植耐受的诱导
, http://www.100md.com
Tab.2 Induction of tolerance to murine skin allograft in B6 mice Group
5×107SC
(Balb/c)
iv.
CY 150 mg/kg
ip.
Parabiosis
1 week
Donor of
skin graft
, http://www.100md.com
n
MST±s
days
1
-
-
-
Balb/c
5
11.0±1.9
2
+
+
, http://www.100md.com -
Balb/c
5
11.2±2.5
3
+
+
+
Balb/c
10
11.9±2.11)
4
-
, 百拇医药
-
-
KM
5
12.2±1.3
5
+
+
+
KM
5
12.6±1.5
Note:1) P<0.1 compared with other groups
, http://www.100md.com
2.2.2 经移植耐受诱导而未联体的小鼠皮肤移植 5×107个B6小鼠脾细胞+150 mg/kg CY组合不能延长Balb/c对B6小鼠皮肤移植物的耐受期。见表1。另外,5×107个Balb/c小鼠脾细胞+CY150 mg/kg组合亦不能延长B6对Balb/c小鼠皮肤移植物的耐受期。见表2。
2.2.3 经移植耐受诱导并联体后皮肤移植 在移植耐受诱导的基础上进行联体,1?w后分开,同时植皮, 发现此时Balb/c小鼠对B6小鼠皮肤移植物的耐受期明显延长,见表1。耐受显示供体特异性。而B6小鼠对Balb/c小鼠皮肤移植物的耐受期无明显延长,见表2。
2.3 小鼠脾细胞对供体的MLR结果 Balb/c与B6联体1 w后分开第1天及第30天,分别检测Balb/c对B6的MLR结果及B6对Balb/c的MLR结果,均显示为抑制状态。抑制呈供体特异性,见图1及图2。

, http://www.100md.com
图2 B6小鼠对异基因脾细胞的混合淋巴细胞反应(n=5)
Fig.2 MLR to allogenetic spleen cells in B6 mice (n=5)
Note: control 1: normal B6-Balb/c, control 2: normal B6-KM
2.4 小鼠对供体的DTH反应结果 分别于联体分开后第1天及第30天检查Balb/c对B6的DTH反应以及B6对Balb/c的DTH反应。发现在联体分开后第1天检测到的Balb/c对B6的DTH呈明显抑制状态,明显较B6对Balb/c的DTH反应程度轻(P<0.05),见图3,图4。

图3 Balb/c小鼠对异基因小鼠脾细胞的迟发型超敏反应(n=5)
, 百拇医药
Fig.3 DTH to allogenetic spleen cells in Balb/c mice (n=5)
Note: control 1: normal Balb/c-B6; control 2: normal Balb/c-KM

图4 B6小鼠对异基因小鼠脾细胞的迟发型超敏反应DTH(n=5)
Fig.4 DTH to allogenetic spleen cells in B6 mice (n=5)
Note: control 1: normal B6-Balb/c, control 2: normal B6-KM
3 讨论
, http://www.100md.com
1945年,Owen 发现胚胎期发生血流交换的异卵双生小牛,出生后可产生对相互组织器官的移植耐受[6]。受此现象的启发,有学者用联体共生模型研究成年小鼠血流交换诱导耐受的可能性,结果证明在H-2完全不同的小鼠间,联体后即发生严重的GVHD或排斥反应而不能存活[7]。本文的结果也证明,成年Balb/c(H-2d) 小鼠和B6(H-2b)小鼠联体后,由于相互排斥,联体处在10 d左右由于明显的排斥反应而分离 ;小鼠明显消瘦,出现肝脾肿大,腹泻等GVHD症状。Mayumi等人及我们过去研究证明,注射供体小鼠脾细胞后2 d再用环磷酰胺可以在H-2完全不相容的小鼠间诱导一定程度的移植耐受,耐受小鼠可以耐受源于供体的肿瘤,但不能使供体皮肤移植物存活期延长[8,9]。本文根据上述研究的结果,设计了一个首先用这种方法诱导Balb/c与B6小鼠相互之间的浅度耐受,再进行联体,以观察成年小鼠血流持续交换是否可以诱导耐受的研究方案。 本设计方案有以下特点:①可以观察这样预处理后的小鼠是否能延长联体时间;②通过成功地联体一段时间后再将二者分开,相互进行皮肤移植,以观察联体是否可以加深移植耐受的深度;③由于联体小鼠血流相通,形成异基因血细胞嵌合体,这样就可以分析联体小鼠分开后的嵌合状态与移植耐受的关系。
, 百拇医药
本文的实验结果显示:H-2完全不相容的小鼠在联体前诱导浅度耐受可以明显延长联体时间,平均可达30 d左右。另外,联体1 w分开后相互进行皮肤移植表现了不同的结果,Balb/c小鼠在联体分开后MLR及DTH反应均明显抑制 (图1,图3),此时移植B6小鼠的皮肤,则皮肤存活期明显延长,平均为25.7 d(见表1);而B6小鼠在联体分开后虽然MLR和DTH反应受抑制 (见图2,图4),但此时移植 Balb/c小鼠的皮肤并不能延长其存活期 (见表2), 这表明联体的Balb/c 与B6 小鼠血流交换1 w后,虽然B6小鼠的MLR 和DTH 反应受抑制,但尚不足以达到皮肤耐受的程度。Balb/c小鼠和B6小鼠于联体分开后出现耐受程度的明显差异,说明了联体共生诱导移植耐受的程度与动物品系有关,这与早先的报道是一致的[10]。
早期的研究表明:各品系联体小鼠在伤口愈合处于联体术后3 d之内有毛细血管或小动静脉水平的血液交通[10],因而形成了异基因血细胞嵌合体。 Starzl 于1996年指出了这种联体共生小鼠在研究嵌合体与移植耐受关系方面是一个理想的模型[1],但是H-2不相容的小鼠之间,如不经任何处理,则联体不能成功,因此Starzl 的这个设想无法在研究中实施。本文通过联体前相互诱导浅度耐受,再行联体,结果获得了成功的H-2完全不相容的成年小鼠的联体共生,并获得了不同程度耐受加深的结果。从而首次建立了研究嵌合状态与移植耐受关系的联体模型。联体共生诱导耐受的机制及耐受程度与嵌合状态的关系,我们将另文报道。■
, http://www.100md.com
①本项目受国家自然科学基金重点课题资助(编号 39830340)
作者简介:吕 艳,女,26岁,硕士生,主要从事移植免疫学研究;
谢蜀生,男,54岁,博士生导师,主要从事移植免疫和肿瘤免疫学研究
参考文献::
[1]Thomas E S,Anthony J D, Noriko M et al. The lost chord: microchimerism and allograft survival. Immunology Today,1996;17:577
[2]Kathryn W, David H S. Chimerism and transplantation tolerance:cause and effect. Immunology Today,1996;17:584
, 百拇医药
[3]Martinez C, Mariani T, Smith J M et al. Induction of immunological tolerance to male skin isografts in female mice subsequent to neonatal period. Proc Soc Exp Biol And Med, 1959;101:596
[4]Mayumi H, Nomoto K, Good R A et al. A surgical technique for experimental free skin grafting in mice. Jap J Surg,1988;18:548
[5]白爱林,谢蜀生,龙振洲. 成年小鼠皮肤移植耐受诱导的实验研究. 中国免疫学杂志, 1994;10(5):274
[6]Billingham R E, Brent L, Medawar P B. Actively acquired tolerance of foreign cells. Nature,1953;172:603
, 百拇医药
[7]Eichwald E J,Lustgraaf E C, Strainer M. Genetic factors in parabiosis. J Nat Cancer Inst,1959;23:1193
[8]Mayumi H, Kayashina K, Shin T et al. Drug-induced tolerance to allografts in mice. Transplantation,1985;39:335
[9]谢蜀生,叶建平,龙振洲 et al. 成年小鼠移植耐受诱导的研究. 中国免疫学杂志, 1989;5 (Suppl.):5
[10]Nisbet N W. Parabiosis in immunobiology. Transplant Rev,1973;15:123
收稿日期:1999-02-18
修回日期:1999-07-08, http://www.100md.com