小鼠成肌细胞的培养纯化和鉴定方法
作者:王训 张成 刘焯霖 陈国俊
单位:中山医科大学附属第一医院神经内科, 广东 广州 510080
关键词:成肌细胞;细胞培养;纯化;免疫细胞化学
00zk02
摘 要:【目的】 建立体外成肌细胞分离培养、纯化和鉴定方法。【方法】 40只小鼠分10次采用分离消化法培养成肌细胞,分别用A、B、C、D 4组不同培养液培养,以Ficoll梯度液纯化,进行Desmin免疫组化鉴定。【结果】 成肌细胞培养后经台盼蓝检查成活率达95%以上,在接种后4~5 d增殖达高峰,A、B、C 3组培养液对成肌细胞的培养效果无差异。Ficoll分离纯化的成肌细胞纯度较高,有97%的成肌细胞Desmin胞浆呈阳性反应。【结果】 采用Ficoll纯化以国产血清培养,可获得高产量高纯度的成肌细胞。
, 百拇医药
中图分类号: R373.23 文献标识码: A
文章编号: 1000-257X(2000)04S0-0006-04
Identification, Purification and Culture of Mouse Skeletal Muscle Cell
WANG Xun, ZHANG Cheng, LIU Zhuo-lin, CHEN Guo-jun
(Department of Neurology, First Affiliated Hospital, Sun Yat-sen University of Medical Sciences, Guangzhou 510089, China)
Abstract: 【Objective】 To establish a practical methods of the culture, purification and identification of mouse myoblasts in vitro. 【Methods】 Muscle samples of 40 mice were minced and digested with trypsin, cultured with four kinds of media namely A, B, C, and D, finally purified with Ficoll gradient liquid. Myogenesis were dynamically observed, myoblast were tested by Desmin immunohistochemistry stains. 【Result】 The myoblast cell viability is up to 95% by Trypan blue, the cell proliferation arrived climax during 4~5 day after planted. There is no difference between A, B, and C culture liquid. The cell purity is up to 97% by Desmin immunohistochemical stains test. 【Conclusion】 Myoblasts could be purified by Ficoll and cultured with DMEM culture liquid contained serum made in our country, in high quantity.
, 百拇医药
Key words: myoblast; cell culture; purification; immunocytochemistry
Duchenne型肌营养不良症(Duchenne muscular dystrophy, DMD)是一种以骨骼肌进行性变性、坏死为主要病理特征的致死性的X-性连锁隐性遗传性肌病。由于肌细胞膜上的抗肌萎缩蛋白(dystrophin)的缺乏或结构变异,引起肌细胞膜的形态和功能损害,致使肌纤维变性坏死。临床缺乏有效的治疗方法。近年来,成肌细胞移植治疗(myoblast transfer therapy, MTT)DMD在实验和临床研究已取得一定进展,是目前唯一能将人类自然基因组完整转移的方式[1]。文献报道MTT实验失败的原因很多[2],其中体外培养的成肌细胞的融合能力和纯度是原因之一,为此我们建立了成肌细胞分离培养和纯化方法,并对其生物学特征进行鉴定。
1 材料与方法
, http://www.100md.com
1.1 实验材料
D-Hanks液:自备。DMEM培养基:Gibco-BRL公司提供。胎牛血清:Gibco-BRL公司、浙江杭州四季青生物制品公司提供。胰蛋白酶和胶原酶:Sigma公司提供。青、链霉素:国产。Ficoll-400:Pharmacia公司提供。结蛋白(desmin)抗体:福州迈新公司提供。C57BL/6新生鼠(1~3 d)40只,购于中山医科大学实验动物中心,有合格证号,体质量4~6 g。
1.2 成肌细胞的原代培养
40只新生鼠分10次,每次4只,引颈法杀死小鼠,剥皮后解离四肢,D-Hanks液10 mL清洗3次。剪碎肌组织成1 mm3肌糜,以1 g/L胶原酶-2.5 g/L胰酶-1 g/L乙二胺四乙酸5 mL消化,37 ℃孵育20 min,700×g(离心机号LXJ-Ⅱ,半径12.5 cm)离心10 min,弃去上清液,然后再加入含不同血清的培养液10 mL,按2×108/L的密度接种于100 mL培养瓶中,体积分数5% CO2、37 ℃饱和湿度二氧化碳培养箱静置培养。1~2 d换液1次。倒置相差显微镜下动态观察细胞生长情况并摄片。培养液分4组:A组为Dulbecco最低必需培养液(Dulbecco's minimum essential medium, DMEM)含体积分数10% Gibcol公司的胎牛血清;B组为含体积分数20%的杭州四季青胎牛血清;C组为含体积分数20%的杭州四季青小牛血清;D组为含体积分数20%的广州畜牧厂的胎牛血清,以观察不同培养液对成肌细胞的培养效果。
, http://www.100md.com
1.3 细胞成活率的检查和细胞生长曲线的绘制
取待测的细胞悬液,吹打均匀,吸取100 μL,另吸100 μL 4 g/L的台盼蓝加入混匀,吸取1滴于血球计数仪上,显微镜下观察,凡着色细胞为不正常或死亡细胞。并分别用A、B两组培养液培养的细胞连续7 d计数,绘制细胞生长曲线,了解细胞生长状况。
1.4 成肌细胞的纯化步骤
Ficoll梯度液制备:将Ficoll-400用D-Hanks液配制成200 g/L,再稀释成170、150、130、100和50 g/L,各取2~3 mL缓慢加入15 mL的刻度离心管制成梯度离心液。然后取原代培养第2天的细胞,以3 mL培养液悬浮后加入,离心10 min,吸取各界面上的细胞,以培养液重悬后计数,接种于培养瓶中继续培养。
1.5 成肌细胞免疫细胞化学染色
, 百拇医药
取培养4~5 d的成肌细胞1×109/L,接种生长载玻片24 h,经4 ℃ D-Hanks液洗2次,冷丙酮固定15 min。按常规Sp染色方法进行Desmin的检测。
1.6 成肌细胞电镜观察
透射电镜标本采用橡胶匙刮除成肌细胞离心沉淀包埋法,前固定液为25 g/L戊二醛-20 g/L多聚甲醛-0.1 mol/L PBS,后固定液为1 g/L锇酸-PBS。环氧树脂812包埋,超薄切片并复染,HITACHI-600透射电镜下观察拍片。
1.7 统计学方法
所有资料结果采用SPSS(8.0)统计软件进行F检验或/及t检验。
2 结 果
2.1 原代培养的成肌细胞动态观察
, http://www.100md.com
原代培养后细胞第1~2天可见单核的纺锤形、长梭形缓慢生长。第3~4天成肌细胞生长迅速,呈单核双极性大量展开,表现出很强的分裂增殖能力(图1A)。第5~6天大量增殖的成肌细胞变得细长,呈平行排列走向,相互融合形成中央核的多核性长管状初生肌管(图1B)。第7~8天肌管数量增多,体积增大,核数明显增多,并见长管状的成肌细胞互相连接,并出现“节律性收缩”现象。各次形成肌管的时间长短不一,平均6~7 d,初生肌管与长梭形成肌细胞常平行排列,间隔分布,有时可观察到成肌细胞胞浆紧贴肌管表面,或肌细胞一端插入肌管胞浆内,显示肌细胞融合形成肌管不断发育成熟的形态特征。
4组不同培养液除含广州畜牧厂胎牛血清的未培养成功外,细胞生长良好。培养结果比较,说明用Gibcol、杭州四季青公司的血清培养效果较好(表1)。
表1 3组不同培养液培养小鼠成肌细胞的生长情况比较
Table 1 The comparison of mouse myoblast growth status between the three groups substrate( ±s)
±s)
, http://www.100md.com
Cell growth time (d)
Cell fuse time (d)
Quantity of myotube (n)
Quantity of nuclear
in myotube (n)
A group
2.75±0.21
7.25±0.707
23.875±2.475
27.125±4.673
, http://www.100md.com B group
3.125±0.64
7.625±0.744
22.625±3.335
25.25±4.527
C group
3.0±0.625
7.125±0.834
22.750±3.808
26.125±4.612
Note: there were no difference between the three groups by F test, P>0.05
, 百拇医药
图1 成肌细胞培养
Fig.1 Cultured myoblasts
A: myoblasts cultured three days, phase of split and proliferation, arrow shows myoblast. B: myoblasts cultured six days, phase of myotube shaped, arrow shows myotube, ×200
2.2 台盼蓝染色检测成肌细胞成活率和绘制生长曲线
培养的细胞经4 g/L台盼蓝染色计数,约有95%以上的细胞不着色,说明二步消化法分离培养的细胞成活率较高。分别用A、B两组培养液培养纯化后的细胞连续计数绘制生长曲线显示,成肌细胞在培养第4~6天增殖达高峰,两组在各时间段均无差异(P>0.05)(图2)。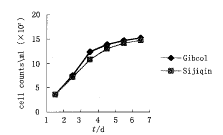
, http://www.100md.com
图2 用不同血清培养纯化的成肌细胞的生长曲线
Fig.2 The growth curve of myoblast cultured with
different substrate
2.3 成肌细胞的电镜观察
分裂增殖早期的成肌细胞胞核含核仁1~3个,胞浆中有不规则分布的束状平行排列的肌丝,部分区域肌丝尚未形成,并有少量幼稚的线粒体,早期成肌细胞胞浆有长梭形高电子密度结构,呈散在分布。晚期成肌细胞胞浆肌丝更丰富,但无明显肌节形成,可见分化较成熟的线粒体、糖原和游离核糖体聚集于肌束周边,使丰富的肌丝呈束状平行排列(图3)。
图3 成肌细胞的电镜观察为放大25 000倍
, 百拇医药
Fig.3 The observation of myoblast by electron
microscope (×25 000)
2.4 成肌细胞的纯化
成肌细胞悬液用Ficoll-400配制的密度梯度液离心纯化,分别在5 g/L和10 g/L、10 g/L和13 g/L的界面形成2个细胞层,各层细胞分别培养后,发现第1层细胞较混杂,第2层细胞纯净,生长形态一致,经desmin免疫染色鉴定证实第2层为高纯度的成肌细胞。镜下随机取4个视野(20×)计数阳性染色的细胞,并与未纯化培养的成肌细胞进行比较,结果显示,Ficoll分离纯化的成肌细胞纯度较高(表2)。
2.5 Desmin免疫细胞化学染色
将分裂增殖4~5 d的成肌细胞及对照的成纤维细胞,用desmin抗体进行间接免疫酶染色,结果均有97%的成肌细胞desmin胞浆呈阳性反应,细胞核外周及胞浆呈棕黄色;对照的成纤维细胞胞浆呈阴性反应,表明培养的细胞为成肌细胞(图4A,B)。
, 百拇医药
图4 成肌细胞的Desmin免疫组化染色
Fig.4 Myoblast immunochemistry stained by Desmin antibody
A: fibroblasts immunochemistry stained, control. B: myoblasts immunochemistry stained by Desmin antibody, black arrow show cell nucleus, white arrow show cytoplasm with positive stains, ×200
表2 成肌细胞的纯化培养前后比较
Table 2 The comparison myoblasts between it purified
, http://www.100md.com
and pre-purified ( ±s)
±s)
(n)
Positive stain cells(n)
Positive stain cell scale (%)
Ficoll purification
8
69.125±3.681
97.73±3.284
Non purification
, 百拇医药
8
61.375±3.998 1)
86.88±1.390 1)
Note: there were obviously difference between myoblast purified and pre-purified by F test;1) P<0.013 讨 论
肌肉在损伤后有一定的再生功能,成熟的肌细胞存在一定数量的卫星细胞,能与外源性成肌细胞融合,继续分化成异核多核性肌纤维修复损伤的肌肉,给成肌细胞移植治疗DMD带来契机。由于肌细胞包含了DMD基因的全顺序,所表达的蛋白质的功能最完整,故成肌细胞移植是较为理想的治疗DMD的手段[1,3]。目前大多学者认为成肌细胞移植需要足够数量、增殖能力强及纯净的成肌细胞[2]。成肌细胞培养技术主要有组织培养块法、消化分离培养法,而组织块法因漂浮的组织块和细胞碎片含有毒性物质,易影响细胞的生长,消化分离培养法使组织块分散成细胞团或单个细胞,易于从培养液中吸取养份和排出代谢产物,细胞能在短时间内生长成片且产量高[4,5]。本实验参照Blau[6]等的消化分离培养方法改进,利用A、B、C、D 4组培养液进行培养,除D组未培养成功外前3种均获得较高的细胞成活率,达95%以上,细胞生长曲线也显示在接种后4~6 d细胞生长最旺盛。A、B、C 3组培养液在成肌细胞生长增殖时间、细胞融合时间、形成肌管数、肌管核数等方面均无明显差异,说明国产血清可以成功替代Gibcol胎牛血清进行培养,并能获得大量增殖能力强的成肌细胞。
, 百拇医药
Delaporte和Blau[6,7]等在培养人骨骼肌细胞时发现,成肌细胞的发育大约有3个阶段,即生长迟滞期约接种后第1~5天;分裂增殖期约第6~14天;肌管形成期约第15天~5周。本实验中小鼠的成肌细胞培养发育时期与人有明显不同,生长迟滞期很短约接种后第1~2天;分裂增殖期约第3~5天;肌管形成期约第6~8天。分裂增殖期成肌细胞在普通光镜下,呈单核双极性大量展开,此期细胞生长最旺盛、增殖能力强,即将进入肌管形成期,说明此期细胞行成肌细胞移植效果较好。在体外原代培养的细胞多呈混合生长,如何去除生长迅速的成纤维细胞进行纯化是培养成功的关键[2]。细胞纯化的方法有多种,等密度沉降分离法是其中的一种,Ficoll-400是一种无毒的密度梯度分离剂,产生的渗透压很小,在全部密度范围保持等张,对细胞无吸附作用,无刺激性[8]。本实验结果显示,采用纯化培养和非纯化培养的成肌细胞经desmin免疫染色计数,Ficoll分离纯化后培养的成肌细胞纯度较高,达97.3%以上,完成达到移植所需水平[1,2]。有研究表明desmin是横纹肌特有的中间丝成分,具有特异性[8]。本实验的desmin免疫染色观察到成肌细胞胞浆中间丝结蛋白呈强阳性反应,并随细胞的成熟而增强,成纤维细胞呈阴性反应。早期成肌细胞的鉴定采用肌动蛋白(actin)检测方法鉴定,因其属于细胞内结构蛋白,广泛存在于横纹肌、平滑肌、心肌细胞,故采用desmin免疫细胞化学染色是鉴别成肌细胞和成纤维细胞更为有效的方法。本实验工作为成肌细胞的基础研究和临床治疗实验提供简便、低耗的体外培养途径。
, 百拇医药
(编辑 关淡庄)
基金项目:国家自然科学基金资助项目(39870804);广东省自然科学基金资助项目(970061);卫生部临床学科重点攻关项目(97040229)
作者简介:王 训(1966-),男,安徽合肥人,博士生,主治医师,讲师.
参考文献:
[1] Law P K. Myoblast transfer: gene therapy for muscular dystrophy [M]. Austin: RG Landes Company, 1994.35~37.
[2] Rando T A, Blau H M. Primary mouse myoblast purification, characterization, and transplantation for cell-mediated gene therapy [J]. J Cell Biol, 1994,125(6):1275.
, http://www.100md.com
[3] Brown R H, Miller J B. Progress, problems, and prospects for gene therapy in muscle [J]. Curr Opin Rheumat, 1996,8(6):539.
[4] 鄂 征.组织培养和分子细胞学技术[M].北京:北京出版社,1995.121~131.
[5] 司徒镇强,吴军正.细胞培养[M].西安:世界图书出版公司,1996.62~72.
[6] Blau H M, Webster C. Isolation and characterization of human muscle cells [J]. Cell Biol, 1981, 78(9):5623.
[7] Delaporte C, Dehaupas M, Fardeau M. Comparison between the growth pattern of cell cultures from normal and Duchenne dystrophy muscle [J]. J Neurol Sci, 1984,64(2):149.
, 百拇医药
[8] Fishchman D A. Monoclonal antibodies to desmin: evidence for stage dependent intermediate filament immunoreactivity during cardiac and skeletal muscle development [J]. Ann NY Acad Sci, 1985,455(2):167.
[9] Allen R E, Temm-Grove C J, Sheehan S M, et al. Skeletal muscle satellite cell cultures [J]. Methods Cell Biol, 1997,52(2):155.
收稿日期:2000-03-16, 百拇医药
单位:中山医科大学附属第一医院神经内科, 广东 广州 510080
关键词:成肌细胞;细胞培养;纯化;免疫细胞化学
00zk02
摘 要:【目的】 建立体外成肌细胞分离培养、纯化和鉴定方法。【方法】 40只小鼠分10次采用分离消化法培养成肌细胞,分别用A、B、C、D 4组不同培养液培养,以Ficoll梯度液纯化,进行Desmin免疫组化鉴定。【结果】 成肌细胞培养后经台盼蓝检查成活率达95%以上,在接种后4~5 d增殖达高峰,A、B、C 3组培养液对成肌细胞的培养效果无差异。Ficoll分离纯化的成肌细胞纯度较高,有97%的成肌细胞Desmin胞浆呈阳性反应。【结果】 采用Ficoll纯化以国产血清培养,可获得高产量高纯度的成肌细胞。
, 百拇医药
中图分类号: R373.23 文献标识码: A
文章编号: 1000-257X(2000)04S0-0006-04
Identification, Purification and Culture of Mouse Skeletal Muscle Cell
WANG Xun, ZHANG Cheng, LIU Zhuo-lin, CHEN Guo-jun
(Department of Neurology, First Affiliated Hospital, Sun Yat-sen University of Medical Sciences, Guangzhou 510089, China)
Abstract: 【Objective】 To establish a practical methods of the culture, purification and identification of mouse myoblasts in vitro. 【Methods】 Muscle samples of 40 mice were minced and digested with trypsin, cultured with four kinds of media namely A, B, C, and D, finally purified with Ficoll gradient liquid. Myogenesis were dynamically observed, myoblast were tested by Desmin immunohistochemistry stains. 【Result】 The myoblast cell viability is up to 95% by Trypan blue, the cell proliferation arrived climax during 4~5 day after planted. There is no difference between A, B, and C culture liquid. The cell purity is up to 97% by Desmin immunohistochemical stains test. 【Conclusion】 Myoblasts could be purified by Ficoll and cultured with DMEM culture liquid contained serum made in our country, in high quantity.
, 百拇医药
Key words: myoblast; cell culture; purification; immunocytochemistry
Duchenne型肌营养不良症(Duchenne muscular dystrophy, DMD)是一种以骨骼肌进行性变性、坏死为主要病理特征的致死性的X-性连锁隐性遗传性肌病。由于肌细胞膜上的抗肌萎缩蛋白(dystrophin)的缺乏或结构变异,引起肌细胞膜的形态和功能损害,致使肌纤维变性坏死。临床缺乏有效的治疗方法。近年来,成肌细胞移植治疗(myoblast transfer therapy, MTT)DMD在实验和临床研究已取得一定进展,是目前唯一能将人类自然基因组完整转移的方式[1]。文献报道MTT实验失败的原因很多[2],其中体外培养的成肌细胞的融合能力和纯度是原因之一,为此我们建立了成肌细胞分离培养和纯化方法,并对其生物学特征进行鉴定。
1 材料与方法
, http://www.100md.com
1.1 实验材料
D-Hanks液:自备。DMEM培养基:Gibco-BRL公司提供。胎牛血清:Gibco-BRL公司、浙江杭州四季青生物制品公司提供。胰蛋白酶和胶原酶:Sigma公司提供。青、链霉素:国产。Ficoll-400:Pharmacia公司提供。结蛋白(desmin)抗体:福州迈新公司提供。C57BL/6新生鼠(1~3 d)40只,购于中山医科大学实验动物中心,有合格证号,体质量4~6 g。
1.2 成肌细胞的原代培养
40只新生鼠分10次,每次4只,引颈法杀死小鼠,剥皮后解离四肢,D-Hanks液10 mL清洗3次。剪碎肌组织成1 mm3肌糜,以1 g/L胶原酶-2.5 g/L胰酶-1 g/L乙二胺四乙酸5 mL消化,37 ℃孵育20 min,700×g(离心机号LXJ-Ⅱ,半径12.5 cm)离心10 min,弃去上清液,然后再加入含不同血清的培养液10 mL,按2×108/L的密度接种于100 mL培养瓶中,体积分数5% CO2、37 ℃饱和湿度二氧化碳培养箱静置培养。1~2 d换液1次。倒置相差显微镜下动态观察细胞生长情况并摄片。培养液分4组:A组为Dulbecco最低必需培养液(Dulbecco's minimum essential medium, DMEM)含体积分数10% Gibcol公司的胎牛血清;B组为含体积分数20%的杭州四季青胎牛血清;C组为含体积分数20%的杭州四季青小牛血清;D组为含体积分数20%的广州畜牧厂的胎牛血清,以观察不同培养液对成肌细胞的培养效果。
, http://www.100md.com
1.3 细胞成活率的检查和细胞生长曲线的绘制
取待测的细胞悬液,吹打均匀,吸取100 μL,另吸100 μL 4 g/L的台盼蓝加入混匀,吸取1滴于血球计数仪上,显微镜下观察,凡着色细胞为不正常或死亡细胞。并分别用A、B两组培养液培养的细胞连续7 d计数,绘制细胞生长曲线,了解细胞生长状况。
1.4 成肌细胞的纯化步骤
Ficoll梯度液制备:将Ficoll-400用D-Hanks液配制成200 g/L,再稀释成170、150、130、100和50 g/L,各取2~3 mL缓慢加入15 mL的刻度离心管制成梯度离心液。然后取原代培养第2天的细胞,以3 mL培养液悬浮后加入,离心10 min,吸取各界面上的细胞,以培养液重悬后计数,接种于培养瓶中继续培养。
1.5 成肌细胞免疫细胞化学染色
, 百拇医药
取培养4~5 d的成肌细胞1×109/L,接种生长载玻片24 h,经4 ℃ D-Hanks液洗2次,冷丙酮固定15 min。按常规Sp染色方法进行Desmin的检测。
1.6 成肌细胞电镜观察
透射电镜标本采用橡胶匙刮除成肌细胞离心沉淀包埋法,前固定液为25 g/L戊二醛-20 g/L多聚甲醛-0.1 mol/L PBS,后固定液为1 g/L锇酸-PBS。环氧树脂812包埋,超薄切片并复染,HITACHI-600透射电镜下观察拍片。
1.7 统计学方法
所有资料结果采用SPSS(8.0)统计软件进行F检验或/及t检验。
2 结 果
2.1 原代培养的成肌细胞动态观察
, http://www.100md.com
原代培养后细胞第1~2天可见单核的纺锤形、长梭形缓慢生长。第3~4天成肌细胞生长迅速,呈单核双极性大量展开,表现出很强的分裂增殖能力(图1A)。第5~6天大量增殖的成肌细胞变得细长,呈平行排列走向,相互融合形成中央核的多核性长管状初生肌管(图1B)。第7~8天肌管数量增多,体积增大,核数明显增多,并见长管状的成肌细胞互相连接,并出现“节律性收缩”现象。各次形成肌管的时间长短不一,平均6~7 d,初生肌管与长梭形成肌细胞常平行排列,间隔分布,有时可观察到成肌细胞胞浆紧贴肌管表面,或肌细胞一端插入肌管胞浆内,显示肌细胞融合形成肌管不断发育成熟的形态特征。
4组不同培养液除含广州畜牧厂胎牛血清的未培养成功外,细胞生长良好。培养结果比较,说明用Gibcol、杭州四季青公司的血清培养效果较好(表1)。
表1 3组不同培养液培养小鼠成肌细胞的生长情况比较
Table 1 The comparison of mouse myoblast growth status between the three groups substrate(
 ±s)
±s), http://www.100md.com
Cell growth time (d)
Cell fuse time (d)
Quantity of myotube (n)
Quantity of nuclear
in myotube (n)
A group
2.75±0.21
7.25±0.707
23.875±2.475
27.125±4.673
, http://www.100md.com B group
3.125±0.64
7.625±0.744
22.625±3.335
25.25±4.527
C group
3.0±0.625
7.125±0.834
22.750±3.808
26.125±4.612
Note: there were no difference between the three groups by F test, P>0.05

, 百拇医药
图1 成肌细胞培养
Fig.1 Cultured myoblasts
A: myoblasts cultured three days, phase of split and proliferation, arrow shows myoblast. B: myoblasts cultured six days, phase of myotube shaped, arrow shows myotube, ×200
2.2 台盼蓝染色检测成肌细胞成活率和绘制生长曲线
培养的细胞经4 g/L台盼蓝染色计数,约有95%以上的细胞不着色,说明二步消化法分离培养的细胞成活率较高。分别用A、B两组培养液培养纯化后的细胞连续计数绘制生长曲线显示,成肌细胞在培养第4~6天增殖达高峰,两组在各时间段均无差异(P>0.05)(图2)。

, http://www.100md.com
图2 用不同血清培养纯化的成肌细胞的生长曲线
Fig.2 The growth curve of myoblast cultured with
different substrate
2.3 成肌细胞的电镜观察
分裂增殖早期的成肌细胞胞核含核仁1~3个,胞浆中有不规则分布的束状平行排列的肌丝,部分区域肌丝尚未形成,并有少量幼稚的线粒体,早期成肌细胞胞浆有长梭形高电子密度结构,呈散在分布。晚期成肌细胞胞浆肌丝更丰富,但无明显肌节形成,可见分化较成熟的线粒体、糖原和游离核糖体聚集于肌束周边,使丰富的肌丝呈束状平行排列(图3)。

图3 成肌细胞的电镜观察为放大25 000倍
, 百拇医药
Fig.3 The observation of myoblast by electron
microscope (×25 000)
2.4 成肌细胞的纯化
成肌细胞悬液用Ficoll-400配制的密度梯度液离心纯化,分别在5 g/L和10 g/L、10 g/L和13 g/L的界面形成2个细胞层,各层细胞分别培养后,发现第1层细胞较混杂,第2层细胞纯净,生长形态一致,经desmin免疫染色鉴定证实第2层为高纯度的成肌细胞。镜下随机取4个视野(20×)计数阳性染色的细胞,并与未纯化培养的成肌细胞进行比较,结果显示,Ficoll分离纯化的成肌细胞纯度较高(表2)。
2.5 Desmin免疫细胞化学染色
将分裂增殖4~5 d的成肌细胞及对照的成纤维细胞,用desmin抗体进行间接免疫酶染色,结果均有97%的成肌细胞desmin胞浆呈阳性反应,细胞核外周及胞浆呈棕黄色;对照的成纤维细胞胞浆呈阴性反应,表明培养的细胞为成肌细胞(图4A,B)。

, 百拇医药
图4 成肌细胞的Desmin免疫组化染色
Fig.4 Myoblast immunochemistry stained by Desmin antibody
A: fibroblasts immunochemistry stained, control. B: myoblasts immunochemistry stained by Desmin antibody, black arrow show cell nucleus, white arrow show cytoplasm with positive stains, ×200
表2 成肌细胞的纯化培养前后比较
Table 2 The comparison myoblasts between it purified
, http://www.100md.com
and pre-purified (
 ±s)
±s)(n)
Positive stain cells(n)
Positive stain cell scale (%)
Ficoll purification
8
69.125±3.681
97.73±3.284
Non purification
, 百拇医药
8
61.375±3.998 1)
86.88±1.390 1)
Note: there were obviously difference between myoblast purified and pre-purified by F test;1) P<0.013 讨 论
肌肉在损伤后有一定的再生功能,成熟的肌细胞存在一定数量的卫星细胞,能与外源性成肌细胞融合,继续分化成异核多核性肌纤维修复损伤的肌肉,给成肌细胞移植治疗DMD带来契机。由于肌细胞包含了DMD基因的全顺序,所表达的蛋白质的功能最完整,故成肌细胞移植是较为理想的治疗DMD的手段[1,3]。目前大多学者认为成肌细胞移植需要足够数量、增殖能力强及纯净的成肌细胞[2]。成肌细胞培养技术主要有组织培养块法、消化分离培养法,而组织块法因漂浮的组织块和细胞碎片含有毒性物质,易影响细胞的生长,消化分离培养法使组织块分散成细胞团或单个细胞,易于从培养液中吸取养份和排出代谢产物,细胞能在短时间内生长成片且产量高[4,5]。本实验参照Blau[6]等的消化分离培养方法改进,利用A、B、C、D 4组培养液进行培养,除D组未培养成功外前3种均获得较高的细胞成活率,达95%以上,细胞生长曲线也显示在接种后4~6 d细胞生长最旺盛。A、B、C 3组培养液在成肌细胞生长增殖时间、细胞融合时间、形成肌管数、肌管核数等方面均无明显差异,说明国产血清可以成功替代Gibcol胎牛血清进行培养,并能获得大量增殖能力强的成肌细胞。
, 百拇医药
Delaporte和Blau[6,7]等在培养人骨骼肌细胞时发现,成肌细胞的发育大约有3个阶段,即生长迟滞期约接种后第1~5天;分裂增殖期约第6~14天;肌管形成期约第15天~5周。本实验中小鼠的成肌细胞培养发育时期与人有明显不同,生长迟滞期很短约接种后第1~2天;分裂增殖期约第3~5天;肌管形成期约第6~8天。分裂增殖期成肌细胞在普通光镜下,呈单核双极性大量展开,此期细胞生长最旺盛、增殖能力强,即将进入肌管形成期,说明此期细胞行成肌细胞移植效果较好。在体外原代培养的细胞多呈混合生长,如何去除生长迅速的成纤维细胞进行纯化是培养成功的关键[2]。细胞纯化的方法有多种,等密度沉降分离法是其中的一种,Ficoll-400是一种无毒的密度梯度分离剂,产生的渗透压很小,在全部密度范围保持等张,对细胞无吸附作用,无刺激性[8]。本实验结果显示,采用纯化培养和非纯化培养的成肌细胞经desmin免疫染色计数,Ficoll分离纯化后培养的成肌细胞纯度较高,达97.3%以上,完成达到移植所需水平[1,2]。有研究表明desmin是横纹肌特有的中间丝成分,具有特异性[8]。本实验的desmin免疫染色观察到成肌细胞胞浆中间丝结蛋白呈强阳性反应,并随细胞的成熟而增强,成纤维细胞呈阴性反应。早期成肌细胞的鉴定采用肌动蛋白(actin)检测方法鉴定,因其属于细胞内结构蛋白,广泛存在于横纹肌、平滑肌、心肌细胞,故采用desmin免疫细胞化学染色是鉴别成肌细胞和成纤维细胞更为有效的方法。本实验工作为成肌细胞的基础研究和临床治疗实验提供简便、低耗的体外培养途径。
, 百拇医药
(编辑 关淡庄)
基金项目:国家自然科学基金资助项目(39870804);广东省自然科学基金资助项目(970061);卫生部临床学科重点攻关项目(97040229)
作者简介:王 训(1966-),男,安徽合肥人,博士生,主治医师,讲师.
参考文献:
[1] Law P K. Myoblast transfer: gene therapy for muscular dystrophy [M]. Austin: RG Landes Company, 1994.35~37.
[2] Rando T A, Blau H M. Primary mouse myoblast purification, characterization, and transplantation for cell-mediated gene therapy [J]. J Cell Biol, 1994,125(6):1275.
, http://www.100md.com
[3] Brown R H, Miller J B. Progress, problems, and prospects for gene therapy in muscle [J]. Curr Opin Rheumat, 1996,8(6):539.
[4] 鄂 征.组织培养和分子细胞学技术[M].北京:北京出版社,1995.121~131.
[5] 司徒镇强,吴军正.细胞培养[M].西安:世界图书出版公司,1996.62~72.
[6] Blau H M, Webster C. Isolation and characterization of human muscle cells [J]. Cell Biol, 1981, 78(9):5623.
[7] Delaporte C, Dehaupas M, Fardeau M. Comparison between the growth pattern of cell cultures from normal and Duchenne dystrophy muscle [J]. J Neurol Sci, 1984,64(2):149.
, 百拇医药
[8] Fishchman D A. Monoclonal antibodies to desmin: evidence for stage dependent intermediate filament immunoreactivity during cardiac and skeletal muscle development [J]. Ann NY Acad Sci, 1985,455(2):167.
[9] Allen R E, Temm-Grove C J, Sheehan S M, et al. Skeletal muscle satellite cell cultures [J]. Methods Cell Biol, 1997,52(2):155.
收稿日期:2000-03-16, 百拇医药