低氧缺血海马神经元内Ca2+动态变化的LSCM测定
作者:李峰 姚志彬 谢瑶 陈以慈
单位:中山医科大学 解剖学教研室脑研究室,广东 广州 510089
关键词:胞内Ca2+ ;激光扫描共聚焦显微镜;Fluo-3/AM;缺血
中国医学物理学杂志000114 摘要:测定脑组织细胞内Ca2+浓度是评价缺血引起神经元损伤的重要指标。本研究用激光扫描共聚焦显微镜(LSCM)和Fluo-3/AM荧光探针标记技术,从单个活细胞水平检测缺血刺激诱发的海马神经元内Ca2+瞬间动态变化。结果显示低氧使胞内Ca2+浓度显著升高。谷氨酸引起Ca2+浓度升高缓慢但持续时间长。缺血对Ca2+浓度影响不显著。撤除葡萄糖则引起胞内Ca2+迅速降低。实验结果表明不同缺血刺激因素引起的钙振荡各异。用LSCM对活细胞内部非侵入光学断层扫描,能清晰记录到这些瞬态钙值变化。
, 百拇医药
中图分类号:R741.02 文献标识码:A 文章编号:1005-202X(2000)01-0041-03
Measure the intracellular calcium by laser scanning confocal microscope during hypoxia and ischemia
LI Feng , YAO Zhi-bin , XIE Yao
(Department of anatomy, Sun Yat-sen university of medical science, Guangzhou 510089, China)
Abstract: Calcium participates in many physiological and pathological metablism as a crucial signal and has important roles in ischemic neuronal damage. In the present study, laser scanning confocal microscope (LSCM) was used to measure [Ca2+]i in cultured neurons from hippocampus dyed with Fluo-3/AM. To establish intracellular calcium hippocampal neurons were exposured to hypoxia/ischemia-simulating mediums such as L-glutamate, NaCN, iodoacete, deprivation of glucose. Our data revealed the [Ca2+]i increased rapidly after adding NaCN. L-glutamate produced a persistent elevation of [Ca2+]i . We measured a detectable small elevation of [Ca2+]i after starting superfusion of ischemia-simulating medium. [Ca2+]i levels were lower in ischemia-simulating medium than in the hypoxia-simulating medium. Deprivation of glucose induced a rapid decrease of [Ca2+]i. We conclude that every hypoxia/ischemia-simulating mediums produces a different change of [Ca2+]i .
, 百拇医药
Key words: intracellular free calcium; laser scanning confocal microscopy(LSCM); Fluo-3/AM; ischemia
细胞内游离钙浓度([Ca2+]i)的改变不仅直接影响细胞的正常生理功能,而且作为重要的信使参与多种受体激活后的信号转导过程。近年来它在缺血性神经元损伤机制中的作用尤为引人关注,因此测定脑组织Ca2+浓度是评价缺血引起神经元损伤的重要指标,但如何监测单细胞内Ca2+的动态变化,却一直以来受到方法学的限制,以往的研究较多检测群体细胞的平均Ca2+浓度,而且多为静态观察。激光扫描共聚焦显微镜(Laser Scanning Confocal Microscopy, LSCM)的问世,才使单细胞内Ca2+瞬间时空动态变化的检测成为可能。本研究用LSCM和Fluo-3/AM荧光探针标记技术,从单个活细胞水平检测缺血条件下海马神经元内Ca2+瞬间动态变化,探讨缺血性神经元凋亡过程中Ca2+信号转导的作用。
, http://www.100md.com
1 材料与方法
1.1 海马神经元分散培养方法
用新生S.D大鼠(出生24 h内)去除脑膜和血管,分离海马神经元,加入0.125%胰蛋白酶37℃消化10 min 。吹打离心后,细胞悬液经200目(74 μm)不锈钢网过滤。以2×105/cm2的细胞密度将海马神经元接种于涂有50 μg/ml多聚赖氨酸的Petri培养皿。加入DMEM后,置于5%CO2培养箱,37℃培养7~10 d,用10 μm阿糖胞苷抑制各种胶质细胞的生长。
1.2 Fluo-3/AM负载
海马神经元经DMEM漂洗后,加入终浓度10 μm/L Fluo-3/AM(Molecular Probe公司),室温下避光孵育40 min。漂洗细胞以去除细胞外剩余的Fluo-3/AM。
, 百拇医药
1.3 LSCM测定Ca2+动态变化
将Petri培养皿置入LSCM的测定小室内,在Olympus IMT-2倒置显微镜和20×物镜下选择检测细胞。用488 nm激发波长在静息状态下预扫描3 min,获得基线值1。继续扫描时快速加药(见下述)。加药后继续扫描10~20 min。作出积分荧光值与时间的函数图,绘出加药前后神经元内钙反应曲线,并用伪彩色显示细胞内Ca2+浓度的变化。
1.4 实验分组:各组随机检测50个海马神经元。
(1)谷氨酸组:加入终浓度1 mm Glutamate(Sigma 公司)。
(2)低氧组:加入终浓度100 μm NaCN。
(3)缺血组:加入终浓度100 μm NaCN和3.5 mm Iodoacete Acid (Borhringer公司)。
, 百拇医药
(4)无葡萄糖组:加入200 μl DMEM-(without glucose)培养基(Borhringer公司)。
2 结果
(1) 谷氨酸组:加入Glutamate后,海马神经元荧光值开始下降。当加药至120 sec时,荧光值从1.0降至0.6。随后荧光开始增强,即[Ca2+]i升高,虽升高幅度不显著,但与加药后出现的降幅最低值比较,相距甚大,从0.6升至2,即荧光值增加1倍以上,其后荧光值几乎稳定在这一水平,直至加药20 min时仍未见荧光值下降,提示谷氨酸可引起[Ca2+]i持续升高造成对神经元的长时程损害(图1、2)。
(2)低氧组:加入NaCN后,立即引起海马神经元出现两种钙振荡,一类神经元加药后荧光值迅速上升达4.5倍以上,呈尖峰波型。但经过短暂的160 sec达到峰值后,开始迅速下降,回落到基线,此后再无升高。另一类神经元加药后荧光强度呈波动性缓慢上升,最终达3.5倍以上,并持续20 min未下降,提示NaCN对神经元的效应可表现为瞬间钙超载和持续钙升高,因而造成对神经元的不同损害(图1)。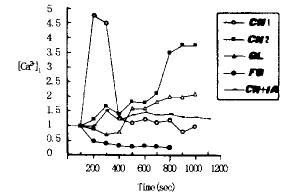
, http://www.100md.com
图1 海马神经元[Ca2+] i 动态变化
CN1:低氧组Ⅰ类神经元。CN2:低氧组Ⅱ类神经元。
GL:谷氨酸组。GF:无葡萄糖组。CN+IA:缺血组。
(3)缺血组:同时加入 NaCN和Iodoacetate后,海马神经元荧光值出现两次小幅上升,其升高幅度不及低氧组,但在第二次升高后,荧光值基本维持不变,最终未回到基线值(图1)。
(4)无葡萄糖组:当加入不含葡萄糖的培养基后,海马神经元显示出独特的钙应答曲线,即荧光强度在基线值小幅波动后迅速出现下降,仅在60 sec内就从基线值1降至0.2,此后胞内钙浓度一直维持在这一水平。提示缺糖供给时神经元不会出现钙超载(图1)。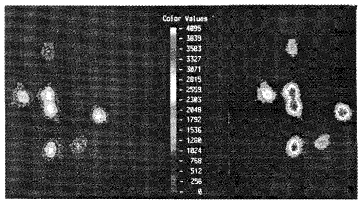
, http://www.100md.com
图2 彩色刻度表示荧光值。左图示加药前荧光值较低。
右图示加入Glutamate后荧光值明显升高。
3 讨论
钙作为重要的细胞内信使,参与多种生理和病理代谢过程,尤其在缺血性神经元损伤的机制中可能起着重要的作用。因此细胞内钙反应曲线的测量和量化一直以来受到科学家的高度重视。然而,由于正常静息细胞内[Ca2+]i低于结合钙20,000倍,如此微量的游离钙不仅使测量十分困难,而且细胞内[Ca2+]i变化过程仅在400毫秒内完成,这种瞬态变化是常规扫描系统不可能观察到的。为了测量细胞内Ca2+变化,多年来先后研制出各种钙指示剂。Indo-1和Fura-2是双激发双发射探针[1,2],它使Ca2+的定量不受染料浓度、细胞大小、照射光强度以及一定程度的光漂白和染料泄漏等因素影响,但由于它需紫外光激发,可造成对细胞的损害和增加潜在自发荧光。Roger Tsien研制的Fluo-3是新的钙敏感探针,具有可见光激发的优点。Fluo-3以细胞渗透酯的形式很容易进入细胞,随后被细胞内的酯酶分离成为对膜不通透的酸。在游离酸状态,Fluo-3的荧光值很低,而与Ca2+结合后荧光增强40倍,可以测定5~10 μmol的Ca2+浓度变化,而且尤其适合测定外源性刺激物诱发的细胞内Ca2+的快速反应。
, http://www.100md.com
普通光学成像时,焦点外的光可导致图像对比度和分辨率降低,但共聚焦成像时,由于限制了光的衍射,减少了焦点以外的光,使图像的分辨率更高。LSCM的优点还在于可以在单个活细胞水平观察细胞内瞬间钙振荡和钙波。通常情况下,细胞负载荧光探针后存在外泄的问题,因而影响细胞内[Ca2+]i的测定,但LSCM可直接观察探针的外泄情况,因而保证了[Ca2+]i测定的准确性。
本实验用LSCM检测海马神经元经几种缺血刺激因素诱发的胞内瞬间Ca2+变化。目的在于阐明缺血性神经元损伤机制中Ca2+参与的作用。一般认为神经元内Ca2+升高通过不同的机制:电压门控钙通道;兴奋性神经递质与其受体结合途径;细胞去极化引起Ca2+/Na+交换以及低氧应激引起胞内钙库释放Ca2+[3,4]。本研究结果显示低氧使胞内Ca2+浓度迅速升高,呈尖峰波型(Spikes),且升幅最大,这可能是因为CN抑制了能量代谢,使线粒体等钙库摄取Ca2+的功能破坏,导致胞内Ca2+释放。因为有研究表明缺血引起的钙库Ca2+释放占总[Ca2+] i的大部分,且胞内Ca2+释放是形成钙振荡的主要机制之一[5]。有研究表明缺血比低氧对[Ca2+] i的影响更大[6,7],但本实验在缺血组并未见到因使用CN+IA两种药物而出现Ca2+升高的叠加,相反,Ca2+升高现象被部分抑制。分析原因可能是同时使用两种药物造成对神经元的毒性作用,以致神经元对刺激应答反应降低,因为在检测[Ca2+]i的过程中常见加药后细胞立即脱壁死亡的现象,这在其它实验组是未出现的。谷氨酸组也未出现理论上所谓的“受体爆发性占领”导致的严重Ca2+超载[8],而是以[Ca2+]i小幅持续上升为特点,这可能与谷氨酸引起迟发性神经元死亡有关。一般认为谷氨酸作用几分钟后出现树突胞体毒,这种急性毒性作用是过量的Na+、Cl-和H2O进入胞内引起;而慢性毒性作用是由Ca2+引起的。但加入谷氨酸后立即出现的[Ca2+]i短时下降是何原因,目前尚不清楚。由于在其它组未见这一现象,因此可以认为这是谷氨酸诱导胞浆Ca2+浓度的特征性变化。缺葡萄糖组胞内Ca2+浓度的变化与各组不同,加药后[Ca2+]i 瞬间急剧下降,此后再无升高。虽然目前尚不清楚是何原因,但可以肯定缺血时葡萄糖供给中断不会造成因Ca2+升高引起的神经元损害[9,10]。
, http://www.100md.com
基金项目:国家自然科学基金资助项目(编号:39470266)
作者简介:李峰(1955年出生),女(汉族),籍贯(河北省河间县),博士,副教授,硕士生导师,研究方向:分子神经病理学。
参考文献:
[1]Roe M. W. , et al. Assessment of fura-2 for measurements of cytosolic free calcium[J]. Cell calcium.1990, 11: 63.
[2]Sick T. J. , et al. Indo-1 measurements of intracellular free calcium in the hippocampal slice: complications of labile NADH fluorecence[J]. Neurosci. Methods. 1989, 28: 125 .
, 百拇医药
[3]Mitani A. ,et al. Changes in intracellular Ca2+ and energy levels during in vivo ischemia in the gerbil hippocampal slice[J]. J. Neurochem . 1994, 62: 626.
[4]Dubinsky T. M. , et al. Intracellular calcium concentration during chemical hypoxia and excitatoxic neuronal injury[J]. J. Neurosci. 1991, 11: 2545.
[5]Loebner D. , et al. Intracellular calcium levels and calcium fluxes in the CA1 region of the rat hippocampal slice during in vitro ischemia: relationship to electrophysilogical cell damage[J]. J. Neurosci. 1993, 13: 4861.
, http://www.100md.com
[6]Siesjo, B. K. , et al. Calcium fluxes, calcium antagonists and calcium-related pathology in brain ischemia, hypoglycemia and spreading depression: a unifying hypothesis[J]. J. Cereb Blood Flow Metab. 1998, 9: 127.
[7]Philip E. , et al. Causes of calcium accumulation in rat cortical brain slices during hypoxia and ischemia :role of ion channels and mambrane damage[J]. Brain Research. 1994, 665: 269.
[8]Giffard G. , et al. Acidosis reduces NMDA receptor activation, glutamate neurotoxicity and oxygen-glucose deprivation neuronal injury in cortical culture[J]. Brain Res. 1990, 506: 339.
, 百拇医药
[9]Honda T. , et al. Prior mechanical injury inhibits rise in intracellular Ca2+ concentration by oxygen-glucose deprivation in mouse hippocampal slices[J]. Brain Res. 1994, 666: 263.
[10]Ebine Y. , et al. Mild acidosis inhibits the rise in intracellular Ca2+ concentration in response to oxygyn-glucose deprivation in rat hippocampal slices[J]. Neurosci Lett. 1994, 168: 155.
收稿日期:1999-06-24, 百拇医药
单位:中山医科大学 解剖学教研室脑研究室,广东 广州 510089
关键词:胞内Ca2+ ;激光扫描共聚焦显微镜;Fluo-3/AM;缺血
中国医学物理学杂志000114 摘要:测定脑组织细胞内Ca2+浓度是评价缺血引起神经元损伤的重要指标。本研究用激光扫描共聚焦显微镜(LSCM)和Fluo-3/AM荧光探针标记技术,从单个活细胞水平检测缺血刺激诱发的海马神经元内Ca2+瞬间动态变化。结果显示低氧使胞内Ca2+浓度显著升高。谷氨酸引起Ca2+浓度升高缓慢但持续时间长。缺血对Ca2+浓度影响不显著。撤除葡萄糖则引起胞内Ca2+迅速降低。实验结果表明不同缺血刺激因素引起的钙振荡各异。用LSCM对活细胞内部非侵入光学断层扫描,能清晰记录到这些瞬态钙值变化。
, 百拇医药
中图分类号:R741.02 文献标识码:A 文章编号:1005-202X(2000)01-0041-03
Measure the intracellular calcium by laser scanning confocal microscope during hypoxia and ischemia
LI Feng , YAO Zhi-bin , XIE Yao
(Department of anatomy, Sun Yat-sen university of medical science, Guangzhou 510089, China)
Abstract: Calcium participates in many physiological and pathological metablism as a crucial signal and has important roles in ischemic neuronal damage. In the present study, laser scanning confocal microscope (LSCM) was used to measure [Ca2+]i in cultured neurons from hippocampus dyed with Fluo-3/AM. To establish intracellular calcium hippocampal neurons were exposured to hypoxia/ischemia-simulating mediums such as L-glutamate, NaCN, iodoacete, deprivation of glucose. Our data revealed the [Ca2+]i increased rapidly after adding NaCN. L-glutamate produced a persistent elevation of [Ca2+]i . We measured a detectable small elevation of [Ca2+]i after starting superfusion of ischemia-simulating medium. [Ca2+]i levels were lower in ischemia-simulating medium than in the hypoxia-simulating medium. Deprivation of glucose induced a rapid decrease of [Ca2+]i. We conclude that every hypoxia/ischemia-simulating mediums produces a different change of [Ca2+]i .
, 百拇医药
Key words: intracellular free calcium; laser scanning confocal microscopy(LSCM); Fluo-3/AM; ischemia
细胞内游离钙浓度([Ca2+]i)的改变不仅直接影响细胞的正常生理功能,而且作为重要的信使参与多种受体激活后的信号转导过程。近年来它在缺血性神经元损伤机制中的作用尤为引人关注,因此测定脑组织Ca2+浓度是评价缺血引起神经元损伤的重要指标,但如何监测单细胞内Ca2+的动态变化,却一直以来受到方法学的限制,以往的研究较多检测群体细胞的平均Ca2+浓度,而且多为静态观察。激光扫描共聚焦显微镜(Laser Scanning Confocal Microscopy, LSCM)的问世,才使单细胞内Ca2+瞬间时空动态变化的检测成为可能。本研究用LSCM和Fluo-3/AM荧光探针标记技术,从单个活细胞水平检测缺血条件下海马神经元内Ca2+瞬间动态变化,探讨缺血性神经元凋亡过程中Ca2+信号转导的作用。
, http://www.100md.com
1 材料与方法
1.1 海马神经元分散培养方法
用新生S.D大鼠(出生24 h内)去除脑膜和血管,分离海马神经元,加入0.125%胰蛋白酶37℃消化10 min 。吹打离心后,细胞悬液经200目(74 μm)不锈钢网过滤。以2×105/cm2的细胞密度将海马神经元接种于涂有50 μg/ml多聚赖氨酸的Petri培养皿。加入DMEM后,置于5%CO2培养箱,37℃培养7~10 d,用10 μm阿糖胞苷抑制各种胶质细胞的生长。
1.2 Fluo-3/AM负载
海马神经元经DMEM漂洗后,加入终浓度10 μm/L Fluo-3/AM(Molecular Probe公司),室温下避光孵育40 min。漂洗细胞以去除细胞外剩余的Fluo-3/AM。
, 百拇医药
1.3 LSCM测定Ca2+动态变化
将Petri培养皿置入LSCM的测定小室内,在Olympus IMT-2倒置显微镜和20×物镜下选择检测细胞。用488 nm激发波长在静息状态下预扫描3 min,获得基线值1。继续扫描时快速加药(见下述)。加药后继续扫描10~20 min。作出积分荧光值与时间的函数图,绘出加药前后神经元内钙反应曲线,并用伪彩色显示细胞内Ca2+浓度的变化。
1.4 实验分组:各组随机检测50个海马神经元。
(1)谷氨酸组:加入终浓度1 mm Glutamate(Sigma 公司)。
(2)低氧组:加入终浓度100 μm NaCN。
(3)缺血组:加入终浓度100 μm NaCN和3.5 mm Iodoacete Acid (Borhringer公司)。
, 百拇医药
(4)无葡萄糖组:加入200 μl DMEM-(without glucose)培养基(Borhringer公司)。
2 结果
(1) 谷氨酸组:加入Glutamate后,海马神经元荧光值开始下降。当加药至120 sec时,荧光值从1.0降至0.6。随后荧光开始增强,即[Ca2+]i升高,虽升高幅度不显著,但与加药后出现的降幅最低值比较,相距甚大,从0.6升至2,即荧光值增加1倍以上,其后荧光值几乎稳定在这一水平,直至加药20 min时仍未见荧光值下降,提示谷氨酸可引起[Ca2+]i持续升高造成对神经元的长时程损害(图1、2)。
(2)低氧组:加入NaCN后,立即引起海马神经元出现两种钙振荡,一类神经元加药后荧光值迅速上升达4.5倍以上,呈尖峰波型。但经过短暂的160 sec达到峰值后,开始迅速下降,回落到基线,此后再无升高。另一类神经元加药后荧光强度呈波动性缓慢上升,最终达3.5倍以上,并持续20 min未下降,提示NaCN对神经元的效应可表现为瞬间钙超载和持续钙升高,因而造成对神经元的不同损害(图1)。

, http://www.100md.com
图1 海马神经元[Ca2+] i 动态变化
CN1:低氧组Ⅰ类神经元。CN2:低氧组Ⅱ类神经元。
GL:谷氨酸组。GF:无葡萄糖组。CN+IA:缺血组。
(3)缺血组:同时加入 NaCN和Iodoacetate后,海马神经元荧光值出现两次小幅上升,其升高幅度不及低氧组,但在第二次升高后,荧光值基本维持不变,最终未回到基线值(图1)。
(4)无葡萄糖组:当加入不含葡萄糖的培养基后,海马神经元显示出独特的钙应答曲线,即荧光强度在基线值小幅波动后迅速出现下降,仅在60 sec内就从基线值1降至0.2,此后胞内钙浓度一直维持在这一水平。提示缺糖供给时神经元不会出现钙超载(图1)。

, http://www.100md.com
图2 彩色刻度表示荧光值。左图示加药前荧光值较低。
右图示加入Glutamate后荧光值明显升高。
3 讨论
钙作为重要的细胞内信使,参与多种生理和病理代谢过程,尤其在缺血性神经元损伤的机制中可能起着重要的作用。因此细胞内钙反应曲线的测量和量化一直以来受到科学家的高度重视。然而,由于正常静息细胞内[Ca2+]i低于结合钙20,000倍,如此微量的游离钙不仅使测量十分困难,而且细胞内[Ca2+]i变化过程仅在400毫秒内完成,这种瞬态变化是常规扫描系统不可能观察到的。为了测量细胞内Ca2+变化,多年来先后研制出各种钙指示剂。Indo-1和Fura-2是双激发双发射探针[1,2],它使Ca2+的定量不受染料浓度、细胞大小、照射光强度以及一定程度的光漂白和染料泄漏等因素影响,但由于它需紫外光激发,可造成对细胞的损害和增加潜在自发荧光。Roger Tsien研制的Fluo-3是新的钙敏感探针,具有可见光激发的优点。Fluo-3以细胞渗透酯的形式很容易进入细胞,随后被细胞内的酯酶分离成为对膜不通透的酸。在游离酸状态,Fluo-3的荧光值很低,而与Ca2+结合后荧光增强40倍,可以测定5~10 μmol的Ca2+浓度变化,而且尤其适合测定外源性刺激物诱发的细胞内Ca2+的快速反应。
, http://www.100md.com
普通光学成像时,焦点外的光可导致图像对比度和分辨率降低,但共聚焦成像时,由于限制了光的衍射,减少了焦点以外的光,使图像的分辨率更高。LSCM的优点还在于可以在单个活细胞水平观察细胞内瞬间钙振荡和钙波。通常情况下,细胞负载荧光探针后存在外泄的问题,因而影响细胞内[Ca2+]i的测定,但LSCM可直接观察探针的外泄情况,因而保证了[Ca2+]i测定的准确性。
本实验用LSCM检测海马神经元经几种缺血刺激因素诱发的胞内瞬间Ca2+变化。目的在于阐明缺血性神经元损伤机制中Ca2+参与的作用。一般认为神经元内Ca2+升高通过不同的机制:电压门控钙通道;兴奋性神经递质与其受体结合途径;细胞去极化引起Ca2+/Na+交换以及低氧应激引起胞内钙库释放Ca2+[3,4]。本研究结果显示低氧使胞内Ca2+浓度迅速升高,呈尖峰波型(Spikes),且升幅最大,这可能是因为CN抑制了能量代谢,使线粒体等钙库摄取Ca2+的功能破坏,导致胞内Ca2+释放。因为有研究表明缺血引起的钙库Ca2+释放占总[Ca2+] i的大部分,且胞内Ca2+释放是形成钙振荡的主要机制之一[5]。有研究表明缺血比低氧对[Ca2+] i的影响更大[6,7],但本实验在缺血组并未见到因使用CN+IA两种药物而出现Ca2+升高的叠加,相反,Ca2+升高现象被部分抑制。分析原因可能是同时使用两种药物造成对神经元的毒性作用,以致神经元对刺激应答反应降低,因为在检测[Ca2+]i的过程中常见加药后细胞立即脱壁死亡的现象,这在其它实验组是未出现的。谷氨酸组也未出现理论上所谓的“受体爆发性占领”导致的严重Ca2+超载[8],而是以[Ca2+]i小幅持续上升为特点,这可能与谷氨酸引起迟发性神经元死亡有关。一般认为谷氨酸作用几分钟后出现树突胞体毒,这种急性毒性作用是过量的Na+、Cl-和H2O进入胞内引起;而慢性毒性作用是由Ca2+引起的。但加入谷氨酸后立即出现的[Ca2+]i短时下降是何原因,目前尚不清楚。由于在其它组未见这一现象,因此可以认为这是谷氨酸诱导胞浆Ca2+浓度的特征性变化。缺葡萄糖组胞内Ca2+浓度的变化与各组不同,加药后[Ca2+]i 瞬间急剧下降,此后再无升高。虽然目前尚不清楚是何原因,但可以肯定缺血时葡萄糖供给中断不会造成因Ca2+升高引起的神经元损害[9,10]。
, http://www.100md.com
基金项目:国家自然科学基金资助项目(编号:39470266)
作者简介:李峰(1955年出生),女(汉族),籍贯(河北省河间县),博士,副教授,硕士生导师,研究方向:分子神经病理学。
参考文献:
[1]Roe M. W. , et al. Assessment of fura-2 for measurements of cytosolic free calcium[J]. Cell calcium.1990, 11: 63.
[2]Sick T. J. , et al. Indo-1 measurements of intracellular free calcium in the hippocampal slice: complications of labile NADH fluorecence[J]. Neurosci. Methods. 1989, 28: 125 .
, 百拇医药
[3]Mitani A. ,et al. Changes in intracellular Ca2+ and energy levels during in vivo ischemia in the gerbil hippocampal slice[J]. J. Neurochem . 1994, 62: 626.
[4]Dubinsky T. M. , et al. Intracellular calcium concentration during chemical hypoxia and excitatoxic neuronal injury[J]. J. Neurosci. 1991, 11: 2545.
[5]Loebner D. , et al. Intracellular calcium levels and calcium fluxes in the CA1 region of the rat hippocampal slice during in vitro ischemia: relationship to electrophysilogical cell damage[J]. J. Neurosci. 1993, 13: 4861.
, http://www.100md.com
[6]Siesjo, B. K. , et al. Calcium fluxes, calcium antagonists and calcium-related pathology in brain ischemia, hypoglycemia and spreading depression: a unifying hypothesis[J]. J. Cereb Blood Flow Metab. 1998, 9: 127.
[7]Philip E. , et al. Causes of calcium accumulation in rat cortical brain slices during hypoxia and ischemia :role of ion channels and mambrane damage[J]. Brain Research. 1994, 665: 269.
[8]Giffard G. , et al. Acidosis reduces NMDA receptor activation, glutamate neurotoxicity and oxygen-glucose deprivation neuronal injury in cortical culture[J]. Brain Res. 1990, 506: 339.
, 百拇医药
[9]Honda T. , et al. Prior mechanical injury inhibits rise in intracellular Ca2+ concentration by oxygen-glucose deprivation in mouse hippocampal slices[J]. Brain Res. 1994, 666: 263.
[10]Ebine Y. , et al. Mild acidosis inhibits the rise in intracellular Ca2+ concentration in response to oxygyn-glucose deprivation in rat hippocampal slices[J]. Neurosci Lett. 1994, 168: 155.
收稿日期:1999-06-24, 百拇医药