一种检测巨噬细胞内NADPH氧化酶活性的新方法
作者:马晓冬 黄行许 朱晓亮 鲍永耀 朴英杰
单位:马晓冬(第一军医大学 中心实验室 广东 广州 510515);黄行许(第一军医大学 中心实验室 广东 广州 510515);朱晓亮(第一军医大学 南方医院皮肤科, 广东 广州 510515);鲍永耀(第一军医大学 中心实验室 广东 广州 510515);朴英杰(第一军医大学 中心实验室 广东 广州 510515)
关键词:激光扫描共聚焦显微镜;HE;NADPH氧化酶;巨噬细胞
第一军医大学学报000226 摘要:目的 建立一种检测活细胞内NADPH氧化酶活性的新方法。方法 用超氧离子物荧光探针HE标记巨噬细胞后,在激光扫描共聚焦显微镜下,用最适发射波长为530nm的检测器1检测巨噬细胞内HE的荧光强度变化。结果 检测器1可检测单个和多个巨噬细胞内HE的荧光强度变化,PMA刺激后巨噬细胞内HE荧光强度增强,NADPH氧化酶活性升高;地塞米松使巨噬细胞内HE荧光强度减弱,NADPH氧化酶活性降低;经地塞米松处理0.5 h,PMA刺激引起的巨噬细胞内HE荧光强度增强幅度减小,NADPH氧化酶活性变化减小。结论 激光扫描共聚焦显微术结合荧光标记技术可原位实时观察活细胞内NADPH氧化酶活性的变化。
, http://www.100md.com
中图分类号:R329.3 文献标识码:B
文章编号:1000-2588 (2000)-02-0161-02
A new way for detection of NADPH oxidase activity in the macrophagesMA Xiao-dong,HUANG Xing-xu,BAO Yong-yao,PIAO Ying-jie
(Central Laboratory, First Military Medical University, Guangzhou 510515, China)
ZHU Xiao-liang
(Department of Dermatology, Nanfang Hospital2, First Military Medical University, Guangzhou 510515, China)Abstract: Objective To establish a new method for detecting NADP oxidase activity in the macrophages. Methods The superoxide-sensitive fluorescence probe HE was used to mark the macrophages, and the alteration of the fluorescence density was observed with detector 1 (optimal emission wavelength 530 nm) of the laser scanning confocal microscope (ACAS570). Results Superoxide generated by NADPH oxidase can oxidize HE into fluorescent product ethidium bromide, and the alterations in the fluorescence density of HE denoting the changes in NADPH oxidase activity of the macrophages can be monitored by detector 1. PMA increased the HE fluorescence of the macrophages, indicating that the NADPH oxidase activity was enhanced; dexamethasone reduced the HE fluorescence, indicating NADPH oxidase activity was decreased. Pretreated with dexamethasone for 0.5 h, the magnitude of the increase in HE fluorescence induced by PMA was lowered, indicating the degree of the enhancement of NADPH oxidase activity lowered also. Conclusion By using laser scanning confocal microscope and superoxide sensitive fluorescence probe HE, the kinetic variations in NADPH oxidase activity of the attached macrophages could be observed originally and continuously in single cell or multiple cells.
, http://www.100md.com
Key words: laser scanning confocal microscope; HE; NADPH oxidase; macrophage
呼吸爆发是吞噬细胞杀灭和吞噬微生物的重要途径,反映吞噬细胞的功能 [1]。烟酰胺腺嘌呤二核苷酸磷酸盐(Nicotinomide adenine dinucleotide phosphate,NADPH)氧化酶是吞噬细胞发生呼吸爆发、生成活性氧(Reactive oxygen species, ROS)的功能酶[2]。为了解细胞内呼吸爆发的情况,有必要检测细胞内NADPH氧化酶活性。NADPH氧化酶可用酶化学法检测,但酶化学法存在反应条件严格、样品处理复杂、反应结果不好定量等缺点[3]。
细胞发生呼吸爆发时,NADPH氧化酶直接催化氧分子生成超氧离子,超氧离子自发或经超氧歧化酶(SOD)作用生成过氧化物和超氧化物等ROS[4]。超氧离子可氧化不发荧光的溴化乙啶(Ethidium bromide,EB)的衍生物HE(hydroethidine),生成发红色荧光的EB。Rothe等[5]用流式细胞仪检测了细胞内NADPH氧化酶的活性。近年来,激光扫描共聚焦显微镜技术和荧光探针的开发利用[6],为开发新的NADPH氧化酶检测方法创造了条件。本实验使用激光扫描共聚焦显微镜检测细胞内EB的荧光强度,借以分析NADPH氧化酶活性变化。
, http://www.100md.com
1 材料和方法
1.1 实验材料
巯基乙醇酸钠(thioglycolate)、HEPES(N-[2-hydroxyethyl] piperazine-N’-[2-ethanesulfonic acid])、地塞米松(dexamethasone)、佛波脂(Phorbol 12-myristate 13-acetate,PMA)均购自美国Sigma公司。HE(hydroethidine)购自美国Molecular Probes公司。RPMI-1640购自德国GIBCO BRL公司。小牛血清购自杭州四季青生物材料厂。其它试剂均为国产分析纯。
1.2 实验方法
1.2.1 细胞培养 18~20 g雌性昆明小鼠,按1次/d、1 ml/次的剂量连续3 d腹腔注射1%巯基乙醇酸钠,停1 d,按鄂征等[7]的方法取腹腔巨噬细胞(台酚兰吞噬实验显示99%为巨噬细胞)以5×105 个/cm2的浓度改装35 mm Petri皿 (Meridian,美国),在含10%小牛血清的RPMI-1640于37℃、5% CO2孵箱(Quene System,美国)内培养12 h。
, 百拇医药
1.2.2 染液配制 将HE溶于二甲亚砜(DMSO), 配成1×10-3 mol/L储备液,分装冻存于- 80~- 20oC 条件下。染色前用HEPES缓冲盐溶液配成5×10-6 mol/L工作液。
1.2.3 荧光探针标记 吸除培养皿内的培养液,用HEPES缓冲盐溶液 (含145×10-3 mol/L NaCl,5×10-3 mol/L KCl,1×10-3 mol/L CaCl2 ,0.5×10-3 mol/L MgSO4,5×10-3 mol/L 葡萄糖,1.0×10-2 mol/L HEPES;pH7.4)洗5次,在培养皿中滴入5×10-6 mol/L HE液0.3 ml,37℃孵育30 min后更换HEPES缓冲液。
, 百拇医药
1.2.4 共焦镜检测 将培养皿置于ACAS570激光扫描共聚焦显微镜(Meridian,美国)载物台上,选用40倍物镜,7%滤光片,确定激发光波长为488 nm,进入Kinetics-Image Scan程序,建立文件,打开检测器1(最适发射波长530 nm),作预扫描后选定最佳扫描参数,对准选定视野扫描并存储所获信息。主要扫描参数如下:Pinhole:1600 m m,PMT1:70%,Step Size:0.5 m m,Stage Speed:4.0 mm/s,Scanning Strength:20%,Laser Power:20 mW,Sample/Pt:32。
1.2.5 分析 进入Kinetics-Image Analysis程序,调入分析文件的存储信息,经处理后在Time Plot下得出反映细胞内NADPH氧化酶活性变化的EB荧光强度时间变化曲线并作归一化处理。
2 结果和讨论
, 百拇医药
通过使用荧光探针HE和激光扫描共聚焦显微镜,检测了巨噬细胞内的超氧化物水平,从而反映巨噬细胞内NADPH氧化酶活性。图1~3为检测器1检测到的巨噬细胞内EB荧光强度变化曲线图。PMA通过PKC途径激活NADPH氧化酶从而增强细胞的呼吸爆发作用[8]。图1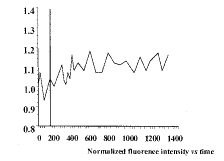
图1 PMA(1×10-8 mol/L)处理后,巨噬细胞内HE荧光强度变化曲线 标记线示PMA加入时间。
Fig.1 Fluorescence variation curve for HE in macrophages treated with PMA (1×10-8 mol/L) The marker indicated the time when the PMA was added.
, http://www.100md.com
显示,加入PMA(终浓度为1×10-8 mol/L)后,巨噬细胞内的荧光强度逐渐增强,在500 s内增强了30%左右,表明PMA使巨噬细胞内NADPH氧化酶活性在500 s内逐渐增强了30%左右,这一结果肯定了PMA通过激活NADPH氧化酶使巨噬细胞呼吸爆发作用增强的结论。
地塞米松使巨噬细胞呼吸爆发作用减弱[9、10],但其作用方式还不清楚。检测发现,地塞米松(终浓度为1´ 10-4 mol/L)处理后,巨噬细胞内EB荧光强度急速降低17%(图2),表明地塞米松使巨噬细胞内NADPH氧化酶活性急剧降低,并因此减弱巨噬细胞呼吸爆发作用。进一步检测发现,地塞米松处理0.5 h后,PMA仍使巨噬细胞内的EB荧光强度增高,但增高速度明显减小(图3),表明地塞米松不仅直接影响NADPH氧化酶活性,同时也降低细胞对PMA的反应性。
, 百拇医药
图2 地塞米松(1´ 10-4 mol/L)处理后,巨噬细胞内HE荧光强度变化曲线 标记线示地塞米松加入时间。
Fig.2 Fluorescence variation curve for HE in macrophages treated with dexamethasone (1´ 10-4 mol/L) The marker indicated the time when the dexamethasone was added.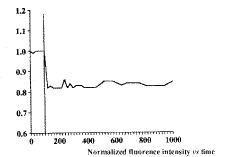
图3 地塞米松(1×10-4 mol/L)处理后,PMA(1×10-8 mol/L)仍使巨噬细胞内HE荧光强度发生改变 标记线示PMA加入时间。
, http://www.100md.com Fig.3 Fluorescence variation curve for HE in macrophages pretreated with dexamethasone (1×10-4 mol/L) prior to the stimulation with PMA (1×10-8 mol/L) The marker indicated the time when the PMA was added.
结果表明,利用荧光探针HE和激光扫描共聚焦显微镜检测细胞内NADPH氧化酶活性变化具备以下优点: (1)实验过程快速。本方法仅需作30 min荧光探针标记、上机检测、测试结果分析处理和打印,实验过程比酶化学法快速得多;(2)样品处理简便,酶化学法样品处理过程复杂,反应条件严格,采取本法仅需在经荧光染料负染的改装35 mm Petri培养皿上选定一个视野后即可检测。由于样品处理简便,细胞所受影响小,经检测后的细胞可继续培养,并用作进一步观察;(3)实验结果准确。由于样品处理简便,细胞所受影响小,对实验结果影响小,保证了实验结果的准确性;(4)可得到清晰全面的数据。首先,共焦镜法不仅可象生化法和流式细胞仪一样得出样品的总体结果,而且可显示各个细胞的荧光强度变化,将检测提高到了单个细胞水平;其次,通常我们只能选择适当的时间点对样品作检测,共焦镜法则可实现对活细胞的荧光强度变化作连续追踪,实行原位实时动态观察,还可准确反映细胞在加样瞬间的变化。尤为突出的是,本方法是在活细胞内进行NADPH氧化酶活性检测,真实的反映了活细胞的功能状态。
, http://www.100md.com
本实验结果也提示我们开发检测细胞内其它酶活性变化方法的可能性,不过,由于共焦镜是近年来开发出的大型贵重仪器,短期内共焦镜还不可能普及,限制了本方法的应用。但快速、简便、准确,并实现了单个活细胞水平的观察这一系列优点,显示了本方法广泛的应用前景。
作者简介:马晓冬(1975-),男,河南安阳人,1997年毕业于第一军医大学,本科,助理实验师,电话:85189037
参考文献
1,Malech HL, Gallin JI. Current concepts: Immunology. Neutrophils in human diseases[J]. N Engl J Med, 1987, 317: 687~92.
2,Cross AR, Jones OTG. Enzymatic mechanisms of superoxide production[J]. Biochem Biophys Acta, 1991, 1057:281~3.
, 百拇医药
3,小川和郎, 中根一穗主编, 朴英杰主译. 组织细胞化学技术: 细胞膜[M]. 广州: 中山大学出版社, 1991. 125~6.
4,Rothe G, Valet G. Measurement of NADPH oxidase activity with hydroethidine. In: Handbook of flow cytometry methods [M]. Robinson JP, editor. Wiley-Liss, Inc, 1993. 159~64.
5,Shingu M, Todoroki T, Nobunaga M. Generation of superoxide by immunologically stimulated normal human neutrophils and possible modulation by intracellular and extracellular SOD and rheumatoid factors [J]. Inflammation, 1987, 11:143~58.
, http://www.100md.com
6,Davin MS. Confocal scanning optical microscope and its applications for biological specimens[J]. J Cell Science, 1989, 94(2):175~9.
7,鄂 征主编. 组织培养技术[M]. 北京:人民卫生出版社,1993. 185~97.
8,Narayanan PK, Ragheb K, Lawler G et al. Defects in intracellular oxidative metabolism of neutrophils undergoing apoptosis[J]. J Leukoc Biol, 1997, 61:481~3.
9,Pogrebbniak HW, Matthews W, Pass HI. Alterations in macrophage free radical and tumor necrosis factor production by a potassium channel activator [J]. J Surg Res, 1992, 52:395~8.
10,王广庆, 胡复荪, 安长荣, 李彩云, 谢立威. 地塞米松抑制巨噬细胞产生氧自由基和一氧化氮[J].中国药理学通报, 1995, 11:406~10.
收稿日期:1999-03-03, http://www.100md.com
单位:马晓冬(第一军医大学 中心实验室 广东 广州 510515);黄行许(第一军医大学 中心实验室 广东 广州 510515);朱晓亮(第一军医大学 南方医院皮肤科, 广东 广州 510515);鲍永耀(第一军医大学 中心实验室 广东 广州 510515);朴英杰(第一军医大学 中心实验室 广东 广州 510515)
关键词:激光扫描共聚焦显微镜;HE;NADPH氧化酶;巨噬细胞
第一军医大学学报000226 摘要:目的 建立一种检测活细胞内NADPH氧化酶活性的新方法。方法 用超氧离子物荧光探针HE标记巨噬细胞后,在激光扫描共聚焦显微镜下,用最适发射波长为530nm的检测器1检测巨噬细胞内HE的荧光强度变化。结果 检测器1可检测单个和多个巨噬细胞内HE的荧光强度变化,PMA刺激后巨噬细胞内HE荧光强度增强,NADPH氧化酶活性升高;地塞米松使巨噬细胞内HE荧光强度减弱,NADPH氧化酶活性降低;经地塞米松处理0.5 h,PMA刺激引起的巨噬细胞内HE荧光强度增强幅度减小,NADPH氧化酶活性变化减小。结论 激光扫描共聚焦显微术结合荧光标记技术可原位实时观察活细胞内NADPH氧化酶活性的变化。
, http://www.100md.com
中图分类号:R329.3 文献标识码:B
文章编号:1000-2588 (2000)-02-0161-02
A new way for detection of NADPH oxidase activity in the macrophagesMA Xiao-dong,HUANG Xing-xu,BAO Yong-yao,PIAO Ying-jie
(Central Laboratory, First Military Medical University, Guangzhou 510515, China)
ZHU Xiao-liang
(Department of Dermatology, Nanfang Hospital2, First Military Medical University, Guangzhou 510515, China)Abstract: Objective To establish a new method for detecting NADP oxidase activity in the macrophages. Methods The superoxide-sensitive fluorescence probe HE was used to mark the macrophages, and the alteration of the fluorescence density was observed with detector 1 (optimal emission wavelength 530 nm) of the laser scanning confocal microscope (ACAS570). Results Superoxide generated by NADPH oxidase can oxidize HE into fluorescent product ethidium bromide, and the alterations in the fluorescence density of HE denoting the changes in NADPH oxidase activity of the macrophages can be monitored by detector 1. PMA increased the HE fluorescence of the macrophages, indicating that the NADPH oxidase activity was enhanced; dexamethasone reduced the HE fluorescence, indicating NADPH oxidase activity was decreased. Pretreated with dexamethasone for 0.5 h, the magnitude of the increase in HE fluorescence induced by PMA was lowered, indicating the degree of the enhancement of NADPH oxidase activity lowered also. Conclusion By using laser scanning confocal microscope and superoxide sensitive fluorescence probe HE, the kinetic variations in NADPH oxidase activity of the attached macrophages could be observed originally and continuously in single cell or multiple cells.
, http://www.100md.com
Key words: laser scanning confocal microscope; HE; NADPH oxidase; macrophage
呼吸爆发是吞噬细胞杀灭和吞噬微生物的重要途径,反映吞噬细胞的功能 [1]。烟酰胺腺嘌呤二核苷酸磷酸盐(Nicotinomide adenine dinucleotide phosphate,NADPH)氧化酶是吞噬细胞发生呼吸爆发、生成活性氧(Reactive oxygen species, ROS)的功能酶[2]。为了解细胞内呼吸爆发的情况,有必要检测细胞内NADPH氧化酶活性。NADPH氧化酶可用酶化学法检测,但酶化学法存在反应条件严格、样品处理复杂、反应结果不好定量等缺点[3]。
细胞发生呼吸爆发时,NADPH氧化酶直接催化氧分子生成超氧离子,超氧离子自发或经超氧歧化酶(SOD)作用生成过氧化物和超氧化物等ROS[4]。超氧离子可氧化不发荧光的溴化乙啶(Ethidium bromide,EB)的衍生物HE(hydroethidine),生成发红色荧光的EB。Rothe等[5]用流式细胞仪检测了细胞内NADPH氧化酶的活性。近年来,激光扫描共聚焦显微镜技术和荧光探针的开发利用[6],为开发新的NADPH氧化酶检测方法创造了条件。本实验使用激光扫描共聚焦显微镜检测细胞内EB的荧光强度,借以分析NADPH氧化酶活性变化。
, http://www.100md.com
1 材料和方法
1.1 实验材料
巯基乙醇酸钠(thioglycolate)、HEPES(N-[2-hydroxyethyl] piperazine-N’-[2-ethanesulfonic acid])、地塞米松(dexamethasone)、佛波脂(Phorbol 12-myristate 13-acetate,PMA)均购自美国Sigma公司。HE(hydroethidine)购自美国Molecular Probes公司。RPMI-1640购自德国GIBCO BRL公司。小牛血清购自杭州四季青生物材料厂。其它试剂均为国产分析纯。
1.2 实验方法
1.2.1 细胞培养 18~20 g雌性昆明小鼠,按1次/d、1 ml/次的剂量连续3 d腹腔注射1%巯基乙醇酸钠,停1 d,按鄂征等[7]的方法取腹腔巨噬细胞(台酚兰吞噬实验显示99%为巨噬细胞)以5×105 个/cm2的浓度改装35 mm Petri皿 (Meridian,美国),在含10%小牛血清的RPMI-1640于37℃、5% CO2孵箱(Quene System,美国)内培养12 h。
, 百拇医药
1.2.2 染液配制 将HE溶于二甲亚砜(DMSO), 配成1×10-3 mol/L储备液,分装冻存于- 80~- 20oC 条件下。染色前用HEPES缓冲盐溶液配成5×10-6 mol/L工作液。
1.2.3 荧光探针标记 吸除培养皿内的培养液,用HEPES缓冲盐溶液 (含145×10-3 mol/L NaCl,5×10-3 mol/L KCl,1×10-3 mol/L CaCl2 ,0.5×10-3 mol/L MgSO4,5×10-3 mol/L 葡萄糖,1.0×10-2 mol/L HEPES;pH7.4)洗5次,在培养皿中滴入5×10-6 mol/L HE液0.3 ml,37℃孵育30 min后更换HEPES缓冲液。
, 百拇医药
1.2.4 共焦镜检测 将培养皿置于ACAS570激光扫描共聚焦显微镜(Meridian,美国)载物台上,选用40倍物镜,7%滤光片,确定激发光波长为488 nm,进入Kinetics-Image Scan程序,建立文件,打开检测器1(最适发射波长530 nm),作预扫描后选定最佳扫描参数,对准选定视野扫描并存储所获信息。主要扫描参数如下:Pinhole:1600 m m,PMT1:70%,Step Size:0.5 m m,Stage Speed:4.0 mm/s,Scanning Strength:20%,Laser Power:20 mW,Sample/Pt:32。
1.2.5 分析 进入Kinetics-Image Analysis程序,调入分析文件的存储信息,经处理后在Time Plot下得出反映细胞内NADPH氧化酶活性变化的EB荧光强度时间变化曲线并作归一化处理。
2 结果和讨论
, 百拇医药
通过使用荧光探针HE和激光扫描共聚焦显微镜,检测了巨噬细胞内的超氧化物水平,从而反映巨噬细胞内NADPH氧化酶活性。图1~3为检测器1检测到的巨噬细胞内EB荧光强度变化曲线图。PMA通过PKC途径激活NADPH氧化酶从而增强细胞的呼吸爆发作用[8]。图1

图1 PMA(1×10-8 mol/L)处理后,巨噬细胞内HE荧光强度变化曲线 标记线示PMA加入时间。
Fig.1 Fluorescence variation curve for HE in macrophages treated with PMA (1×10-8 mol/L) The marker indicated the time when the PMA was added.
, http://www.100md.com
显示,加入PMA(终浓度为1×10-8 mol/L)后,巨噬细胞内的荧光强度逐渐增强,在500 s内增强了30%左右,表明PMA使巨噬细胞内NADPH氧化酶活性在500 s内逐渐增强了30%左右,这一结果肯定了PMA通过激活NADPH氧化酶使巨噬细胞呼吸爆发作用增强的结论。
地塞米松使巨噬细胞呼吸爆发作用减弱[9、10],但其作用方式还不清楚。检测发现,地塞米松(终浓度为1´ 10-4 mol/L)处理后,巨噬细胞内EB荧光强度急速降低17%(图2),表明地塞米松使巨噬细胞内NADPH氧化酶活性急剧降低,并因此减弱巨噬细胞呼吸爆发作用。进一步检测发现,地塞米松处理0.5 h后,PMA仍使巨噬细胞内的EB荧光强度增高,但增高速度明显减小(图3),表明地塞米松不仅直接影响NADPH氧化酶活性,同时也降低细胞对PMA的反应性。

, 百拇医药
图2 地塞米松(1´ 10-4 mol/L)处理后,巨噬细胞内HE荧光强度变化曲线 标记线示地塞米松加入时间。
Fig.2 Fluorescence variation curve for HE in macrophages treated with dexamethasone (1´ 10-4 mol/L) The marker indicated the time when the dexamethasone was added.

图3 地塞米松(1×10-4 mol/L)处理后,PMA(1×10-8 mol/L)仍使巨噬细胞内HE荧光强度发生改变 标记线示PMA加入时间。
, http://www.100md.com Fig.3 Fluorescence variation curve for HE in macrophages pretreated with dexamethasone (1×10-4 mol/L) prior to the stimulation with PMA (1×10-8 mol/L) The marker indicated the time when the PMA was added.
结果表明,利用荧光探针HE和激光扫描共聚焦显微镜检测细胞内NADPH氧化酶活性变化具备以下优点: (1)实验过程快速。本方法仅需作30 min荧光探针标记、上机检测、测试结果分析处理和打印,实验过程比酶化学法快速得多;(2)样品处理简便,酶化学法样品处理过程复杂,反应条件严格,采取本法仅需在经荧光染料负染的改装35 mm Petri培养皿上选定一个视野后即可检测。由于样品处理简便,细胞所受影响小,经检测后的细胞可继续培养,并用作进一步观察;(3)实验结果准确。由于样品处理简便,细胞所受影响小,对实验结果影响小,保证了实验结果的准确性;(4)可得到清晰全面的数据。首先,共焦镜法不仅可象生化法和流式细胞仪一样得出样品的总体结果,而且可显示各个细胞的荧光强度变化,将检测提高到了单个细胞水平;其次,通常我们只能选择适当的时间点对样品作检测,共焦镜法则可实现对活细胞的荧光强度变化作连续追踪,实行原位实时动态观察,还可准确反映细胞在加样瞬间的变化。尤为突出的是,本方法是在活细胞内进行NADPH氧化酶活性检测,真实的反映了活细胞的功能状态。
, http://www.100md.com
本实验结果也提示我们开发检测细胞内其它酶活性变化方法的可能性,不过,由于共焦镜是近年来开发出的大型贵重仪器,短期内共焦镜还不可能普及,限制了本方法的应用。但快速、简便、准确,并实现了单个活细胞水平的观察这一系列优点,显示了本方法广泛的应用前景。
作者简介:马晓冬(1975-),男,河南安阳人,1997年毕业于第一军医大学,本科,助理实验师,电话:85189037
参考文献
1,Malech HL, Gallin JI. Current concepts: Immunology. Neutrophils in human diseases[J]. N Engl J Med, 1987, 317: 687~92.
2,Cross AR, Jones OTG. Enzymatic mechanisms of superoxide production[J]. Biochem Biophys Acta, 1991, 1057:281~3.
, 百拇医药
3,小川和郎, 中根一穗主编, 朴英杰主译. 组织细胞化学技术: 细胞膜[M]. 广州: 中山大学出版社, 1991. 125~6.
4,Rothe G, Valet G. Measurement of NADPH oxidase activity with hydroethidine. In: Handbook of flow cytometry methods [M]. Robinson JP, editor. Wiley-Liss, Inc, 1993. 159~64.
5,Shingu M, Todoroki T, Nobunaga M. Generation of superoxide by immunologically stimulated normal human neutrophils and possible modulation by intracellular and extracellular SOD and rheumatoid factors [J]. Inflammation, 1987, 11:143~58.
, http://www.100md.com
6,Davin MS. Confocal scanning optical microscope and its applications for biological specimens[J]. J Cell Science, 1989, 94(2):175~9.
7,鄂 征主编. 组织培养技术[M]. 北京:人民卫生出版社,1993. 185~97.
8,Narayanan PK, Ragheb K, Lawler G et al. Defects in intracellular oxidative metabolism of neutrophils undergoing apoptosis[J]. J Leukoc Biol, 1997, 61:481~3.
9,Pogrebbniak HW, Matthews W, Pass HI. Alterations in macrophage free radical and tumor necrosis factor production by a potassium channel activator [J]. J Surg Res, 1992, 52:395~8.
10,王广庆, 胡复荪, 安长荣, 李彩云, 谢立威. 地塞米松抑制巨噬细胞产生氧自由基和一氧化氮[J].中国药理学通报, 1995, 11:406~10.
收稿日期:1999-03-03, http://www.100md.com