脑梗死患者聚胺代谢研究
作者:李义召 卢林 李明欣 傅善基
单位:李义召(山东医科大学附属医院神经内科 250012);卢林(山东医科大学附属医院神经内科 250012);李明欣(山东医科大学附属医院神经内科 250012);傅善基(山东医科大学附属医院神经内科 250012)
关键词:脑梗死;聚胺;腐胺;精脒;精胺
摘 要 目的
摘 要 目的:观察脑梗死患者血清腐胺、精脒、精胺水平,探讨聚胺代谢紊乱在脑梗死病理生理过程中的作用。方法:选择62例脑梗死患者及26例正常人,应用高效液相色谱法测定血清腐胺、精脒、精胺水平。结果:脑梗死病人发病7天内腐胺水平显著升高并达峰值,7天后开始下降,14天后仍明显高于对照组;精脒、精胺水平7天内显著低于对照组,7天后恢复并逐渐达对照组水平。脑梗死急性期腐胺水平随病情加重显著升高,精脒、精胺水平随病情加重而下降。血清腐胺、精脒、精胺水平变化与脑梗死部位关系不大。结论:聚胺代谢紊乱参与了脑梗死的病理生理过程。
, 百拇医药
聚胺(polyamines,PAs)主要包括腐胺(Putrescine,Put)、精脒(spermidine,Spd)和精胺(spermine,Spm)。PAs广泛分布于人体细胞内,是一类带正电荷的小分子脂肪族化合物,与细胞内RNA和蛋白质的合成有密切关系。动物实验表明[1~4],脑缺血时存在明显的PAs代谢紊乱,且其与缺血性脑细胞损伤的程度密切相关[2,5,6]。目前PAs代谢紊乱与缺血性脑损伤关系研究尚局限于动物实验阶段,有关其与脑梗死(CI)的关系及其在CI发病机制中的作用尚未见有系统研究报道。本研究的目的:①观察CI患者Put、Spd、Spm水平动态变化;②观察Put、Spd、Spm与CI病情轻重、病灶部位的关系;③探讨Put、Spd、Spm参与CI的可能病理生理机制及临床意义。
资 料 与 方 法
一、临床资料
选择62例CI患者,均经CT证实。男37例,女25例,年龄48~76(平均61.5)岁,严重心、肺、肝、肾及肿瘤等疾病者除外。选择年龄相匹配26例健康查体者为对照组,男16例,女10例,年龄50~78(平均62.10)岁。所有检查者抽血前1周内均未用阿司匹林、神经节苷脂、地塞米松等影响聚胺代谢的药物。
, 百拇医药
二、方法
1.分组:按CI病情严重程度、病变部位、病程分为3个亚组。病情严重程度据全国第四次脑血管病会议制定的临床神经功能缺损程度评分标准评分分为轻型组(0~15分)、中型组(16~30分)与重型组(31~45分);据病程分>7天组、7~14天组;据CI部位分为基底节区组与非基底节区组。
2.实验方法
(1)仪器与试剂:HP1090M高效液相色谱仪,HP1046荧光检测器,KFC18色谱柱(250×4.6mm),Put、Spd及Spm内标均为Sigma产品,DNS-CI为Fluka产品。
(2)色谱条件:流动相由甲醇和双蒸水组成。采用梯度淋洗方法。柱温50℃,流速1ml/min,荧光检测波长370nm和506nm。
(3)样品处理:自凝静脉血3ml,用0.2M PH7.2的磷酸缓冲液处理,3500rpm离心10分钟,取上清液400ul加三氯醋酸除去蛋白质,而后DNS-CI进样分析,进样量6ul。
, http://www.100md.com
三、统计学方法:F检验、Q检验、t检验。
结 果
一、不同病程CI患者血PAs水平测定结果:见表1。
表1 不同病程CI患者血清聚胺水平及
对比(nmol/ml,(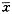 ±s))
±s))
对照组
(n=26)
<7天组
(n=31)
, 百拇医药
7~14天组
(n=18)
>14天组
(n=13)
腐胺
0.62±0.36
4.07±0.98b
2.14±0.85a
1.17±0.69a
精脒
0.57±0.13
, 百拇医药 0.35±0.15a
0.48±0.36
0.63±0.35
精胺
0.51±0.22
0.29±0.18a
0.45±0.27
0.59±0.32
注:与对照组比较aP<0.05,bP<0.01
由表1可知:CI发病7天内腐胺水平显著升高,>14天仍显著高于对照组;精脒、精胺水平7天内显著低于对照组,7天后逐渐恢复至对照组。
, http://www.100md.com
二、病程7天内的不同严重程度CI患者血清PAs测定结果:见表2。表2 病程7天内不同严重程度CI患者血清
聚胺水平及比较(nmol/ml,(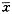 ±s))
±s))
对照组
(n=26)
轻型组
(n=11)
中型组
(n=13)
重型组
, http://www.100md.com
(n=7)
腐胺
0.62±0.36
2.07±0.86b
3.25±0.78b
4.96±1.15b,d
精脒
0.57±0.13
0.46±0.37
0.48±0.23
0.32±0.13ac
, http://www.100md.com
精胺
0.53±0.22
0.49±0.33
0.34±0.27a
0.25±0.16ac
注:与对照组相比:aP<0.05,bP<0.01;与轻型组相比:cP<0.05 dP<0.01。
由表2可知:病情越重,腐胺水平升高越明显,而精脒、精胺水平下降越明显。
三、病程7天内的不同部位CI患者血清PAs水平测定结果:见表3。表3 病程7天内CI不同部位血清聚胺
水平比较(nmlos/ml,(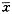 ±s))
±s))
, http://www.100md.com
基底节区组
(n=19)
非基底节区组
(n=12)
P值
腐胺
4.67±1.26
3.89±0.97
P>0.05
精脒
0.31±0.17
0.38±0.21
, 百拇医药 P>0.05
精胺
0.32±0.19
0.27±0.15
P>0.05
由表3可知:基底节区CI患者血清腐胺、精脒、精胺水平与非基底节区无显著差异。讨 论
动物实验表明脑缺血后有以Put急剧升高为主要特征的PAs代谢紊乱,受损脑区Spd、Spm显著下降,PAs代谢的这种变化被称为“聚胺反应”(polyamines response)[7~8]。缺血后细胞损伤的密度与缺血后Put水平变化相关[2,5]。用鸟氨酸脱羧酶(ODC)不可逆性抑制剂——DFMO治疗,能够减轻伴随缺血和再灌注损伤的海马CA1亚区的迟发性神经元死亡(DND),且这种减轻是剂量依赖性的[1,9],加入外源性Put消除了DFMO对神经元的保护作用[9],表明PAs在DND中起着关键作用。Koenig[10~11]在动物实验中证实,PAs可介导血脑屏障的破坏,大脑皮层PAs的产生增加导致了其在微血管的积聚,血管渗透性增加。脑缺血后神经组织异常升高的PAs能够透过血脑屏障进入血液循环,因此可以通过监测血清PAs水平以观察脑组织PAs变化[10~11]。本研究结果发现:CI发病7天内Put显著升高,7~14天有所下降,14天后仍然显著高于对照组,而Spd、Spm在7天内显著低于对照组,7天后逐渐升高接近对照组水平。CI病情越重,Put水平显著升高,而Spd、Spm水平则较明显下降。Put、Spd、Spm水平变化与CI部位关系不大。由此可见,聚胺反应参与了脑梗死的病理生理过程,Put、Spd与Spm是反映急性CI病情严重程度的较好的生化指标,这与实验研究结论一致[1,2,5]。
, http://www.100md.com
ODC是PAs代谢途径中的关键酶,其催化鸟氨酸脱羧生成Put。脑缺血后即有ODC活性的升高,而Put的升高是由于ODC活性升高引起;Put能够通过在细胞膜上介导刺激——反应耦联发挥着第二信使作用,并可诱发神经末梢天门冬氨酸继发性释放,使得细胞膜对Ca2+通透性改变,促进Ca2+跨膜内流;脑缺血长时间再灌注后,Spm、Spd水平的降低也使得线粒体对Ca2+的缓冲能力下降;这些因素导致细胞内Ca2+浓度增加,导致一系列病理生理过程[9]。药理学研究发现[2]:在N-甲基-D-门冬氨酸受体(NMDA-R)上有PAs识别位点,PAs是该识别部位的增效剂,能够加强NMDA-R的活化状态,由此加强了兴奋性氨基酸的兴奋性毒性。大鼠脑薄片放射自显影研究发现,NMDA-R在大脑皮层、海马、基底节及感觉系统中占优势,尤以海马CA1亚区shaffer侧束终区含量最高[2],由此可以解释全部脑组织中PAs水平无明显差异,却有神经元的选择易损性。Ifen-prodil(一种NMDA-R复合体上PAs识别部位的拮抗剂)能显著降低大鼠局灶脑缺血模型中梗死组织的体积,而地塞米松、阿斯匹林可抑制脑缺血后Put的蓄积,从而对血脑屏障的破坏产生保护作用[4],这一结果进一步表明了PAs介入了脑缺血的病理生理过程[9],PAs抑制剂或其作用的拮抗剂为CI的治疗提供了一新的手段。因此,进一步阐明PAs在缺血性神经细胞死亡中的病理生理作用及其分子机制,对于缺血性脑损伤的治疗可能会开辟一全新途径。
, 百拇医药
参考文献
1,Koenig H,Goldstone AD,Lu CY.Brain polyamines are controlled by N-methyl-D-aspartate receptors during ischemia and recirculation.Stroke,1990,21(supp Ⅲ)∶98~102.
2,Rohn G,Kocher M,Oschlies V,et al.Putrescine content and structural defects in isolated fractionsn of rat brain after reversible cerebral ischemia.Exp Neurol.1990;107∶149~255.
3,Pascen W,Rohn G,Schmidt KR.Transglutminase activity in reversible cerebral ischemia in the rat.Neurosci Lett,1990;2,10∶232~236.
, 百拇医药
4,Paschen W,Csiba L,Rohn G,et al.Polyamine metabolism in transient focal ischemia of rat brain.Brain Res,1991;566∶354~357.
5,Paschen W,Hallmayer J,Mies G,et al.Ornithine decarbosyoase activity and putrscine levels in reversible cerebral ischemia of Mongolian gerbils:effect of barbiturate.J Cereb Blood Folw Metab,1990;10∶236~242.
6,Paschen E,Hallmayer J,Rohn G.Relationship between putrescine content and density of ischemic cell damage in the brain of mongolian gerbils.Acat Neuropathol,1998;76∶388~394.
, 百拇医药
7,Paschen W,Schmidt KR,Diuricie B,et al.Polyamines changes in reversible cerebral ischemia,J Neurochem,1987;49∶35.
8,Paschen W.Polyamine metabolism in reversible cerebral ischenia.Cererovasc Brain Metab Rev,1992;4∶59.
9,Paschen W,Widmann R,Weber C.Changes in regional polamines profiles in rat brain after transient cerebral ischemia (single versus repetitive ischemia):evidence for release of polyamines from injured neurons.Neurosci Lett,1992;135∶121~124.
, http://www.100md.com
10,Koenig H.Blood brain barrier breakdown in brain edema following cold ijury is mediated by microvascular plyamines.Biochem Biophys Res Commun,1983;116∶1039~1048.
11,Koenig H.Blood brain barrier breakdown in cold injured brain is linked to a biphasic stimulation of ornithine decarboxylase activity and plyamines synthesis;both are coordinately inhabited by verapamil,dwxamethasone and aspirin.J Neurochem,1989;52∶101~109.
12,Lipartiti M,Lazzaro A,Zanoni R,et al.Mono-sialoganglioside GM,reduces NMDA neurotoxicity in neonatal rat brain.Experimental Neurology,1991;113∶301~305.
收稿日期:2000-03-10, 百拇医药
单位:李义召(山东医科大学附属医院神经内科 250012);卢林(山东医科大学附属医院神经内科 250012);李明欣(山东医科大学附属医院神经内科 250012);傅善基(山东医科大学附属医院神经内科 250012)
关键词:脑梗死;聚胺;腐胺;精脒;精胺
摘 要 目的
摘 要 目的:观察脑梗死患者血清腐胺、精脒、精胺水平,探讨聚胺代谢紊乱在脑梗死病理生理过程中的作用。方法:选择62例脑梗死患者及26例正常人,应用高效液相色谱法测定血清腐胺、精脒、精胺水平。结果:脑梗死病人发病7天内腐胺水平显著升高并达峰值,7天后开始下降,14天后仍明显高于对照组;精脒、精胺水平7天内显著低于对照组,7天后恢复并逐渐达对照组水平。脑梗死急性期腐胺水平随病情加重显著升高,精脒、精胺水平随病情加重而下降。血清腐胺、精脒、精胺水平变化与脑梗死部位关系不大。结论:聚胺代谢紊乱参与了脑梗死的病理生理过程。
, 百拇医药
聚胺(polyamines,PAs)主要包括腐胺(Putrescine,Put)、精脒(spermidine,Spd)和精胺(spermine,Spm)。PAs广泛分布于人体细胞内,是一类带正电荷的小分子脂肪族化合物,与细胞内RNA和蛋白质的合成有密切关系。动物实验表明[1~4],脑缺血时存在明显的PAs代谢紊乱,且其与缺血性脑细胞损伤的程度密切相关[2,5,6]。目前PAs代谢紊乱与缺血性脑损伤关系研究尚局限于动物实验阶段,有关其与脑梗死(CI)的关系及其在CI发病机制中的作用尚未见有系统研究报道。本研究的目的:①观察CI患者Put、Spd、Spm水平动态变化;②观察Put、Spd、Spm与CI病情轻重、病灶部位的关系;③探讨Put、Spd、Spm参与CI的可能病理生理机制及临床意义。
资 料 与 方 法
一、临床资料
选择62例CI患者,均经CT证实。男37例,女25例,年龄48~76(平均61.5)岁,严重心、肺、肝、肾及肿瘤等疾病者除外。选择年龄相匹配26例健康查体者为对照组,男16例,女10例,年龄50~78(平均62.10)岁。所有检查者抽血前1周内均未用阿司匹林、神经节苷脂、地塞米松等影响聚胺代谢的药物。
, 百拇医药
二、方法
1.分组:按CI病情严重程度、病变部位、病程分为3个亚组。病情严重程度据全国第四次脑血管病会议制定的临床神经功能缺损程度评分标准评分分为轻型组(0~15分)、中型组(16~30分)与重型组(31~45分);据病程分>7天组、7~14天组;据CI部位分为基底节区组与非基底节区组。
2.实验方法
(1)仪器与试剂:HP1090M高效液相色谱仪,HP1046荧光检测器,KFC18色谱柱(250×4.6mm),Put、Spd及Spm内标均为Sigma产品,DNS-CI为Fluka产品。
(2)色谱条件:流动相由甲醇和双蒸水组成。采用梯度淋洗方法。柱温50℃,流速1ml/min,荧光检测波长370nm和506nm。
(3)样品处理:自凝静脉血3ml,用0.2M PH7.2的磷酸缓冲液处理,3500rpm离心10分钟,取上清液400ul加三氯醋酸除去蛋白质,而后DNS-CI进样分析,进样量6ul。
, http://www.100md.com
三、统计学方法:F检验、Q检验、t检验。
结 果
一、不同病程CI患者血PAs水平测定结果:见表1。
表1 不同病程CI患者血清聚胺水平及
对比(nmol/ml,(
对照组
(n=26)
<7天组
(n=31)
, 百拇医药
7~14天组
(n=18)
>14天组
(n=13)
腐胺
0.62±0.36
4.07±0.98b
2.14±0.85a
1.17±0.69a
精脒
0.57±0.13
, 百拇医药 0.35±0.15a
0.48±0.36
0.63±0.35
精胺
0.51±0.22
0.29±0.18a
0.45±0.27
0.59±0.32
注:与对照组比较aP<0.05,bP<0.01
由表1可知:CI发病7天内腐胺水平显著升高,>14天仍显著高于对照组;精脒、精胺水平7天内显著低于对照组,7天后逐渐恢复至对照组。
, http://www.100md.com
二、病程7天内的不同严重程度CI患者血清PAs测定结果:见表2。表2 病程7天内不同严重程度CI患者血清
聚胺水平及比较(nmol/ml,(
对照组
(n=26)
轻型组
(n=11)
中型组
(n=13)
重型组
, http://www.100md.com
(n=7)
腐胺
0.62±0.36
2.07±0.86b
3.25±0.78b
4.96±1.15b,d
精脒
0.57±0.13
0.46±0.37
0.48±0.23
0.32±0.13ac
, http://www.100md.com
精胺
0.53±0.22
0.49±0.33
0.34±0.27a
0.25±0.16ac
注:与对照组相比:aP<0.05,bP<0.01;与轻型组相比:cP<0.05 dP<0.01。
由表2可知:病情越重,腐胺水平升高越明显,而精脒、精胺水平下降越明显。
三、病程7天内的不同部位CI患者血清PAs水平测定结果:见表3。表3 病程7天内CI不同部位血清聚胺
水平比较(nmlos/ml,(
, http://www.100md.com
基底节区组
(n=19)
非基底节区组
(n=12)
P值
腐胺
4.67±1.26
3.89±0.97
P>0.05
精脒
0.31±0.17
0.38±0.21
, 百拇医药 P>0.05
精胺
0.32±0.19
0.27±0.15
P>0.05
由表3可知:基底节区CI患者血清腐胺、精脒、精胺水平与非基底节区无显著差异。讨 论
动物实验表明脑缺血后有以Put急剧升高为主要特征的PAs代谢紊乱,受损脑区Spd、Spm显著下降,PAs代谢的这种变化被称为“聚胺反应”(polyamines response)[7~8]。缺血后细胞损伤的密度与缺血后Put水平变化相关[2,5]。用鸟氨酸脱羧酶(ODC)不可逆性抑制剂——DFMO治疗,能够减轻伴随缺血和再灌注损伤的海马CA1亚区的迟发性神经元死亡(DND),且这种减轻是剂量依赖性的[1,9],加入外源性Put消除了DFMO对神经元的保护作用[9],表明PAs在DND中起着关键作用。Koenig[10~11]在动物实验中证实,PAs可介导血脑屏障的破坏,大脑皮层PAs的产生增加导致了其在微血管的积聚,血管渗透性增加。脑缺血后神经组织异常升高的PAs能够透过血脑屏障进入血液循环,因此可以通过监测血清PAs水平以观察脑组织PAs变化[10~11]。本研究结果发现:CI发病7天内Put显著升高,7~14天有所下降,14天后仍然显著高于对照组,而Spd、Spm在7天内显著低于对照组,7天后逐渐升高接近对照组水平。CI病情越重,Put水平显著升高,而Spd、Spm水平则较明显下降。Put、Spd、Spm水平变化与CI部位关系不大。由此可见,聚胺反应参与了脑梗死的病理生理过程,Put、Spd与Spm是反映急性CI病情严重程度的较好的生化指标,这与实验研究结论一致[1,2,5]。
, http://www.100md.com
ODC是PAs代谢途径中的关键酶,其催化鸟氨酸脱羧生成Put。脑缺血后即有ODC活性的升高,而Put的升高是由于ODC活性升高引起;Put能够通过在细胞膜上介导刺激——反应耦联发挥着第二信使作用,并可诱发神经末梢天门冬氨酸继发性释放,使得细胞膜对Ca2+通透性改变,促进Ca2+跨膜内流;脑缺血长时间再灌注后,Spm、Spd水平的降低也使得线粒体对Ca2+的缓冲能力下降;这些因素导致细胞内Ca2+浓度增加,导致一系列病理生理过程[9]。药理学研究发现[2]:在N-甲基-D-门冬氨酸受体(NMDA-R)上有PAs识别位点,PAs是该识别部位的增效剂,能够加强NMDA-R的活化状态,由此加强了兴奋性氨基酸的兴奋性毒性。大鼠脑薄片放射自显影研究发现,NMDA-R在大脑皮层、海马、基底节及感觉系统中占优势,尤以海马CA1亚区shaffer侧束终区含量最高[2],由此可以解释全部脑组织中PAs水平无明显差异,却有神经元的选择易损性。Ifen-prodil(一种NMDA-R复合体上PAs识别部位的拮抗剂)能显著降低大鼠局灶脑缺血模型中梗死组织的体积,而地塞米松、阿斯匹林可抑制脑缺血后Put的蓄积,从而对血脑屏障的破坏产生保护作用[4],这一结果进一步表明了PAs介入了脑缺血的病理生理过程[9],PAs抑制剂或其作用的拮抗剂为CI的治疗提供了一新的手段。因此,进一步阐明PAs在缺血性神经细胞死亡中的病理生理作用及其分子机制,对于缺血性脑损伤的治疗可能会开辟一全新途径。
, 百拇医药
参考文献
1,Koenig H,Goldstone AD,Lu CY.Brain polyamines are controlled by N-methyl-D-aspartate receptors during ischemia and recirculation.Stroke,1990,21(supp Ⅲ)∶98~102.
2,Rohn G,Kocher M,Oschlies V,et al.Putrescine content and structural defects in isolated fractionsn of rat brain after reversible cerebral ischemia.Exp Neurol.1990;107∶149~255.
3,Pascen W,Rohn G,Schmidt KR.Transglutminase activity in reversible cerebral ischemia in the rat.Neurosci Lett,1990;2,10∶232~236.
, 百拇医药
4,Paschen W,Csiba L,Rohn G,et al.Polyamine metabolism in transient focal ischemia of rat brain.Brain Res,1991;566∶354~357.
5,Paschen W,Hallmayer J,Mies G,et al.Ornithine decarbosyoase activity and putrscine levels in reversible cerebral ischemia of Mongolian gerbils:effect of barbiturate.J Cereb Blood Folw Metab,1990;10∶236~242.
6,Paschen E,Hallmayer J,Rohn G.Relationship between putrescine content and density of ischemic cell damage in the brain of mongolian gerbils.Acat Neuropathol,1998;76∶388~394.
, 百拇医药
7,Paschen W,Schmidt KR,Diuricie B,et al.Polyamines changes in reversible cerebral ischemia,J Neurochem,1987;49∶35.
8,Paschen W.Polyamine metabolism in reversible cerebral ischenia.Cererovasc Brain Metab Rev,1992;4∶59.
9,Paschen W,Widmann R,Weber C.Changes in regional polamines profiles in rat brain after transient cerebral ischemia (single versus repetitive ischemia):evidence for release of polyamines from injured neurons.Neurosci Lett,1992;135∶121~124.
, http://www.100md.com
10,Koenig H.Blood brain barrier breakdown in brain edema following cold ijury is mediated by microvascular plyamines.Biochem Biophys Res Commun,1983;116∶1039~1048.
11,Koenig H.Blood brain barrier breakdown in cold injured brain is linked to a biphasic stimulation of ornithine decarboxylase activity and plyamines synthesis;both are coordinately inhabited by verapamil,dwxamethasone and aspirin.J Neurochem,1989;52∶101~109.
12,Lipartiti M,Lazzaro A,Zanoni R,et al.Mono-sialoganglioside GM,reduces NMDA neurotoxicity in neonatal rat brain.Experimental Neurology,1991;113∶301~305.
收稿日期:2000-03-10, 百拇医药