TRAb间接ELISA测定的建立
作者:贾卫国 魏松全 陈德才 安振梅 李俊
单位:贾卫国 魏松全 陈德才 安振梅(华西医科大学附属第一医院内分泌科 成都 610041);李俊(四川省德阳市人民医院普外科 德阳 618200)
关键词:Graves’病;促甲状腺素受体自身抗体;酶联免疫吸附测定
华西医学000284
摘要:为了解不同类型TRAb在Graves病中的作用及满足大规模筛选TRAb的需要,我们利用可溶性膜受体技术建立了TRAb的间接ELISA测定。利用猪的TSHr作为包被抗原,HRP-羊抗人Ig(A+G+M)为二抗可以检出IgG、IgM、IgA型TRAb的总体。若分别以HRP-羊抗人IgG/IgM为二抗则可以分别检出IgG型/IgM型TRAb。该法与TBⅡ放射受体检测试剂盒有很好的相关性(r=0.708),可应用于临床,尤其适用于杂交瘤技术中的大规模抗体筛选。
, 百拇医药
[中图分类号]R581.1 〔文献标识码〕A
[文章编号]1002-0179(2000)02-0249-03
An Indirect Enzyme-Linked Immunosorbent Assay of Anti-Throtropin Autoantibody
JIA Wei-guo,WEI Song-quan,CHEN De-cai,et al.
(Division of Endocrology,the First University Hospital,West China University of Medical Sciences,Chengdu,610041)
Abstract:For investigating the distribution of different isotope of anti-thyrotropin receptor autoantibody(TRAb)in Graves patients and for the need of screening this kind of antibody in supernatents from EBV-transformed Graves lymphocytes,we have established an indirect enzyme-linked immunosorbent assay of TRAb,using 96-wellplates coated with porcine thytropin receptor,goat anti-human Ig(A+G+M),Horseradish peroxidase conjagate,and O-plenylenecliamine as substrate.This assay can determine different isotype of TRAb using different isotype of goat anti-human immunoglobulin as second antibody.Our assay have a good relationship with TRAb radioreceptor kits(r=0.798)and can be used in clinical detection.
, 百拇医药
Key words:Graves disease;autoantibody;thyrotropin receptor;enzyme-linked immunosorbent assay
Graves' 病(Graves' disease,GD)是临床常见的器官特异性自体免疫性疾病。以弥漫性甲状腺肿大、甲状腺机能亢进和眼球外突为主要临床特征。血清学最明显的特征是可以检出针对TSH受体(thyrotropin receptor,TSHr)的自身抗体(anti-TSHr autoantibody,TRAb)〔1〕。TRAb是一组异质性抗体〔2〕,由促甲状腺素结合抑制免疫球蛋白(thyrotropin-binding inhibitor immunoglobulin,TBⅡ)、刺激性抗体(thyroid stimulating autoantibody,TSAb)和阻滞性抗体(thyroid stimulation-blocking autoantibody,TSAb)等各种功能不同的抗体组成。
, 百拇医药
目前对TRAb的检测主要有两种方法〔1〕:放射性受体分析法(radio receptor assay,RRA)和生物活性法(bioassay)。生物法需要培养细胞,费时且价格昂贵;放射受体法的敏感性和特异性虽然都比较高,但有放射性污染,且不能满足大规模抗体测定。为了满足大规模抗体筛选的需要,我们利用可溶性膜受体建立了TRAb的间接ELISA测定。
1 实验方法
1.1 可溶性受体的制备 摘除猪新鲜甲状腺组织,立即投入冰壶中。在4℃下剥离包膜,剔净脂肪和结缔组织,称重后剪碎,按每1g组织加入10mmol/L pH7.5,Tris-HCl缓冲液5ml,制成匀浆,过滤。然后再在4℃下,500rpm离心过滤液10min。上清液再以15000rpm离心20min。弃去上清液。用含1.5%Triton X-100的Tris-NaCl缓冲液(含10mmol/LTris-HCl,50mmol/L NaCl,pH7.5)悬浮沉淀。每1g组织(按制备前的组织重量)加入1ml Triton缓冲液,在磁力搅拌器上搅拌60min。再用冰冻离心机4℃,100,000rpm离心60min,上清液中即含可溶性TSHr。再透析除去Triton X-100,蛋白质定量后分装,-70℃保存待用。
, 百拇医药
1.2 TRAb间接ELISA测定的建立
1.2.1 酶标抗体工作浓度的选择 用包被缓冲液稀释纯化人Ig至100μg/L,包被酶标板,4℃过夜,洗涤;将HRP-标记的羊抗人Ig(A+G+M)用PBS缓冲液一系列稀释后分别加入包被孔中,37℃保温1hr,洗涤;OPD室温下显色20min,2MH2SO4终止反应,读取A490nm值;取A值接近1.0时的羊抗人Ig(A+G+M)稀释度为工作浓度。
1.2.2 包被抗原浓度的选择 用包被缓冲液系列稀释可溶性TSHr,包被ELISA板,每一浓度包被一个纵行的4个孔,4℃过夜,洗涤。加入1%BSA-PBS,100μl/孔。37℃,1hr,洗涤三次;取临床上GD患者血清为参考血清,其TBⅡ值分别为:强阳性117.90U/L;弱阳性16.63U/L;阴性0.50U/L。参考血清均用PBS液作1∶100稀释。三种参考血清分别加入一个横行,100μl/孔。PBS稀释液100μl/孔,加入第四个横行,37℃保温lhr,洗涤。
, 百拇医药
加入最适工作浓度的酶标抗体,100μl/孔,37℃,lhr,洗涤;OPD底物室温下显色20分钟,2MH2SO4终止反应。读取A490nm值。选择强阳性参考血清的A值为0.8左右,弱阳性为0.1左右的包被抗原浓度为最佳TSHr包被浓度。
1.2.3 TRAb的ELISA测定 可溶性TSHr用包被缓冲液稀释至10μg/ml,每孔100μl包被酶标板,4℃过夜。洗涤。每孔加入100μl含1%BSA的PBS缓冲液,37℃封闭lhr,洗涤。待测标本为PBS1∶2稀释的EBV转化Graves病患者B淋巴细胞上清液50μl加入各孔,每份样本设复份。每块板均设阳性对照(2.2.2试验中强阳性血清,1∶100稀释),阴性对照(只含PBS缓冲液)。37℃温育lhr,洗涤三次,酶标抗体用1∶2000HRP-羊抗人Ig(A+G+M)100μl加入各孔。37℃温育lhr,洗涤三次。OPD显色20min,2MH2SO.终止反应,测定A值。A值大于阴性对照吸光值的均数+3SD(16个阴性对照)的孔认为是阳性孔。
, 百拇医药
1.3 放射受体法测TBⅡ 随机挑选TRAb阳性孔上清30例,EBV转化B细胞中Ig阳性、但TRAb阴性上清5例,测定TBⅡ。应用TBⅡ试剂盒(INCSTAR,USA),按说明书操作。
2 实验结果
2.1 羊抗人抗Ig(A+G+M)工作浓度的选择 随着酶标抗体稀释度的增加,吸光度也逐渐下降。当酶标二抗的稀释度为1∶2000时,吸光值接近1.0。故选取1∶2000为二抗的最佳工作浓度。
2.2 可溶性TSHr最佳包被浓度的选择 随着TSHr包被浓度的增加,TSHr与阳性血清结合反应的A值逐渐变大,且强阳性血清与弱阳性血清的A值距离逐渐加大。当可溶性TSHr的浓度接近10μg/ml时,TSHr与强阳性血清结合反应的A值接近于0.80,弱阳性血清的A值接近于0.1,且强阳性血清与弱阳性血清的A值相距最为显著。当TSHr包被浓度越过10μg/ml呈进一步加大时,TSHr与阳性血清结合反应的A值反而呈逐渐下降趋势,强阳性与弱阳性血清的A值相距缩小。故选用10μg/ml作为可溶性TSHr的最佳包被浓度(见图1)。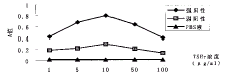
, 百拇医药
图1.TSHr包被浓度反应曲线
2.3 ELISA测TRAb的吸光度与TBⅡ的相关性 以ELISA测16个阴性对照的吸光值范围为:0.095±0.017(M±SD)。设定吸光度大于M+3SD为阳性,则吸光值大于0.146的孔考虑为阳性孔。从EBV转化B淋巴细胞的阳性孔中随机选出30个,阴性孔随机选出5个(35个标本的吸光值M±SD为0.458±0.275),用受体法测TBⅡ(U/L)37.20±1.26。其中阳性有31个。两种方法有相关性,r=0.708(P<0.05)。有趣的是,有一孔ELISA测得吸光值为0.729,但用受体法仅5.22U/L(阴性)。 而另有二孔ELISA测为阴性(吸光值分别为0.071,0.109),而TBⅡ阳性(分别为18.04U/L,17.51U/L)(见图2)。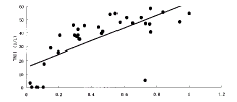
图2.ELISA测TRAb与RRA测TBⅡ的相关性
, 百拇医药
3 讨论
现知TSHr是一个有着多个构象型抗原表位的糖蛋白〔3〕。针对受上不同抗原表位的自身抗体构成了TRAb的异质性群体〔1,4〕。这些异源性自身抗体都可以和TSHr上相应的抗原表位结合,这是ELISA法检测TRAb的理论依据。Triton精制的可溶性膜受体并不丢失受体的高亲和力结合位点〔5〕,为我们提供了技术上的可行性。我们建立的ELISA法经实践验证是可行合理的。该法不涉及放射性物质,具有特异性强、操作简便及不需特殊仪器等优点,且受体来源丰富。尤其适用于在分离单克隆性分泌TRAb的EBV转化B细胞或杂交瘤时大规模抗体筛选。
本法以羊抗人Ig(A+G+M)为二抗,可以检出IgA、IgG、IgM型TRAb的群体。尚可根据不同的需要检测TRAb的免疫球蛋白类型,若用羊抗人IgG为二抗,则可以检出IgG型TRAb;用羊抗人IgM为二抗则检出的是IgM型TRAb。从而可以用来研究TRAb的免疫球蛋白类型在GD发病中的作用。这是放射受体法所未能做到的。
, 百拇医药
本法与放射受体法有较好的相关性(r=0.708),但有部分标本用两种方法检测差异较大。有一例ELISA法测得值较高,而受体法都为阴性。另有二孔ELISA法测为阴性,而受体法却检出有弱阳性抗体存在。造成这种差异的不同可能有以下几个方面:
受体法是利用自身抗体与TSH竞争结合TSHr上的位点而检出。因而可以检出与TSHr结合并竞争性抑制TSH与受体结合的免疫球蛋白群体(TBⅡ)。理论上还可能存在与受体上TSH作用位点以外的抗原表位结合,既不抑制TSH与受体结合,本身也无刺激作用的中性抗体的存在〔2〕。Konish等〔6〕应用免疫沉淀技术发现:存在着与受体有关,但不影响125I-TSH与受体结合的自身抗体。这些抗体是否就是或含有中性抗体尚需进一步研究。Yoshida等〔5〕从单克隆水平对TRAb进行了研究。发现自身抗体与TSHr的结合形式比较复杂:或竞争性抑制TSH的结合,或非竞争性抑制TSH结合,或与TSHr结合但不影响TSH的结合。后二种类型的抗体会影响到受体法的检测。而间接ELISA法则不然,理论上可以将各种异质性TRAb检出,与受体法的检测谱不同。然而我们的方法在灵敏度上并不比试剂盒优越,这可能与我们制备的TSHr纯度不够,若进一步改进方法,增加纯度将有可能增加检测的敏感性和准确性。
, http://www.100md.com
猪与人的TSHr有很高的同源性,目前多用作TSHr的来源。两种方法所用的TSHr均来源于猪甲状腺,这可能是二者相关性较好的主要原因。由于TSHr存在种属差异性,应用人TSHr有可能进一步提高方法的敏感性〔7〕。
应用可溶性猪的TSHr技术,按ELISA原理直接测定TRAb水平,可以检出各种异质性TRAb,尤其适用于大规模抗体筛选。但本方法尚需进一步完善,增加TSHr的纯度,以提高敏感性和特异性。进而可应用于临床,对GD的诊断、治疗及预测复发都有一定的实用价值。
参考文献
1,Smith B.R,Mclachlan S.M.,and Furmaniak J.,Autoantibodies to the thyrotropin receptor.Endocr Rev,1988;9∶106~121.
, 百拇医药 2,Editorial∶Monoclonal human autoantibodies to the TSH receptor-the Holy Grail and why are we looking for it.J Clin Endocrinol Metab,1996;81∶3152~3154.
3,Parmentier M,LIbert F,Maenhaut C,et al.Molecular cloning of the thyotropin receptor.Science 1989;246∶1620~1622.
4,Vassart D.,and Dumont,A.E.,The thyrotropin receptor and regulation of thyrocyte function and growth.Endocr Rev,1992;13∶596~611.
5,Yoshida T,Ichikawa Y,Ito K,et al.Monoclonal antibodies to the TSH receptor bind to a 56-kDa subunit of the TSH receptor and show heterogenous bioactivity.J Bio Chem,1988;262∶16341~16347.
, http://www.100md.com
6,Konishi.J,Iida Y,Kasagi K,et al.Adipoctyte-TSH-receptor-related antibodies in Graves'disease detected by immunoprecipitation.Endocrinol Jpn,1982;29∶219~225.
7,Filetti S,Foti D,Constante G,et al.1991.Recombinant human TSH receptor in a radio receptor assay for the measurement of TSH receptor autoantibodies.J Clin Endocrinol Metab,72∶1096~1101.
(收稿日期:1999-07-23), 百拇医药
单位:贾卫国 魏松全 陈德才 安振梅(华西医科大学附属第一医院内分泌科 成都 610041);李俊(四川省德阳市人民医院普外科 德阳 618200)
关键词:Graves’病;促甲状腺素受体自身抗体;酶联免疫吸附测定
华西医学000284
摘要:为了解不同类型TRAb在Graves病中的作用及满足大规模筛选TRAb的需要,我们利用可溶性膜受体技术建立了TRAb的间接ELISA测定。利用猪的TSHr作为包被抗原,HRP-羊抗人Ig(A+G+M)为二抗可以检出IgG、IgM、IgA型TRAb的总体。若分别以HRP-羊抗人IgG/IgM为二抗则可以分别检出IgG型/IgM型TRAb。该法与TBⅡ放射受体检测试剂盒有很好的相关性(r=0.708),可应用于临床,尤其适用于杂交瘤技术中的大规模抗体筛选。
, 百拇医药
[中图分类号]R581.1 〔文献标识码〕A
[文章编号]1002-0179(2000)02-0249-03
An Indirect Enzyme-Linked Immunosorbent Assay of Anti-Throtropin Autoantibody
JIA Wei-guo,WEI Song-quan,CHEN De-cai,et al.
(Division of Endocrology,the First University Hospital,West China University of Medical Sciences,Chengdu,610041)
Abstract:For investigating the distribution of different isotope of anti-thyrotropin receptor autoantibody(TRAb)in Graves patients and for the need of screening this kind of antibody in supernatents from EBV-transformed Graves lymphocytes,we have established an indirect enzyme-linked immunosorbent assay of TRAb,using 96-wellplates coated with porcine thytropin receptor,goat anti-human Ig(A+G+M),Horseradish peroxidase conjagate,and O-plenylenecliamine as substrate.This assay can determine different isotype of TRAb using different isotype of goat anti-human immunoglobulin as second antibody.Our assay have a good relationship with TRAb radioreceptor kits(r=0.798)and can be used in clinical detection.
, 百拇医药
Key words:Graves disease;autoantibody;thyrotropin receptor;enzyme-linked immunosorbent assay
Graves' 病(Graves' disease,GD)是临床常见的器官特异性自体免疫性疾病。以弥漫性甲状腺肿大、甲状腺机能亢进和眼球外突为主要临床特征。血清学最明显的特征是可以检出针对TSH受体(thyrotropin receptor,TSHr)的自身抗体(anti-TSHr autoantibody,TRAb)〔1〕。TRAb是一组异质性抗体〔2〕,由促甲状腺素结合抑制免疫球蛋白(thyrotropin-binding inhibitor immunoglobulin,TBⅡ)、刺激性抗体(thyroid stimulating autoantibody,TSAb)和阻滞性抗体(thyroid stimulation-blocking autoantibody,TSAb)等各种功能不同的抗体组成。
, 百拇医药
目前对TRAb的检测主要有两种方法〔1〕:放射性受体分析法(radio receptor assay,RRA)和生物活性法(bioassay)。生物法需要培养细胞,费时且价格昂贵;放射受体法的敏感性和特异性虽然都比较高,但有放射性污染,且不能满足大规模抗体测定。为了满足大规模抗体筛选的需要,我们利用可溶性膜受体建立了TRAb的间接ELISA测定。
1 实验方法
1.1 可溶性受体的制备 摘除猪新鲜甲状腺组织,立即投入冰壶中。在4℃下剥离包膜,剔净脂肪和结缔组织,称重后剪碎,按每1g组织加入10mmol/L pH7.5,Tris-HCl缓冲液5ml,制成匀浆,过滤。然后再在4℃下,500rpm离心过滤液10min。上清液再以15000rpm离心20min。弃去上清液。用含1.5%Triton X-100的Tris-NaCl缓冲液(含10mmol/LTris-HCl,50mmol/L NaCl,pH7.5)悬浮沉淀。每1g组织(按制备前的组织重量)加入1ml Triton缓冲液,在磁力搅拌器上搅拌60min。再用冰冻离心机4℃,100,000rpm离心60min,上清液中即含可溶性TSHr。再透析除去Triton X-100,蛋白质定量后分装,-70℃保存待用。
, 百拇医药
1.2 TRAb间接ELISA测定的建立
1.2.1 酶标抗体工作浓度的选择 用包被缓冲液稀释纯化人Ig至100μg/L,包被酶标板,4℃过夜,洗涤;将HRP-标记的羊抗人Ig(A+G+M)用PBS缓冲液一系列稀释后分别加入包被孔中,37℃保温1hr,洗涤;OPD室温下显色20min,2MH2SO4终止反应,读取A490nm值;取A值接近1.0时的羊抗人Ig(A+G+M)稀释度为工作浓度。
1.2.2 包被抗原浓度的选择 用包被缓冲液系列稀释可溶性TSHr,包被ELISA板,每一浓度包被一个纵行的4个孔,4℃过夜,洗涤。加入1%BSA-PBS,100μl/孔。37℃,1hr,洗涤三次;取临床上GD患者血清为参考血清,其TBⅡ值分别为:强阳性117.90U/L;弱阳性16.63U/L;阴性0.50U/L。参考血清均用PBS液作1∶100稀释。三种参考血清分别加入一个横行,100μl/孔。PBS稀释液100μl/孔,加入第四个横行,37℃保温lhr,洗涤。
, 百拇医药
加入最适工作浓度的酶标抗体,100μl/孔,37℃,lhr,洗涤;OPD底物室温下显色20分钟,2MH2SO4终止反应。读取A490nm值。选择强阳性参考血清的A值为0.8左右,弱阳性为0.1左右的包被抗原浓度为最佳TSHr包被浓度。
1.2.3 TRAb的ELISA测定 可溶性TSHr用包被缓冲液稀释至10μg/ml,每孔100μl包被酶标板,4℃过夜。洗涤。每孔加入100μl含1%BSA的PBS缓冲液,37℃封闭lhr,洗涤。待测标本为PBS1∶2稀释的EBV转化Graves病患者B淋巴细胞上清液50μl加入各孔,每份样本设复份。每块板均设阳性对照(2.2.2试验中强阳性血清,1∶100稀释),阴性对照(只含PBS缓冲液)。37℃温育lhr,洗涤三次,酶标抗体用1∶2000HRP-羊抗人Ig(A+G+M)100μl加入各孔。37℃温育lhr,洗涤三次。OPD显色20min,2MH2SO.终止反应,测定A值。A值大于阴性对照吸光值的均数+3SD(16个阴性对照)的孔认为是阳性孔。
, 百拇医药
1.3 放射受体法测TBⅡ 随机挑选TRAb阳性孔上清30例,EBV转化B细胞中Ig阳性、但TRAb阴性上清5例,测定TBⅡ。应用TBⅡ试剂盒(INCSTAR,USA),按说明书操作。
2 实验结果
2.1 羊抗人抗Ig(A+G+M)工作浓度的选择 随着酶标抗体稀释度的增加,吸光度也逐渐下降。当酶标二抗的稀释度为1∶2000时,吸光值接近1.0。故选取1∶2000为二抗的最佳工作浓度。
2.2 可溶性TSHr最佳包被浓度的选择 随着TSHr包被浓度的增加,TSHr与阳性血清结合反应的A值逐渐变大,且强阳性血清与弱阳性血清的A值距离逐渐加大。当可溶性TSHr的浓度接近10μg/ml时,TSHr与强阳性血清结合反应的A值接近于0.80,弱阳性血清的A值接近于0.1,且强阳性血清与弱阳性血清的A值相距最为显著。当TSHr包被浓度越过10μg/ml呈进一步加大时,TSHr与阳性血清结合反应的A值反而呈逐渐下降趋势,强阳性与弱阳性血清的A值相距缩小。故选用10μg/ml作为可溶性TSHr的最佳包被浓度(见图1)。

, 百拇医药
图1.TSHr包被浓度反应曲线
2.3 ELISA测TRAb的吸光度与TBⅡ的相关性 以ELISA测16个阴性对照的吸光值范围为:0.095±0.017(M±SD)。设定吸光度大于M+3SD为阳性,则吸光值大于0.146的孔考虑为阳性孔。从EBV转化B淋巴细胞的阳性孔中随机选出30个,阴性孔随机选出5个(35个标本的吸光值M±SD为0.458±0.275),用受体法测TBⅡ(U/L)37.20±1.26。其中阳性有31个。两种方法有相关性,r=0.708(P<0.05)。有趣的是,有一孔ELISA测得吸光值为0.729,但用受体法仅5.22U/L(阴性)。 而另有二孔ELISA测为阴性(吸光值分别为0.071,0.109),而TBⅡ阳性(分别为18.04U/L,17.51U/L)(见图2)。

图2.ELISA测TRAb与RRA测TBⅡ的相关性
, 百拇医药
3 讨论
现知TSHr是一个有着多个构象型抗原表位的糖蛋白〔3〕。针对受上不同抗原表位的自身抗体构成了TRAb的异质性群体〔1,4〕。这些异源性自身抗体都可以和TSHr上相应的抗原表位结合,这是ELISA法检测TRAb的理论依据。Triton精制的可溶性膜受体并不丢失受体的高亲和力结合位点〔5〕,为我们提供了技术上的可行性。我们建立的ELISA法经实践验证是可行合理的。该法不涉及放射性物质,具有特异性强、操作简便及不需特殊仪器等优点,且受体来源丰富。尤其适用于在分离单克隆性分泌TRAb的EBV转化B细胞或杂交瘤时大规模抗体筛选。
本法以羊抗人Ig(A+G+M)为二抗,可以检出IgA、IgG、IgM型TRAb的群体。尚可根据不同的需要检测TRAb的免疫球蛋白类型,若用羊抗人IgG为二抗,则可以检出IgG型TRAb;用羊抗人IgM为二抗则检出的是IgM型TRAb。从而可以用来研究TRAb的免疫球蛋白类型在GD发病中的作用。这是放射受体法所未能做到的。
, 百拇医药
本法与放射受体法有较好的相关性(r=0.708),但有部分标本用两种方法检测差异较大。有一例ELISA法测得值较高,而受体法都为阴性。另有二孔ELISA法测为阴性,而受体法却检出有弱阳性抗体存在。造成这种差异的不同可能有以下几个方面:
受体法是利用自身抗体与TSH竞争结合TSHr上的位点而检出。因而可以检出与TSHr结合并竞争性抑制TSH与受体结合的免疫球蛋白群体(TBⅡ)。理论上还可能存在与受体上TSH作用位点以外的抗原表位结合,既不抑制TSH与受体结合,本身也无刺激作用的中性抗体的存在〔2〕。Konish等〔6〕应用免疫沉淀技术发现:存在着与受体有关,但不影响125I-TSH与受体结合的自身抗体。这些抗体是否就是或含有中性抗体尚需进一步研究。Yoshida等〔5〕从单克隆水平对TRAb进行了研究。发现自身抗体与TSHr的结合形式比较复杂:或竞争性抑制TSH的结合,或非竞争性抑制TSH结合,或与TSHr结合但不影响TSH的结合。后二种类型的抗体会影响到受体法的检测。而间接ELISA法则不然,理论上可以将各种异质性TRAb检出,与受体法的检测谱不同。然而我们的方法在灵敏度上并不比试剂盒优越,这可能与我们制备的TSHr纯度不够,若进一步改进方法,增加纯度将有可能增加检测的敏感性和准确性。
, http://www.100md.com
猪与人的TSHr有很高的同源性,目前多用作TSHr的来源。两种方法所用的TSHr均来源于猪甲状腺,这可能是二者相关性较好的主要原因。由于TSHr存在种属差异性,应用人TSHr有可能进一步提高方法的敏感性〔7〕。
应用可溶性猪的TSHr技术,按ELISA原理直接测定TRAb水平,可以检出各种异质性TRAb,尤其适用于大规模抗体筛选。但本方法尚需进一步完善,增加TSHr的纯度,以提高敏感性和特异性。进而可应用于临床,对GD的诊断、治疗及预测复发都有一定的实用价值。
参考文献
1,Smith B.R,Mclachlan S.M.,and Furmaniak J.,Autoantibodies to the thyrotropin receptor.Endocr Rev,1988;9∶106~121.
, 百拇医药 2,Editorial∶Monoclonal human autoantibodies to the TSH receptor-the Holy Grail and why are we looking for it.J Clin Endocrinol Metab,1996;81∶3152~3154.
3,Parmentier M,LIbert F,Maenhaut C,et al.Molecular cloning of the thyotropin receptor.Science 1989;246∶1620~1622.
4,Vassart D.,and Dumont,A.E.,The thyrotropin receptor and regulation of thyrocyte function and growth.Endocr Rev,1992;13∶596~611.
5,Yoshida T,Ichikawa Y,Ito K,et al.Monoclonal antibodies to the TSH receptor bind to a 56-kDa subunit of the TSH receptor and show heterogenous bioactivity.J Bio Chem,1988;262∶16341~16347.
, http://www.100md.com
6,Konishi.J,Iida Y,Kasagi K,et al.Adipoctyte-TSH-receptor-related antibodies in Graves'disease detected by immunoprecipitation.Endocrinol Jpn,1982;29∶219~225.
7,Filetti S,Foti D,Constante G,et al.1991.Recombinant human TSH receptor in a radio receptor assay for the measurement of TSH receptor autoantibodies.J Clin Endocrinol Metab,72∶1096~1101.
(收稿日期:1999-07-23), 百拇医药