部分液体通气对内毒素肺损伤肺表面活性物质系统超微结构的影响
作者:邓小明 李金宝 朱科明
单位:(第二军医大学长海医院麻醉科, 上海 200433)
关键词:肺表面活性剂;肺,损伤;超微结构
中国病理生理杂志000816
[摘 要] 目的: 研究部分液体通气对内毒素肺损伤大鼠肺表面活性物质(pulmonary surfactant,PS)系统超微结构的影响。方法:运用电子显微镜细胞化学方法,对内毒素肺损伤鼠PS系统进行观察及部分液体通气对其的影响。结果: 内毒素肺损伤后可见PS层失去连续性,呈断裂或堆积;肺泡II型细胞内板层小体、线粒体空泡化,少数发生坏死并崩解、脱落进入肺泡腔。液体通气+肺损伤组PS系统损伤程度明显低于内毒素肺损伤组。结论: 液体通气可明显改善内毒素肺损伤时PS系统的损伤。
[中图分类号] R655.3; R332 [文献标识码] A
, 百拇医药
[文章编号] 1000-4718(2000)08-0734-04
The effect of partial liquid ventilation on the ultrastructure of pulmonary
surfactant system in endotoxin-induced acute lung injury in rats
DENG Xiao-ming, LI Jin-bao, ZHU Ke-ming
(Department of Anesthesiology, Changhai Hospital, The Second Military
Medical University of PLA, Shanghai 200433,China)
, 百拇医药
[Abstract] AIM: To study the effect of partial liquid ventilation on the ultrastructure of pulmonary surfactant(PS) system in endotoxin-induced acute lung injury. METHODS: The effect of partial liquid ventilation on the ultrastructure of PS system in endotoxin-induced acute lung injury was observed with electronmicroscope histochemistry. RESULTS: There was ultrastructure impairment of PS system in endotoxin-induced acute lung injury, the pulmonary surfactant layer was discontinuous, lamellar bodies and plasmosomes in type Ⅱ pneumonocytes vacuolated, and a few of them were even necrotized and disrupted into the alveolar space. The pulmonary surfactant layer was still continuous, the vacuolation of lamellar bodies and plasmosomes in type Ⅱ pneumonocytes was little with partial liquid ventilation. CONCLUSION: Partial liquid ventilation can lessen the impairment of PS system in endotoxin-induced acute lung injury in rats.
, http://www.100md.com
[MeSH] Pulmonary surfactants; Lung injuries; Ultrastructure
在急性肺损伤(acute lung injury,ALI)、急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)、哮喘持续状态、肺移植等疾病中均存在肺表面活性物质(pulmonary surfactant,PS)的生化组成、功能、代谢异常[1]。自1966年Clark等[2]证明小鼠在自发性吸入充氧的高氟化碳(perfluocarbon,PFC)期间具有足够的气体交换能力以来,大量研究证实利用PFC实施部分液体通气(partial liquid ventilation,PLV)可显著改善ALI、ARDS动物及患者的气体交换和肺动力学特性。本研究利用电镜细胞化学方法进一步观察PLV对内毒素肺损伤大鼠PS系统超微结构的影响。
材 料 和 方 法
, http://www.100md.com
一、 实验动物分组及部分液体通气的实施
雄性SD大鼠18只(本校动物中心提供,280~400 g),实验前禁食12h,但不禁水。2.5%硫贲妥钠(60 mg/kg ip)麻醉后,气管切开插管,接动物呼吸机行机械通气,经左颈内静脉置管接微泵持续输注生理盐水2 mL/h,经右颈总动脉置管并肝素化连接多道生理记录仪监测血压。稳定20 min后,随机分为对照组、肺损伤组和PLV+肺损伤组(n=6),肺损伤组和PLV+肺损伤组均经颈静脉10 min内缓慢注射内毒素(E coli O111-B4,Sigma)8 mg/kg,对照组注入等量的生理盐水,PLV+肺损伤组在注射内毒素0.5h后经气管插管将PFC(美国Alliance制药公司生产)10 mL/kg缓慢注入肺内,5 min注完,注入时变动动物体位,以使PFC在肺内分布均匀,随后继续机械通气。3组机械通气参数相同(VT=10 mL/kg,RF=80 bpm,FiO2=0.60),肺损伤组和PLV+肺损伤组在注射内毒素前(T0)、注射内毒素0.5 h(T1)、1 h (T2)、2 h(T3)、4 h(T4)、6 h(T5),对照组在对应时点,取动脉血0.1 mL作血气分析。各点取血后注入0.1 mL生理盐水以补充血容量。各时点通过多道生理记录仪记录血压和心率。实验在注入内毒素6 h后结束,立即取肺组织行肺病理和PS超微结构的观察。
, http://www.100md.com
二、 肺组织标本的制备和观察
采用Luft的钌红-四氧化锇复合染色法[3],略加改动,在暗室中操作。
(一)试剂准备 1.钌红Ⅰ液:钌红10 mg/mL,0.3 mol/L二甲砷酸盐缓冲液(pH 7.3),18%戊二醛,1.8%单宁酸。将上述4种液体储存于4℃冰箱中备用,临用时按2∶2∶1∶1的比例配制混匀。2.钌红Ⅱ液:钌红10 mg/mL, 0.3 mol/L二甲砷酸盐缓冲液(pH 7.3),5%四氧化锇。将上述3种液体储存于4℃冰箱中备用,临用时按1∶1∶1的比例配制混匀。
(二)取材 经动脉放血处死大鼠,立即连同气管取出肺脏,气管口与装有“钌红Ⅰ液”的微泵注射器(黑色避光)延长管相连,用小针头于肺脏边缘散在性穿孔20~30个,以恒定流量灌流肺脏,0.5 h后取约1 mm×1 mm×1 mm的肺组织块10~15个投入有“钌红Ⅰ液”的小瓶中,并对小瓶抽气,以排除组织内残留气体,直至组织块沉至瓶底。如发现大体标本有陈旧性损伤(如陈旧性出血点、胸膜粘连等)则弃除不用。
, 百拇医药
(三)标本处理 按改良的Luft方法处理:1.前固定:将盛有标本的小瓶放入有水的培养皿中,置于微波炉中微波固定8 s,再放置4℃冰箱,1.5 h后去除浸泡液。2.后固定:0.1 mol/L二甲砷酸盐缓冲液冲洗组织块3次,每次10 min,接着加入“钌红Ⅱ液”3 mL浸泡,置于4℃冰箱,1 h后再用0.1 mol/L二甲砷酸盐缓冲液冲洗2次,每次8 min。3.脱水、包埋、切片、染色:经后固定及冲洗后的标本逐级用乙醇、丙酮系列脱水,环氧丙烷煤浸,环氧树脂(Epon 812)包埋,相差显微镜定位,超薄切片(厚约50~70 nm),醋酸铀和枸橼酸铅染色,H-800透射电镜观察。
(四)光镜标本的制作 采用10%甲醛浸泡固定,常规石蜡切片,苏木精-伊红染色,光镜观察。
三、统计方法
数据以 ±s表示,对每一观察指标两组间同一时点采用非配对t检验。
±s表示,对每一观察指标两组间同一时点采用非配对t检验。
, 百拇医药
结 果
一、部分液体通气对循环的影响
肺损伤组在注入内毒素后0.5 h血压和心率均下降,均无显著差异(P>0.05);PLV+肺损伤组与肺损伤组相比血压无明显差异(P>0.05),心率差异无显著(P>0.05)。
二、部分液体通气对内毒素肺损伤大鼠血气的影响(表 1)
表1 部分液体通气对内毒素肺损伤大鼠血气的影响
Tab 1 The effect of partial liquid ventilation on blood gas of rats with endotoxin-induced lung injury( ±s,n=6) Time
±s,n=6) Time
, http://www.100md.com
(h)
PaO2(kPa)
PaCO2(kPa)
pH
Control
ALI
PLV+ALI
Control
ALI
PLV+ALI
Control
ALI
, 百拇医药
PLV+ALI
T0
31.4±3.2
32.2±4.3
29.8±1.7
4.3±1.0
3.9±0.7
4.1±0.9
7.39±0.07
7.40±0.08
7.39±0.06
T1
, 百拇医药
30.9±3.8
20.3±3.7* *
21.2±3.2* *
4.1±0.9
5.2±2.3
5.5±1.4
7.40±0.08
7.21±0.05* *
7.22±0.07* *
T2
, 百拇医药 31.9±4.1
15.7±2.3* *
20.1±1.9* *△
4.4±0.5
5.9±3.1
5.1±1.3
7.39±0.09
7.15±0.07* *
7.32±0.07△△
T3
30.7±2.3
, http://www.100md.com
12.9±1.9* *
23.6±2.1* *△△
4.0±0.6
6.0±2.4
5.0±1.0
7.37±0.05
7.09±0.08* *
7.35±0.13△△
T4
30.5±1.9
, 百拇医药 11.8±3.1* *
26.5±1.8*△△
4.2±0.8
5.6±3.2
4.7±1.1
7.39±0.09
6.95±0.12* *
7.37±0.12△△
T5
29.9±2.9
10.5±2.7* *
, http://www.100md.com
28.8±2.1△△
4.3±0.5
6.2±3.4
4.3±0.9
7.38±0.08
6.94±0.11* *
7.39±0.08* *
* P<0.05, * * P<0.01, vs control group; △ P<0.05, △△ P<0.01, vs ALI group
(一)PaO2 对照组动物PaO2在观察6 h内未见明显改变(P>0.05)。肺损伤组在给予内毒素后PaO2呈进行性下降,PLV+肺损伤组在给予PFC 0.5 h后明显回升,其中给予PFC 1 h 及以后各点显著高于肺损伤组(P<0.01)。
, http://www.100md.com
(二)PaCO2 PaCO2在对照组、肺损伤组、PLV+肺损伤组3组之间各时点均无显著差异(P>0.05)。
(三)pH 对照组在观察时间内无明显变化(P>0.05);肺损伤组在注射内毒素后0.5 h即显著下降,PLV+肺损伤组在给予PFC后0.5 h即有所回升,以后与肺损伤组相比有显著差异(P<0.01)。
三、肺组织病理改变
光镜观察显示肺损伤组支气管痉挛,管腔狭窄,有粘液栓形成,肺间质及肺泡毛细血管明显扩张充血,支气管壁及毛细血管周围有大量炎性细胞浸润,肺泡隔内亦有炎性细胞浸润。液体通气组支气管痉挛较肺损伤组为轻,肺间质及肺泡毛细血管扩张不明显,有少量的炎性细胞浸润。
四、PS系统的超微结构变化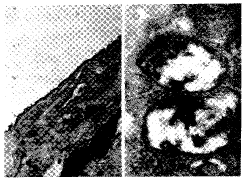
, http://www.100md.com
Fig 1 The ultrastructure of pulmonary surfactant system of control group: pulmonary surfactant layer was continuous, lamellar bodies in type Ⅱ pneumonocytes was normal (×30000)
图1 对照组肺表面活性物质系统超微结构
(一)正常PS系统形态 对照组透射电镜观察PS层呈双相,分为电子密度致密的界面层和电子密度较低的“下相”(hypophase)。气-液面的PS层呈连续的电子致密带。肺泡Ⅱ型上皮细胞微绒毛呈细长的指状突起,微绒毛间和表面覆盖有PS。Ⅱ型上皮细胞胞浆内有大量的板层小体和线粒体,板层小体胞核结构清晰(图1)。
, http://www.100md.com Fig 2 The ultrastructure of pulmonary surfactant system of ALI group: pulmonary surfactant layer was discontinuous, lamellar bodies in type Ⅱ pneumonocytes vacuolated, even necrotized and disrupted into the alveolar space (×30000)
图2 肺损伤组肺表面活性物质系统超微结构
Fig 3 The ultrastructure of pulmonary surfactant system of PLV+ALI group: pulmonary surfactant layer was still continuous, the vacuolation of lamellar bodies in type Ⅱ pneumonocytes was little (×30000)
, 百拇医药
图3 PLV+肺损伤组肺表面活性物质系统超微结构
(二)肺损伤时PS系统的改变 肺损伤时PS层失去柔和的线状表面,出现断裂、脱落入肺泡腔或聚集成块现象;肺泡Ⅱ型上皮细胞变性、坏死,甚至崩解,胞质内容物脱落入肺泡腔;板层小体空泡化;线粒体结构破坏;肺泡腔内有较多脱落的嗜锇性物质,并可见脱落的板层小体(图2)。
(三)液体通气时PS系统的变化 液体通气时PS层保留有柔和的线性表面;肺泡Ⅱ型上皮细胞有部分变性,但无坏死及崩解;板层小体空泡化不明显;线粒体结构完整(图3)。
讨 论
PS在肺泡II型上皮细胞的内质网合成,通过高尔基复合体转运到板层小体中储存,当板层小体通过胞吐作用被分泌入肺泡腔后,转变为管状髓磷脂,最终形成吸附在细支气管和肺泡表面的单分子膜,发挥降低细支气管、肺泡气-液界面张力,防止呼气末细支气管和肺泡塌陷的作用。
, 百拇医药
本研究采用改良的钌红-四氧化锇复合染色法观察PS系统超微结构,钌红主要与细胞表面和活性层下相的粘多糖成分反应,形成沉积物,四氧化锇与PS的卵磷脂反应而增加电子密度,同时四氧化锇被结合在组织上的钌红还原而分解成锇黑;将肺组织行整体灌注可增加肺组织的韧性,减少切割时肺泡面之间的摩擦,有助于保持完整的表面活性层;通过这一方法染色,可以清晰完整地观察PS系统超微结构。
本研究观察到正常大鼠有连续的PS层,且清楚显示肺泡Ⅱ型细胞中丰富的板层小体及线粒体;而ALI时观察到PS层堆积或脱落,板层小体和线粒体空泡化,Ⅱ型上皮细胞变性坏死、胞浆内容物脱落,提示ALI时有PS系统损伤,其损伤的可能机制有:(1)炎性反应时渗出的血浆蛋白与PS结合导致失活,以及炎性水肿和粘液分泌加速PS分解和清除,使PS量减少,机体通过自身调节要求肺泡Ⅱ型细胞代偿合成和分泌增加,但短时间PS系统不能维持正常的合成和分泌,因此出现板层小体的空泡化[5]。(2)ALI时缺氧和间质水肿致Ⅱ型上皮细胞代谢障碍,炎性水肿也可改变PS层的结构,出现结构紊乱和崩解。PS层的断裂和脱落使其难以发挥降低表面张力的作用;Ⅱ型上皮细胞的破坏直接影响PS的合成;板层小体的空泡化影响PS的分泌和功能发挥,说明ALI时PS系统的结构异常可使PS功能降低。这个病理过程在PS与ALI或ARDS发病的关系中可能起着一定的作用[6]。
, 百拇医药
PFC为一种无色的惰性液体,比重较高,表面张力低,具有充分的携氧和二氧化碳能力,极少量通过肺泡吸收入血,在体内不被代谢。本研究表明用PFC进行部分液体通气治疗内毒素肺损伤大鼠时,PS系统的损伤明显改善,其可能机制为:(1)抗炎作用:PFC可减少内毒素肺损伤时肺泡的渗出,减少中性粒细胞在肺的聚集,从而减轻肺损伤,其机制可能是抑制中性粒细胞与内皮细胞的粘附[7]。(2)肺灌洗作用:PFC可将肺泡和小气道内的分泌物和渗出物及形成透明膜的蛋白质清洗带入中央气道,通过抽吸排出;PFC极少经肺血管进入循环,不会发生肺间质水肿[8]。(3)促进内源性PS的产生:PFC不会被蛋白质灭活,可以在富含蛋白质的肺泡环境中降低表面张力,液体建立的呼气末正压可稳定肺泡结构,使肺泡充盈,供氧改善,加上清洗肺泡内蛋白质的作用,有利于内源性PS的产生和恢复[9]。
动物实验及临床报道应用部分液体通气可明显改善ARDS的肺部氧合功能,以及本研究显示内毒素肺损伤进行部分液体通气时PS系统超微结构的变化,这些结果对于部分液体通气在ARDS防治中的应用具有一定的指导意义。
, http://www.100md.com
[参 考 文 献]
[1] Bersten AD,Davidson K,Nicholas TE, et al. Respiratory mechanics and surfactant in the acute repiratory distress syndrome[J]. Clin Exp Pharmacol Physiol, 1998, 25:955~963.
[2] Clark LC, Gollan F. Survival of mammals breathing organic liquids equillibrated with oxygen at atmospheric pressure[J]. Science, 1966, 20: 1755~1756.
[3] Luft JH. Ruthenium red and violet. Ⅱ. Fine structure localization in animal tissues[J]. Anat Rec, 1971, 171:369~415.
, 百拇医药
[4] Bernard GR, Artigas A, Brigham KL, et al. The American-European consensus conference on ARDS:definitions, mechanisms, relevant outcomes, and clinical trial coordination[J]. Am J Respir Crit Care Med, 1994, 149:818~824.
[5] Seeger WG, Stohr G, Wolf HRD, et al. Alteration of surfactant function due to protein leakage:special interaction with fibrin monomer[J]. J Appl Physiol, 1985, 58:326~331.
[6] Bredenberg CE, Paskanik AM, Nieman GF. High surface tension pulmonary edema[J]. J Surg Res, 1983, 34:515~523.
, 百拇医药
[7] Leach CL, Fuhrman BP, Morin FC, et al. Perfluorocarbon-associated gas exchange(partial liquid ventilation) in respiratory distress syndrome: a prospective, randomized, controlled study[J]. Crit Care Med, 1993, 21:1270~1278.
[8] Nesti FD, Fuhrman BP, Papo MC, et al. Perfluocarbon-associated gas exchange in gastric aspiration[J]. Crit Care Med, 1994, 22:1445~1452.
[9] Shapiro B, Cane R, Harrison R. Positive endexpiratory pressure therapy in adults with special reference to acute lung injury: a review of the literature and suggested clinical correlations[J]. Crit Care Med, 1984, 12: 127~141.
[10] 陆月良,颜永碧. 微波照射在显示肺泡表面活性物质中的应用[J]. 解剖学杂志,1997,20:300~301.
[收稿日期] 1999-12-08 [修回日期] 2000-03-22, http://www.100md.com
单位:(第二军医大学长海医院麻醉科, 上海 200433)
关键词:肺表面活性剂;肺,损伤;超微结构
中国病理生理杂志000816
[摘 要] 目的: 研究部分液体通气对内毒素肺损伤大鼠肺表面活性物质(pulmonary surfactant,PS)系统超微结构的影响。方法:运用电子显微镜细胞化学方法,对内毒素肺损伤鼠PS系统进行观察及部分液体通气对其的影响。结果: 内毒素肺损伤后可见PS层失去连续性,呈断裂或堆积;肺泡II型细胞内板层小体、线粒体空泡化,少数发生坏死并崩解、脱落进入肺泡腔。液体通气+肺损伤组PS系统损伤程度明显低于内毒素肺损伤组。结论: 液体通气可明显改善内毒素肺损伤时PS系统的损伤。
[中图分类号] R655.3; R332 [文献标识码] A
, 百拇医药
[文章编号] 1000-4718(2000)08-0734-04
The effect of partial liquid ventilation on the ultrastructure of pulmonary
surfactant system in endotoxin-induced acute lung injury in rats
DENG Xiao-ming, LI Jin-bao, ZHU Ke-ming
(Department of Anesthesiology, Changhai Hospital, The Second Military
Medical University of PLA, Shanghai 200433,China)
, 百拇医药
[Abstract] AIM: To study the effect of partial liquid ventilation on the ultrastructure of pulmonary surfactant(PS) system in endotoxin-induced acute lung injury. METHODS: The effect of partial liquid ventilation on the ultrastructure of PS system in endotoxin-induced acute lung injury was observed with electronmicroscope histochemistry. RESULTS: There was ultrastructure impairment of PS system in endotoxin-induced acute lung injury, the pulmonary surfactant layer was discontinuous, lamellar bodies and plasmosomes in type Ⅱ pneumonocytes vacuolated, and a few of them were even necrotized and disrupted into the alveolar space. The pulmonary surfactant layer was still continuous, the vacuolation of lamellar bodies and plasmosomes in type Ⅱ pneumonocytes was little with partial liquid ventilation. CONCLUSION: Partial liquid ventilation can lessen the impairment of PS system in endotoxin-induced acute lung injury in rats.
, http://www.100md.com
[MeSH] Pulmonary surfactants; Lung injuries; Ultrastructure
在急性肺损伤(acute lung injury,ALI)、急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)、哮喘持续状态、肺移植等疾病中均存在肺表面活性物质(pulmonary surfactant,PS)的生化组成、功能、代谢异常[1]。自1966年Clark等[2]证明小鼠在自发性吸入充氧的高氟化碳(perfluocarbon,PFC)期间具有足够的气体交换能力以来,大量研究证实利用PFC实施部分液体通气(partial liquid ventilation,PLV)可显著改善ALI、ARDS动物及患者的气体交换和肺动力学特性。本研究利用电镜细胞化学方法进一步观察PLV对内毒素肺损伤大鼠PS系统超微结构的影响。
材 料 和 方 法
, http://www.100md.com
一、 实验动物分组及部分液体通气的实施
雄性SD大鼠18只(本校动物中心提供,280~400 g),实验前禁食12h,但不禁水。2.5%硫贲妥钠(60 mg/kg ip)麻醉后,气管切开插管,接动物呼吸机行机械通气,经左颈内静脉置管接微泵持续输注生理盐水2 mL/h,经右颈总动脉置管并肝素化连接多道生理记录仪监测血压。稳定20 min后,随机分为对照组、肺损伤组和PLV+肺损伤组(n=6),肺损伤组和PLV+肺损伤组均经颈静脉10 min内缓慢注射内毒素(E coli O111-B4,Sigma)8 mg/kg,对照组注入等量的生理盐水,PLV+肺损伤组在注射内毒素0.5h后经气管插管将PFC(美国Alliance制药公司生产)10 mL/kg缓慢注入肺内,5 min注完,注入时变动动物体位,以使PFC在肺内分布均匀,随后继续机械通气。3组机械通气参数相同(VT=10 mL/kg,RF=80 bpm,FiO2=0.60),肺损伤组和PLV+肺损伤组在注射内毒素前(T0)、注射内毒素0.5 h(T1)、1 h (T2)、2 h(T3)、4 h(T4)、6 h(T5),对照组在对应时点,取动脉血0.1 mL作血气分析。各点取血后注入0.1 mL生理盐水以补充血容量。各时点通过多道生理记录仪记录血压和心率。实验在注入内毒素6 h后结束,立即取肺组织行肺病理和PS超微结构的观察。
, http://www.100md.com
二、 肺组织标本的制备和观察
采用Luft的钌红-四氧化锇复合染色法[3],略加改动,在暗室中操作。
(一)试剂准备 1.钌红Ⅰ液:钌红10 mg/mL,0.3 mol/L二甲砷酸盐缓冲液(pH 7.3),18%戊二醛,1.8%单宁酸。将上述4种液体储存于4℃冰箱中备用,临用时按2∶2∶1∶1的比例配制混匀。2.钌红Ⅱ液:钌红10 mg/mL, 0.3 mol/L二甲砷酸盐缓冲液(pH 7.3),5%四氧化锇。将上述3种液体储存于4℃冰箱中备用,临用时按1∶1∶1的比例配制混匀。
(二)取材 经动脉放血处死大鼠,立即连同气管取出肺脏,气管口与装有“钌红Ⅰ液”的微泵注射器(黑色避光)延长管相连,用小针头于肺脏边缘散在性穿孔20~30个,以恒定流量灌流肺脏,0.5 h后取约1 mm×1 mm×1 mm的肺组织块10~15个投入有“钌红Ⅰ液”的小瓶中,并对小瓶抽气,以排除组织内残留气体,直至组织块沉至瓶底。如发现大体标本有陈旧性损伤(如陈旧性出血点、胸膜粘连等)则弃除不用。
, 百拇医药
(三)标本处理 按改良的Luft方法处理:1.前固定:将盛有标本的小瓶放入有水的培养皿中,置于微波炉中微波固定8 s,再放置4℃冰箱,1.5 h后去除浸泡液。2.后固定:0.1 mol/L二甲砷酸盐缓冲液冲洗组织块3次,每次10 min,接着加入“钌红Ⅱ液”3 mL浸泡,置于4℃冰箱,1 h后再用0.1 mol/L二甲砷酸盐缓冲液冲洗2次,每次8 min。3.脱水、包埋、切片、染色:经后固定及冲洗后的标本逐级用乙醇、丙酮系列脱水,环氧丙烷煤浸,环氧树脂(Epon 812)包埋,相差显微镜定位,超薄切片(厚约50~70 nm),醋酸铀和枸橼酸铅染色,H-800透射电镜观察。
(四)光镜标本的制作 采用10%甲醛浸泡固定,常规石蜡切片,苏木精-伊红染色,光镜观察。
三、统计方法
数据以
 ±s表示,对每一观察指标两组间同一时点采用非配对t检验。
±s表示,对每一观察指标两组间同一时点采用非配对t检验。, 百拇医药
结 果
一、部分液体通气对循环的影响
肺损伤组在注入内毒素后0.5 h血压和心率均下降,均无显著差异(P>0.05);PLV+肺损伤组与肺损伤组相比血压无明显差异(P>0.05),心率差异无显著(P>0.05)。
二、部分液体通气对内毒素肺损伤大鼠血气的影响(表 1)
表1 部分液体通气对内毒素肺损伤大鼠血气的影响
Tab 1 The effect of partial liquid ventilation on blood gas of rats with endotoxin-induced lung injury(
 ±s,n=6) Time
±s,n=6) Time, http://www.100md.com
(h)
PaO2(kPa)
PaCO2(kPa)
pH
Control
ALI
PLV+ALI
Control
ALI
PLV+ALI
Control
ALI
, 百拇医药
PLV+ALI
T0
31.4±3.2
32.2±4.3
29.8±1.7
4.3±1.0
3.9±0.7
4.1±0.9
7.39±0.07
7.40±0.08
7.39±0.06
T1
, 百拇医药
30.9±3.8
20.3±3.7* *
21.2±3.2* *
4.1±0.9
5.2±2.3
5.5±1.4
7.40±0.08
7.21±0.05* *
7.22±0.07* *
T2
, 百拇医药 31.9±4.1
15.7±2.3* *
20.1±1.9* *△
4.4±0.5
5.9±3.1
5.1±1.3
7.39±0.09
7.15±0.07* *
7.32±0.07△△
T3
30.7±2.3
, http://www.100md.com
12.9±1.9* *
23.6±2.1* *△△
4.0±0.6
6.0±2.4
5.0±1.0
7.37±0.05
7.09±0.08* *
7.35±0.13△△
T4
30.5±1.9
, 百拇医药 11.8±3.1* *
26.5±1.8*△△
4.2±0.8
5.6±3.2
4.7±1.1
7.39±0.09
6.95±0.12* *
7.37±0.12△△
T5
29.9±2.9
10.5±2.7* *
, http://www.100md.com
28.8±2.1△△
4.3±0.5
6.2±3.4
4.3±0.9
7.38±0.08
6.94±0.11* *
7.39±0.08* *
* P<0.05, * * P<0.01, vs control group; △ P<0.05, △△ P<0.01, vs ALI group
(一)PaO2 对照组动物PaO2在观察6 h内未见明显改变(P>0.05)。肺损伤组在给予内毒素后PaO2呈进行性下降,PLV+肺损伤组在给予PFC 0.5 h后明显回升,其中给予PFC 1 h 及以后各点显著高于肺损伤组(P<0.01)。
, http://www.100md.com
(二)PaCO2 PaCO2在对照组、肺损伤组、PLV+肺损伤组3组之间各时点均无显著差异(P>0.05)。
(三)pH 对照组在观察时间内无明显变化(P>0.05);肺损伤组在注射内毒素后0.5 h即显著下降,PLV+肺损伤组在给予PFC后0.5 h即有所回升,以后与肺损伤组相比有显著差异(P<0.01)。
三、肺组织病理改变
光镜观察显示肺损伤组支气管痉挛,管腔狭窄,有粘液栓形成,肺间质及肺泡毛细血管明显扩张充血,支气管壁及毛细血管周围有大量炎性细胞浸润,肺泡隔内亦有炎性细胞浸润。液体通气组支气管痉挛较肺损伤组为轻,肺间质及肺泡毛细血管扩张不明显,有少量的炎性细胞浸润。
四、PS系统的超微结构变化

, http://www.100md.com
Fig 1 The ultrastructure of pulmonary surfactant system of control group: pulmonary surfactant layer was continuous, lamellar bodies in type Ⅱ pneumonocytes was normal (×30000)
图1 对照组肺表面活性物质系统超微结构
(一)正常PS系统形态 对照组透射电镜观察PS层呈双相,分为电子密度致密的界面层和电子密度较低的“下相”(hypophase)。气-液面的PS层呈连续的电子致密带。肺泡Ⅱ型上皮细胞微绒毛呈细长的指状突起,微绒毛间和表面覆盖有PS。Ⅱ型上皮细胞胞浆内有大量的板层小体和线粒体,板层小体胞核结构清晰(图1)。

, http://www.100md.com Fig 2 The ultrastructure of pulmonary surfactant system of ALI group: pulmonary surfactant layer was discontinuous, lamellar bodies in type Ⅱ pneumonocytes vacuolated, even necrotized and disrupted into the alveolar space (×30000)
图2 肺损伤组肺表面活性物质系统超微结构

Fig 3 The ultrastructure of pulmonary surfactant system of PLV+ALI group: pulmonary surfactant layer was still continuous, the vacuolation of lamellar bodies in type Ⅱ pneumonocytes was little (×30000)
, 百拇医药
图3 PLV+肺损伤组肺表面活性物质系统超微结构
(二)肺损伤时PS系统的改变 肺损伤时PS层失去柔和的线状表面,出现断裂、脱落入肺泡腔或聚集成块现象;肺泡Ⅱ型上皮细胞变性、坏死,甚至崩解,胞质内容物脱落入肺泡腔;板层小体空泡化;线粒体结构破坏;肺泡腔内有较多脱落的嗜锇性物质,并可见脱落的板层小体(图2)。
(三)液体通气时PS系统的变化 液体通气时PS层保留有柔和的线性表面;肺泡Ⅱ型上皮细胞有部分变性,但无坏死及崩解;板层小体空泡化不明显;线粒体结构完整(图3)。
讨 论
PS在肺泡II型上皮细胞的内质网合成,通过高尔基复合体转运到板层小体中储存,当板层小体通过胞吐作用被分泌入肺泡腔后,转变为管状髓磷脂,最终形成吸附在细支气管和肺泡表面的单分子膜,发挥降低细支气管、肺泡气-液界面张力,防止呼气末细支气管和肺泡塌陷的作用。
, 百拇医药
本研究采用改良的钌红-四氧化锇复合染色法观察PS系统超微结构,钌红主要与细胞表面和活性层下相的粘多糖成分反应,形成沉积物,四氧化锇与PS的卵磷脂反应而增加电子密度,同时四氧化锇被结合在组织上的钌红还原而分解成锇黑;将肺组织行整体灌注可增加肺组织的韧性,减少切割时肺泡面之间的摩擦,有助于保持完整的表面活性层;通过这一方法染色,可以清晰完整地观察PS系统超微结构。
本研究观察到正常大鼠有连续的PS层,且清楚显示肺泡Ⅱ型细胞中丰富的板层小体及线粒体;而ALI时观察到PS层堆积或脱落,板层小体和线粒体空泡化,Ⅱ型上皮细胞变性坏死、胞浆内容物脱落,提示ALI时有PS系统损伤,其损伤的可能机制有:(1)炎性反应时渗出的血浆蛋白与PS结合导致失活,以及炎性水肿和粘液分泌加速PS分解和清除,使PS量减少,机体通过自身调节要求肺泡Ⅱ型细胞代偿合成和分泌增加,但短时间PS系统不能维持正常的合成和分泌,因此出现板层小体的空泡化[5]。(2)ALI时缺氧和间质水肿致Ⅱ型上皮细胞代谢障碍,炎性水肿也可改变PS层的结构,出现结构紊乱和崩解。PS层的断裂和脱落使其难以发挥降低表面张力的作用;Ⅱ型上皮细胞的破坏直接影响PS的合成;板层小体的空泡化影响PS的分泌和功能发挥,说明ALI时PS系统的结构异常可使PS功能降低。这个病理过程在PS与ALI或ARDS发病的关系中可能起着一定的作用[6]。
, 百拇医药
PFC为一种无色的惰性液体,比重较高,表面张力低,具有充分的携氧和二氧化碳能力,极少量通过肺泡吸收入血,在体内不被代谢。本研究表明用PFC进行部分液体通气治疗内毒素肺损伤大鼠时,PS系统的损伤明显改善,其可能机制为:(1)抗炎作用:PFC可减少内毒素肺损伤时肺泡的渗出,减少中性粒细胞在肺的聚集,从而减轻肺损伤,其机制可能是抑制中性粒细胞与内皮细胞的粘附[7]。(2)肺灌洗作用:PFC可将肺泡和小气道内的分泌物和渗出物及形成透明膜的蛋白质清洗带入中央气道,通过抽吸排出;PFC极少经肺血管进入循环,不会发生肺间质水肿[8]。(3)促进内源性PS的产生:PFC不会被蛋白质灭活,可以在富含蛋白质的肺泡环境中降低表面张力,液体建立的呼气末正压可稳定肺泡结构,使肺泡充盈,供氧改善,加上清洗肺泡内蛋白质的作用,有利于内源性PS的产生和恢复[9]。
动物实验及临床报道应用部分液体通气可明显改善ARDS的肺部氧合功能,以及本研究显示内毒素肺损伤进行部分液体通气时PS系统超微结构的变化,这些结果对于部分液体通气在ARDS防治中的应用具有一定的指导意义。
, http://www.100md.com
[参 考 文 献]
[1] Bersten AD,Davidson K,Nicholas TE, et al. Respiratory mechanics and surfactant in the acute repiratory distress syndrome[J]. Clin Exp Pharmacol Physiol, 1998, 25:955~963.
[2] Clark LC, Gollan F. Survival of mammals breathing organic liquids equillibrated with oxygen at atmospheric pressure[J]. Science, 1966, 20: 1755~1756.
[3] Luft JH. Ruthenium red and violet. Ⅱ. Fine structure localization in animal tissues[J]. Anat Rec, 1971, 171:369~415.
, 百拇医药
[4] Bernard GR, Artigas A, Brigham KL, et al. The American-European consensus conference on ARDS:definitions, mechanisms, relevant outcomes, and clinical trial coordination[J]. Am J Respir Crit Care Med, 1994, 149:818~824.
[5] Seeger WG, Stohr G, Wolf HRD, et al. Alteration of surfactant function due to protein leakage:special interaction with fibrin monomer[J]. J Appl Physiol, 1985, 58:326~331.
[6] Bredenberg CE, Paskanik AM, Nieman GF. High surface tension pulmonary edema[J]. J Surg Res, 1983, 34:515~523.
, 百拇医药
[7] Leach CL, Fuhrman BP, Morin FC, et al. Perfluorocarbon-associated gas exchange(partial liquid ventilation) in respiratory distress syndrome: a prospective, randomized, controlled study[J]. Crit Care Med, 1993, 21:1270~1278.
[8] Nesti FD, Fuhrman BP, Papo MC, et al. Perfluocarbon-associated gas exchange in gastric aspiration[J]. Crit Care Med, 1994, 22:1445~1452.
[9] Shapiro B, Cane R, Harrison R. Positive endexpiratory pressure therapy in adults with special reference to acute lung injury: a review of the literature and suggested clinical correlations[J]. Crit Care Med, 1984, 12: 127~141.
[10] 陆月良,颜永碧. 微波照射在显示肺泡表面活性物质中的应用[J]. 解剖学杂志,1997,20:300~301.
[收稿日期] 1999-12-08 [修回日期] 2000-03-22, http://www.100md.com