成纤维细胞介导的人IL-10基因疗法的实验研究
作者:陈敏亮 林子豪 曹雪涛△ 章卫平△ 陶 群△ 鞠佃文△ 雷 虹△ 吴 宏 宋慧锋
单位:
关键词:
摘要 目的摘要 目的:建立IL-10基因疗法的实验模型,并动态观察其体内IL-10分泌水平。方法和结果:构建携带鼠IL-10基因的重组逆转录病毒载体,体外转染小鼠NIH3T3成纤维细胞,筛选到1株高分泌IL-10的细胞克隆株;将此阳性克隆株移植到小鼠腹腔内,可在小鼠血清中检测出IL-10的活性。结论:成纤维细胞能成功地将IL-10基因导入体内并有效表达。
中国图书资料分类法分类号 R619.605
Study of experimental model of interleukin-10 gene therapy with fibroblasts
, 百拇医药
Chen Minliang, Lin Zihao, Cao Xuetao, Zhang Weiping, Tao Qun, Ju Dianwen, Lei Hong, Wu Hong, Song Huifeng (Department of Plastic and Reconstructive Surgery, Changzheng Hospital, Second Military Medical University, Shanghai, 200003)
Abstract Objective: To establish an experimental model of IL-10 gene therapy with fibroblasts. Methods and results: By infecting the murine fibroblast cell line NIH3T3 with pLGSN retrovirion,a cell clone designated as NIH3T3-IL-10 secreting the highest IL-10 level was obtained. The cell clone was expanded in vitro, encapsulated into collagen and implanted i.p. into mice. The activity of IL-10 could be detected in mouse serum. Conclusion: These results demonstrate that fibroblasts could successfully transfer the IL-10 gene which could express in vivo.
, 百拇医药
Key words interleukin-10; gene therapy; fibroblast
在同种组织器官移植中,目前存在的主要问题依然是移植后的免疫排斥反应。虽然各种免疫抑制剂已不断被发现,但临床应用仍有许多不尽人意之处。细胞因子白细胞介素10(IL-10)可以抑制免疫效应分子的产生[1],细胞因子可合成抑制因子(CSIF)[2],用于抑制同种移植排斥反应。另一方面,细胞因子基因疗法是近年来兴起的生物治疗学研究课题,在肿瘤治疗中具有很大潜力[3]。我们以IL-10基因为治疗性目的基因,以成纤维细胞为载体,建立了IL-10基因疗法的实验模型,并观察了其体内IL-10的分泌水平,为以后进一步的研究奠定基础。
1 材料和方法
1.1 主要试剂 小鼠IL-10重组逆转录病毒载体由日本Harmada博士惠赠,Superscript逆转录试剂盒、DMEM培养基均为Gibco公司产品,G418购自Sigma公司。
, 百拇医药
1.2 动物与细胞株 逆转录病毒的单向性包装细胞CRE细胞株和双向性包装细胞CRIP细胞株由德国MDC分子医学中心Blankenstein博士惠赠。小鼠成纤维细胞株NIH3T3由本校免疫学教研室保存。鼠IL-10 ELISA试剂盒购自Endogen公司;BALB/c小鼠购自上海西普尔-必凯动物有限公司。
1.3 IL-10重组逆转录病毒载体的包装及病毒滴度的测定 用Lipofectin (Gibco)脂质体融合法将IL-10逆转录病毒载体导入包装细胞CRE,进行第1次包装;取其病毒上清感染CRIP包装细胞(Polybrene 8 μg/ml),进行第2次包装。经600 μg/ml G418筛选得到包装细胞克隆株,病毒滴度的检测以NIH3T3细胞为靶细胞,结果用G418抗性克隆表示。
1.4 IL-10活性的检测 应用酶联免疫吸附试验 (ELISA)检测。
1.5 鼠胶原提取制备 采用乙醇浸泡,冰醋酸溶解等步骤从大鼠胶原中提取。制备好的胶原置4℃冰箱保存备用。
, 百拇医药
1.6 IL-10高分泌成纤维细胞克隆的体内移植 采用胶原包裹后腹腔内移植法。 将体外大量扩增、 处于对数生长期的成纤维细胞用胰酶消化后, 用Hank液洗2遍, 置于双倍DMEM培养基中(含20%小牛血清), 然后迅速与等体积的鼠胶原基质混匀, 再移植于小鼠腹腔中 (细胞数为1×107个/只)。
2 结 果
2.1 IL-10重组逆转录病毒载体的包装 IL-10重组逆转录病毒载体经体外包装,最终病毒滴度为3.8×105 CFU/ml。包装细胞在体外连续传代1个月,产生病毒的滴度比较稳定。大量扩增上述包装细胞,液氮冻存备用。
2.2 IL-10在NIH3T3细胞中的表达 用已包装好的IL-10逆转录病毒上清感染NIH3T3成纤维细胞,获得一分泌IL-10为824 U/ml的细胞克隆株(NIH3T3-IL-10);而野生型NIH3T3细胞及感染对照病毒的NIH3T3-Neo细胞均不分泌IL-10。NIH3T3-IL-10细胞在体外连续传代数月,表达IL-10的活性比较稳定(图1)。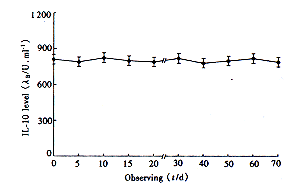
, http://www.100md.com
图 1 NIH3T3-IL-10细胞体外分泌IL-10的动态观察
Fig 1 Long-term observation on the IL-10 level secreted
by NIH3T3-IL-10 secreting the highest level of IL-10
2.3 NIH3T3-IL-10细胞植入体内后IL-10的表达 如图2所示,植入NIH3T3-IL-10细胞2 d后即可在小鼠血清中检测出其活性,于植入4 d时达峰值,持续检测30 d,均能检测到IL-10的活性;而移植对照细胞NIH3T3-Neo的小鼠则未检出。
3 讨 论
宿主对移植物的免疫排斥反应是同种组织器官移植中存在的最棘手的问题。免疫抑制剂的使用虽然能降低宿主对移植物的排斥反应,提高同种移植物的存活率,但也存在着许多不足,如需要反复使用、毒副作用严重,疗效受到一定的限制,且费用昂贵等。随着生物技术的发展和应用,基因治疗已成为研究热点,其治疗对象也不仅仅局限于单基因遗传病、恶性肿瘤的治疗,而是拓展到心血管疾病、移植排斥等更多的领域。在基因治疗的众多研究中,以细胞因子的免疫基因治疗居多,其模式之一是将细胞因子基因在体外转染载体细胞,经过适当的选择,把高分泌细胞因子的载体细胞回植宿主体内,让细胞因子在体内表达和分泌,从而达到治疗目的[4]。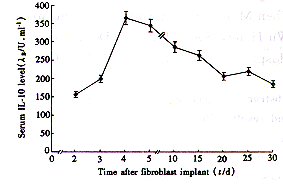
, http://www.100md.com
图 2 小鼠血清中IL-10分泌水平的动态观察
Fig 2 Dynamic observation on the serum IL-10 levels in mice
近来的研究表明,IL-10可以对免疫效应分子的产生起抑制作用,最主要的是对TH1细胞IFN-γ、IL-2、TNF-α、IL-1、IL-3、GM-CSF等的产生均有程度不同的抑制效应。在体外,IL-10能抑制单核细胞和巨噬细胞的活性,能够在一定程度上抑制机体受到某些抗原刺激后而发生的免疫应答,从而对移植排斥反应具有一定的抑制作用。为克服注射外源性药物的缺点,我们设想将有抗移植排斥作用的细胞因子IL-10的基因导入成纤维细胞使之表达并回植体内,使宿主体内持续分泌内源性细胞因子,降低宿主对移植物的排斥反应[5]。
本研究结果表明,用IL-10基因体外转染小鼠NIH3T3成纤维细胞,经基因转染的NIH3T3成纤维细胞能稳定、有效地表达导入的IL-10外源基因,并能将其携至体内表达。该结果为成纤维细胞介导的IL-10基因疗法抗移植排斥的进一步研究提供了可行性。有关IL-10基因在体内表达后对机体免疫功能的影响,我们将另文报道。
, 百拇医药
参 考 文 献
1 Everson MP, Spalding DM, Koopman WJ, et al. Enhancement of IL-2 induced T cell proliferation by a novel factor present in murine spleen dentritic cell-t cell culture supernatants. J Immunol, 1989,142(2):1183
2 Zlotuik A, Moore K. Interleukin-10. Cytokine, 1991,3(5):366
3 Gerard C, Bruyns C, Marchant A, et al. Interleukin-10 reduces the release of TNF and prevents lethatity in experimental endotoxemia. J Exp Med, 1993,177(2):547
, http://www.100md.com
4 Bradley JA, Gracie JA, Porteous C, et al. The role of CD4 and CD8 cells in rejection of class IMHC disparate renal allograft. Transp Proc, 1991,23(1 Pt):266
5 Durez P, Abramdwicz D, Gerard C, et al. In vivo induction of interleukin-10 by anti-CD3 monoclonal antibody or bacterial lipopolysaccharide: differential modulation by cyclosporin A. J Exp Med, 1993,177(2):551
(1998-04-06收稿, 1998-10-19修回), 百拇医药
单位:
关键词:
摘要 目的摘要 目的:建立IL-10基因疗法的实验模型,并动态观察其体内IL-10分泌水平。方法和结果:构建携带鼠IL-10基因的重组逆转录病毒载体,体外转染小鼠NIH3T3成纤维细胞,筛选到1株高分泌IL-10的细胞克隆株;将此阳性克隆株移植到小鼠腹腔内,可在小鼠血清中检测出IL-10的活性。结论:成纤维细胞能成功地将IL-10基因导入体内并有效表达。
中国图书资料分类法分类号 R619.605
Study of experimental model of interleukin-10 gene therapy with fibroblasts
, 百拇医药
Chen Minliang, Lin Zihao, Cao Xuetao, Zhang Weiping, Tao Qun, Ju Dianwen, Lei Hong, Wu Hong, Song Huifeng (Department of Plastic and Reconstructive Surgery, Changzheng Hospital, Second Military Medical University, Shanghai, 200003)
Abstract Objective: To establish an experimental model of IL-10 gene therapy with fibroblasts. Methods and results: By infecting the murine fibroblast cell line NIH3T3 with pLGSN retrovirion,a cell clone designated as NIH3T3-IL-10 secreting the highest IL-10 level was obtained. The cell clone was expanded in vitro, encapsulated into collagen and implanted i.p. into mice. The activity of IL-10 could be detected in mouse serum. Conclusion: These results demonstrate that fibroblasts could successfully transfer the IL-10 gene which could express in vivo.
, 百拇医药
Key words interleukin-10; gene therapy; fibroblast
在同种组织器官移植中,目前存在的主要问题依然是移植后的免疫排斥反应。虽然各种免疫抑制剂已不断被发现,但临床应用仍有许多不尽人意之处。细胞因子白细胞介素10(IL-10)可以抑制免疫效应分子的产生[1],细胞因子可合成抑制因子(CSIF)[2],用于抑制同种移植排斥反应。另一方面,细胞因子基因疗法是近年来兴起的生物治疗学研究课题,在肿瘤治疗中具有很大潜力[3]。我们以IL-10基因为治疗性目的基因,以成纤维细胞为载体,建立了IL-10基因疗法的实验模型,并观察了其体内IL-10的分泌水平,为以后进一步的研究奠定基础。
1 材料和方法
1.1 主要试剂 小鼠IL-10重组逆转录病毒载体由日本Harmada博士惠赠,Superscript逆转录试剂盒、DMEM培养基均为Gibco公司产品,G418购自Sigma公司。
, 百拇医药
1.2 动物与细胞株 逆转录病毒的单向性包装细胞CRE细胞株和双向性包装细胞CRIP细胞株由德国MDC分子医学中心Blankenstein博士惠赠。小鼠成纤维细胞株NIH3T3由本校免疫学教研室保存。鼠IL-10 ELISA试剂盒购自Endogen公司;BALB/c小鼠购自上海西普尔-必凯动物有限公司。
1.3 IL-10重组逆转录病毒载体的包装及病毒滴度的测定 用Lipofectin (Gibco)脂质体融合法将IL-10逆转录病毒载体导入包装细胞CRE,进行第1次包装;取其病毒上清感染CRIP包装细胞(Polybrene 8 μg/ml),进行第2次包装。经600 μg/ml G418筛选得到包装细胞克隆株,病毒滴度的检测以NIH3T3细胞为靶细胞,结果用G418抗性克隆表示。
1.4 IL-10活性的检测 应用酶联免疫吸附试验 (ELISA)检测。
1.5 鼠胶原提取制备 采用乙醇浸泡,冰醋酸溶解等步骤从大鼠胶原中提取。制备好的胶原置4℃冰箱保存备用。
, 百拇医药
1.6 IL-10高分泌成纤维细胞克隆的体内移植 采用胶原包裹后腹腔内移植法。 将体外大量扩增、 处于对数生长期的成纤维细胞用胰酶消化后, 用Hank液洗2遍, 置于双倍DMEM培养基中(含20%小牛血清), 然后迅速与等体积的鼠胶原基质混匀, 再移植于小鼠腹腔中 (细胞数为1×107个/只)。
2 结 果
2.1 IL-10重组逆转录病毒载体的包装 IL-10重组逆转录病毒载体经体外包装,最终病毒滴度为3.8×105 CFU/ml。包装细胞在体外连续传代1个月,产生病毒的滴度比较稳定。大量扩增上述包装细胞,液氮冻存备用。
2.2 IL-10在NIH3T3细胞中的表达 用已包装好的IL-10逆转录病毒上清感染NIH3T3成纤维细胞,获得一分泌IL-10为824 U/ml的细胞克隆株(NIH3T3-IL-10);而野生型NIH3T3细胞及感染对照病毒的NIH3T3-Neo细胞均不分泌IL-10。NIH3T3-IL-10细胞在体外连续传代数月,表达IL-10的活性比较稳定(图1)。

, http://www.100md.com
图 1 NIH3T3-IL-10细胞体外分泌IL-10的动态观察
Fig 1 Long-term observation on the IL-10 level secreted
by NIH3T3-IL-10 secreting the highest level of IL-10
2.3 NIH3T3-IL-10细胞植入体内后IL-10的表达 如图2所示,植入NIH3T3-IL-10细胞2 d后即可在小鼠血清中检测出其活性,于植入4 d时达峰值,持续检测30 d,均能检测到IL-10的活性;而移植对照细胞NIH3T3-Neo的小鼠则未检出。
3 讨 论
宿主对移植物的免疫排斥反应是同种组织器官移植中存在的最棘手的问题。免疫抑制剂的使用虽然能降低宿主对移植物的排斥反应,提高同种移植物的存活率,但也存在着许多不足,如需要反复使用、毒副作用严重,疗效受到一定的限制,且费用昂贵等。随着生物技术的发展和应用,基因治疗已成为研究热点,其治疗对象也不仅仅局限于单基因遗传病、恶性肿瘤的治疗,而是拓展到心血管疾病、移植排斥等更多的领域。在基因治疗的众多研究中,以细胞因子的免疫基因治疗居多,其模式之一是将细胞因子基因在体外转染载体细胞,经过适当的选择,把高分泌细胞因子的载体细胞回植宿主体内,让细胞因子在体内表达和分泌,从而达到治疗目的[4]。

, http://www.100md.com
图 2 小鼠血清中IL-10分泌水平的动态观察
Fig 2 Dynamic observation on the serum IL-10 levels in mice
近来的研究表明,IL-10可以对免疫效应分子的产生起抑制作用,最主要的是对TH1细胞IFN-γ、IL-2、TNF-α、IL-1、IL-3、GM-CSF等的产生均有程度不同的抑制效应。在体外,IL-10能抑制单核细胞和巨噬细胞的活性,能够在一定程度上抑制机体受到某些抗原刺激后而发生的免疫应答,从而对移植排斥反应具有一定的抑制作用。为克服注射外源性药物的缺点,我们设想将有抗移植排斥作用的细胞因子IL-10的基因导入成纤维细胞使之表达并回植体内,使宿主体内持续分泌内源性细胞因子,降低宿主对移植物的排斥反应[5]。
本研究结果表明,用IL-10基因体外转染小鼠NIH3T3成纤维细胞,经基因转染的NIH3T3成纤维细胞能稳定、有效地表达导入的IL-10外源基因,并能将其携至体内表达。该结果为成纤维细胞介导的IL-10基因疗法抗移植排斥的进一步研究提供了可行性。有关IL-10基因在体内表达后对机体免疫功能的影响,我们将另文报道。
, 百拇医药
参 考 文 献
1 Everson MP, Spalding DM, Koopman WJ, et al. Enhancement of IL-2 induced T cell proliferation by a novel factor present in murine spleen dentritic cell-t cell culture supernatants. J Immunol, 1989,142(2):1183
2 Zlotuik A, Moore K. Interleukin-10. Cytokine, 1991,3(5):366
3 Gerard C, Bruyns C, Marchant A, et al. Interleukin-10 reduces the release of TNF and prevents lethatity in experimental endotoxemia. J Exp Med, 1993,177(2):547
, http://www.100md.com
4 Bradley JA, Gracie JA, Porteous C, et al. The role of CD4 and CD8 cells in rejection of class IMHC disparate renal allograft. Transp Proc, 1991,23(1 Pt):266
5 Durez P, Abramdwicz D, Gerard C, et al. In vivo induction of interleukin-10 by anti-CD3 monoclonal antibody or bacterial lipopolysaccharide: differential modulation by cyclosporin A. J Exp Med, 1993,177(2):551
(1998-04-06收稿, 1998-10-19修回), 百拇医药