离子通道在卵母细胞中的表达及电生理实验方法
http://www.100md.com
37c医学网
作者:蒋学俊 李晓艳 Randall L Rasmusson
单位:蒋学俊 Randall L Rasmusson(Penn State College of Medicine,Department of Cellular and Molecular Physiology);李晓艳(Penn State College of Medicine,Department of Cellular and Molecular Physiology)(湖北医科大学附属第一医院心内科 湖北武汉 430060)
关键词:
中国心脏起搏与心电生理杂志000322 中图分类号 Q813.1+1 R331.3+8 文献标识码 A
文章编号 1007—2659(2000)03—0210—03
, http://www.100md.com
Ⅱ 卵母细胞的电生理实验方法
1 双微电极电压钳制法(two electrode voltageclamp,TEV)是卵母细胞电生理实验的基本方法。该方法操作简便。实际工作中也可用来筛选电流表达较好的卵母细胞进行cut-open及macro-patch实验。
1.1 基本原理 TEV需用两个电极插入细胞内,一个用于电位的钳制,一个用于通道电流的记录。参见图1。
图1 双微电极电压钳制法电路模式图
1.2 仪器、设备 多家公司提供双微电极电压钳制所需的放大器。以DAGAN公司为例,有CA-1B,TEV-200A,Cell clamp2等多种型号供选择。其他设备需显微镜一台,示波器一台,三维微操纵器两个,数模转换器、计算机及相关软件一套。记录槽可选用Warner公司的RC系列,具体方法可在http://www.warnerinstrument.com网站上查找。
, 百拇医药
实验要求仪器有良好的稳定性和接地。相对而言,本方法对环境要求并不很高,无气垫屏蔽台也可。
电极:实验所需电极尖端直径约1~5 μm,电阻在0.5~1.5 MΩ之间。常规的电极拉制器即可满足需要,拉制好的电极在一定湿度的容器中可保存数天。有人认为,只要电极的电阻合适,电极可反复使用,但我们均为一次性使用。
琼脂糖盐桥:实验需2~3个琼脂糖盐桥,浓度为1%~2%,置入相应大小的支持物中,其内充以3M的KCl溶液。三个盐桥一端置入记录槽中,一端连接于P1,P2及V2。以CA-1B为例,headstage V1用于电压的钳制,Vi则用于通道电流的记录。
1.3 实验方法 首先在记录槽底部正中粘上一小片网格状薄片,或用刀片在记录槽底部划出网格状细槽,以防止钳制和灌流时卵母细胞在底部滑动。挑选状态良好的细胞置入正中,使着色部分朝上,这样易于看清针尖的位置。
, http://www.100md.com
在拉制好的电极中充以3M的KCl溶液,插入到headstage上,待针尖进入液面后,将放大器上的V1,V2,Vi电位调节至零电位,同时测量电极的电阻是否满足要求。
卵母细胞体积较大,准确判断针尖和细胞的相对位置十分重要,需要足够的耐心和反复实践。如果使用倒置显微镜,针尖位置更难看清,可用以下方法判断:两电极以45°从左右两个方向穿刺。首先调节焦距使卵母细胞的边缘清晰(位置A),然后调节焦距使细胞底部平面清晰(位置B),AB之间的距离(a)相当于卵母细胞的半径,再将焦距从位置A向相反方向转动相同的距离(位置C),使AC=AB,小心调节电极位置使其尖端位于C平面和卵母细胞边缘处(图2)。此时应观察放大器上膜电位的变化,以此判断电极尖端的位置。当电极接触到细胞膜时,膜电位可能有轻微的变化,再稍向下旋转,电极刺入细胞,膜电位一般在-20~-80 mV。注意穿刺的角度很重要,角度不准则位置判断可能出现偏差,导致钳制失败或漏电流过大。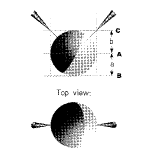
, 百拇医药
图2 微电极穿刺卵母细胞的侧面观(上图)和上面观(下图)
穿刺成功后即可实现电压钳制,记录通道电流。实际上,电压钳制是将记录槽中的液体均钳制到同一电位,液体过多容易造成振荡,因此记录时应尽可能降低记录槽中液面水平。
液体灌流:本方法可很方便进行细胞外灌流。使用重力即可实现有效灌流,也可用吸管手工进行灌流,另一端用负压抽吸。灌流过程中降低Clamp Gain,避免振荡。如果需要在记录过程中持续灌流,应保持匀速,同时保持较低的液面水平。
1.4 小结
TEV是卵母细胞电生理实验的基本方法,主要的优点在于:操作简单,对设备要求不高;记录稳定,可长达数小时;细胞外灌流简便;对电流大小要求不高;相对而言,对细胞状态的要求也不是很严格。
主要问题:本方法时间和空间上的分辨率不高,如果需要记录很快的信号,则要用patch clamp技术。另一个主要问题是实验过程中电极的电阻可能增加,常引起振荡,影响钳制。电极插入细胞后可能出现两种情况:一是细胞内成分通过电极尖端渗入到电极中,另一种情况是电极内液渗入到胞浆中,前者是引起电极电阻增高的主要原因。因此,比较理想的情况是使电极内的液体缓慢外渗,但这很难预测和控制,因此常需在怀疑电阻增高时测量电极的电阻。
, 百拇医药
2 macro-patch voltage clamp 和 giant-patch voltage clamp
Macro-patch和giant-patch电压钳方法实际上是从膜片钳技术上发展出来的,主要的差别在于电极尖端直径较大,可记录到几个至几十个通道的电流,适用于通道电流密度较低的情况。此方法也可形成内面向外(inside-out)和外面向外(outside-out)的记录方式,对研究细胞内、外环境对通道功能的影响有很重要的作用。
2.1 基本原理 同patch-clamp原理相似。通过特殊处理的电极,使电极尖端和细胞膜表面形成1~100 GΩ的高阻抗封接。形成这种紧密封接后,不仅可进行细胞贴附(cell attached)式记录,还可将膜片从细胞上游离下来,进行内面向外或外面向外的记录。记录的方法以及得到的电流图形和全细胞记录技术相近。
2.2 仪器 与常规膜片钳技术一样,包括放大器、显微镜、示波器、三维微操纵器、数模转换器、计算机及相关软件。
, 百拇医药
实验需良好的稳定性和接地,本方法对环境要求较高,应在气垫屏蔽台中进行实验。
2.3 电极 电极处理是本方法最重要的部分之一。
用于macro-patch的电极尖端大小一般在5~10 μm,电阻小于1 MΩ。电极可用常规电极拉制器拉制,并在电极前端涂抹一薄层硅酮树酯(sylgard)。Sylgard是由两部分在使用前混合而成,可在4℃下保存一周。涂抹时注意不要影响电极尖端,尾端应超出液面水平。处理的目的在于减小电极和细胞外液之间的电容,并形成亲水界面。处理后的电极对封接并无影响,但可明显降低本底噪音。此后电极还需抛光,在显微镜下将电极尖端靠近铂金丝,通电加热时,电极尖端微微回缩,尖端更加光滑,易于封接。
用于giant-patch的电极尖端更大,直径在20~40 μm,电阻在200 KΩ以下。常规方法拉制的电极无法满足这样的要求,因此拉制后需切去尖端。在抛光器上换为直径0.3~0.6 mm的铂金丝,通电加热后,用低熔点的软质玻璃拉制的电极接触铂金丝,此电极尖端则在铂金丝上熔化形成球状。移走此电极,将待切的电极逐渐靠近铂金丝,稍加热,待玻璃球熔时,将电极尖端插入到玻璃球中,断电使铂金丝上玻璃球快速冷却,迅速提起电极,电极尖端与玻璃球融在一起而被切断,见图3。如果电极尖端不理想,可重复数次直至满足实验需要。
, 百拇医药
电极处理的第二步是抛光,抛光过程与其他的电极处理相同。图4示抛光前后电极尖端的形状。
图3 电极制备过程图示
图4 电极尖端抛光前后对比 抛光前(左),抛光后(右)
为降低噪音,增加高阻封接的成功率,还需在抛光后的电极上涂以一种混合物。混合物常用配方为:在等量的轻、重矿物油中加入5%~10%的石蜡膜(parafilm),稍加热,不断搅拌至胶状。如混合物较稀薄,则将电极在其中快速蘸一下取出,电极前端会形成一层薄膜。如混合物较为粘稠,则用细玻棒蘸取后,在显微镜下小心涂抹于电极的前端。涂抹后封接可能更为困难,但一旦封接成功,则较为稳定,有利于细胞膜片的游离。在混合物中加入5%~10%的蜡可能会提高封接的稳定性。
, 百拇医药
2.4 高阻封接的形成 总的说来,实验技术和心肌细胞膜片钳技术方法相似,因此不再重复。根据卵母细胞的特点,以下几点与小细胞的封接技术有所不同。
(1)一般而言,心肌细胞实验中电极的角度以45°为宜,但对于卵母细胞的钳制,角度应较平,一方面易于封接,另一方面也有利于膜片的游离。
(2)相对而言,卵母细胞的高阻封接较为困难。阻抗从几十兆到几百兆增加较快,但几百兆到千兆封接的形成可能需数分钟的时间。此时,给予轻度的刺激可能有所帮助。少数情况下,也可以和小细胞一样很快封接成功。
(3)实验条件要求更高,实验台的稳定和良好的接地均十分重要,尤其在膜片游离以后,任何轻微的干扰都可能导致高阻封接脱落。
(4)膜片游离后,有效的实验时间一般仅能维持15~30 min,因此实验设计和信号采集均需周密计划。
, 百拇医药
(5)本方法形成外面向外方式比较困难。若实验需要,则应选用厚壁的电极管拉制电极。实验过程参见图5。
图5 内面向外和外面向外实验方法模式图
(6)本方法最主要的特点之一是可以很方便地进行细胞内(inside-out)或细胞外(outside-out)的灌流,因此,灌流的装置和方法就显得十分重要。由于实验时间有限,必须强调局部灌流,即用很精细的毛细管从游离膜片的对面直接进行灌流。首先,必须保证灌流的有效性,可在显微镜下观察灌流液是否直接冲向游离的细胞膜。第二,必须保证灌流时封接的稳定性。因此在正式实验前,应预先测定不同的灌流速度(在保证有效灌流的前提下)时封接稳定的维持时间。第三,实验中常常需要记录很快的信号变化,有时需观察灌流液切换过程中通道电流的动态变化,因此,灌流的控制建议采用数字控制(开-关)和压力控制(流速)。可参考ALA公司的灌流系统ALA-BPA系列和压力调节系统PR-10(http://www.alascience.com)。
, 百拇医药
2.5 小结
主要优点:电极尖端大,可记录到多个通道的电流,可用于电导较低的通道;具有很高的时间和空间分辨率;形成内面向外的方式后,可很方便地控制细胞内成分,且不受细胞内其他间接因素的影响。
主要缺点:实验对设备环境要求高,对细胞的状态和电流大小要求均高,TEV方法记录到细胞电流在10 μA以上时,才有可能用本方法记录到电流;实验时间较短,大多在30 min以内;一般情况下,外面向外方式很难成功。
(待续)
作者简介:蒋学俊(1967— ),男(汉族),湖北武汉人,博士后,现从事心血管的临床及基础研究。
(2000-10-07收稿), 百拇医药
单位:蒋学俊 Randall L Rasmusson(Penn State College of Medicine,Department of Cellular and Molecular Physiology);李晓艳(Penn State College of Medicine,Department of Cellular and Molecular Physiology)(湖北医科大学附属第一医院心内科 湖北武汉 430060)
关键词:
中国心脏起搏与心电生理杂志000322 中图分类号 Q813.1+1 R331.3+8 文献标识码 A
文章编号 1007—2659(2000)03—0210—03
, http://www.100md.com
Ⅱ 卵母细胞的电生理实验方法
1 双微电极电压钳制法(two electrode voltageclamp,TEV)是卵母细胞电生理实验的基本方法。该方法操作简便。实际工作中也可用来筛选电流表达较好的卵母细胞进行cut-open及macro-patch实验。
1.1 基本原理 TEV需用两个电极插入细胞内,一个用于电位的钳制,一个用于通道电流的记录。参见图1。

图1 双微电极电压钳制法电路模式图
1.2 仪器、设备 多家公司提供双微电极电压钳制所需的放大器。以DAGAN公司为例,有CA-1B,TEV-200A,Cell clamp2等多种型号供选择。其他设备需显微镜一台,示波器一台,三维微操纵器两个,数模转换器、计算机及相关软件一套。记录槽可选用Warner公司的RC系列,具体方法可在http://www.warnerinstrument.com网站上查找。
, 百拇医药
实验要求仪器有良好的稳定性和接地。相对而言,本方法对环境要求并不很高,无气垫屏蔽台也可。
电极:实验所需电极尖端直径约1~5 μm,电阻在0.5~1.5 MΩ之间。常规的电极拉制器即可满足需要,拉制好的电极在一定湿度的容器中可保存数天。有人认为,只要电极的电阻合适,电极可反复使用,但我们均为一次性使用。
琼脂糖盐桥:实验需2~3个琼脂糖盐桥,浓度为1%~2%,置入相应大小的支持物中,其内充以3M的KCl溶液。三个盐桥一端置入记录槽中,一端连接于P1,P2及V2。以CA-1B为例,headstage V1用于电压的钳制,Vi则用于通道电流的记录。
1.3 实验方法 首先在记录槽底部正中粘上一小片网格状薄片,或用刀片在记录槽底部划出网格状细槽,以防止钳制和灌流时卵母细胞在底部滑动。挑选状态良好的细胞置入正中,使着色部分朝上,这样易于看清针尖的位置。
, http://www.100md.com
在拉制好的电极中充以3M的KCl溶液,插入到headstage上,待针尖进入液面后,将放大器上的V1,V2,Vi电位调节至零电位,同时测量电极的电阻是否满足要求。
卵母细胞体积较大,准确判断针尖和细胞的相对位置十分重要,需要足够的耐心和反复实践。如果使用倒置显微镜,针尖位置更难看清,可用以下方法判断:两电极以45°从左右两个方向穿刺。首先调节焦距使卵母细胞的边缘清晰(位置A),然后调节焦距使细胞底部平面清晰(位置B),AB之间的距离(a)相当于卵母细胞的半径,再将焦距从位置A向相反方向转动相同的距离(位置C),使AC=AB,小心调节电极位置使其尖端位于C平面和卵母细胞边缘处(图2)。此时应观察放大器上膜电位的变化,以此判断电极尖端的位置。当电极接触到细胞膜时,膜电位可能有轻微的变化,再稍向下旋转,电极刺入细胞,膜电位一般在-20~-80 mV。注意穿刺的角度很重要,角度不准则位置判断可能出现偏差,导致钳制失败或漏电流过大。

, 百拇医药
图2 微电极穿刺卵母细胞的侧面观(上图)和上面观(下图)
穿刺成功后即可实现电压钳制,记录通道电流。实际上,电压钳制是将记录槽中的液体均钳制到同一电位,液体过多容易造成振荡,因此记录时应尽可能降低记录槽中液面水平。
液体灌流:本方法可很方便进行细胞外灌流。使用重力即可实现有效灌流,也可用吸管手工进行灌流,另一端用负压抽吸。灌流过程中降低Clamp Gain,避免振荡。如果需要在记录过程中持续灌流,应保持匀速,同时保持较低的液面水平。
1.4 小结
TEV是卵母细胞电生理实验的基本方法,主要的优点在于:操作简单,对设备要求不高;记录稳定,可长达数小时;细胞外灌流简便;对电流大小要求不高;相对而言,对细胞状态的要求也不是很严格。
主要问题:本方法时间和空间上的分辨率不高,如果需要记录很快的信号,则要用patch clamp技术。另一个主要问题是实验过程中电极的电阻可能增加,常引起振荡,影响钳制。电极插入细胞后可能出现两种情况:一是细胞内成分通过电极尖端渗入到电极中,另一种情况是电极内液渗入到胞浆中,前者是引起电极电阻增高的主要原因。因此,比较理想的情况是使电极内的液体缓慢外渗,但这很难预测和控制,因此常需在怀疑电阻增高时测量电极的电阻。
, 百拇医药
2 macro-patch voltage clamp 和 giant-patch voltage clamp
Macro-patch和giant-patch电压钳方法实际上是从膜片钳技术上发展出来的,主要的差别在于电极尖端直径较大,可记录到几个至几十个通道的电流,适用于通道电流密度较低的情况。此方法也可形成内面向外(inside-out)和外面向外(outside-out)的记录方式,对研究细胞内、外环境对通道功能的影响有很重要的作用。
2.1 基本原理 同patch-clamp原理相似。通过特殊处理的电极,使电极尖端和细胞膜表面形成1~100 GΩ的高阻抗封接。形成这种紧密封接后,不仅可进行细胞贴附(cell attached)式记录,还可将膜片从细胞上游离下来,进行内面向外或外面向外的记录。记录的方法以及得到的电流图形和全细胞记录技术相近。
2.2 仪器 与常规膜片钳技术一样,包括放大器、显微镜、示波器、三维微操纵器、数模转换器、计算机及相关软件。
, 百拇医药
实验需良好的稳定性和接地,本方法对环境要求较高,应在气垫屏蔽台中进行实验。
2.3 电极 电极处理是本方法最重要的部分之一。
用于macro-patch的电极尖端大小一般在5~10 μm,电阻小于1 MΩ。电极可用常规电极拉制器拉制,并在电极前端涂抹一薄层硅酮树酯(sylgard)。Sylgard是由两部分在使用前混合而成,可在4℃下保存一周。涂抹时注意不要影响电极尖端,尾端应超出液面水平。处理的目的在于减小电极和细胞外液之间的电容,并形成亲水界面。处理后的电极对封接并无影响,但可明显降低本底噪音。此后电极还需抛光,在显微镜下将电极尖端靠近铂金丝,通电加热时,电极尖端微微回缩,尖端更加光滑,易于封接。
用于giant-patch的电极尖端更大,直径在20~40 μm,电阻在200 KΩ以下。常规方法拉制的电极无法满足这样的要求,因此拉制后需切去尖端。在抛光器上换为直径0.3~0.6 mm的铂金丝,通电加热后,用低熔点的软质玻璃拉制的电极接触铂金丝,此电极尖端则在铂金丝上熔化形成球状。移走此电极,将待切的电极逐渐靠近铂金丝,稍加热,待玻璃球熔时,将电极尖端插入到玻璃球中,断电使铂金丝上玻璃球快速冷却,迅速提起电极,电极尖端与玻璃球融在一起而被切断,见图3。如果电极尖端不理想,可重复数次直至满足实验需要。
, 百拇医药
电极处理的第二步是抛光,抛光过程与其他的电极处理相同。图4示抛光前后电极尖端的形状。

图3 电极制备过程图示

图4 电极尖端抛光前后对比 抛光前(左),抛光后(右)
为降低噪音,增加高阻封接的成功率,还需在抛光后的电极上涂以一种混合物。混合物常用配方为:在等量的轻、重矿物油中加入5%~10%的石蜡膜(parafilm),稍加热,不断搅拌至胶状。如混合物较稀薄,则将电极在其中快速蘸一下取出,电极前端会形成一层薄膜。如混合物较为粘稠,则用细玻棒蘸取后,在显微镜下小心涂抹于电极的前端。涂抹后封接可能更为困难,但一旦封接成功,则较为稳定,有利于细胞膜片的游离。在混合物中加入5%~10%的蜡可能会提高封接的稳定性。
, 百拇医药
2.4 高阻封接的形成 总的说来,实验技术和心肌细胞膜片钳技术方法相似,因此不再重复。根据卵母细胞的特点,以下几点与小细胞的封接技术有所不同。
(1)一般而言,心肌细胞实验中电极的角度以45°为宜,但对于卵母细胞的钳制,角度应较平,一方面易于封接,另一方面也有利于膜片的游离。
(2)相对而言,卵母细胞的高阻封接较为困难。阻抗从几十兆到几百兆增加较快,但几百兆到千兆封接的形成可能需数分钟的时间。此时,给予轻度的刺激可能有所帮助。少数情况下,也可以和小细胞一样很快封接成功。
(3)实验条件要求更高,实验台的稳定和良好的接地均十分重要,尤其在膜片游离以后,任何轻微的干扰都可能导致高阻封接脱落。
(4)膜片游离后,有效的实验时间一般仅能维持15~30 min,因此实验设计和信号采集均需周密计划。
, 百拇医药
(5)本方法形成外面向外方式比较困难。若实验需要,则应选用厚壁的电极管拉制电极。实验过程参见图5。

图5 内面向外和外面向外实验方法模式图
(6)本方法最主要的特点之一是可以很方便地进行细胞内(inside-out)或细胞外(outside-out)的灌流,因此,灌流的装置和方法就显得十分重要。由于实验时间有限,必须强调局部灌流,即用很精细的毛细管从游离膜片的对面直接进行灌流。首先,必须保证灌流的有效性,可在显微镜下观察灌流液是否直接冲向游离的细胞膜。第二,必须保证灌流时封接的稳定性。因此在正式实验前,应预先测定不同的灌流速度(在保证有效灌流的前提下)时封接稳定的维持时间。第三,实验中常常需要记录很快的信号变化,有时需观察灌流液切换过程中通道电流的动态变化,因此,灌流的控制建议采用数字控制(开-关)和压力控制(流速)。可参考ALA公司的灌流系统ALA-BPA系列和压力调节系统PR-10(http://www.alascience.com)。
, 百拇医药
2.5 小结
主要优点:电极尖端大,可记录到多个通道的电流,可用于电导较低的通道;具有很高的时间和空间分辨率;形成内面向外的方式后,可很方便地控制细胞内成分,且不受细胞内其他间接因素的影响。
主要缺点:实验对设备环境要求高,对细胞的状态和电流大小要求均高,TEV方法记录到细胞电流在10 μA以上时,才有可能用本方法记录到电流;实验时间较短,大多在30 min以内;一般情况下,外面向外方式很难成功。
(待续)
作者简介:蒋学俊(1967— ),男(汉族),湖北武汉人,博士后,现从事心血管的临床及基础研究。
(2000-10-07收稿), 百拇医药