鼠种植性胃肿瘤模型的制作方法及抗癌药物的治疗作用
http://www.100md.com
37c医学网
作者:陶凯雄 田源 陈道达
单位:同济医科大学附属协和医院外科,武汉 430022
关键词:种植性胃肿瘤;Walker-256细胞株;阿霉素
同济医科大学学报000314 摘要 利用Walker-256细胞株可成功地复制出种植性 胃肿瘤模型,病理组织学证实该肿瘤与皮下实体瘤同源;皮下注射阿霉素可明显改善荷瘤鼠 的生存质量,延长其生存时间,抑制肿瘤的生长(P<0.01),提示该动物模型的制作及初 步实验为胃癌的实验研究提供了较为理想的动物模型。
中图法分类号 R735.2, R979.1, R329.2
Development of Implanted Gastric Tumor M odel in Mice and Therapeutic
, 百拇医药
Effects of Anticarcinogen
Tao Kaixiong Tian Yuan Chen Daoda
(Department of Surgery, Xiehe Hospital, Tonggi Medical University, Wuhan 430022)
Abstract The models of implanted gastric tumor in mice were dup licated successfully by using malignant tumor cell line Walker-256. Their histo pathologic features were homologous to those of the subcutaneous implanted tumor of Walker-256 cells in mice. Subcutaneous injection of adriamycin could obviou sly improve the life qualities of the mice bearing implanted gastric tumor, prol ong the survival time and inhibit the tumor growth (P<0.01), suggesting that the model of implanted gastric tumor in mice was an ideal one for the experimen tal study in gastric cancer.
, 百拇医药
Key words implanted gastric tumor; Walker-256 cell line; adr iamycin
制作实验动物的肿瘤模型对于肿瘤的研究和抗肿瘤药物的研制、开发及筛选等工作有极其重 要的意义。本研究从1997年3月至1998年1月,利用Walker-256细胞株成功地复制出大鼠种 植性胃肿瘤模型,并观察阿霉素对该肿瘤生长的抑制作用,旨在探讨该动物模型的制作方法 及意义。
1 材料与方法
1.1 材料与药品
1.1.1Walker-256癌肉瘤细胞株:由中国医学科学院药物研究所提供。
1.1.2 动物:纯系健康Wistar大白鼠24只,雄性,鼠龄8周,体重250~300 g,均由同济 医科大学实验动物学部提供。
, 百拇医药
1.1.3 盐酸阿霉素注射针剂:为意大利爱宝大药厂生产。
1.2 实验方法
1.2.1动物肿瘤模型的制作方法:①皮下实体瘤的复制:将冷存的Walker-256细胞株 复苏后,取0.1~0.2 ml(含细胞约106个)注入Wistar大白鼠腹腔内,清洁条件饲养, 5 ~7 d即可形成鼠肿瘤性腹水模型。腹水台盼蓝染色判断瘤细胞活性,巴氏染色分类判定瘤细 胞纯度。然后取腹水约0.1 ml(含瘤细胞约1~2×105 个,存活率99%,纯度>95%)接种 于 2只Wistar大白鼠后肢皮下,7~10 d即形成皮下实体瘤。②鼠种植性胃肿瘤模型的制作:(1) 严格无菌条件切取上述皮下实体瘤肿块,生理盐水洗尽血迹,剪成约0.5 mm×0.1 mm大小 的 组织碎片备用。(2)22只Wistar大白鼠10 g/L异戊巴比妥钠腹腔麻醉,仰卧位,四肢固定于 手术台上,腹腔以25 g/L碘酊和600 g/L酒精消毒皮肤,取上腹正中切口约1.0~1.5 cm切 开皮肤,沿腹白线进腹腔,暴露鼠胃,于胃窦区前壁近小弯侧以眼科镊(尖头)或玻璃探针 刺破胃壁浆膜层1.0~1.5 mm。探针潜行钝性刺入胃壁肌层或达粘膜下层(勿刺破粘膜层 )。(3)选取适当之备用肿瘤组织碎片一块,塞入胃壁浆肌层隧道内,局部压迫3~4 min, 若接种组织块易脱落时,可用胃周少许网膜覆盖接种区或用5-0可吸收线间断缝合一针,检 查无明显渗血后逐层关腹。(2只动物因麻醉意外死亡,20只存活动物纳入实验组)1周左右 沿原切口进腹观测肿瘤的生长情况,并取少许肿瘤组织病理学检查。
, 百拇医药
1.2.2 阿霉素对鼠种植性胃肿瘤的治疗作用:① 分组及治疗方法:20只肿瘤模型动物分 为治疗组(10只):接种后1周开始于后侧肢体皮下注射阿霉素针剂(5 mg/kg),隔日1次, 共5次;对照组(10只):注射生理盐水。②观察指标:(1)动物的一般状况包括活动、对外 界的刺激、饮食及皮毛光泽等情况。(2)肿瘤的抑制率及动物生存时间延长率:每组各取5只 实验动物于接种后第28 d开腹,精密卡尺测量肿瘤最长径a(cm)及垂直最短径b(cm),根据公 式=0.4ab2[1]求得肿瘤近似体积,按下列公式计算肿瘤体积抑制率。继续 相同条件 下饲养,观察各组动物的生存时间并计算出生存时间延长率。(3)肿瘤的病理组织学观察: 分别取Walker-256细胞的皮下实体瘤,种植性胃肿瘤及治疗组瘤体标本,100 ml/L福尔马 林固定,沿肿瘤长轴切开取材,常规石蜡包埋制片,HE染色,光学显微镜观察。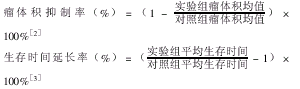
1.3 统计方法
, 百拇医药
数据采用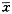 ±s,配对资料t检验。
±s,配对资料t检验。
2 结果
2.1 制作成功的鼠种植性胃肿瘤模型
鼠Walker-256细胞皮下实体瘤模型于接种后7~10 d即可见鼠后肢接种区形成约1.0~1.5 cm的肿块形成,病理组织学呈实体瘤表现, 见图1。
鼠Walker-256细胞种植性胃肿瘤于接种后7 d左右形成,原切口进腹可见在鼠胃接种区形成 大小约0.5~0.6 cm的肿瘤,表面光滑,与周围网膜少许粘连,易分开,边界清,无明显 脏 器侵犯,见图2,组织学证实与皮下实体瘤同源,见图3,该肿瘤模型复制成功率为100%(20 /20)。
2.2 抗癌药物对鼠种植性胃肿瘤的抑制作用
, 百拇医药
实验鼠一般状况的观察:对照组实验动物于接种2周后出现食量明显减少,活动少,倦怠状 ,对外界刺激反应迟钝,皮毛欠光泽,逐渐消瘦,甚至腹水形成,而治疗组接种后1周即开 始注射阿霉素,约于4周后才陆续出现上述表现。
治疗组动物种植性胃肿瘤的生长抑制率及生存时间延长率的变化:于接种后第28 d观察两组 移植肿瘤的生长情况,结果治疗组鼠胃肿瘤生长明显缓慢,治疗组和对照组肿瘤体积分别为 (3.37±0.36) cm3 和(6.58±0.72) cm3,肿瘤体积抑制率为48.8%(P<0.05 );治 疗组动物生存时间与对照组比较普遍延长,分别为(43.6±10.4) d和(21.3±5.8) d, 治疗组动物生存时间延长率达104.7%(P<0.05)。
2.3 鼠种植性胃肿瘤的病理组织学观察
空白组瘤体组织学显示肿瘤细胞生长活跃,瘤细胞排列规律,核分裂相多见,核浆比例 增大,较少炎性浸润;而治疗组,则可见部分肿瘤细胞变性坏死,少许纤维组织增生,周围 可见少许巨噬细胞浸润,见图4。
, 百拇医药
3 讨论
Walker-256细胞系具有恶性程度较高的癌肉瘤细胞特征,将该细胞接种于Wistar大白鼠腹 腔和皮下可分别制成腹水型肿瘤模型及皮下实体瘤模型[4]。近来有报道制作Walke r-256细胞的种植性肝癌模型[5],但尚未见到该恶性肿瘤细胞的种植性胃肿瘤模 型的报道。本实验在复制该肿瘤细胞的腹水型及皮下实体瘤模型的基础上,将皮下实体瘤组 织原位种植于鼠胃壁制成Wistar鼠Walker-256细胞种植性胃肿瘤模型,成功率达100%(20/ 20),病理组织学证实该种植性胃肿瘤与皮下实体瘤同源。作者制作模型的体会是①接种动 物应选用纯系Wistar大白鼠,鼠龄6~8周,体重120~250 g为宜,太大或太小均不宜成功, 笔者曾用6只体重大于450 g(平均550 g)SD大白鼠接种,无一例成功。②接种时选用的肿 瘤组织活性要高,一般选鱼肉状,质稍硬组织块,血管丰富者更佳,种植后成活率高;③组 织碎块大小约0.5~1.0 mm,沿胃壁纵轴刺破浆 膜层后稍潜行约1~2 mm,再钝性分离达粘膜下层(切勿穿破粘膜层),塞入组织块后局部稍加压迫,或以胃周网膜覆盖接种区,也可将网 膜与胃壁浆肌层间断缝合一针固定。④在批量接种时,每接种完一只大鼠,取瘤所用器械均 应用酒精灯烧灼灭活可能残留之瘤细胞;同时瘤块及器械均应避免与腹壁或切口接触,以免 造成腹腔内或腹壁种植,每次所取瘤组织均应在1 h内接种完毕。⑤接种后一般于5~7 d在 接种区胃壁形成大小约0.5~0.8 cm肿瘤,即可用于实验。未经治疗的荷瘤鼠生存时间一般 在3周左右,最长达27 d,最终因大量血性腹水,巨大肿瘤侵犯,梗阻、衰竭而死亡。
, http://www.100md.com
图1 皮下实体瘤组织形态学(HE ×20)
图2 鼠种植性胃肿瘤模型
图3 鼠种植性胃肿瘤组织形态学(HE ×40)
图4 治疗组肿瘤组织形态学(HE ×100)
本实验观察了抗癌药物阿霉素对该种植性胃肿瘤的抑制作用,与对照组比较,治疗组荷 瘤动物生存质量提高,生存时间明显延长,肿瘤的生长受到显著抑制,从而表明该肿瘤模型 对抗癌药物具有良好的反应性。
因此,本实验建立的Walker-256肿瘤细胞大鼠种植性胃肿瘤模型,具有制作简便,重复性 及稳定性好,同时对敏感抗癌药物有较好的反应性等特点,为研究胃癌的基础理论和临床治 疗,尤其是手术治疗及药物治疗途径等方面提供了较为理想的实验动物模型。
, 百拇医药
国家“九五”重点医学科技攻关专题资助项目(No.969060116)
陶凯雄,男,1967年生,医学博士,主治医师
参 考 文 献
1,Block P C, Baughman K L, Pastrnak R C et al. Transluminal angi oplasty: correlation of morphologic angiographlic findings in an experimental mo del. Circulation, 1980,61:788
2,张恩罴,钟强荣,孔振权等. 血卟啉衍生物对人食道鳞状细胞癌裸鼠移植瘤的 放射增敏研究. 癌症杂志,1992,11(1):10
3,曾育麟. 抗癌药物研究的标准化. 云南医药,1979,4(1):57
4,谢丛华,王 涛,张 红. 尿素合并放疗对大白鼠Walker-256癌肉瘤的治疗 作用.肿瘤防治研究, 1996, 23(4):234
5,杨继金,朱永法,左长高等. 大白鼠转移性肝癌模型的制作.中华放射学杂志, 1993,27(2):122
(1999-09-09 收稿), http://www.100md.com
单位:同济医科大学附属协和医院外科,武汉 430022
关键词:种植性胃肿瘤;Walker-256细胞株;阿霉素
同济医科大学学报000314 摘要 利用Walker-256细胞株可成功地复制出种植性 胃肿瘤模型,病理组织学证实该肿瘤与皮下实体瘤同源;皮下注射阿霉素可明显改善荷瘤鼠 的生存质量,延长其生存时间,抑制肿瘤的生长(P<0.01),提示该动物模型的制作及初 步实验为胃癌的实验研究提供了较为理想的动物模型。
中图法分类号 R735.2, R979.1, R329.2
Development of Implanted Gastric Tumor M odel in Mice and Therapeutic
, 百拇医药
Effects of Anticarcinogen
Tao Kaixiong Tian Yuan Chen Daoda
(Department of Surgery, Xiehe Hospital, Tonggi Medical University, Wuhan 430022)
Abstract The models of implanted gastric tumor in mice were dup licated successfully by using malignant tumor cell line Walker-256. Their histo pathologic features were homologous to those of the subcutaneous implanted tumor of Walker-256 cells in mice. Subcutaneous injection of adriamycin could obviou sly improve the life qualities of the mice bearing implanted gastric tumor, prol ong the survival time and inhibit the tumor growth (P<0.01), suggesting that the model of implanted gastric tumor in mice was an ideal one for the experimen tal study in gastric cancer.
, 百拇医药
Key words implanted gastric tumor; Walker-256 cell line; adr iamycin
制作实验动物的肿瘤模型对于肿瘤的研究和抗肿瘤药物的研制、开发及筛选等工作有极其重 要的意义。本研究从1997年3月至1998年1月,利用Walker-256细胞株成功地复制出大鼠种 植性胃肿瘤模型,并观察阿霉素对该肿瘤生长的抑制作用,旨在探讨该动物模型的制作方法 及意义。
1 材料与方法
1.1 材料与药品
1.1.1Walker-256癌肉瘤细胞株:由中国医学科学院药物研究所提供。
1.1.2 动物:纯系健康Wistar大白鼠24只,雄性,鼠龄8周,体重250~300 g,均由同济 医科大学实验动物学部提供。
, 百拇医药
1.1.3 盐酸阿霉素注射针剂:为意大利爱宝大药厂生产。
1.2 实验方法
1.2.1动物肿瘤模型的制作方法:①皮下实体瘤的复制:将冷存的Walker-256细胞株 复苏后,取0.1~0.2 ml(含细胞约106个)注入Wistar大白鼠腹腔内,清洁条件饲养, 5 ~7 d即可形成鼠肿瘤性腹水模型。腹水台盼蓝染色判断瘤细胞活性,巴氏染色分类判定瘤细 胞纯度。然后取腹水约0.1 ml(含瘤细胞约1~2×105 个,存活率99%,纯度>95%)接种 于 2只Wistar大白鼠后肢皮下,7~10 d即形成皮下实体瘤。②鼠种植性胃肿瘤模型的制作:(1) 严格无菌条件切取上述皮下实体瘤肿块,生理盐水洗尽血迹,剪成约0.5 mm×0.1 mm大小 的 组织碎片备用。(2)22只Wistar大白鼠10 g/L异戊巴比妥钠腹腔麻醉,仰卧位,四肢固定于 手术台上,腹腔以25 g/L碘酊和600 g/L酒精消毒皮肤,取上腹正中切口约1.0~1.5 cm切 开皮肤,沿腹白线进腹腔,暴露鼠胃,于胃窦区前壁近小弯侧以眼科镊(尖头)或玻璃探针 刺破胃壁浆膜层1.0~1.5 mm。探针潜行钝性刺入胃壁肌层或达粘膜下层(勿刺破粘膜层 )。(3)选取适当之备用肿瘤组织碎片一块,塞入胃壁浆肌层隧道内,局部压迫3~4 min, 若接种组织块易脱落时,可用胃周少许网膜覆盖接种区或用5-0可吸收线间断缝合一针,检 查无明显渗血后逐层关腹。(2只动物因麻醉意外死亡,20只存活动物纳入实验组)1周左右 沿原切口进腹观测肿瘤的生长情况,并取少许肿瘤组织病理学检查。
, 百拇医药
1.2.2 阿霉素对鼠种植性胃肿瘤的治疗作用:① 分组及治疗方法:20只肿瘤模型动物分 为治疗组(10只):接种后1周开始于后侧肢体皮下注射阿霉素针剂(5 mg/kg),隔日1次, 共5次;对照组(10只):注射生理盐水。②观察指标:(1)动物的一般状况包括活动、对外 界的刺激、饮食及皮毛光泽等情况。(2)肿瘤的抑制率及动物生存时间延长率:每组各取5只 实验动物于接种后第28 d开腹,精密卡尺测量肿瘤最长径a(cm)及垂直最短径b(cm),根据公 式=0.4ab2[1]求得肿瘤近似体积,按下列公式计算肿瘤体积抑制率。继续 相同条件 下饲养,观察各组动物的生存时间并计算出生存时间延长率。(3)肿瘤的病理组织学观察: 分别取Walker-256细胞的皮下实体瘤,种植性胃肿瘤及治疗组瘤体标本,100 ml/L福尔马 林固定,沿肿瘤长轴切开取材,常规石蜡包埋制片,HE染色,光学显微镜观察。
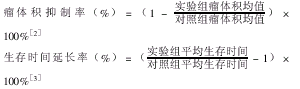
1.3 统计方法
, 百拇医药
数据采用
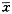 ±s,配对资料t检验。
±s,配对资料t检验。2 结果
2.1 制作成功的鼠种植性胃肿瘤模型
鼠Walker-256细胞皮下实体瘤模型于接种后7~10 d即可见鼠后肢接种区形成约1.0~1.5 cm的肿块形成,病理组织学呈实体瘤表现, 见图1。
鼠Walker-256细胞种植性胃肿瘤于接种后7 d左右形成,原切口进腹可见在鼠胃接种区形成 大小约0.5~0.6 cm的肿瘤,表面光滑,与周围网膜少许粘连,易分开,边界清,无明显 脏 器侵犯,见图2,组织学证实与皮下实体瘤同源,见图3,该肿瘤模型复制成功率为100%(20 /20)。
2.2 抗癌药物对鼠种植性胃肿瘤的抑制作用
, 百拇医药
实验鼠一般状况的观察:对照组实验动物于接种2周后出现食量明显减少,活动少,倦怠状 ,对外界刺激反应迟钝,皮毛欠光泽,逐渐消瘦,甚至腹水形成,而治疗组接种后1周即开 始注射阿霉素,约于4周后才陆续出现上述表现。
治疗组动物种植性胃肿瘤的生长抑制率及生存时间延长率的变化:于接种后第28 d观察两组 移植肿瘤的生长情况,结果治疗组鼠胃肿瘤生长明显缓慢,治疗组和对照组肿瘤体积分别为 (3.37±0.36) cm3 和(6.58±0.72) cm3,肿瘤体积抑制率为48.8%(P<0.05 );治 疗组动物生存时间与对照组比较普遍延长,分别为(43.6±10.4) d和(21.3±5.8) d, 治疗组动物生存时间延长率达104.7%(P<0.05)。
2.3 鼠种植性胃肿瘤的病理组织学观察
空白组瘤体组织学显示肿瘤细胞生长活跃,瘤细胞排列规律,核分裂相多见,核浆比例 增大,较少炎性浸润;而治疗组,则可见部分肿瘤细胞变性坏死,少许纤维组织增生,周围 可见少许巨噬细胞浸润,见图4。
, 百拇医药
3 讨论
Walker-256细胞系具有恶性程度较高的癌肉瘤细胞特征,将该细胞接种于Wistar大白鼠腹 腔和皮下可分别制成腹水型肿瘤模型及皮下实体瘤模型[4]。近来有报道制作Walke r-256细胞的种植性肝癌模型[5],但尚未见到该恶性肿瘤细胞的种植性胃肿瘤模 型的报道。本实验在复制该肿瘤细胞的腹水型及皮下实体瘤模型的基础上,将皮下实体瘤组 织原位种植于鼠胃壁制成Wistar鼠Walker-256细胞种植性胃肿瘤模型,成功率达100%(20/ 20),病理组织学证实该种植性胃肿瘤与皮下实体瘤同源。作者制作模型的体会是①接种动 物应选用纯系Wistar大白鼠,鼠龄6~8周,体重120~250 g为宜,太大或太小均不宜成功, 笔者曾用6只体重大于450 g(平均550 g)SD大白鼠接种,无一例成功。②接种时选用的肿 瘤组织活性要高,一般选鱼肉状,质稍硬组织块,血管丰富者更佳,种植后成活率高;③组 织碎块大小约0.5~1.0 mm,沿胃壁纵轴刺破浆 膜层后稍潜行约1~2 mm,再钝性分离达粘膜下层(切勿穿破粘膜层),塞入组织块后局部稍加压迫,或以胃周网膜覆盖接种区,也可将网 膜与胃壁浆肌层间断缝合一针固定。④在批量接种时,每接种完一只大鼠,取瘤所用器械均 应用酒精灯烧灼灭活可能残留之瘤细胞;同时瘤块及器械均应避免与腹壁或切口接触,以免 造成腹腔内或腹壁种植,每次所取瘤组织均应在1 h内接种完毕。⑤接种后一般于5~7 d在 接种区胃壁形成大小约0.5~0.8 cm肿瘤,即可用于实验。未经治疗的荷瘤鼠生存时间一般 在3周左右,最长达27 d,最终因大量血性腹水,巨大肿瘤侵犯,梗阻、衰竭而死亡。

, http://www.100md.com
图1 皮下实体瘤组织形态学(HE ×20)

图2 鼠种植性胃肿瘤模型

图3 鼠种植性胃肿瘤组织形态学(HE ×40)

图4 治疗组肿瘤组织形态学(HE ×100)
本实验观察了抗癌药物阿霉素对该种植性胃肿瘤的抑制作用,与对照组比较,治疗组荷 瘤动物生存质量提高,生存时间明显延长,肿瘤的生长受到显著抑制,从而表明该肿瘤模型 对抗癌药物具有良好的反应性。
因此,本实验建立的Walker-256肿瘤细胞大鼠种植性胃肿瘤模型,具有制作简便,重复性 及稳定性好,同时对敏感抗癌药物有较好的反应性等特点,为研究胃癌的基础理论和临床治 疗,尤其是手术治疗及药物治疗途径等方面提供了较为理想的实验动物模型。
, 百拇医药
国家“九五”重点医学科技攻关专题资助项目(No.969060116)
陶凯雄,男,1967年生,医学博士,主治医师
参 考 文 献
1,Block P C, Baughman K L, Pastrnak R C et al. Transluminal angi oplasty: correlation of morphologic angiographlic findings in an experimental mo del. Circulation, 1980,61:788
2,张恩罴,钟强荣,孔振权等. 血卟啉衍生物对人食道鳞状细胞癌裸鼠移植瘤的 放射增敏研究. 癌症杂志,1992,11(1):10
3,曾育麟. 抗癌药物研究的标准化. 云南医药,1979,4(1):57
4,谢丛华,王 涛,张 红. 尿素合并放疗对大白鼠Walker-256癌肉瘤的治疗 作用.肿瘤防治研究, 1996, 23(4):234
5,杨继金,朱永法,左长高等. 大白鼠转移性肝癌模型的制作.中华放射学杂志, 1993,27(2):122
(1999-09-09 收稿), http://www.100md.com