戊型肝炎病毒最新研究进展(1)
 |
 |
 |
戊型肝炎病毒( hepatitis E virus, HEV)是非甲非乙型急性肝炎的病原体之一,其传播方式主要经粪-口途径,也有报道可以通过口-鼻和血液传播。前苏联学者Balayan 等[1]1983 年首次用免疫电镜技术自1名志愿感染者粪便中检测到HEV颗粒。在1989 年的东京国际会议上, 该型肝炎及相关病毒分别被正式命名为戊型肝炎( hepatitis E, HE) 和戊型肝炎病毒(HEV)。HE在亚洲、非洲及美洲的墨西哥等发展中国家常呈爆发流行,我国1986 —1988年在新疆曾经发生爆发流行[2] ,在世界范围内呈散发传播[3] 。人类为HEV易感群体,病人发病症状严重,病死率高,青壮年病死率可达1% ~2% ,远较其他各型肝炎高,孕妇的病死率可高达20%左右,HEV 对人类健康造成严重威胁。
1病原体
ICTV 第8 次报告建议将HEV 暂归为戊型肝炎病毒科(family Hepeviridae), 并为唯一的戊型肝炎病毒属(genus Hepevirus)成员(http://www.ncbi.nlm.nih.gov/ICTV)。 HEV是单股正链RNA病毒,无囊膜,表面有纤突,病毒粒子直径24~34 nm。该病毒内部呈现两种不同形态:一种内部密集,含遗传物质的,为完整病毒颗粒。另一种内部透亮,为不含完整基因的缺陷病毒颗粒。蔗糖梯度离心前者沉降系数为183 S,后者为165 S。病毒的浮密度在蔗糖溶液中为1.349 g/mL,在酒石酸钾溶液中为1.189 g/mL。
基于HEV核苷酸序列的系统进化分析,HEV可以分为4种不同的基因型,即基因1、2、3和4型。其中基因1型在世界范围内广泛流行,被认为只在人群中流行。2006年有研究报道在柬埔寨猪粪样中检测到基因1型HEV RNA[4],但是其确切情况还有待进一步证实。基因2型HEV只在墨西哥和非洲少数地区人群中流行,迄今为止,还未在世界其他地区发现。基因3和4型被认为是人兽共患病病原体,其中3型在世界范围内的人群和猪群中流行,我国2007年首次在上海猪群中发现基因3型HEV感染[5]。1993年,基因4型首先在中国人群中被发现。除中国以外,基因4型还主要在日本、印度、印度尼西亚以及越南的猪群和人群中流行[6]。4种基因型HEV被认为只有一种血清型[7]。自2000年以来,4型HEV已经成为在中国流行的主要基因型[8]。
2基因组结构
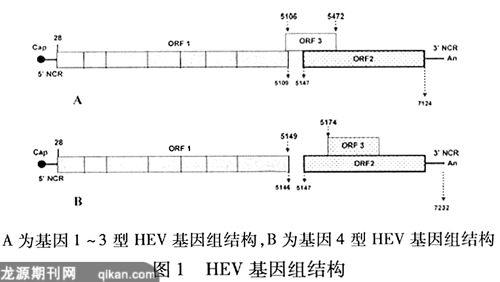
图1显示了HEV基因1~3型和基因4型的基因组结构。研究数据表明,HEV基因组结构上不存在人和动物之间的差别。HEV整个基因组约为7.2 kb,分析来自各个区域的分离株基因组结构显示,HEV基因组含有3个相互重叠的阅读框。5’端含有帽子结构和一段28 bp的非编码区。3’端含有约68 bp的非编码区和Poly A结构。ORF-1主要编码与病毒RNA复制有关的非结构蛋白,具有甲基转移酶,木瓜蛋白酶样半胱氨酸蛋白酶, RNA解旋酶, RNA依赖的RNA聚合酶的活性。ORF-2编码660氨基酸的结构蛋白, pORF 22蛋白因其具有良好的抗原性,是目前公认的最有应用前景的亚单位候选疫苗,已有许多ORF-2基因或其片段在不同细胞中成功地进行了表达,如原核细胞、昆虫细胞、酵母细胞、动物和植物细胞等[9] ,且其表达产物均有良好的免疫原性。ORF-3含有369个碱基,其5’端和ORF-1 有1个碱基的重叠,其余大部分和ORF-2重叠。ORF-3所编码的产物为123个氨基酸残基的磷酸化蛋白[10],目前为止还不是很清楚其主要功能。报道显示,基因4型在ORF-1下游有3个碱基缺失,从而导致基因4型的ORF-2和ORF-3编码基因短于其他毒株,分别编码659和122个氨基酸[11]。
3病毒的宿主范围与增殖
最近越来越多的报道显示,HE是人兽共患疾病。人是HEV的天然宿主,但是动物却作为HEV的天然寄主,从而扩增病毒以感染人类。已经有几种灵长类动物被证实对HEV易感,包括绢毛猴、食蟹猴、猕猴、 猫头鹰猴、黑猩猩、非洲绿猴、豚尾猴[12~14]。其中猕猴已经被认为是用于研究HEV最有价值的模式动物,因为它能很好地模拟HEV感染后的各种症状。实验室研究表明,灵长类动物感染HEV后的发病过程和人类相似,只是病毒粒子在体内持续时间上稍有区别[12,14,15]。许多报道表明,在自然状态下家养的猪、羊、及其野鹿可以被HEV感染,而且在实验室中,这些物种也可以实验感染HEV[16~19]。多种检测及研究手段在人类及动物中检测HEV结果均支持HE是一种人兽共患病[16]。分离自美国猪的1株HEV毒株已经在实验室证实可以感染灵长类动物[20,21]。而且系统进化分析表明该株HEV在核苷酸序列水平上和美国分离自人类的HEV高度同源,却与墨西哥分离株及缅甸分离株有很大分歧。来自世界不同地区越来越多的证据证实HE是人兽共患病,包括新西兰、日本、荷兰、加拿大、中国大陆及台湾地区。近来,一种新的类似于哺乳动物HEV的病毒从美国鸡的胆汁中分离出来[22],血清流行病学及病毒异质性研究显示,禽类HEV在美国鸡群中广泛流行[23]。更近的一项报道发现了HEV从鹿直接传染给人的证据[24],而HEV从其他动物传染至人的事件也已有大量报道。其中基因3型的人兽共患主要发生于美国、欧洲和日本;基因4型HEV 的人兽跨种传播主要发生于日本,中国大陆和台湾地区。基因1和2型至今还没有在动物中发现,是否他们不以动物作为宿主还有待于进一步研究。
4流行模式与地理分布
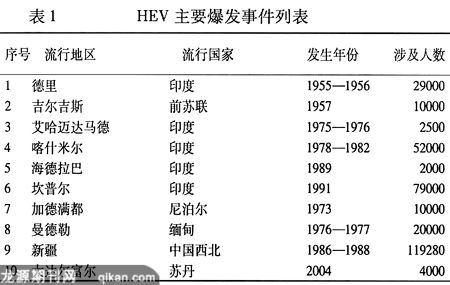
HEV在世界范围内以散发和局部流行区爆发式流行。世界上第一次HE爆发发生在1955—1956年印度的德里地区,该次爆发由自来水加氯不完善引起,有2.9万人感染[25]。自此以后,HE的主要爆发事件时有发生(表1)。在HE爆发期间,15~40岁成年人感染率最高,为1%~15%[26]。但也有报道显示儿童对HEV比成人更易感[27,28]。在爆发期间,HEV致死率为0.2%~4%,但是至今还令人迷惑的是,有10%~20%感染HEV的孕妇发生急性肝衰,特别是在妊娠第三期[29,30]。
世界上报道的HEV流行区域分布见图2,图中显示的为本土HEV流行,伊拉克的流行情况有待于进一步证实[31]。
5HE与怀孕
报道显示,怀孕处于妊娠三期的妇女感染HEV后死亡率高达20%[29],研究认为HEV会导致怀孕妇女子宫内感染从而会引起产前发病和死亡[32],而且死亡常由脑部疾病、出血性素质或肾衰竭引起。有研究者给食蟹猴静脉注射感染HEV,发现食蟹猴出现急性肾小管坏死并伴有出血,说明HEV在肾中复制[33]。然而以灵长类动物模型研究怀孕与HEV的关系时,却发现怀孕的猴子并不比未怀孕的猴子死亡率高[34,35]。研究已经清楚阐明怀孕妇女HEV感染在血管内出现高度的沉积物,但是HEV流行区的散发型孕妇病例却并不像爆发时期死亡率那么高,仍然有待于进一步研究。我国新疆1986 —1988年爆发HE,死亡人数高达707人,其中有414名孕妇,而且孕妇患HEV的死亡率远高于该地区的正常人群及其他地区的HEV散发群体。该特征也在印度HE爆发案例中存在,其具体机制有待进一步研究,推测与病毒的基因型,地区人们的生活习惯及爆发和散发时病毒的剂量差异有一定的关系。, 百拇医药(桑志迪 张 文 沈 权 华修国)