医药新产品的开发与选择
 |
 |
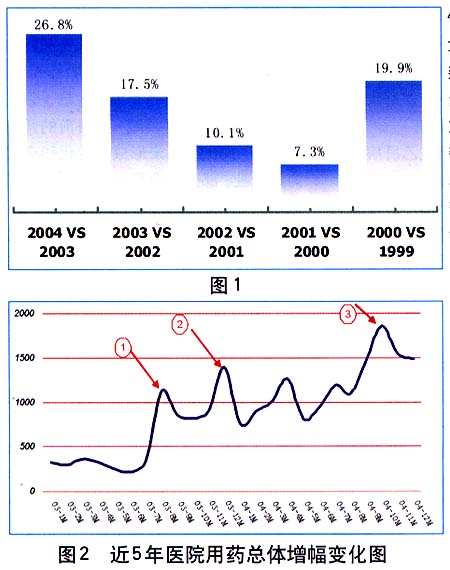
医药产业虽然盘子不大,却十分热闹,近几年,资本更是在这个市场上重新加大了投资力度,使得整个市场风声水起。从市场上看,整个医药产业规模继续放大,以医院市场为例,用药金额持续大幅上扬,较上一年度增加了26.8%,远高于2002年的17.5%增长速度,全国医院药物销售总额超过900亿元人民币。
从2000年开始的医院药品招标采购活动虽然对药品的销售产生了一定的影响,使当年医院购药金额增幅一度大跌,但随着医药企业、中间流通商及医院三方对于药品招标采购已经有了较强的“免疫力”,使得需求各方重新寻求到了新的利益均衡点,对于市场的预期更加明确。因此企业各方加大了市场的力度,使得用药的整体增幅也逐年回升,而且从目前的情况来看,这一变化趋势短期内仍然会走高(见图1)。
2004年7月国内企业大规模整体GMP认证接近尾声,一方面是GMP认证后淘汰了大量的低端品种;另一方面是GMP认证企业投资新增的巨大产能与资本负担,因此国内企业普遍出现了产品饥荒的局面。其实这种局面早在三年前就已经出现了端倪。
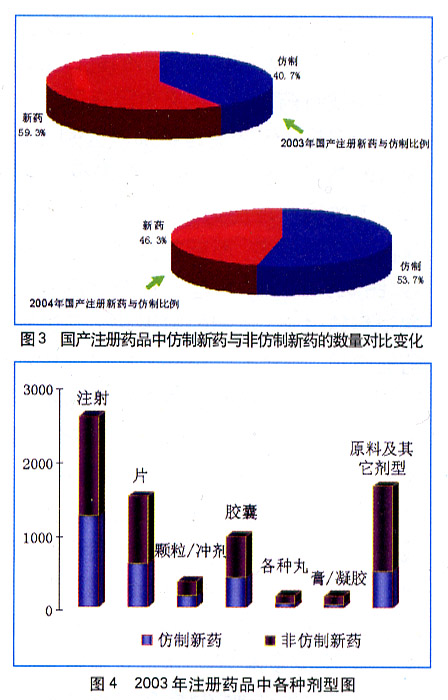
1991-1996年由卫生部进行药品管理时(不含地方标准药品),共批准新药1546项,其中二类(仿制)和四类(改变剂型)的药物是其中的主体,分别为336项和1019项,而一类新药(即创新药物)仅有41种,占2.6%
1997年以后每年批准的各种新药超过1000个,2002年达到了2125个新药,2002年12月1日起开始实施的《药品注册管理办法》(试行),对新药重新进行了定义,同时也使药品注册管理方式上发生了变革,进而导致新药的注册申报情况也发生了根本性的变化。多种因素的蓄积导致了2003年新药申报的“井喷”,全年共有近八千个产品根据新的办法进行了新药的注册申报工作,即使以原有概念计算的新药有四千多种。然而,原本应于2004年中就到期的这个“试行”管理办法却迟迟不能退出舞台,新的管理办法一再难产,使得医药注册在“无法无天”中跃进——2004年国内新药申报数量将超过15000件!
在新试行办法实施的两年多时间里,2003年上半年申报数量较少,延续了前几年的缓步增长趋势,2003年上半年申报新药数量不足当年全年申报数量的四分之一(24.7%)。7月份出现了第一个转折点,新药申报开始大跃进,7月份以后 ......
您现在查看是摘要页,全文长 8827 字符。