人外周血内皮前体细胞体外增殖规律的动态观察及其特性(2)
 |
 |
 |
1.2.方法:
1.2.1 外周血单个核细胞的分离与培养:Ficoll液密度梯度离心提取单个核细胞,接种在人纤连蛋白(5ug/cm2)包被的24孔培养板上,置于37℃、5%的CO2、饱和湿度的CO2培养箱中培养。细胞培养4d后,去除未附着细胞,继续培养黏附细胞至第7d,倒置显微镜观察其生长情况。
1.2.2 EPCs的染色:单个核细胞培养4d后,去除未附着细胞,向培养孔中加入Dil-AC-LDL(2.4ug/ml),37℃避光孵育2h,加入2%的多聚甲醛固定20min,37℃的PBS冲洗3次,每次5min,再与FITC-UEA-1(10ug/ml)一起避光孵育1h,PBS冲洗3次,荧光显微镜观察细胞,每孔多个视野计数。
1.2.3 流式细胞仪检测:单个核细胞培养第7d,用0.25%的胰蛋白酶/0.02%EDTA,收集5×105个黏附细胞分别与抗人的单克隆抗体:PE标记的CD34、FITC标记的CD31,PE标记的KDR在室温孵育30min,以同种型单克隆抗体作为阴性对照,PBS冲洗,4%的多聚甲醛固定,流式细胞仪检测。
, 百拇医药
2结果
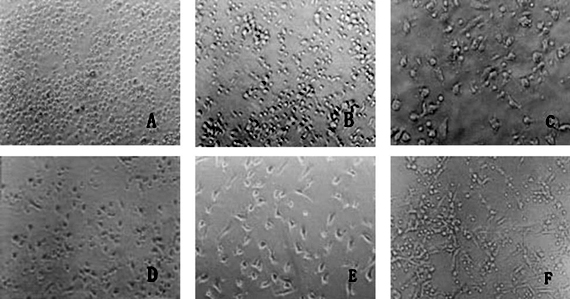
2.1 单个核细胞的分离与培养:离心后,单个核细胞密度与分层液密度相当,密集在血浆层和分层液的界面中,呈白膜状。单个核细胞在铺有人纤连蛋白以及加入生长刺激因子的EGM-2MV培养基上培养,倒置显微镜下观察细胞的形态,1d后,一些细胞变形;2d后, 可见大量的细胞团形成,3d后,细胞团周围一些贴壁细胞开始出现;4d后去除未附着细胞,细胞贴壁生长,内皮细胞呈扁平的短梭形或多角形,大小均匀,胞核清晰,呈卵圆,有核的区域比无核的区域突出。在5d时生长最快,梭形细胞的大小和数量都明显增加,细胞呈单层鹅卵石样或铺路石样镶嵌状排列生长。大约在培养的第7d,可见长梭形细胞以细胞团为中心呈放射状生长,同时,也可见散在的长梭形细胞。(如图Fig1)。
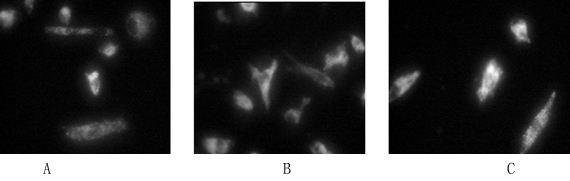
2.2 EPCs的染色:单个核细胞培养4d后,黏附细胞与Dil-AC-LDL一起孵育,再与FITC-UEA-1一起孵育,荧光显微镜和共聚焦激光扫描显微镜下观察,Dil-AC-LDL呈红色荧光,FITC-UEA-1呈绿色荧光,出现这种双阳性荧光的细胞即被鉴定为EPCs(如图Fig2)
, 百拇医药
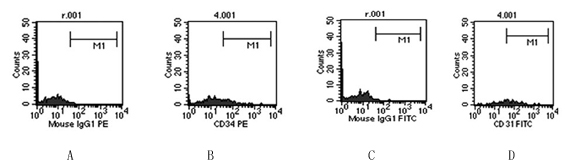
2.3 流式细胞仪检测:单个核细胞培养第7d ,FACS分析,CD34和CD31阳性细胞阳性率分别为 (14.13±2.79)%、(54.67±3.44)%。(如图Fig3)
3讨论:
从成年人的骨髓中分离到的EPCs为CD133+/CD34+/KDR+,成人外周循环血中,更成熟分化的内皮前体细胞(CEPs),其CD133表达降低,成熟黏附的ECs为CD133-/KDR+,很明显,EPCs在分化过程中失去了CD133的表达[2]。因此外周循环血中比CEPs更成熟的内皮前体是CD34+/ KDR+/CD31+/VE-cad+,并开始表达血管血友病因子vWF。目前认为CD133是区别内皮前体细胞与成熟内皮细胞的主要标志[2,7],成人的外周血可作为EPCs的一个源泉,从外周血获取EPCs是最快捷和方便的方法,而外周血中EPCs的数量相当有限,因此,外周血中EPCs的分离、体外诱导与分化,以及适当的培养条件的探索是必要的。在本研究中,我们可以看到EPCs从外周血中被分离出来,在铺有人纤连蛋白的24孔培养板中黏附、增殖,并且分化在有VEGF、bFGF、IGF-1和EGF存在的培养液中短时间内完成。
, 百拇医药
单个核细胞培养7d后,FACS分析,CD34、CD31、KDR都有表达,说明单个核细胞在EGM-2 MV培养液中,经过7d的培养,诱导分化出了EPCs,MNCs在人纤连蛋白上培养4d后,去除未附着细胞,镜下可见大量的细胞团形成。在第5d时生长最快,梭形细胞的大小与数目都增加。大约在培养第7天,可见长梭形细胞以细胞团为中心呈放射状生长,细胞团中心为圆形细胞,周边为梭形细胞。培养中出现形态特征与胚胎发育时期血岛相类似的细胞团。呈梭形的内皮样的黏附细胞与Dil-AC-LDL一起孵育,再与FITC-UEA-1一起孵育,荧光显微镜下观察,Dil-AC-LDL呈红色荧光, FITC标记的UEA-1呈绿色荧光,双阳性荧光(黄色)的细胞即被鉴定为EPCs。
在细胞的迁移试验中[8],MNCs培养第7d,用胰酶收集2×104个贴壁细胞,悬浮在50μl培养液注入上室,然后将25μl培养液和VEGF (50ng/ml)加入改良的Boyden小室的下室,37℃培养24h,清去滤膜上面的未迁移的细胞,用甲醛固定,Giemsa 染色,显微镜下3个随机选择视野(×400),计数迁移到下层的细胞,迁移率为48.34±1.34%。细胞的迁移试验表明,EPCs对应于VEGF具有迁移功能。目前认为VEGF是最有效的动员EPCs的外源性动员剂,能促进内皮细胞迁移,并促使其分裂、增殖和分化,从而促进新生血管的修复与生成。
, 百拇医药
本研究是从单个核细胞诱导EPCs,进行的是EPCs的短期培养,通过EPCs体外生长增殖规律的观察,旨在探讨EPCs体外诱导分化的方法,以期为EPCs的功能研究及血管生成的细胞治疗打下基础。有资料表明[4],该培养诱导的EPCs很大一部分来源于CD14+单核细胞的转分化,在长期培养(多于2周),EPCs来源于有惊人的增殖能力的内皮克隆,作为对造,单核的EPCs的增殖较缓慢,并且在2-3周内死去。但是两种来源的(CD14-和单核CD14+细胞)细胞治疗潜能在体内都有效:两种亚群的细胞在小鼠的后肢缺血模型中都显示能渗入到血管结构中,并明显地增强了新血管化。
Fig1:倒置显微镜下,EPCs的体外生长增殖的动态观察(×200)。
(A)刚分离接种1d的MNCs 。(B)培养2d,有细胞团形成,一些细胞开始变形。
(C)培养3-4d,细胞团周围有一些贴壁细胞出现。(D) 培养5d, 贴壁细胞成
, 百拇医药
短梭形。(E) 培养6d,贴壁细胞明显增加。(F) 培养7d,贴壁细胞为长梭形。
Fig2:M NCs培养第5d,荧光显微镜下观察摄取Dil-AC-LDL(红色)、联结FITC-UEA-1(绿色),的双阳性的黏附细胞。
Fig 3:MNCs在铺有人纤连蛋白以及EGM-2MV培养基上培养第7d,FACS分析,CD34 、CD31阳性细胞率分别为:(14.13±2.79)%、(54.67±3.44)%。
A:CD34+细胞的阴性对照。B:培养7d后的CD34+细胞。C.CD31+细胞的阴性
对照。D.培养7d后的CD31+细胞。
参考文献
1Asahara T,Murohara T,Sullivan A,et al. Isolation of putative progenitor endothelial cells for angiogenesis[J].Science,1997,275(5302):964-967.
, 百拇医药
2Masuda H and Asahara T.Post-natal endothelial progenitor cells for neovascularization in tissue regeneration [J].Cardiovascular Research,2003,58(2):390-398.
3Iwami Y, Masuda H,Asahara T. Endothelial progenitor cells:past, state of the art, and future[J]. Cell.Mol.Med,2004,8(4):488-497.
4Zammaretti P and Zisch AH. Adult ‘endothelial progenitor cells’:renewing vasculature[J].The International Journal of Biochemistry and Cell Biology,2005,37(3):493-503.
, 百拇医药
5Asahara T,Takahashi T,Masuda H,et al. VEGF contributes to postnatal progenitor cells[J].EMBO J,1999,18(14):3964-3972.
6Rabbany SY,Heissig B,Hattori B,et al. Molecular pathways regulating mobilization of marrow-derived stem cells for tissue revascularization [J].TRENDS in Molecular Medicine,2003,9(3):109-117.
7Hristov M,Erl W,Weber PC,et al. Endothelial Progenitor Cells Isolation and Characterization[J].TCM,2003,13(5):201-206.
8Chen JZ, Zhu JH , Wang XX, et al. Effects of homocysteine on number and activity of endothelial progenitor cells from peripheral blood[J]. Mol Cell Cardiology, 2004 ,36(2):233-239.
[ 上 页 ], 百拇医药(秦宏伟)