微生物产弹性蛋白酶制取方法的探讨
 |
 |
 |
| 第1页 |
参见附件(443KB,3页)。
摘要:目的探讨微生物产弹性蛋白酶的制取方法。方法将产弹性蛋白酶的枯草芽孢杆菌接种到发酵培养基中,摇床发酵培养后,离心收集发酵液,并经过硫酸铵盐析、DEAE-Sephadex A-25阴离子交换层析、Sephadex G-75凝胶过滤层析等步骤纯化弹性蛋白酶。结果经过上述纯化步骤,弹性蛋白酶纯化倍数达到了33倍,回收率达到12 %,酶蛋白比活达到了528 U/mg 。结论此纯化工艺较为理想,获得了较纯的酶蛋白。
关键词:弹性蛋白酶;枯草芽孢杆菌;分离;纯化
中图分类号:Q939.97文献标识码:A文章编号:1672-979X(2007)11-0040-03
Approach on Preparative Method of Elastase Produced by Microorganism
FANG Shang-ling, HU Jia- jun , ZHU Nan
(College of Bioengineering, Hubei University of Technology, Wuhan 430068 ,China)
Abstract:Objective To investigate the preparative method of elastase produced by microorganism. Methods A elastase-producing strain of Bacillus subtilis was inoculated into fermentation medium and cultivated on a rotary shaker。The broth was collected by centrifugation. The purification of elastase was achieved by combination methods of (NH4)2S04 fractionation, anion exchange chromatography on DEAE-Sephadex A-25 and gel filtration chromatography on Sephadex G-75. Results Through the purification procedures shown above, the purification multiple of elastase was 33, the recovery rate was up to 12 % and the specific activity was about 528 U/mg.Conclusion The purer elastase can be obtained by this ideal purification technology.
Key words:elastase; Bacillus subtilis; separation; purification
弹性蛋白酶(elastase)是一种以降解不溶性弹性蛋白质为特征的水解酶,此酶属于丝 氨酸蛋白酶,可由动物胰脏提取或由微生物发酵制得。从胰脏提取的弹性蛋白酶价格较高,因此,采用微生物发酵法生产弹性蛋白酶具有广阔的应用前景[1]。本研究以微生物发酵液为原料,采用盐析、离子交换层析和凝胶过滤层析方法进行弹性蛋白酶纯化,并结合SDS-PAGE对纯化酶进行测定。
1材料
1.1菌种
弹性蛋白酶生产菌株枯草芽孢杆菌B1由本实验室筛选并分离。
1.2试剂
弹性蛋白、刚果红-弹性蛋白(Sigma公司);K2HPO4(上海恒信化学试剂有限公司);DEAE-Sephadex A-25,Sephadex G-75(Pharmacia公司)。
1.3仪器
磁力搅拌器(江苏岸头分析仪器厂);旋转式摇床(中国科学院武汉科学仪器厂);可见分光光度计(北京瑞利分析仪器公司);电热干燥箱(江苏海门县三和农具厂)。
1.4培养基
发酵培养基(w/v):干酪素3.0 g,葡萄糖4.0 g,玉米提取液0.2 g,K2HPO4 0.2 g,MgSO4·7H2O 0.01 g,pH 8.8。115 ℃下灭菌30 min。
种子培养基(w/v):牛肉膏0.4 g、 蛋白胨0.6 g、酵母膏0.2 g、NaCl 0.5 g,pH 8.8。121 ℃下灭菌20 min。
2方法
2.1丙酮沉淀法提取弹性蛋白酶
发酵液在4 ℃、5 000 r/min条件下离心30 min,去除菌体,上清液置冰浴中。取上清液,加入与上清液等体积的预冷丙酮,充分搅拌后在4℃下静置30 min。4 ℃,5 000 r/min离心30 min,弃上清液,即得酶蛋白粗品。收集后测定酶活性。
2.2酶的分离纯化
2.2.1pH值对盐析的影响加入65%的硫酸铵作盐析时的沉淀剂,测量不同pH条件下沉淀出酶的活性,确定最适盐析pH值。
2.2.2盐析时硫酸铵最佳浓度的确定发酵液在4 ℃,5 000 r/min条件下离心30 min,去除菌体。冰浴条件下向发酵液中缓慢加入不同量的硫酸铵,盐析液在4 ℃下静置过夜。4 ℃,5 000 r/min离心30 min,分别收集酶蛋白和上清液。将收集的酶蛋白粗品溶于0.02 mol/L、pH 8.0的100 mL Tris-HCl缓冲液中透析,测定酶活性,并确定硫酸铵的最佳盐析浓度。
2.2.3DEAE-Sephadex A-25阴离子交换层析盐析、透析后的酶液采用聚乙二醇浓缩至适当浓度后过离子交换柱。洗脱液检测A280值,吸附的蛋白质用NaCl溶液连续线性洗脱。NaCl浓度0~0.6 mol/L,共800 mL,流速为5 mL/min,每管收集5 mL。分别测定各管A280值和酶活性,合并具有活性的各管溶液,并检测酶液的酶活性。
2.2.4Sephadex G-75凝胶过滤层析[2]收集经过离子交换柱的酶液,用聚乙二醇浓缩至4 mL,加入用0.05 mol/L Tris-HCl缓冲液平衡过的Sephadex G-75凝胶柱中,洗脱并分部收集,流速为5 mL/min,每管收集5 mL,分别检测各管A280值和酶活性。
2.2.5SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)按照Laemmli方法,采用DYY-Ⅲ型垂直板电泳槽进行SDS-PAGE,电泳后的凝胶直接银染或考马斯亮蓝染色。
3结果与讨论
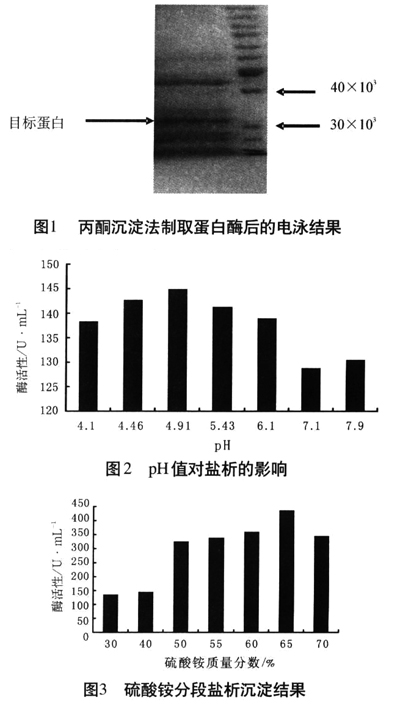
3.1丙酮沉淀法制取弹性蛋白酶的结果
对经丙酮沉淀纯化后的粗酶进行SDS-PAGE凝胶电泳,在相对分子质量32 ×103处有一条单一的蛋白质条带,与文献报道的弹性蛋白酶相对分子质量大小基本一致。结果见图1。
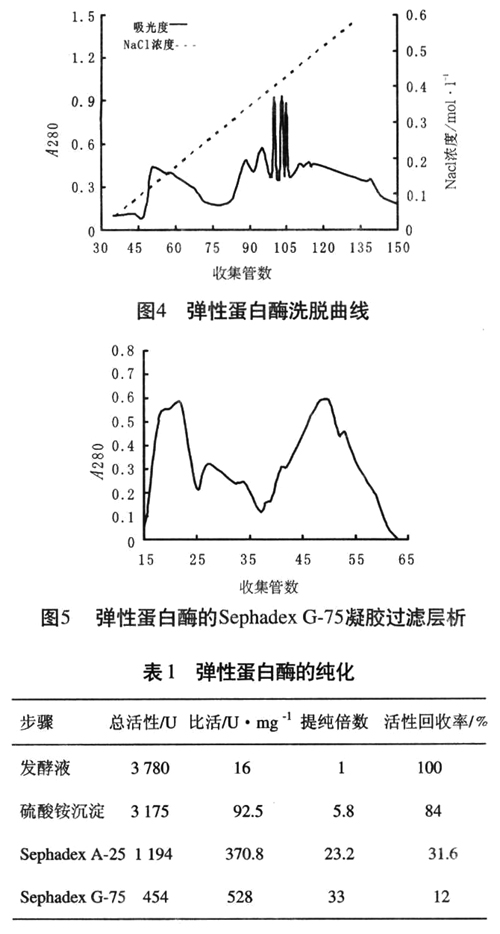
3.2pH值对盐析的影响
酶在等电点或接近等电点时溶解度最低 ......
您现在查看是摘要介绍页,详见PDF附件(443KB,3页)。